Сравнительная оценка экологической вариабельности мембранных фосфолипидов водных растений
Автор: Poзeнцвeт O.A., Макурина О.Н.
Журнал: Самарская Лука: проблемы региональной и глобальной экологии @ssc-sl
Рубрика: Результаты научных исследований
Статья в выпуске: 4 т.16, 2007 года.
Бесплатный доступ
Фосфолипиды, как основной структурный компонент биомембран, играют важную роль в различных метаболических процессах водных растений, в частности - в реакциях адаптации к условиям внешней среды. Нами выявлены качественный и количественный составы фосфолипидов растений различных жизненных форм, а также тканевые отличия в содержании этой группы липидов в растениях, произрастающих в водоемах региона Средней Волги. В настоящей работе установлены закономерности вариабельности различных видов фосфолипидов, что свидетельствует о возможной роли отдельных пулов липидов в адаптации водных растений к изменяющимся условиям среды.
Фосфолипиды, водные растения, адаптация
Короткий адрес: https://sciup.org/148314716
IDR: 148314716
Текст научной статьи Сравнительная оценка экологической вариабельности мембранных фосфолипидов водных растений
СРАВНИТЕЛЬНАЯ ОЦЕНКА ЭКОЛОГИЧЕСКОЙ ВАРИАБЕЛЬНОСТИ МЕМБРАННЫХ ФОСФОЛИПИДОВВОДНЫХ РАСТЕНИЙ
Фосфолипиды, как основной структурный компонент биомембран, играют важную роль в различных метаболических процессах водных растений, в частности – в реакциях адаптации к условиям внешней среды. Нами выявлены качественный и количественный составы фосфолипидов растений различных жизненных форм, а также тканевые отличия в содержании этой группы липидов в растениях, произрастающих в водоемах региона Средней Волги. В настоящей работе установлены закономерности вариабельности различных видов фосфолипидов, что свидетельствует о возможной роли отдельных пулов липидов в адаптации водных растений к изменяющимся условиям среды.
Phospholipids as the basic structural component of biomembranes play the important role in various metabolic processes of water plants, in particular in reactions of adaptation to conditions of an environment. It was revealed the qualitative and quantitative contents of plant phospholipids of various vital forms and also, tissue differences in the content of this group of lipids in the plants, growing in reservoirs of Middle Volga region. In the present work the dependence of variability of various kinds of phospholipids are established, that testifies to a possible role of separate pools of lipids in adaptation of water plants to changing conditions of environment.
Водная растительность является важным компонентом гидроэкосистем. От них зависит состояние водоемов, разнообразие и обилие населяющих их животных, для многих из которых растения служат источником питания, местом разведения или убежища молоди (Гаевская. 1966; Пшенникова, 2005). Высока роль водных растений в самоочищении за- грязненных вод (Мережко и др., 1996; Матвеев и др., 2004). Так, водные растения служат барьером для поступления в водоемы тяжелых металлов, нефтепродуктов, пестицидов, радионуклидов и других загрязняющих веществ (Кокин, 1982).
Согласно общепринятым представлениям, общая схема эволюционного пути водных растений: море–пресные воды–суша–пресные во-ды–море. Поэтому водные растения, с одной стороны, характеризуются сходством с наземными растениями в силу их филогенетической связи, но в то же время, имеют отличительные структурные и функциональные особенности, связанные с приспособлением к водной среде (Лукина, Смирнова, 1988).
Представители водной флоры, также как и наземные виды, обладают широким спектром органических соединений, играющих в жизни растений определяющую роль. Одной из важнейших групп биомолекул, обеспечивающих жизненно необходимые процессы растительных клеток, являются липиды. Особую роль среди этой группы биомолекул отводят мембранным липидам. Они способны не только отделять содержимое клетки от внешней среды и обеспечивать разделение внутреннего объема клетки на компартменты, но и участвовать в регуляции множества процессов (Болдырев и др., 1990; Антонов и др., 1992). К мембранным липидам растений относятся глико- (ГЛ) и фосфолипиды (ФЛ) (Васьковский, 1997). ГЛ входят в состав ограниченного числа клеточных структур, таких как хлоропласты или протопласты, ФЛ являются основным компонентом всех без исключения биологических мембран, как внешних, отделяющих клетку от окружающей среды, так и внутренних, разделяющих клетку на отдельные компартменты, или отграничивающих внутренние области внутриклеточных структур (субкомпартменты) (Marechal et al, 1997 ) . Среди растительных липидов сравнительно недавно обнаружен третий тип мембранных липидов – бетаиновые липиды (БЛ) (Dembitsky, 1996). Установлено, что эти липиды синтезируются некоторыми бактериями, грибами, водорослями и лишайниками (Benning et al., 1995; Dembitsky, 1996; Vaskovsky et al ., 1998; Geiger et al., 1999), а также высшими растениями Sporophyta (Sato, Furuya, 1984; Бычек, 1994). Наиболее часто встречаемым липидом в растениях является 1(3),2-диацилглицеро-3(1)-0-4′-(N,N,N-триметил)-гомосерин (ДГТС).
К сожалению, о липидном составе высших водных растений известно мало. О липидах водных растений накоплен большой экспериментальный материал, но он, в основном, касается морских растений или пресноводных водорослей. Детальные исследования липидов высших гидрофильных растений всего ряда увлажнения в настоящее время отсутствуют.
Учитывая большое систематическое разнообразие водных растений, включающее как низшие, так и высшие растения, с разной степенью погружения, а также важности такого структурно-функционального соединения клетки, как липиды, в институте экологии Волжского бассейна РАН на протяжении ряда лет проводились исследования липидного состава этой 661
группы растений (Rozentsvet et al., 1995; Dembitsky, Rozentsvet, 1996; Ро-зенцвет и др., 2000; 2002; 2005; Розенцвет, Босенко, 2002). Наиболее полная информация по составу липидов водных растений получена относительно ФЛ. Целью настоящей работы стало выявление особенностей липидного состава водных растений и границ вариабельности состава мембранных липидов в зависимости от систематического положения, характера жизненной формы, условий обитания, стадии развития и типа тканей, слагающих разные органы растений.
МАТЕРИАЛЫ И МЕТОДЫ
Растительный материал . Объектами исследования служили наиболее распространенные для региона Средней Волги водные растения (табл. 1).
Места отбора материала. Образцы растений отбирали в разных типах водоемов, в которых данные растения образуют разнообразные фитоценозы, нередко являясь в них доминантами:
-
1) мелководный залив у острова Шалыга-Середыш на акватории Саратовского водохранилища, расположенного в 17 км ниже Жигулевской ГЭС им. В.И. Ленина;
-
2) залив Волги – Змеиный затон, расположен в 60 км ниже по течению от плотины Жигулевской ГЭС им. В.И. Ленина (территория национального парка «Самарская Лука»);
-
3) озера окрестностей города Тольятти (оз. Светлое, Рыбацкое, Васильевское);
-
4) озера Жигулевского государственного заповедника (оз. Чистое, Злачное, Тещины Слезки, Глинистое);
-
5) болото «Клюквенное» (территория национального парка «Самарская Лука»);
-
6) ручей «Безымянный» (деревня Студенец, Ульяновской области).
Растения собраны по стандартным методикам, разработанным для водных растений (Катанская, 1991). Для анализа отбирали усредненные пробы биомассы, состоящие из нескольких растений целиком, т.е. листьев, стеблей и корней, или отдельные органы растений.
Таблица 1
Классификация и места отбора образцов высших водных растений (Черепанов, 1995)
|
Отдел, класс |
Порядок |
Семейство |
Вид |
Происхождение образцов |
|
1 |
2 |
3 |
4 |
5 |
|
Polypodio-phyta |
Polypodiales |
Athyriaceae |
Thelypteris palustris |
4 |
|
Salviniales |
Salviniaceae |
Salvinia natans |
3,4 |
|
|
Equisetophyta Angiospermae |
Equisetales |
Equisetaceae |
Equisetum fluviatile |
4 |
|
1 |
2 |
3 |
4 |
5 |
|
MAGNOLIO |
Ranales |
Nymphaceae |
Nuphar lutea (L.) Smith |
3 |
|
PSIDA |
Ceratophylla- |
Ceratophyllum demer- |
2,3 |
|
|
ceae |
sum L. |
|||
|
Polygonales |
Polygonaceae |
Polygonum amphibium L . =Persicaria amphibian (L.) S.F.Gray |
4 |
|
|
Myrtales |
Haloragaceae |
Myriophyllum spicatum L. |
2,4 |
|
|
Myriophyllum verticilla-tum L. |
4 |
|||
|
Polemoniales |
Lentibularia- |
Utricularia vulgaris L. |
4 |
|
|
ceae |
||||
|
Scrophularia- |
Veronica beccabunga L. |
6 |
||
|
ceae |
Veronica anagalis- aquatica L. |
6 |
||
|
LILIOPSIDA |
Butomales |
Hydrocharita- |
Elodea canadensis |
|
|
ceae |
Michx. |
|||
|
Alismatales |
Alismataceae |
Alisma plantago- |
1,2,3,4 |
|
|
aquatica L . Sagittaria sagittifolia L . |
1,4 |
|||
|
Potamogeto- |
Potamogetona- |
Potamogeton compres- |
1 |
|
|
nales |
cea |
sus L. Potamogeton filiformis Pers. |
1 |
|
|
Potamogeton berchtoldii Fieb. |
1 |
|||
|
Potamogeton friesii |
1 |
|||
|
Ruрr. Potamogeton lucens L. |
1,2,4 |
|||
|
Potamogeton perfolitus L. |
1,2,3,4 |
|||
|
Potamogeton pectinatus L. |
1 |
|||
|
Potamogeton pusillus L. |
1 |
|||
|
Potamogeton trichoides Cham. Et Schlecht. |
1,2,4 |
|||
|
Potamogeton natans L. |
4 |
|||
|
Arales |
Lemnaceae |
Spirodela polyrhiza |
4 |
|
|
Schleid. Lemna trisulca L. |
4 |
|||
|
Lemna minor L. |
3,4 |
|||
|
Thyphales |
Thyphaceae |
Typha angustifolia L . |
4 |
|
|
Cyperales |
Cyperaceae |
Scirpus sylvaticus L. |
4 |
|
|
Graminales |
Poaceae |
Alopecurus aequalis Sobol. |
4 |
1 - залив Волги о. Шалыга-Середыш; 2 - Змеиный затон; 3- озера г. Тольятти; 4 - озера Жигулевского заповедника им. И.И. Спрыгина; 5 - болото «Клюквенное»; 6 - ручей «Безымянный»
Экстракция и анализ липидов. Отмытые в проточной воде от эпифитов образцы измельчали с помощью высокоскоростного гомогенизатора (Кейтс, 1975). Экстракцию липидов проводили по методу Блайя и Дайера (Bligh, Dyer, 1959). ФЛ разделяли методом тонкослойной хроматографии на пластинках (6 х 6 см) с закрепленным слоем силиказоля (эстонская фирма "Хаапсалу) с применением систем растворителей: хлороформ-метанол-бензол-аммиак (130 : 60 : 20 : 12) – первое направление и хлоро-форм-метанол-бензол-ацетон-уксусная кислота (140 : 60 : 20 : 10 : 8) – второе направление. Для обнаружения и идентификации ФЛ использовали специфические реагенты: для фосфорсодержащих компонентов – молибденовый синий (Vaskovsky, Latyshev, 1975), для холинсодержащих липидов – реактив Драгендорфа, для аминосодержащих липидов – 0,2%-ый раствор нингидрина в ацетоне (Кейтс, 1975). Идентификация ДГТС проводилась по характерному окрашиванию с реактивом Драгендорфа (Dembitsky, 1996).
Содержание ДГТС определяли на спектрофотометре Sресо1-11 (Ро-зенцвет и др., 2000). Калибровочные кривые строили по количеству предварительно выделенного и очищенного ДГТС в диапазоне 1-10 мкг. Количество ФЛ анализировали методом Васьковского (Vaskovsky et al., 1975).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Вариабельность состава липидов в зависимости от систематического положения вида. Главным критерием для выделения водных растений в отдельную группу считают сам факт обитания их в водной среде. Это растения анатомо-морфологически и физиологически приспособленные к жизни в воде, которая является для них оптимальной средой обитания. Для многих из них в онтогенезе характерен различный контакт с воздушной, эдафической и водной средами. Но у некоторых растений весь жизненный цикл проходит только в воде (Лукина, Смирнова, 1988). По морфологическим и анатомическим особенностям водные растения разделяют на низшие (микрофиты) и высшие (макрофиты) растения. В систематическом аспекте к макрофитам относятся помимо цветковых растений и многоклеточные крупные водоросли и низшие споровые растения (Распопов, 1977; Белавская, 1982).
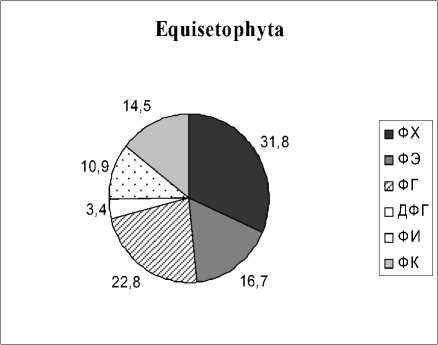
В данной работе изучен липидный состав растений, которые представляют собой 3 отдела, 4 класса, 13 порядков и 15 семейств (табл. 1). Из числа споровых растений (Sporophyta) проанализировано только три вида: Thelypteris palustris, Salvinia natans, Equisetum fluviatile . Большая часть исследованных нами растений является однодольными (Magno-liopsida) и двудольными (Liliopsida) цветковыми растениями (Angios-permae).
Среди ФЛ исследуемых видов водных растений обнаружены следующие компоненты: фосфатидилхолин (ФХ), фосфатидилэтаноламин (ФЭ), фосфатидилглицерин (ФГ) фосфатидилинозит (ФИ), фосфосфатидилсерин (ФС), фосфатидная кислота (ФК) и дифосфатилдилглицерин (ДФГ). Ре-664
зультаты количественных анализов мембранных ФЛ приведены в табл. 2. Распределение ФЛ по средним значениям каждого из фосфолипидных показателей для таксонов уровня отдела и класса представлено на рис. 1. Результаты свидетельствуют о том, что основную часть ФЛ в водных растениях составляют ФХ, ФЭ, ФГ и ФИ, который определялся совместно с ФС. Минорными компонентами являются ФК и ДФГ. Аналогичное распределение ФЛ характерно для листьев большинства наземных растений и зеленых водорослей (Somerville, Вrowse, 1991; Douce, Joyard, 1996; Harwood, 1998).
Таблица 2
Состав фосфолипидов водных растений
|
Вид |
Фосфолипиды, % от суммы |
|||||
|
ФХ |
ФЭ |
ФГ |
ДФГ |
ФИ |
ФК |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Thelypteris palustris |
59.6 |
4.7 |
11.6 |
3.4 |
9.11 |
11.5 |
|
36.8 |
12.4 |
21.8 |
6.4 |
12.7 |
10.0 |
|
|
Salvinia natans |
39.3 |
14.1 |
13.7 |
3.6 |
14.5 |
14.8 |
|
40.5 |
10.8 |
28.4 |
4.0 |
8.1 |
8.1 |
|
|
Equisetum fluviatile |
35.7 |
19.9 |
23.4 |
3.7 |
10.4 |
6.8 |
|
27.8 |
13.4 |
22.2 |
3.0 |
11.4 |
22.2 |
|
|
Ceratophyllum demersum |
36.0 |
19.2 |
13.4 |
4.0 |
14.4 |
13.1 |
|
59.3 |
16.9 |
11.3 |
2.7 |
6.7 |
3.1 |
|
|
48.4 |
18.4 |
17.3 |
2.9 |
6.3 |
6.5 |
|
|
Nuphar lutea |
37.6 |
20.6 |
12.2 |
7.1 |
16.3 |
6.2 |
|
43.1 |
19.9 |
17.7 |
2.7 |
13.0 |
3.6 |
|
|
42.3 |
15.3 |
12.3 |
3.7 |
17.3 |
9.1 |
|
|
36.3 |
20.5 |
15.9 |
2.2 |
14.1 |
11.0 |
|
|
43.1 |
17.0 |
12.2 |
2.7 |
21.4 |
3.6 |
|
|
Polygonum amphibium |
46.9 |
15.9 |
13.0 |
4.0 |
12.2 |
6.7 |
|
Myriophyllum verticillatum |
38.0 |
16.7 |
15.7 |
5.3 |
18.0 |
6.3 |
|
Myriophyllum spicatum |
49.1 |
20.8 |
14.6 |
3.2 |
6.8 |
5.5 |
|
33.9 |
18.9 |
17.2 |
3.6 |
10.7 |
15.7 |
|
|
Veronica beccabunga |
38.4 |
11.9 |
21.5 |
1.3 |
15.7 |
11.2 |
|
39.3 |
21.4 |
16.8 |
2.4 |
11.0 |
8.8 |
|
|
34.4 |
8.0 |
20.9 |
2.8 |
18.7 |
15.2 |
|
|
44.3 |
10.0 |
12.4 |
4.4 |
19.6 |
9.2 |
|
|
51.3 |
5.9 |
23.4 |
2.7 |
6.5 |
10.1 |
|
|
41.8 |
4.6 |
24.6 |
2.4 |
14.3 |
12.2 |
|
|
Veronica anagalis-aquatica |
37.8 |
17.4 |
21.3 |
4.3 |
8.6 |
10.6 |
|
41.6 |
24.2 |
17.8 |
1.7 |
8.2 |
6.5 |
|
|
41.6 |
25.7 |
16.3 |
0.7 |
5.7 |
10.0 |
|
|
37.9 |
23.1 |
23.9 |
2.3 |
6.8 |
5.8 |
|
|
Utricularia vulgaris |
51.1 |
10.8 |
18.7 |
4.3 |
12 |
3.1 |
|
30.1 |
11.7 |
36.0 |
3.3 |
16.6 |
2.3 |
|
|
43.3 |
10.1 |
14.6 |
3.2 |
14.2 |
14.6 |
|
|
44.0 |
10.4 |
19.0 |
3.3 |
12.0 |
11.3 |
|
|
32.1 |
4.8 |
36.2 |
6.2 |
18.3 |
2.4 |
|
|
39.4 |
19.1 |
20.5 |
3.2 |
16.4 |
10.5 |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Elodea canadensis |
47.4 |
20.2 |
22.1 |
1.7 |
4.4 |
3.6 |
|
45.1 |
20.7 |
23.8 |
2.2 |
4.6 |
3.6 |
|
|
52.8 |
19.0 |
19.3 |
2.0 |
4.0 |
2.9 |
|
|
42.0 |
23.7 |
22.9 |
1.6 |
3.9 |
3.3 |
|
|
52.8 |
22.0 |
20.5 |
1.1 |
3.6 |
0.1 |
|
|
46.4 |
22.8 |
20.1 |
1.0 |
6.5 |
2.4 |
|
|
Alisma plantago-aquatica |
55.8 |
13.2 |
16.4 |
2.4 |
9.4 |
2.8 |
|
35.9 |
20.5 |
15.90 |
2.6 |
14.1 |
11.0 |
|
|
41.6 |
17.7 |
18.60 |
3.8 |
10.0 |
4.9 |
|
|
51.6 |
19.8 |
12.9 |
1.2 |
13.3 |
1.2 |
|
|
43.4 |
23.0 |
10.60 |
3.9 |
17.3 |
1.8 |
|
|
41.0 |
29.2 |
11.80 |
1.9 |
14.6 |
1.5 |
|
|
Sagittaria sagittifolia |
42.7 |
10.9 |
21.9 |
4.0 |
12.4 |
8.1 |
|
42.5 |
24.3 |
17.5 |
2.0 |
10.8 |
2.8 |
|
|
36.6 |
21.6 |
18.1 |
2.1 |
14.6 |
7.0 |
|
|
Potamogeton compressus |
40.4 |
21.9 |
20.8 |
2.4 |
6.2 |
8.1 |
|
Potamogeton filiformis |
35.6 |
15.6 |
28.2 |
7.6 |
10.7 |
2.3 |
|
Potamogeton friesii |
40.1 |
18.4 |
14.8 |
3.7 |
8.9 |
14 |
|
Potamogeton pectinatus |
40.4 |
18.4 |
22.0 |
4.0 |
10.3 |
4.9 |
|
38.4 |
17.8 |
20.9 |
6.7 |
11.5 |
4.7 |
|
|
Potamogeton pusillus |
49.0 |
25.6 |
13.9 |
4.4 |
4.7 |
2.4 |
|
Potamogeton trichoides |
45.7 |
16.9 |
18.1 |
4.0 |
4.9 |
10.3 |
|
48.3 |
14.4 |
21.8 |
5.8 |
9.6 |
0.1 |
|
|
45.9 |
17.7 |
15.1 |
5.8 |
5.8 |
9.7 |
|
|
Potamogeton berchtoldii |
41.5 |
33.2 |
13.3 |
1.8 |
8.9 |
1.4 |
|
Potamogeton lucens |
48.0 |
16.1 |
20.2 |
3.5 |
11.4 |
0.9 |
|
49.0 |
15.9 |
18.3 |
5.1 |
9.0 |
2.6 |
|
|
57.7 |
17.2 |
15.6 |
3.6 |
5.2 |
0.6 |
|
|
50.0 |
14.9 |
16.4 |
5.6 |
9.6 |
3.6 |
|
|
44.7 |
14.1 |
21.4 |
6.1 |
8.6 |
5.1 |
|
|
48.2 |
14.6 |
20.4 |
2.8 |
9.1 |
5.0 |
|
|
Potamogeton natans |
57.7 |
5.7 |
18.11 |
6.3 |
9.4 |
2.8 |
|
50.3 |
6.3 |
21.0 |
6.8 |
14.0 |
1.2 |
|
|
42.9 |
19.8 |
18.0 |
7.3 |
10.5 |
1.7 |
|
|
Potamogeton perfoliatus |
42.2 |
11.2 |
23.9 |
4.7 |
11.3 |
6.7 |
|
58.2 |
19.9 |
14.0 |
1.5 |
5.9 |
0.5 |
|
|
41.4 |
11.0 |
24.9 |
3.0 |
14.0 |
5.7 |
|
|
42.2 |
11.2 |
23.9 |
4.7 |
11.3 |
7.7 |
|
|
49.3 |
16.6 |
21.7 |
3.3 |
4.1 |
5.4 |
|
|
48.6 |
17.8 |
21.9 |
2.4 |
5.0 |
4.1 |
|
|
47.2 |
16.3 |
23.0 |
2.7 |
5.8 |
5.1 |
|
|
55.3 |
11.8 |
23.5 |
1.5 |
4.8 |
3.2 |
|
|
49.5 |
19.9 |
24.4 |
1.7 |
1.2 |
3.3 |
|
|
46.5 |
19.5 |
18.9 |
4.5 |
6.3 |
4.4 |
|
|
53.2 |
10.3 |
25.1 |
3.2 |
3.2 |
5.0 |
|
|
51.9 |
17.8 |
20.8 |
3.4 |
2.3 |
3.8 |
|
|
50.8 |
12.4 |
23.8 |
5.6 |
5.6 |
1.8 |
|
|
43.8 |
18.2 |
17.1 |
4.7 |
9.2 |
7.1 |
|
|
45.7 |
19.2 |
17.3 |
5.7 |
3.6 |
8.5 |
|
|
49.3 |
16.6 |
21.7 |
3.3 |
4.1 |
5.4 |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Lemna trisulca |
35.5 |
20.2 |
16.1 |
9.1 |
11.3 |
7.8 |
|
43.1 |
16.8 |
15.7 |
0.1 |
23.1 |
1.2 |
|
|
37.6 |
23.2 |
16.8 |
3.2 |
15.2 |
4.0 |
|
|
45.1 |
17.2 |
17.1 |
2.2 |
12.7 |
2.6 |
|
|
Lemna minor |
50.8 |
18.8 |
14.8 |
2.0 |
12.5 |
1.1 |
|
34.4 |
21.9 |
14.4 |
3.7 |
14.9 |
10.7 |
|
|
40.5 |
17.5 |
22.0 |
4.0 |
12.5 |
3.5 |
|
|
Spirodela polyrhiza |
44.1 |
26.3 |
8.8 |
1.5 |
12.1 |
7.2 |
|
41.9 |
23.6 |
14.4 |
2.0 |
12.3 |
5.7 |
|
|
Typha angustifolia |
31.9 |
19.3 |
18.9 |
3.3 |
16.4 |
10.3 |
|
48.6 |
22.5 |
13.6 |
0.8 |
14.5 |
0.1 |
|
|
Scirpus sylvaticus |
35.2 |
19.3 |
24.2 |
1.5 |
15.5 |
4.2 |
|
Alopecurus aqualis |
35.2 |
21.0 |
15.6 |
0.4 |
14.6 |
13.3 |
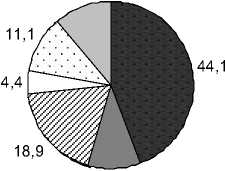
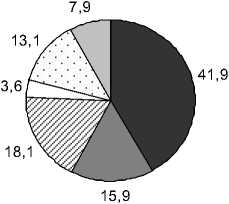
Доминирующим ФЛ является ФХ, как у всех фотосинтезирующих растений. Его содержание в зависимости от вида изменяется от 31.8% до 59.3% от суммы ФЛ. Далее по мере убывания следуют ФГ, ФЭ, ФИ, ФК и ДФГ. Причем, у растений Liliopsida среднее содержание ФГ и ФЭ практически одинаково. Несмотря на сходство в составе мембранных ФЛ у всех четырех групп растений, липиды растений Polypodiophyta и Equsetophyta
Polypodiophyta
11,1
10,5
□ ФХ
□ ФЭ
□ФГ
□ДФГ
□ФИ
□ФК
Magnoliopsida
■ ФХ
□ ФЭ
Q ФГ
□ДФГ
□ ФИ
□ ФК
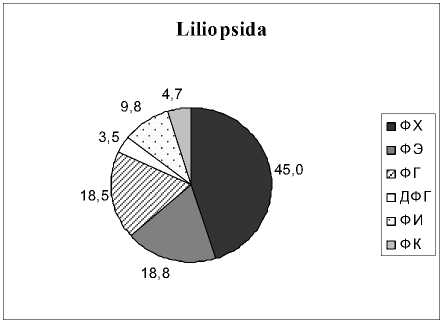
Рис. 1. Фосфолипиды (ФЛ) водных растений разных таксономических групп, % от суммы ФЛ
отличаются от липидов Angiospermae присутствием бетаинового липида ДГТС. Как следует из наших результатов, водные представители Polypodi-ophyta и Equsetophyta не являются исключением и подобно своим наземным аналогам способны синтезировать данный липид. В составе мембранных липидов водных растений отдела Angiospermae, также как и в наземных видах, данный липид не обнаружен. Это подтверждает известную из литературных источников гипотезу о том, что синтез БЛ был утрачен на определенном этапе эволюции (Benning et al ., 1995; Künzler, Eichenberger, 1997).
Анализ вариабельности фосфолипидных компонентов показывает, что интервалы, в которых варьируют эти показатели, заметно различаются. Например, для ФХ у Polypodiophyta диапазон вариабельности составляет 36.9-59.6% от суммы ФЛ, у Equsetophyta – 27.8-35.7%, у Magnoliopsida – 30.1-59.3%, у Liliopsida – 31.9-58.2%. Отношение максимального к минимальному содержанию ФХ варьирует в интервале 1.28-1.97 для разных таксонов. Для ФЭ это же отношение составляет 1.5-6.4; ФГ – 1.3-3.2; ФИ – 1.9-9.1; ФК – 1.8- и более 16. Из этого можно сделать вывод, что для всех видов водных растений ФХ является наименее вариабельным и, следовательно, более устойчивым компонентом мембран, исходя из того, что варьирование его содержания отличается наиболее узким диапазоном по сравнению с другими ФЛ.
Для наиболее близкородственных растений ранга семейства (Potamo-getonaceae) вариабельность ФХ составляет 35.6-58.2%, ФЭ – 5.7-33.2% , ФГ – 13.3-28.2%. Еще более узкие пределы вариабельности ФЛ наблюдаются для одного вида растений. Например, для P. perfoliatus , представленного в наших исследованиях наибольшим широкой выборкой материала, вариабельность содержания ФХ составляет 41.2-58.2%, ФЭ – 10.3-19.9%, ФГ – 14.0-25.1%. Заметно более узкие пределы вариабельности для каждого из ФЛ наблюдаются также для A.plantago - aquatica и U. vulgaris. Но во всех случаях ФХ остается наиболее устойчивым компонентом ФЛ. Этот факт объясняется тем, что ФХ по своему строению является полностью электронейтральным липидом. Он обладает исключительной способностью существовать в виде бимолекулярных слоев в крайне широком диапазоне ионных концентраций и температур, причем, он не только сам образует стабильные ламеллярные структуры, но и способствует их образованию при смешивании с другими липидами, не способными образовывать бислои при данных условиях (Ивков, Берестовский, 1981). Исходя из этого, наиболее постоянный уровень в содержании ФХ, по-видимому, вызван необходимостью поддержания бислойной структуры мембран.
Вариабельность состава липидов в зависимости от экологического статуса растений. С экологической точки зрения, то есть с учетом приспособленности к водной среде, водные растения, встречаемые в водоемах и водотоках Среднего Поволжья, проанализированные в данной работе, согласно классификации Папченкова (1986) делятся на следующие 668
экологические группы: I – свободно плавающие в толще воды ( Cerato-phyllum demersum, Spirodela polyrhiza, Lemna trisulca, Utricularia vulgaris); II – погруженные укореняющиеся растения ( Myriophyllum spicatum, Myriophyllum verticillatum, Potamogeton compressus, P. filiformis, P. friesii, P. lucens, P. perfoliatus, P. pectinatus, P. pussillus P. berchtoldii P. trichoides, Elodea canadensis;) III – свободно плавающие на поверхности воды ( Lemna minor, Salvinia natans); IV – укореняющиеся гидрофиты с плавающими листьями ( Nuphar lutea, Potamogeton natans, Polygonum amphi-bium ); V – высокотравные гелофиты ( Typha angustifolia); VI – низкотравные гелофиты ( Alisma plantago-aquatica, Alopecurus aеqualis, Veronica beccabunga, V. anagalis-aquatica); VII – Equisetum fluviatile, Sagittaria sagit-tifolia, Thelypteris palustris ); VIII – околоводные травянистые гигрофиты ( Scirpus sylvaticus).
Сравнение состава липидов растений в зависимости от экологической принадлежности проведено для наиболее значимых в количественном отношении липидов, а именно ФХ, ФЭ, ФГ и ФИ, которые можно назвать главными ФЛ (табл. 2). Для всех гидрофитных растений (группы I-IV) содержание ФХ варьирует в диапазоне 30.1-59.3% от суммы ФЛ, ФЭ – 4.633.2%, ФГ – 8.8-36.2%. Для гелофитов соответствующие показатели выглядят следующим образом: ФХ – 27.8-59.6%; ФЭ – 4.7-29.2%; ФГ – 10.424.2%. При достаточно широком уровне содержания практически всех главных ФЛ, диапазоны вариабельности для гидрофитов и гелофитов оказались одинаковыми. На рис. 2 приведены границы вариабельности ФЛ растений в отдельных экологических группах. Очевидно, что изменчивость количественного состава липидов имеет общий характер для всех экологических групп, исходя из сходства полученных диаграмм. В то же время, оказалось, что для растений плавающих (группы I, III), и гелофитов и око-ловодных гигрофитов (группы V-VIII) диапазоны варьирования содержания ФЛ более узкие по сравнению с диапазоном варьирования ФЛ погруженных укореняющихся растений (группа II) и погруженных растений с плавающими на поверхности листьями (группа IV) (рис. 2). Возможно, что эти различия, связаны с тем, что каждая из экологических групп растений имеет разную степень контакта с воздушной, водной и почвенной средами. Если растения группы I в основном связаны с водной средой, то диапазон вариабельности их ФЛ достаточно узок. Гелофитные растения (группы VVIII) в большей степени контактируют с воздушной средой и состав липидов у этих растений также менее вариабелен. Растения группы IV (погруженные укореняющиеся растения) связаны в равной мере со всеми тремя средами, что приводит к большей лабильности мембран и липидов, входящих в их состав.
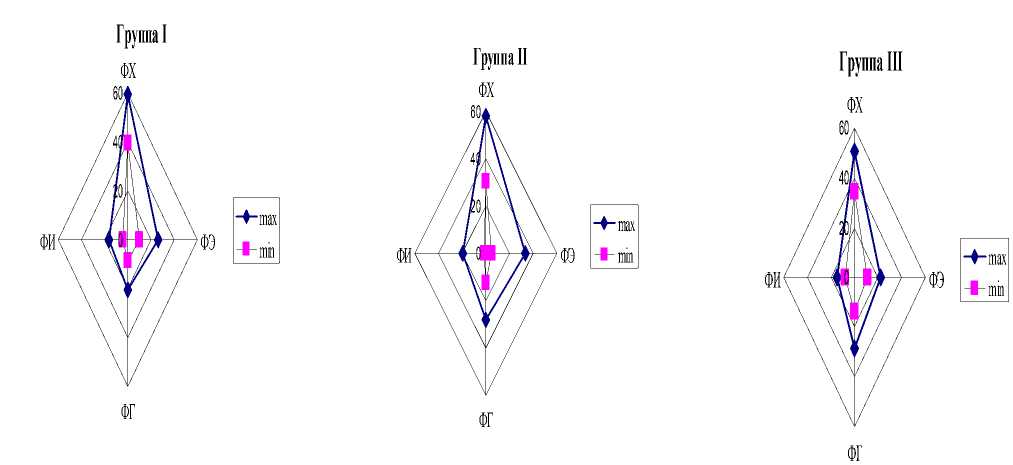
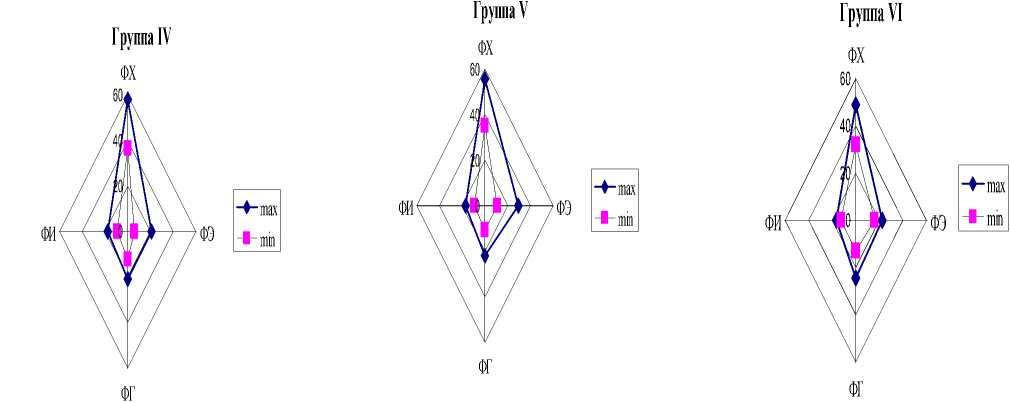
Рис. 2. Распределение фосфолипидов в водных растениях в зависимости от экологической группы
Многие исследователи отмечают, что состав липидов может существенно изменяться в зависимости то условий обитания (Kuiper, 1984; Harwood, 1998). В связи с этим вариабельность липидного состава растений может служить мерой адаптационного потенциала растительного организма. Вполне возможно, что границы вариабельности состава липидов растений в разных жизненных формах, могут свидетельствовать о разных адаптационных возможностях растений, относящихся к этим группам. С этой точки зрения, погруженные укореняющиеся водные растения (группа II) должны обладать большей пластичностью, чем все остальные группы растений, поскольку вариабельность их липидных характеристик выше по сравнению с липидами растений других экологических групп.
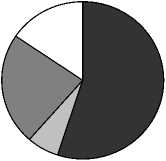
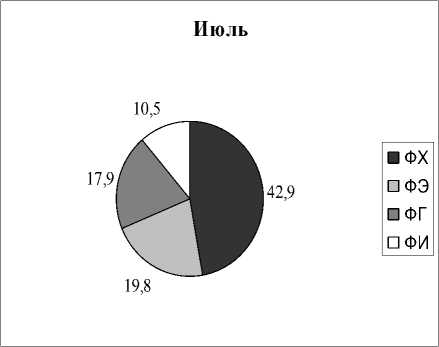
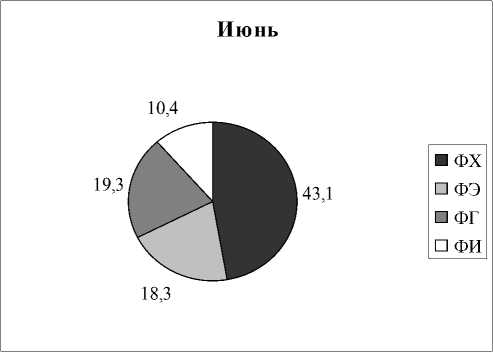
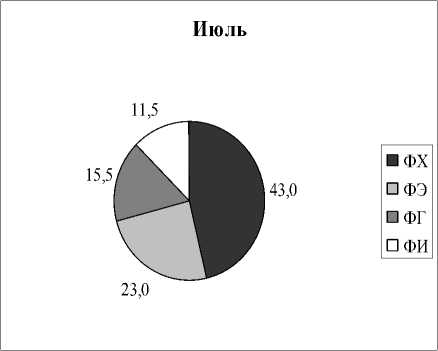
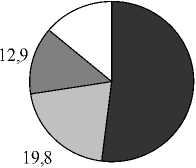
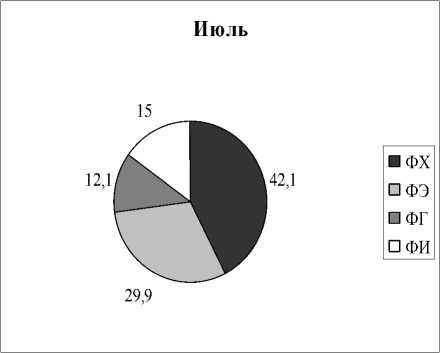
Вариабельность состава липидов в зависимости от времени отбора. Как следует из представленных выше результатов, все растения отбирались в разных типах водоемов и в разное время. Но для некоторых видов растений оказалось возможным проведение сравнительных исследований, когда пробы отбирались в разных озерах и дважды в течение одного вегетационного сезона. На рисунках 3,4 приведены результаты анализов состава ФЛ для Potomogeton natas и Alisma plantago-aquatica . Это растения одного класса Liliopsida, но разных порядков и семейств ( P. natas – порядок Potamogetonales, A. plantago-aquatica- порядок Alismatales). По экологическим признакам P. natas является гидрофитом, а A. plantago-aquatica - гелофитом . Для гидрофита P. natas (рис. 3) содержание ФЛ в образцах, собранных в июне в разных озерах, практически идентичны, за исключением содержания ФЭ. Мало отличается состав ФЛ в образцах этого растения, собранных в июле из разных озер, снова исключая ФЭ. Если учесть, что места обитания этого вида растения представляют собой близко расположенные друг от друга озера, имеющие одинаковые источники питания и гидрохимический состав (Розенцвет и др., 2000), то вполне естественно, что состав ФЛ в разных образцах является одинаковым. Небольшое изменение, не превышающее 15%, отмечено в содержании ФХ в образцах, собранных в июне и в июле. Наибольшая вариабельность как от места обитания, так и от времени сбора материала, обнаружена в содержании ФЭ, разница между минимальным и максимальным его содержанием отличалась более, чем в три раза. Для гелофита A. plantago-aquatica (рис. 4) разница в содержании всех главных ФЛ оказалась менее заметной, и даже для ФЭ вариабельность не превысила 33%. Вероятно, состав липидов у взрослых растений (поздняя стадия онтогенеза), обитающих в идентичных местах, существенно не меняется.
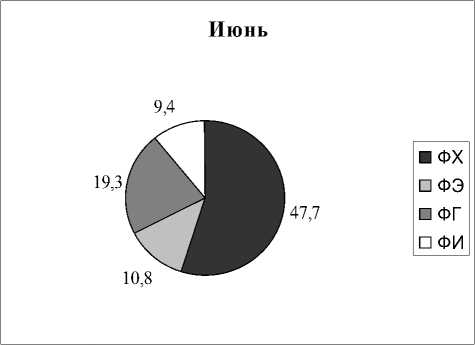
Июль
6,6
22,0
43,5
8,7
□ ФХ
□ ФЭ
□ ФГ
□ ФИ
Озеро Чистое
Июнь
14,0
21,0
50,0
5,8
□ ФХ □ ФЭ □ ФГ □ ФИ
Озеро Тещины слезки
Рис. 3. Распределение фосфолипидов у Potamogeon perfoliatus в зависимости от времени и места обитания, % от суммы ФЛ
Вариабельность состава липидов в разных органах растений. Тело высших или листостебельных растений расчленено на органы: корни, стебли, листья, цветки, клубни и т.д. (Лотова, 2000). В связи с этим представляло интерес выяснить, в какой мере эта дифференциация отражается на качественном и количественном составе липидов. С этой целью был исследован ФЛ состав отдельных органов трех видов растений Veronica beссabunga, Potamogeton perfoliatus и Salvinia natans, которые имеют разные систематический и экологический статусы . Из нескольких, примерно равного возраста растений, отбирались отдельно листья, стебли, корни и цветы в количестве достаточном для выделения липидов и их последующего анализа.
Как следует из данных, представленных в табл. 3, ФХ является главным ФЛ в листьях и цветах всех трех видов. Однако, если в листьях V. beccabunga количество ФХ составляет 53.6% от суммы ФЛ, то в цветах его уровень составляет только 29.4%, а в стеблях – 22.2%. Второе место по вкладу в ФЛ в листьях всех видов занимает ФГ. ФЭ в листьях и корнях
Озеро Чистое
Июнь
13,3
49,6
-
□ ФХ
-
□ ФЭ
-
□ ФГ
-
□ ФИ
Озеро Глинистое
Рис. 4. Распределение фосфолипидов у Alisma plantago-aquatica в зависимости от времени и места обитания, % от суммы ФЛ составляет лишь 2.5 - 6.3%. Уровень ФИ практически одинаков в липидных экстрактах, выделенных из разных органов. Количество ФК и ДФГ отличается более значительно. Так, в цветах V. beccabunga ФК больше, чем в листьях почти в 3 раза, в стеблях ФК занимает лидирующее положение (39.9% от суммы ФЛ), а в корнях уровень ФК равен уровню ФХ. Более высокое содержание ФК в стеблях по сравнением с содержанием в листьях отмечено и для P. perfoliatus. Если принять во внимание, что ФК является основным субстратом в синтезе ФЛ, то, возможно, что большое количество ФК, обнаруженное нами в корнях и стеблях, связано с меньшей скоростью липидного обмена в этих органах.
Таблица 3
Состав фосфо- и бетаиновых полярных липидов в разных органах водных растений
|
Название |
Фосфолипиды, % от суммы |
ДГТС, мг/г |
|||||
|
органа |
ФХ |
ФЭ |
ФГ |
ДФГ |
ФИ |
ФК |
липидов |
Veronica beccabunga
|
Листья |
53.6 |
2.5 |
23.8 |
6.0 |
9. 8 |
4.3 |
Отсутствие |
|
Стебли |
22.2 |
8.3 |
18.1 |
3.4 |
8.1 |
39.9 |
Отсутствие |
|
Корни |
33.5 |
20.8 |
9.9 |
1.2 |
9.8 |
24.8 |
Отсутствие |
|
Цветы |
29.4 |
6.3 |
24.5 |
7.4 |
17.0 |
15.4 |
Отсутствие |
Potamogeton perfoliatus
|
Листья |
48.2 |
16.6 |
19.4 |
5.3 |
6.1 |
10.2 |
Отсутствие |
|
Стебли |
25.6 |
17.2 |
14.3 |
6.0 |
11.3 |
25.2 |
Отсутствие |
Salvinia natans
|
Надводные |
40.5 |
10.8 |
28.4 |
4.0 |
8.1 |
8.1 |
20.3 |
|
листья Подводные |
71.7 |
21.0 |
0 |
1.6 |
5.2 |
0.5 |
34.0 |
|
листья Сорусы |
51.2 |
16.7 |
2.3 |
0.5 |
20.3 |
9.0 |
20.8 |
У S. natans, в отличие от наземных представителей Polypodiophyta, существует два типа листьев – надводные и подводные, но отсутствуют корни (Губанов и др., 1984). Под водой развиваются и шаровидные сорусы, представляющие собой группу расположенных скученно спорангиев, ответственных за бесполое размножение. В надводных листьях S. natans главным ФЛ является ФХ (40.5%), затем следуют ФГ, ФЭ и другие липиды, что согласуется с данными по анализу ФЛ наземных видов (Rozentsvet et al ., 2001; Розенцвет и др., 2002). В подводных листьях ФХ по-прежнему лидирует среди всех ФЛ. Однако его доля намного выше, чем в надводных листьях и достигает 71.7%. Доля ФГ при этом составляет только 2.7%. В сорусах количество ФХ равно 51.2%, то есть почти столько же, сколько и в надводных листьях, но содержание ФГ в них аналогично содержанию ФГ в подводных листьях (2.3%). Достаточно большая разница в содержании и других ФЛ. Содержание ФЭ в подводных листьях в два раза превышает его содержание в надводных листьях (21.0% против 10.8%). Все это говорит о том, что состав липидов клеточных мембран, соответствующих клеткам разных органов одного и того же растения и разным жизненным формам одного органа (подводные и надводные листья), значительно различается. В надводных листьях наблюдается достаточно типичное распределение ФЛ, характерное для листьев высших растений, а липиды подводных листьев более обогащены ФХ при низком содержании ФГ.
Количество ДГТС в надводных листьях S. natans составляет 20.3 мг/г липидов, что практически равно содержанию ДГТС в сорусах. В подводных листьях уровень ДГТС выше и составляет 34.0 мг/г липидов. Сравнивая количества ДГТС и ФЛ, можно отметить, что вклад этого липида у S. natans довольно значителен и составляет 13.9-33.6% от суммы ФЛ и ДГТС.
Таким образом, количественное соотношение ФЛ может существенным образом зависеть как от ткани, слагающей разные органы исследованных растений, так и от типа листьев в случае их гетерофильного существования .
ЗАКЛЮЧЕНИЕ
На основании полученных данных можно прийти к следующим выводам. Качественный состав мембранных липидов водных растений не имеет принципиальных отличий от состава липидов наземных растений соответствующего систематического ранга.
Экологическая вариабельность количественного состава мембранных фосфолипидов водных растений зависит от экологической группы и жизненной формы растения, а также от типа ткани. Границы изменчивости в содержании ФГ и ФЭ, являются более широкими по сравнению с ФХ, что позволяет говорить о том, что эти липиды являются более чувствительными к совокупному воздействию факторов среды.
Список литературы Сравнительная оценка экологической вариабельности мембранных фосфолипидов водных растений
- Антонов В.Ф., Смирнова Е.Ю., Шевченко Е.В. Липидные мембраны при фазовых превращениях. М.: Наука, 1992. 136 с.
- Белавская А.П. Основные проблемы изучения водной растительности СССР // Бот. журн. 1982. Т. 67, № 10. С. 1313-1320.
- Бычек И.А. Особенности распределения липидов в бриофитах: таксонометрический и экологический аспекты // Биохимия. 1994. Т 59, № 11. С. 1646-1662.
- Васьковский В.Е. Липиды // Соросовский образоват. журн. 1997. № 3. С. 32-37.
- Гаевская Н.С. Роль высших растений в питании животных пресных водоемов. М.: Наука, 1966. 328 с.


