Сравнительная оценка микробной контаминации при пародонтите и периимплантите. Обзор
Автор: Тунева Н.А., Богачева Н.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2021 года.
Бесплатный доступ
Представлен обзор литературы, посвящённой изучению микрофлоры при воспалительных заболеваниях пародонта. Патологический процесс в виде пародонтита, который часто является причиной потери зубов и постановки имплантатов, способствует прогрессированию воспалительного процесса в тканях пародонта. Проведена сравнительная оценка микробиоты при пародонтитах и периимплантитах, которые, по мнению отдельных авторов, по составу микроорганизмов являются разными экосистемами. Рассмотрены альтернативные взгляды на данный вопрос. На основании проанализированных научных данных сделано заключение о сходстве и различии микробиоты полости рта при пародонтитах и периимплантитах, а также при их сочетанном течении. Обоснована целесообразность оценки микробных патогенов в периимплантной зоне с целью разработки мер профилактики и лечения, направленных на долгосрочную выживаемость дентальных имплантатов.
Микроорганизмы пародонтопатогены, дентальный имплантат, мукозит, периимплантит, пародонтит, факторы риска дентальной имплантации
Короткий адрес: https://sciup.org/147235447
IDR: 147235447 | УДК: 616.31-022:579 | DOI: 10.17072/1994-9952-2021-2-101-109
Текст научной статьи Сравнительная оценка микробной контаминации при пародонтите и периимплантите. Обзор
На современном этапе дентальная имплантация стала широко применяться у различных групп пациентов.
Успех постановки дентальных имплантатов во многом зависит как от общего состояния организма пациента, так и от техники постановки имплантатов, мастерства и опыта врача-имплантолога и ведения пациента в постоперационном периоде.
Одной из ключевых причин развития периим-плантита является инфицирование периимплан-татных тканей микроорганизмами полости рта, которое происходит вследствие неудовлетворитель- ной индивидуальной гигиены полости рта и образования зубной бляшки на поверхности супраструктуры имплантата.
Следует отметить такой немаловажный фактор риска при имплантации зубов, как наличие в анамнезе пациента пародонтита. В литературе описано множество доказательных фактов о связи этого заболевания с предрасположенностью к пе-риимплантиту. Так, у больных с хроническим пародонтитом чаще можно встретить осложнения имплантации зубов.
Развитие периимплантита у лиц с воспалитель-
ными заболеваниями пародонта в анамнезе под- научные взгляды на особенности микробиоценоза тверждено результатами множества научных исследований, посвященных данной проблеме [Гру-дянов, Фоменков, 2009; Пашкова и др., 2013; Николаева и др., 2014; Николаев, Цепов, 2019].
Результаты клинических исследований доказали, что риск развития периимплантита у больных пародонтитом как в активной форме, так и в стадии ремиссии, выше в пять раз, чем у пациентов со здоровым пародонтом [Тунева, Богачева, Тунева, 2019].
Есть основания полагать, что микроорганизмы, вызывающие пародонтит и периимплантит, идентичны. В пародонтальных карманах зубов и зоне вокруг имплантатов обнаруживаются аналогичные патогенные микроорганизмы. Однако ряд авторов отрицают возможность инфицирования периим-плантатной зоны от патологических очагов инфекции в тканях пародонта. Таким образом, вопрос изучения микробиоты при сочетанном течении двух данных процессов остается не до конца изу- [Николаев, Цепов, 2019]. На рис. 1 представлен ченным [Гударьян, 2014; Мащенко и др., 2019]. пародонт зуба в норме и при наличии воспали-
Рассмотрим последовательно существующие тельных явлений.
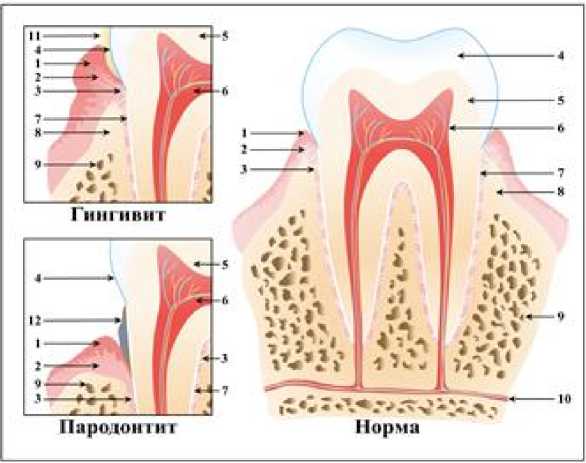
Рис. 1 . Строение пародонта в норме и при заболеваниях пародонта:
1 – эпителиальный слой слизистой оболочки; 2 – собственная пластинка слизистой оболочки с подслизистой основой; 3 – волокна периодонта; 4 – эмаль; 5 – дентин; 6 – пульпа; 7 – цемент; 8 – кортикальная кость; 9 – губчатая кость; 10 – сосуды и нервы; 11 – мягкие зубные отложения; 12 – твердые зубные отложения
Существует множество концепций патогенеза воспалительных заболеваний пародонта: «теория бактериальной бляшки», «теория нарушения трофики тканей», «теория аутоиммунных процессов на ткани зуба», «цитокиновая концепция» [Орехова, 2004], при этом пародонтопатогенная микрофлора выступает в роли триггерного (пускового) механизма в активации патологического процесса [Ван Дер Бийль, 2014].
Различные виды микроорганизмов образуют ассоциации (биопленки) для совместного выжива- у пациентов с воспалительными поражениями пародонта.
Пародонт – это комплекс тканей, окружающих и поддерживающих зубы в альвеолах верхней и нижней челюстей. В состав пародонта входят десны, периодонт, цемент зуба, надкостница и, собственно альвеолярные отростки,
Заболевания пародонта – воспалительнодеструктивные процессы, сопровождающиеся разрушением связочного аппарата зуба и альвеоляр- ной кости. Пусковым механизмом возникновения воспаления тканей пародонта, как уже было отмечено выше, являются зубные отложения – мягкий зубной налет и зубная бляшка. Они образуются вследствие недостаточной гигиены полости рта, качественных и количественных изменений состава микрофлоры полости рта, анатомических особенностей строения зубочелюстной системы и снижения иммунитета на общем и местном уровне ния в ротовой полости. В биопленках микробы находятся в тесном межвидовом взаимодействии, при этом возрастает патогенность микроорганизмов, происходит взаимное обеспечение их питательными веществами, обмен генетической информацией, формируются собственные сигнальные связи внутри колонии, повышается способность к адгезии и т.д. [Медицинская …, 2016].
Среди микробных комплексов, играющих значимую роль в развитии заболеваний пародонта, наиболее важным для поддержания нормального микробиоценоза полости рта, является «желтый комплекс», состоящий из следующих представителей рода Streptococcus: S. viridans, S. sanguis, S. in-termedius, S. mitis, S. oralis. Бактерии «желтого комплекса» вступают в антагонизм с пародонтопа-тогенами и играют защитную роль. «Пурпурный комплекс» включает Veillonella parvula и Actinomyces odontolyticus. «Зеленый комплекс» представлен Aggregatibacter actinomycetem comi-tans, Eikenella corrodent, Capnocytophaga spp. Данное сочетание микробов в «зеленом комплексе» является причиной как заболеваний пародонта, так и прочих поражений слизистой оболочки рта и твердых тканей зубов. В «оранжевом комплексе» группируется множество различных видов: Prevo-rella nigrescens, P. intermedia, Eubacterium nodatum Peptostreptococcus micros, Campylobacter rectus, C. spp., Streptococcus constellatus, Fusobacte-rium periodonticum, F. nucleatum. Среди перечисленных F. nucleatum имеет высокую коагрегатив-ную способность относительно других бактерий и соединяет бактерии «желтого» и «оранжевого комплексов». «Красный комплекс» состоит из Porphi-romonas gingivalis, Tannerella forsythia, и Treponema denticola. Эти микроорганизмы обнаруживаются в поддесневом пространстве и рассматриваются как основные пародонтопатогены в развитии заболеваний пародонта [Ximénez-Fyvie, Haf-fajee, Socransky, 2000].
Взгляды ученых на первостепенную роль микробных патогенов в развитии воспалительных заболеваний пародонта неоднозначны.
По мнению Л.Ю. Ореховой [2004], в пародон-тальных карманах в 100% случаев выделяются микроорганизмы рода Streptococcus и Peptostrep-tococcus, в 96% случаев – Staphylococcus, в 68% – Micrococcus, Peptococcus и Lactobacillus, в 26% – Actinomyces, в 14 – 16% – Bacteroides, Porphiromo-nas, Prevotella, Bacillus, Bifidobacterium, Candida .
А.В. Цимбалистов с соавт. [2010] доказали ведущую роль в этиологии локализованного агрессивного пародонтита микроорганизма Aggregati-bacter actinomycetemcomitans .
Н.А. Агаева [2010], при исследовании мазков ротовой полости, установила увеличение численности представителей актиномицетов ( Actinomyces viscosus, A. naeslundii, A. israelli ) при заболеваниях пародонта.
В.Н. Царев с соавт. считают, что для подтверждения диагноза заболеваний пародонта достаточно идентификации одного или двух видов бактерий: Aggregatibacter actinomycetemcomitans, Tan-nerella forsythia, Porphyromonas gingivalis, Prevotella intermedia, Campylobacter rectus, Fuso-bacterium nucleatum /periodonticum, Treponema denticola, Parvimonas micra [Царев, Николаева, Ипполитов, 2017].
Л.П. Герасимова с соавт. [2017] полагают, что основной причиной, индуцирующей длительное хроническое воспаление с разрушением тканей десны, а в дальнейшем приводящих к резорбции костной ткани являются две группы резидентных микроорганизмов, присутствующих в «зубной» бляшке – кариесогенных ( Streptococcus mutans, S. sobrinus, S. sanguis, S. uberis, Lactobacillus aci-dophyllus, Rothia dentacariosa, Porphyromonas en-dodоntalis ) и пародонтопатогенных ( Porphyromo-nas gingivalis, Tannerella forsythia, Treponema denticola, Aggregatibacter actinomycetemcomitans, Fusobacterium nucleatum, Veionella parvulla, Actinomyces viscosus, Phoprionibacterium aches, Prevotella intermedia ).
Если подходить к вопросу значимых пародон-топатогенов с позиции их идентификации, то среди некультивируемых микроорганизмов полости рта, выделяемых при помощи молекулярногенетического метода, по мнению А.Б. Чухловина и др. [Патент РФ …, 2008], наиболее значимыми в развитии пародонтита являются 5 видов микроорганизмов: Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Aggregatibacter ac-tinomycetemcomitans, Prevotella intermedia .
По данным F. Romano с соавт., у больных пародонтитом при использовании ПЦР Tannerella forsythia , Porphiromonas gingivalis , Prevotella intermedia , Treponema denticola и Aggregatibacter аctinomycetemcomitans были выявлены, соответственно, в 72.2, в 61.1, в 55.6, в 50.0 и в 33.3% случаев [Romano, Barbui, Aimetti, 2007].
Установлено, что в процессе развития патологического процесса в пародонте, в том числе на фоне лечения, состав микрофлоры пародонтально-го кармана существенно меняется.
Э.Р. Тамарова с соавт. [Тамарова и др., 2020] в своих исследованиях выявили, что у больных хроническим пародонтитом до лечения в содержимом пародонтального кармана наиболее часто выявляются Streptococcus mutans – у 78.1%, S. oralis и S. sobrinus, соответственно, у 67.2 и 56.3% обследованных больных.
О.А. Зорина считает, что лидерами роста на фоне прогрессирования пародонтита являются Porphiromonas gingivalis, Prevotella intermedia и Tannerella forsythia , демонстрирующие прогрессирующее увеличение относительно общей бактериальной массы более чем в 100 раз [Зорина и др., 2011].
В.Н. Царев с соавт. [Царев, Николаева, Ипполитов, 2017], кроме вышеперечисленных микроорганизмов, к патогенам прогрессирования относит Aggregatibacter actinomycetemcomitans .
Таким образом, мнение ученых относительно ведущих пародонтогенов неоднозначно. Однако большинство в развитии воспалительных заболе- ваний пародонта среди культивируемых отдают приоритет Streptococcus mutans, S. sobrinus, S. mi-tis, S. uberis, Veionella parvulla, Rothia dentacari-osa, Actinomyces viscosus, A. naeslundii, A. israelli, Capnocytophaga spp., Enterobacter spp., и др. Среди некультивируемых ведущая роль принадлежит – Porphyromonas gingivalis, Tannerella forsythia, Treponema denticola, Prevotella intermedia, Aggre-gatibacter аctinomycetemcomitans, Campylobacter rectus, Parvimonas micra, Fusobacterium nucleatum, F. periodonticum. Микроорганизмами-маркерами начала патологического процесса в пародонте можно рассматривать Tannerella forsythia, Actinomyces israelli и Campylobacter rectus, а маркерами
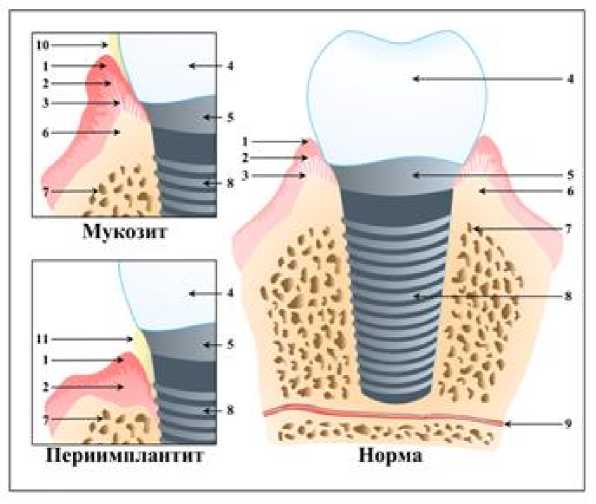
Рис. 2. Строение структур периимплантных тканей в норме и при патологии:
1 – эпителиальный слой слизистой оболочки; 2 – собственная пластинка слизистой оболочки с подслизистой основой; 3 – коллагеновые волокна; 4 – коронка; 5 – абатмент; 6 – кортикальная кость; 7 – губчатая кость; 8 – имплантат; 9 – сосуды и нервы; 10, 11 – бактериальная бляшка
Однако патология в виде периимплантита более сложна. Это связано прежде всего со структурными особенностями периимплантной зоны. Так, Canullo L, Penarrocha-Oltra D с соавт. высказали предположение, что отсутствие пародонтальной связки у имплантата делает ткани периимпланта-татной зоны подвижными, соответственно это приводит к большей травматизации, а следовательно, повышает адгезивные возможности микроорганизмов, способствуя контаминации ими пери-имплантных зон и быстрому прогрессированию периимплантита [Canullo et al., 2015].
Поверхностный оксидный слой имплантата требует определенного физико-химического состояния для обеспечения биосовместимости имплантата с окружающими его тканями. Периимплант-ная зона является благоприятным местом обитания анаэробов. Патологический процесс в виде паро- прогрессирования воспалительного процесса являются Porphyromonas gingivalis, P. intermedia, Treponema denticola и Aggregatibacter actinomy-cetemcomitans.
Проведем сравнительную оценку микробиоценоза у пациентов с пародонтитами и периимплан-титами.
Воспалительная реакция тканей, окружающих остеоинтегрированный имплантат, сопровождается потерей опорной кости, что делает его сходным с хроническим пародонтитом [Esposito, Grusovin, Worthington, 2012].
На рисунке 2 представлено строение структур периимплантных тканей в норме и при патологии.
донтита, который часто является причиной потери зубов, способствует возникновению или прогрессированию воспалительного процесса в тканях, окружающих имплантат. При этом анаэробная инфекция создает кислую среду вокруг имплантата и является физико-химической угрозой для стабильности оксидного слоя имплантата, что может вызвать нарушение соединения имплантата с десной и костью и в дальнейшем потерю окружающих и поддерживающих имплантат тканей.
По этим причинам знание микробиологического профиля, связанного с периимплантитом, является одним из факторов, необходимых для профилактики и успешного лечения периимплантитов, особенно у лиц, страдающих пародонтитом в анамнезе.
Анализ литературных источников свидетельствует о том, что микробиоценоз периимплантитов и пародонтитов различается по составу и количеству микроорганизмов [Агаева, 2010; Гударьян, 2014; Николаева и др., 2014; Lafaurie et al., 2017].
Существуют явные различия между результатами исследования субгингивальной биопленки у пациентов, больных периимплантитом со здоровым пародонтом и больных пародонтитом и пери-имплантитом. Изучение микробиома субгингивальной биопленки позволяет определить некуль-тивируемые бактерии, которые колонизируют имплантаты при периимплантите. Как здоровые имплантаты, так и периимплантиты колонизируются пародонтопатогенными микроорганизмами . При этом перимплантит, по сравнению с пародонтитом, представляет собой гетерогенную инфекцию большей сложности, вызванную преимущественно некультивируемыми грамотрицательными видами бактерий.
По данным научных исследований ученых Университета Эль Боске (Колумбия), частоту обнаружения методом ПЦР пародонтопатогенов полости рта у пациентов с типичными формами пе-риимплантита можно представить следующим образом: A. actinomycetemcomitans – в 52.3%; P. intermedia – 42.8% ; P. gingivalis – в 33.3%; T. forsythia – в 23.8% случаев [Lafaurie et al., 2017].
Однако P. intermedia, C. rectus и T. forsythia встречались более часто при пародонтите, чем при периимплантите. Также при периимплантите чаще чем при пародонтите обнаруживались P. aeruginosa, S. aureus и C. аlbicans. В то время как P. micra, P. intermedia и F. nucleatum были в более высокой пропорции в консорциумах при пе-риимплантите в сравнении со здоровыми имплантатами.
При сравнении бактериальных сообществ пе-риимплантитов и пародонтитов также наблюдались различия. Периимплантит характеризовался большим бактериологическим разнообразием ( Peptococcus spp, , Mycoplasma spp. , Campylobacter spp, , Butyrivibrio spp. , S. mutans, Eubacterium spp. , Porphyromonas spp., Achromobacter xylosoxidans ), чем пародонтит, и содержанием более высоких концентраций микроорганизмов в анализируемом биологическом материале. При этом микробный состав периимплантых зон представлен в исследованиях следующими некультивируемыми микроорганизмами: Eubacterium nodatum, E. brachy, Eu-bacterium saphenum, E. minutum, Filifactor alocis, Slackia exigua, Parascardovia denticolens. Dialister invisus, Eubacterium infirmum, Actinomyces car-diffensis и Gemella sanguinis , а также грамотрица-тельными анаэробами, такими как Mitsuokella spp. , Leptotrichia hofstadii, Kingella denitrificans, Treponema lecithinolyticum . Микроорганизмы оранжевого комплекса, такие как P. intermedia и
Streptococcus spp., также ассоциировались с пери-имплантитом, что указывает на важную роль этих микроорганизмов в этиологии периимплантита [Lafaurie et al., 2017].
Интересно мнение Т.Л. Шевеллы [2020], которая выдвигает предположение о роли Helicobacter pylori в развитии периимплантита. Проведенные исследования показали присутствие H. pylori в ротовой жидкости и в содержимом костной раны, где находились дезинтегрировнные дентальные имплантаты.
Н.И. Быкова с соавт. при изучении микробной обсемененности периимплантных зон при периим-плантите отмечают увеличение уровня обсеменен-ности на 2‒3 порядка по сравнению с результатами микробиологического анализа пациентов с интактной периимплантатной зоной опорных имплантатов. Из 15 обследованных у 8 больных (53.3%), по результатам проведённого обследования, были выявлены аэробно-анаэробно-грибковые ассоциации микроорганизмов, у 7 (46.6%) – аэробно-анаэробные. Во всех случаях доминировали облигатные анаэробы: у 10 больных (66.6%) – Fuso-bacterium nucleatum со степенью обсемененности 107‒108 КОЕ/мл; у 6 больных (40%) – Prevotella oralis со степенью обсемененности 106‒108 КОЕ/мл; у 5 больных (33.3%) – Porphyromonas spp . со степенью обсемененности 108 КОЕ/мл. Кроме того, в исследуемом материале выделены стафилококки – у 13 пациентов (86.6%), стрептококки – у 12 пациентов (80.0%), различные виды энтеробактерий – у 7 больных (46.6%), пепто-стрептококки – у 2 пациентов (13.3%), патогенные дрожжевые грибы – у 8 больных (53.3%) [Быкова, Будзинский, Максимова, 2017].
Исследования D. Ziebolz [2017] в дифференциальной диагностике периимплантита выявили преобладание микроорганизмов вида Treponema denticola в десневой жидкости.
По мнению Н.А. Панахова, существует бесспорная связь между формированием биопленки на поверхности имплантата и инициированием воспалительного процесса вокруг остеоинтегриро-ванных зубных имплантатов. При этом наблюдается увеличение микробной обсемененности пери-имплантных зон в динамике после постановки имплантатов. Через месяц после имплантации в образцах из десневой борозды зуба концентрация Treponema denticola и Tannerella forsythia увеличивается на 19.1 и 5.8%, соответственно. Через 12 месяцев распространенность Tannerella forsythia и Prevotella intermediа в периимплантатной борозде по сравнению с их количеством в десневой борозде, была выше на 24.0 и 13.9% соответственно. Сравнительный анализ распространенности микроорганизмов в период между первым и двенадцатым месяцами показал возрастание Prevotella intermediа в местах имплантации в среднем на 15.3%; Tannerella forsythia ‒ на 39.2 (р < 0.05) [Guerra et al., 2016; Pan et al., 2017; Панахов, Ма- хмудов, 2018].
В работах же И.С. Мащенко и др. [2019], возникновение и развитие воспалительно-деструктивного процесса в периимплантной зоне в отсрочен- ном периоде после дентальной имплантации свя- рта при пародонтитах и периимплантитах (рис. 3).
зывают с воздействием специфической пародон-
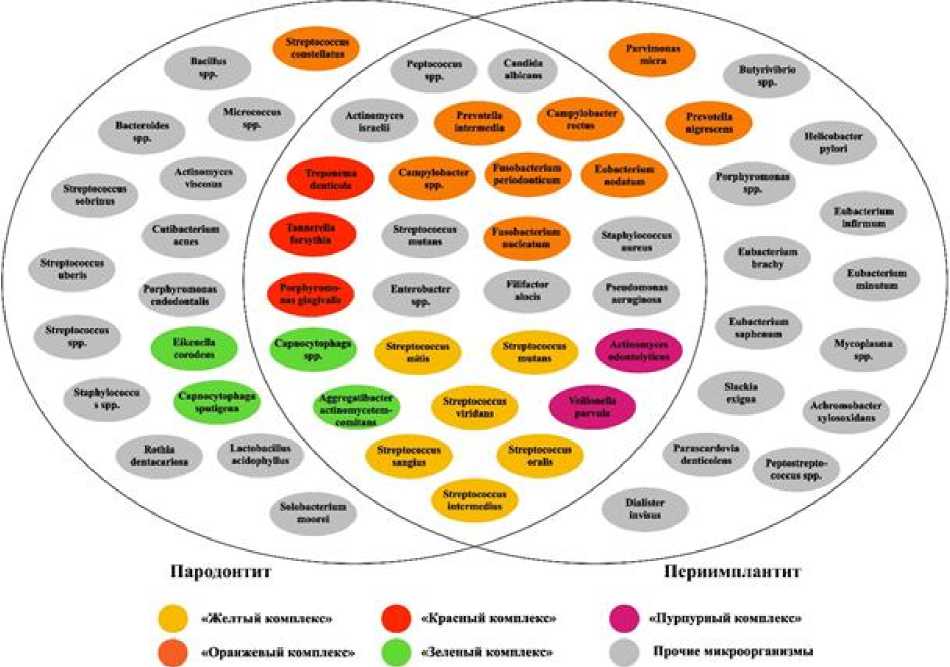
Рис. 3 . Сходство и различие микробной флоры при пародонтите и периимплантите
Таким образом, проведенный анализ данных литературы показал значимость участия микробиоты в развитии и прогрессировании воспалительных изменений пародонта. В связи с ростом частоты использования зубных имплантатов существует необходимость изучения спектра этиологически значимых микроорганизмов в развитии пе-риимплантитов с целью разработки мер профилактики и лечения, поскольку долгосрочная выживаемость дентальных имплантатов зависит от состава микробиоты, окружающей имплантаты.
Исследование проведено в рамках Грантовой программы ФГБОУ ВО Кировский ГМУ Минздрава России «Университетский научный грант» в рамках проекта «Создание коллекции микроорганизмов, статистически значимых в развитии пе-риимпланититов, для разработки иммунобиологи- тальной инфекции, состоящей обычно из комплекса 6‒7 пародонтопатогенных бактерий, оказывающих свой повреждающий эффект в любой комби- нации.
По результатам проанализированных источников литературы, нами разработана схема, отражающая сходство и различие микробиоты полости ческого препарата направленного действия» № 11.1/2021.
Список литературы Сравнительная оценка микробной контаминации при пародонтите и периимплантите. Обзор
- Агаева Н.А. Микробиологическая и иммунологическая характеристика пародонтитов и гингивитов с актиномикотической этиологией // Международный медицинский журнал. 2010. № 3. С. 103-106.
- Быкова Н.И., Будзинский Н.Э., Максимова Е.М. Роль микробной флоры в патогенезе периим-плантита и воспалительных заболеваний тканей пародонта // Научный альманах. 2017. № 2-3. С. 319-325.
- Ван Дер Бийль П. Взаимосвязь заболеваний пародонта и сердечно-сосудистой системы // Проблемы стоматологии. 2014. № 6. С. 116-119.
- Герасимова Л.П. и др. Особенности состояния стоматологического и микробиологического статуса полости рта у лиц с воспалительными заболеваниями пародонта в зависимости от возраста // Уральский медицинский журнал. 2017. № 7. C. 5-9.
- Грудянов А.И., Фоменков Е.В. Этиология и патогенез воспалительных заболеваний пародонта // Грудянов А.И. Заболевания пародонта. М.: МИА, 2009. С. 9-43.
- Гударьян А.А. Роль аэробной и анаэробной микрофлоры в развиши дентального мукозита и дентального периимплантита // Вюник проблем бюлогп i медицини. 2014. № 2 (1). C. 132-135.
- Зорина О.А. и др. Соотношение патогенных представителей микробиоценоза пародонтальных карманов при пародонтите разной степени тяжести // Acta Naturae. 2011. № 2 (9). С. 106.
- Мащенко И.С. и др. Факторы развития и современные методы профилактики и лечения ранних и отсроченных воспалительных осложнений дентальной имплантации (обзор) // Медицинские науки. 2019. № 10-3(56). C. 234-250.
- Медицинская микробиология, вирусология и иммунология / под ред. В.В. Зверева, А.С. Быкова. М.: ГЭОТАР-Медиа, 2016. 816 с.
- Николаев А.И., Цепов Л.М. Практическая терапевтическая стоматология. М.: Медпресс-информ, 2019. 928 с.
- Николаева Е.Н. и др. Ассоциативные связи паро-донтопатогенных видов бактерий I и II порядков в смешанных биопленках у пациентов с пе-риимплантитами // Стоматология для всех. 2014. № 4. С. 38-42.
- Орехова Л.Ю. Заболевания пародонта. М.: Поли Медиа Пресс, 2004. С. 218-220.
- Панахов Н.А.О., Махмудов Т.Г.О. Уровень стабильности зубных имплантатов в различные сроки функционирования // Проблемы стоматологии. 2018. Т. 14, № 1. C. 89-93.
- Пат. РФ № 2324182. Чухловин А.Б. и др. Способ диагностики патологических изменений микрофлоры полости рта. Заявка от 13.11.2006. Опубл. 10.05.2008. Бюл. № 13. C. 8.
- Пашкова Г.С. и др. Особенности микрофлоры полости рта у пациентов с воспалительными заболеваниями пародонта // Лечение и профилактика. 2013. № 4 (8). C. 74-80.
- Тамарова Э.Р. и др. Создание молекулярно-генетической тест-системы для ранней диагностики и оценки эффективности лечения воспалительных заболеваний пародонта // Клиническая лабораторная диагностика. 2020. Т. 65, № 1. С. 55-60.
- Тунева Н.А., Богачева Н.В., Тунева Ю.О. Проблемы дентальной имплантации // Вятский медицинский вестник 2019. № 2 (62). С. 86 - 93.
- Царев В.Н., Николаева Е.Н., Ипполитов Е.В. Па-родонтопатогенные бактерии - основной фактор возникновения и развития пародонтита // Журнал микробиологии, эпидемиологии и иммунобиологии. 2017. № 5. С. 101-112.
- Цимбалистов А.В. и др. Особенности микрофлоры пародонтальных карманов при агрессивных формах пародонтита // Институт стоматологии. 2010. № 49 (4). C. 73-75.
- Шевела Т.Л. Helicobacter pylori - как этиологический фактор развития периимплантита (клинический пример) // Здравоохранение Кыргызстана. 2020. № 2. C. 11-16.
- Canullo L. et al. Microbiological assessment of the implant-abutment interface in different connections: cross-sectional study after 5 years of functional loading // Clinical Oral Implants Research. 2015. Vol. 26, № 4. P. 426-434.
- Esposito M., Grusovin M.G., Worthington H.V. Treatment of peri-implantitis: what interventions are effective? A Cochrane systematic review // European Journal of Oral Implantology. 2012. № 5. P. 21-41.
- Guerra E. et al. The Impact of Conical and Nonconi-cal Abutments on Bacterial Infiltration at the Implant-Abutment Interface // International Journal of Periodontics & Restorative Dentistry. 2016. Vol. 36, № 6. P. 825-831.
- Lafaurie G.I. et al. Microbiome and Microbial Biofilm Profiles of Peri-Implantitis: A Systematic Review // Journal of Periodontology. 2017. Vol. 88, № 10. Р. 1066-1089.
- Pan S. et al. Profiling of subgingival plaque biofilm microbiota in adolescents after completion of orthodontic therapy // PLoS ONE. 2017. Vol. 12, № 2. Р. 2-13.
- Romano F., Barbui A., Aimetti M. Periodontal pathogens in periodontal pockets and in carotid ather-omatous plaques // Minerva Stomatologica. 2007. № 4 (56). P. 169-179.
- Ximenez-Fyvie L.A., Haffajee A.D., Socransky S.S. Microbial composition of supra-and subgingival plaque in subjects with adult periodontitis // Journal of Clinical Periodontology. 2000. Vol. 10 (27). P. 722-732.
- Ziebolz D. Microbiological and aMMP-8 findings depending on periimplant disease in patients undergoing supportive implant therapy // Diagn. Micro-biol. Infect. Dis. 2017. Vol. 88, № 1. Р. 47-52.


