Сравнительная оценка отдаленных результатов дистанционной и сочетанной лучевой терапии у больных раком предстательной железы высокого риска
Автор: Потапова А.В., Гладилина И.А., Петровский А.В., Ротобельская Л.Е., Шабанов М.А., Черняев В.А., Шолохов В.Н., Ткачев С.И.
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования. Вопросы лучевой терапии
Статья в выпуске: 3 т.10, 2020 года.
Бесплатный доступ
Рак предстательной железы (РПЖ) высокого риска представляет собой одну из ключевых проблем онкоурологии. Лучевая терапия (ЛТ) наряду с хирургическим лечением является неотъемлемым компонентом комплексного лечения больных РПЖ высокого риска. Для улучшения отдаленных онкологических результатов у больных РПЖ высокого риска целесообразно проведение ЛТ с эскалацией дозы, что в настоящее время проводится с использованием методик дистанционного и контактного облучения. В исследование были включены 109 пациентов с РПЖ высокого риска, которым была проведена либо дистанционная ЛТ до СД 76 Гр, либо сочетанная ЛТ (дистанционная +внутритканевая ЛТ) с использованием источников 125I на фоне длительной андрогенной депривационной терапии (АДТ). Сравнительный анализ отдаленных результатов лечения больных РПЖ высокого риска выявил улучшение показателей 5-летней безрецидивной выживаемости в группе сочетанной ЛТ по сравнению с больными после дистанционной ЛТ. В группе сочетанной ЛТ отмечается снижение острых постлучевых ректитов на 33% после сочетанной ЛТ по сравнению с группой дистанционной ЛТ: 13,2% и 46,4%, соответственно (р
Рак предстательной железы, дистанционная конформная лучевая терапия, сочетанная лучевая терапия, брахитерапия
Короткий адрес: https://sciup.org/140257632
IDR: 140257632 | DOI: 10.18027/2224-5057-2020-10-2-26-33
Текст научной статьи Сравнительная оценка отдаленных результатов дистанционной и сочетанной лучевой терапии у больных раком предстательной железы высокого риска
ЛТ с эскалацией дозы является стандартным подходом в лечении больных РПЖ высокого риска. Известно, что увеличение дозы дистанционной лучевой терапии (ДЛТ) до 79 Гр у больных РПЖ высокого риска улучшает отдаленные результаты лечения [1–6]. Однако эскалация дозы у данной группы больных сопряжена с возрастанием риска поздних побочных эффектов со стороны критических органов [3]. Одним из безопасных методов эскалации дозы является комбинация дистанционной и контактной ЛТ: контактная ЛТ создает возможность подведения максимальных доз облучения непосредственно в опухолевый очаг с минимальным воздействием на критические органы, а дистанционная составляющая позволяет воздействовать на зоны регионарного лимфооттока. Многие исследования подтвердили преимущества сочетанной ЛТ (СЛТ) по сравнению с ДЛТ по показателям безрецидивной выживаемости у больных РПЖ высокого риска [5, 7–12].
Вместе с тем, результаты исследований, сравнивающих два метода ЛТ, свидетельствуют о высокой частоте поздних побочных эффектов со стороны критических органов после СЛТ — 8,6% по сравнению с ДЛТ — 2,2% (p > 0,05, [13]). Однако увеличение частоты поздних побочных эффектов при СЛТ было связано с высокой концентрацией дозы в верхушке предстательной железы, а также включением в объем PTV мочеполовой диафрагмы [11–13], и, возможно, с недостаточным опытом специалистов, проводивших имплантацию источников в предстательную железу [14].
Сравнительная оценка отдаленных результатов лечения больных РПЖ высокого риска после ДЛТ и СЛТ с использованием современных технологий представляется нам актуальным направлением.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Сравнить отдаленные результаты лечения больных РПЖ высокого риска после ДЛТ и СЛТ с использованием радиоактивных источников 125I.
А.В. Потапова, И.А. Гладилина, А.В. Петровский, Л.Е. Ротобельская, М.А. Шабанов, В.А. Черняев, В.Н. Шолохов, С.И. Ткачев
СРАВНИТЕЛЬНАЯ ОЦЕНКА ОТДАЛЕННЫХ РЕЗУЛЬТАТОВ ДИСТАНЦИОННОЙ И СОЧЕТАННОЙ ЛУЧЕВОЙ ТЕРАПИИ У БОЛЬНЫХ РАКОМ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ВЫСОКОГО РИСКА
ЗАДАЧИ ИССЛЕДОВАНИЯ
-
1. Провести сравнительный анализ общей и безрецидив-ной выживаемости больных раком предстательной железы высокого риска после сочетанной и дистанционной лучевой терапии.
-
2. Дать сравнительную оценку частоты и выраженности побочных эффектов в группе сочетанной и дистанционной лучевой терапии у больных раком предстательной железы высокого риска.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование является ретроспективным и нерандомизированным. В исследование были включены 109 пациентов в возрасте от 51 года до 81 года с клиническим диагнозом РПЖ, которым была выполнена ДЛТ или СЛТ с использованием радиоактивных источников 125I на фоне длительной АДТ в ФГБУ «НМИЦ онкологии им. Н.Н. Блохина» Минздрава России с мая 2011 года по декабрь 2017 года. В зависимости от вида ЛТ больные были распределены на 2 группы. Больные, которым была проведена СЛТ, составили проспективную группу исследования, а в качестве сравнения были выбраны ретроспективные данные больных после ДЛТ.
Основная группа включала 53 пациента, которым была проведена СЛТ: ДЛТ на область малого таза в режиме стандартного фракционирования дозы до СД 46 Гр и имплантация источников 125I в предстательную железу в предписанной дозе 110 Гр. Имплантация источников проводилась как до, так и после ДЛТ. Медиана наблюдения в данной группе составила 49,9 мес. Контрольная группа включала 56 пациентов, которым была проведена ДЛТ на область малого таза в режиме стандартного фракционирования дозы до СД 76 Гр. Поскольку контрольная группа была ретроспективной, медиана наблюдения составила 91,7 мес.
В исследование были включены пациенты с гистологически верифицированным диагнозом РПЖ, со стадией заболевания T2–3N0M0, с индексом Глисона 6–10, или с уровнем сывороточного ПСА > 20 нг/мл, с объемом предстательной железы менее 60 см3. У всех больных основной и контрольной групп отмечен высокий риск рецидивиро-вания по классификации D'Amico.
Критериями исключения пациентов из исследования было отдаленное метастазирование, трансуретральная резекция предстательной железы в анамнезе, наличие противопоказаний к проведению спинального и общего обезболивания, ожидаемая продолжительность жизни менее 5 лет, ранее проведенная ЛТ на органы малого таза, первично-множественное злокачественное новообразование.
Больные, включенные в основную и контрольную группы, были сопоставимы по клиническим и морфологическим данным (табл. 1).
Таблица 1. Характеристика больных, включенных в основную и контрольную группы
|
Характеристика |
Сочетанная ЛТ (n= 53) |
Дистанционная ЛТ (n= 56) |
|
Возраст |
||
|
Средний возраст |
68,1 |
68,4 |
|
Клиническая стадия |
||
|
T2N0M0 |
11 (20,8%) |
14 (25%) |
|
T3N0M0 |
42 (79,2%) |
42 (75%) |
|
Шкала Глисона |
||
|
3 + 3 = 6 |
11 (20,7%) |
25 (44,6%) |
|
3 + 4 = 7 |
13 (24,5%) |
21 (37,5%) |
|
4 + 3 = 7 |
15 (28,3%) |
— |
|
4 + 4 = 8 |
10 (18,9%) |
5 (9%) |
|
4 + 5 = 9 |
3 (5,7%) |
4 (7,1%) |
|
5 + 5 = 10 |
1 (1,9%) |
1 (1,8%) |
|
Уровень ПСА до лечения |
||
|
<10 нг/мл |
11 (20,7%) |
11 (20%) |
|
10–20 нг/мл |
14 (26,4%) |
14 (25%) |
|
>20 нг/мл |
28 (52,8%) |
31 (55%) |
ЛТ — лучевая терапия; ПСА — простатоспецифический антиген.
Несмотря на принадлежность больных, включенных в исследование, к группе высокого риска по D'Amico, больные основной группы имели больше агрессивных неблагоприятных факторов по морфологическим критериям.
ДЛТ выполнялась на линейном ускорителе электронов Clinac (Varian, USA) 5 раз в неделю, РД 2 Гр, СД 46 Гр (23 сеанса) с использованием технологии VMAT. В соответствии с рекомендациями ICRU (International Commission on Radiation Units and Measurements), в клинический объем облучения включали предстательную железу с парапро-статической клетчаткой, семенные пузырьки, зоны регионарного лимфооттока (общие, внутренние и наружные подвздошные, пресакральные и запирательные лимфатические узлы). Имплантация источников 125I (Isocord, BEBIG, Россия) в предстательную железу проводилась под УЗ-контролем с использованием планирующей системы PSID 5.0 в режиме онлайн. Предписанная суммарная доза в предстательную железу составляла 110 Гр. Больным контрольной группы на первом этапе в клинический объем облучения включали предстательную железу с парапростатической клетчаткой, семенные пузырьки, зоны регионарного метастазирования, с подведением СД 46 Гр. На втором этапе в клинический объем облучения включали предстательную железу с па-рапростатической клетчаткой и семенные пузырьки, СД 16 Гр. На третьем этапе проводилось локальное облучения предстательной железы до СД 14 Гр. Суммарная доза ДЛТ за 3 этапа лечения составила 76 Гр.
АДТ получали все больные основной и контрольной групп в неоадьювантном (2–4 мес.), адьювантном режимах
(не менее 24 месяцев) и на фоне лучевой терапии аналогами лютеинизирующего рилизинг-гормона (гозерелин 3,6 мг 1 раз в 28 дней подкожно).
Статистическая обработка полученных в ходе исследования результатов проводилась с помощью программы Statistica for Windows 6.1 (StatSoft Inc.), MedCalc и был применен пакет программ «АСТА». Для оценки статистически значимых различий в группах использовался критерий Стьюдента. Статистически значимым различием считалось различие с вероятностью ошибки менее 5% (p < 0,05). Выживаемость рассчитывалась по методу дожития Kaplan-Meier Survival statistic. Продолжительность жизни оценивали с первого дня лечения больных до последнего дня наблюдения или смерти.
РЕЗУЛЬТАТЫ
Анализ результатов больных РПЖ высокого риска после ДЛТ и СЛТ был проведен путем оценки показателей общей и безрецидивной выживаемости. В данном исследовании было нецелесообразно анализировать результаты опухолеспецифической выживаемости и выживаемости без отдаленного метастазирования из-за небольшого числа наблюдений, поскольку в группе ДЛТ от РПЖ умерло четверо больных (7,1 %), а в группе СЛТ ни одного больного.
Больные были прослежены от 30 до 118 мес. Медиана наблюдения больных составила 68,7 мес.
Сравнительный анализ общей выживаемости больных в основной и контрольной группах
Среди больных основной группы умерло 2 пациента (3,8%) от причин, не связанных с РПЖ. В контрольной группе умерли 8 пациентов (14,2%), из них от РПЖ — 4 пациента (7,1%), от других причин — также 4 пациента (7,1%). Показатель 5-летней общей выживаемости в основной группе составил 96,2 ± 2,64 %, а в контрольной группе 92,6±3,56% (р = 0,46). Динамика общей выживаемости в зависимости от метода лечения представлена на рис. 1.
Сравнительный анализ безрецидивной выживаемости больных в основной и контрольной группах
У 7 (13,2%) пациентов основной группы наблюдалось прогрессирование заболевания через 20–67 мес. после завершения лучевой терапии. Медиана до прогрессирования заболевания составила 41 мес. У двух больных были диагностированы только биохимические рецидивы (3,8%), у 5 больных выявлены отдаленные метастазы (9,4%). Отдаленные метастазы локализовались в парааортальных лимфатическихузлах (1,9%), легких (3,8%) и костях (3,8%).
Среди пациентов контрольной группы у 18 пациентов (32,1%) наблюдалось прогрессирование заболевания через 23–99 мес. Медиана до прогрессирования составила 42 мес. У 8 пациентов (14,3%) были диагностированы только биохимические рецидивы, у 3 — локальные рецидивы (5,3%), а у 7 пациентов выявлены отдаленные метастазы (12,5%). Отдаленные метастазы локализовались в костях (10,7%) и в легких (1,8%).
В основной группе 5-летняя безрецидивная выживаемость составила 96,2 ± 2,67%, а в контрольной 86,9 ± 4,61% (р = 0,08), однако разница была статистически не значимой. Динамика безрецидивной выживаемости в зависимости от метода лечения представлена на рис. 2.
Как видно из рис. 2, в основной группе отмечается тенденция к улучшению показателя безрецидивной выживаемости, по сравнению с контрольной группой.
Для выявления факторов, влияющих на безрецидив-ную выживаемость, был проведен однофакторный анализ в зависимости от возраста больных, стадии заболевания, индекса Глисона и числа положительных биоптатов, а также исходного уровня ПСА (табл. 2).
Таким образом, однофакторный анализ выявил, что стадия заболевания Т3 оказывает статистически значимое влияние на показатель безрецидивной выживаемости в обеих группах (р = 0,02). Анализ других неблагоприятных факторов не выявил статистически значимых различий в зависимости от вида лечения. Однако прослеживается
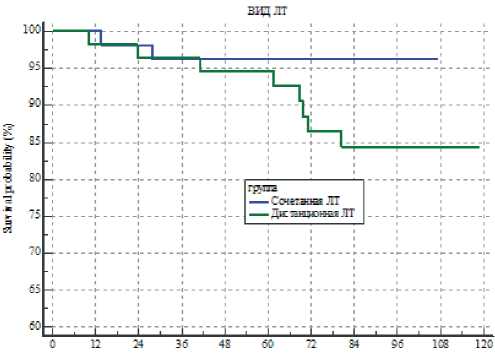
Рисунок 1. Общая выживаемость больных в зависимости от вида лучевой терапии: СЛТ — синяя линия, ДЛТ — зеленая линия.
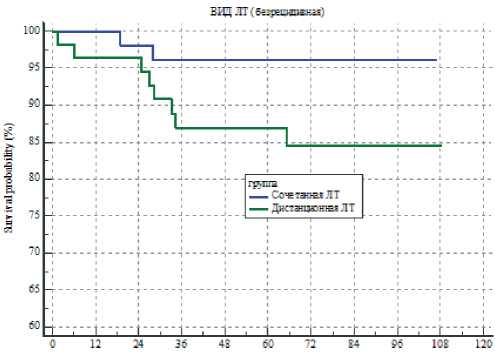
Рисунок 2. Безрецидивная выживаемость больных в зависимости от вида лучевой терапии: СЛТ — синяя линия, ДЛТ — зеленая линия.
А.В. Потапова, И.А. Гладилина, А.В. Петровский, Л.Е. Ротобельская, М.А. Шабанов, В.А. Черняев, В.Н. Шолохов, С.И. Ткачев
СРАВНИТЕЛЬНАЯ ОЦЕНКА ОТДАЛЕННЫХ РЕЗУЛЬТАТОВ ДИСТАНЦИОННОЙ И СОЧЕТАННОЙ ЛУЧЕВОЙ ТЕРАПИИ У БОЛЬНЫХ РАКОМ ПРЕДСТАТЕЛЬНОЙ ЖЕЛЕЗЫ ВЫСОКОГО РИСКА
Таблица 2. Однофакторный анализ безрецидивной выживаемости больных в основной и контрольной группах
ПОБОЧНЫЕ ЭФФЕКТЫ ДИСТАНЦИОННОЙ И СОЧЕТАННОЙ ЛУЧЕВОЙ ТЕРАПИИ
Оценку ранних и поздних побочных эффектов ЛТ проводили по шкале RTOG/EORTC. После ЛТ у больных РПЖ наблюдались побочные эффекты со стороны мочевыделительной системы (циститы) и со стороны нижних отделов желудочно-кишечного тракта (ректиты).
Частота острых лучевых циститов (ОЛЦ) существенно не различалась в обеих группах, в основной группе частота составила 49%, а в контрольной 53,6% (табл. 3).
Частота развития ОЛЦ I степени была сопоставимой в группах, ОЛЦ II степени в контрольной группе наблюдались у 6 больных (10,7%), а в основной группе у 2 больных (3,8%). ОЛЦ III степени наблюдался всего у 1 больного, как в основной (1,9%), так и в контрольной группе (1,8%). Различия были статистически не значимыми. У больных после проведения СЛТ отмечается статистически значимое уменьшение частоты острых лучевых ректитов (ОЛР) по сравнению с больными после ДЛТ: 13,2% против 46,4%, соответственно (p < 0,01). Необходимо отметить, что
Таблица 3. Частота возникновения ранних побочных эффектов лучевой терапии в основной и контрольной группах
|
Степень выраженности острых лучевых реакций |
Дистанционная ЛТ |
Сочетанная ЛТ |
||
|
Абс. |
Отн. |
Абс. |
Отн. |
|
|
Острые лучевые циститы |
||||
|
0 |
26 |
46,4% |
27 |
50,9% |
|
I степень |
23 |
41,1% |
23 |
43,4% |
|
II степень |
6 |
10,7% |
2 |
3,8% |
|
III степень |
1 |
1,8% |
1 |
1,9% |
|
Частота циститов |
30 |
53,6% |
26 |
49,1% |
|
Острые лучевые ректиты |
||||
|
0 |
30 |
53,6% |
46 |
86,8% |
|
I степень |
25 |
44,6% |
7 |
13,2% |
|
II степень |
1 |
1,8% |
0 |
0% |
|
Частота ректитов |
26 |
46,4%* |
7 |
13,2%* |
-
* — статистически значимая разница (p < 0,01).
в общей когорте больных не наблюдались ОЛР III–IV степени, а в основной группе ОЛР зарегистрированы только в I степени (13,2%), в то время как в контрольной группе ОЛР I степени выявлены у 44,6% больных.
Поздние побочные эффекты (ППЭ) со стороны мочевого пузыря чаще наблюдались в контрольной группе — в 19,6%, в основной группе — в 9,5%. Несмотря на отсутствие статистически значимых различий, после ДЛТ ППЭ мочевого пузыря наблюдались в 2 раза чаще, чем после СЛТ. Следует отметить, что в обеих группах не отмечены ППЭ III–IV степени. Частота развития ППЭ со стороны мочевого пузыря I степени в контрольной группе составила 12,5%, а в основной группе 5,7%. В контрольной группе также чаще наблюдались поздние осложнения II степени, чем в основной группе: 7,1 % против 3,8 %, соответственно.
Таблица 4. Частота возникновения поздних побочных эффектов мочевого пузыря и прямой кишки в основной и контрольной группах
|
Степень выраженности поздних лучевых повреждений |
Дистанционная ЛТ |
Сочетанная ЛТ |
||
|
Абс. |
Отн. |
Абс. |
Отн. |
|
|
Поздние побочные эффекты со стороны мочевого пузыря |
||||
|
0 |
45 |
80,4% |
48 |
90,6% |
|
I степень |
7 |
12,5% |
3 |
5,7% |
|
II степень |
4 |
7,1 % |
2 |
3,8% |
|
Частота |
11 |
19,6% |
5 |
9,5% |
|
Поздние побочные эффекты со стороны прямой кишки |
||||
|
0 |
49 |
87,5% |
50 |
94,3% |
|
1 |
6 |
10,7% |
3 |
5,7% |
|
2 |
1 |
1,8% |
0 |
0% |
|
Частота |
7 |
12,5% |
3 |
5,7% |
Частота развития ППЭ со стороны прямой кишки была на низком уровне в обеих группах: в контрольной группе у 12,5% больных, а в основной —у 5,7%. ППЭ прямой кишки III–IV степени не наблюдались, а осложнения II степени были только у 1 больного из группы ДЛТ. Частота развития ППЭ со стороны прямой кишки I степени составила 10,7% в контрольной группе и 5,7% в основной группе, но различия были статистически не значимы. (табл. 4).
ОБСУЖДЕНИЕ
РПЖ остается одной из наиболее актуальных проблем в онкоурологии. За 10-летний период отмечается стремительный рост заболеваемости РПЖ во всем мире, во многом это связано с проведением ПСА-скрининга и совершенствованием диагностики [15,16].
Основной целью в лечении РПЖ высокого риска, прежде всего, является улучшение отдаленных онкологических результатов. Для осуществления этой цели важно придерживаться современного принципа улучшения локального контроля и воздействие на пути регионарного лимфооттока с использованием ЛТ. В настоящее время эскалация дозы ЛТ при РПЖ достигается путем проведения ДЛТ и внутритканевой ЛТ. Многие исследования подтвердили преимущество СЛТ с использованием различных радиоактивных источников [4–6,20].
С 2011 г. по 2017 гг. в НМИЦ онкологии им. Н.Н. Блохина 109 больным с гистологически верифицированной аденокарциномой предстательной железы была выполнена ДЛТ и СЛТ с использованием радиоактивных источников 125I на фоне длительной АДТ. Средний возраст больных составил 68,5 ± 6,8 лет. В качестве контрольной группы был выбран ретроспективный материал 56 историй болезни больных, которым была проведена ДЛТ на область малого таза в режиме стандартного фракционирования дозы до СД 76 Гр. Больным основной группы была проведена СЛТ: ДЛТ на область малого таза в режиме стандартного фракционирования дозы до СД 46 Гр и имплантация источников 125I в предстательную железу с предписанной дозой 110 Гр. АДТ проводилась всем больным в неоадъювантном (3 месяца) и адъювантном (не менее 24 месяцев) режимах, а также на фоне лучевой терапии.
Больные, включенные в исследование, были сопоставимы по основным клиническим критериям, однако в основной группе преобладали больные с агрессивными формами РПЖ. По результатам проведенного нами анализа не было выявлено статистически значимых различий в показателе 5-летней общей выживаемости среди больных основной и контрольной групп. В качестве критериев однофакторного анализа были выбраны неблагоприятные факторы, которые могли существенно повлиять на общую выживаемость (возраст больных старше 65 лет, Т-стадия, индекс Глисона и число положительных биоптатов, исходный уровень ПСА). Однако статистически значимого влияния данных факторов на общую выживаемость не было отмечено. 5-летняя безрецидивная выживаемость в основной группе была выше на 11% по сравнению с контрольной группой: 96,2 ± 2,67% и 84,6 ± 5,05%, соответственно (р = 0,08). Однофакторный анализ показал, что стадия заболевания Т3 оказывает статистически значимое влияние на без-рецидивную выживаемость. Среди больных со стадией заболевания Т3 5-летняя безрецидивная выживаемость в основной группе составила 97,5 ± 2,47 % и 82,6 ± 5,98 % в контрольной группе (р = 0,02). Кроме того, отмечается преимущество показателя безрецидивной выживаемости в основной группе по сравнению с контрольной группой при наличии неблагоприятных факторов (возраст больных старше 65 лет, ПСА > 20 нг /мл, индекс Глисона 7 и более). Такая тенденция свидетельствует о высокой эффективности СЛТ с использованием радиоактивных источников 125I.
Помимо улучшения онкологических результатов и снижения частоты побочных эффектов СЛТ позволяет сократить длительность курса ЛТ. Длительность курса ДЛТ при стандартном фракционировании дозы составляет 7–8 недель, а длительность курса СЛТ составляет 5 недель и 1 сеанс брахитерапии.
ВЫВОДЫ
Сравнительный анализ отдаленных результатов ДЛТ и СЛТ больных РПЖ высокого риска выявил улучшение показателей 5-летней безрецидивной выживаемости после СЛТ по сравнению с больными после ДЛТ. При анализе ранних побочных эффектов в зависимости от метода ЛТ отмечено статистическое значимое уменьшение частоты ОПР на 33% у больных после СЛТ по сравнению с ДЛТ: 13,2% и 46,4%, соответственно (р < 0,01). Проведение современных методик ДЛТ и СЛТ у больных РПЖ высокого риска привело к отсутствию поздних побочных эффектов мочевого пузыря и прямой кишки III–IV степени. СЛТ позволяет сократить курс лечения на 2–3 недели по сравнению с ДЛТ.
Список литературы Сравнительная оценка отдаленных результатов дистанционной и сочетанной лучевой терапии у больных раком предстательной железы высокого риска
- Dearnaley D. Escalated-dose versus standard-dose conformal radiotherapy in prostate cancer: first results from the MRC RT01 randomised controlled trial / Dearnaley D.P., Sydes M.R., Graham J.D., Aird E.G., et al. // Lancet Oncol. – 2007 – V. 8 (6) – P. 475–487.
- Kuban D. Long-term failure patterns and survival in a randomized dose-escalation trial for prostate cancer. Who dies of disease? / Kuban D.A., Levy L.B., Cheung M.R., Lee A.K., et al. // Int. J Radiat. Oncol. Biol. Phys. – 2011 – V. 79 (5) – P. 1310-1317.
- Michalski J. Effect of Standard vs Dose-Escalated Radiation Therapy for Patients With Intermediate-Risk Prostate Cancer: The NRG Oncology RTOG 0126 Randomized Clinical Trial / Michalski J.M., Moughan J., Purdy J., et al. // JAMA Oncol. – 2018 – V. 4 (6) – P. 180039.
- Peeters S. Dose-response in radiotherapy for localized prostate cancer: results of the Dutch multicenter randomized phase III trial comparing 68 Gy of radiotherapy with 78 Gy / Peeters S.T., Heemsbergen W.D., Koper P.C., van Putten W.L., et al. // J Clin. Oncol. – 2006 – V. 24 (13) – V. 1990-1996.
- Sathya J. Randomized trial comparing iridium implant plus external-beam radiation therapy with external-beam radiation therapy alone in node-negative locally advanced cancer of the prostate / Sathya J.R., Davis I.R., Julian J.A., et al. // J Clin. Oncol. - 2005 – V. 23 (6) – P. 1192-1199.
- Zietman A. Randomized trial comparing conventional-dose with high-dose conformal radiation therapy in early-stage adenocarcinoma of the prostate: long-term results from proton radiation oncology group/american college of radiology 95-09 / Zietman A.L., Bae K., Slater J.D., Shipley W.U., et al. // J Clin. Oncol. – 2010 – V. 28 (7) – P. 1106-1111.
- Shilkrut M. The addition of low-dose-rate brachytherapy and androgen-deprivation therapy decreases biochemical failure and prostate cancer death compared with dose-escalated external-beam radiation therapy for high-risk prostate cancer / Shilkrut M., Merrick G.S., McLaughlin P.W., et al. // Cancer – 2013 – V. 119 (3) – P. 681-690.
- Taira A. Long-term outcomes of prostate cancer patients with Gleason pattern 5 treated with combined brachytherapy and external beam radiotherapy / Taira A.V., Merrick G.S., Galbreath R.W., et al. // Brachytherapy – 2013 – V. 12 (5) – P. 408-414.
- Liss A. Combination therapy improves prostate cancer survival for patients with potentially lethal prostate cancer: The impact of Gleason pattern 5 / Liss A.L., Abu-Isa E.I., Jawad M.S., et al. // Brachytherapy – 2015 – V. 14 (4) – P. 502-510
- Hoskin P. Randomised trial of external beam radiotherapy alone or combined with high-dose-rate brachytherapy boost for localised prostate cancer / Hoskin P.J., Rojas A.M., Bownes P.J., et al. // Radiother. Oncol. – 2012 – V. 103 (2) – P. 217-222.
- Morris W. Is ASCENDE-RT still pertinent? Is LDR-PB obsolete? / W. James Morris, Scott Tyldesley, Sree Rodda, Ross Halperin et al. // URL: https://www.prostatebrachytherapy.org.uk/2016-presentations/J-Morris%20170516.pdf – 2016
- Morris W. Androgen suppression Combined with elective nodal and dose escalated radiation therapy (the ASCENDE-RT Trial): an analysis of survival endpoints for a randomized trial comparing a low-dose-rate Brachytherapy boost to a dose-escalated external beam boost for high- and intermediate-risk prostate cancer / Morris W.J., Tyldesley S., Rodda S., Halperin R., Pai H., McKenzie M., et al. // Int. J Radiat. Oncol. Biol. Phys. – 2017 – V. 98 (2) – P. 275-285.
- Rodda S. ASCENDE-RT: An Analysis of Treatment-Related Morbidity for a Randomized Trial Comparing a Low-Dose-Rate Brachytherapy Boost with a Dose-Escalated External Beam Boost for High- and Intermediate-Risk Prostate Cancer / Rodda S., Tyldesley S., Morris W.J., Keyes M., et al. // Int. J Radiat. Oncol. Biol. Phys. – 2017 – V. 98 (2) – P. 286-295.
- Chan E. Decline in acute urinary toxicity: A long-term study in 2011 patients with prostate brachytherapy within a provincial institution / Chan E.K., Keyes M., Pickles T., et al. // Brachytherapy – 2014 – V. 13 (1) – P. 46-52.
- Cancer Stat Facts: Prostate Cancer. SEER, 2018. https://seer.cancer.gov/statfacts/html/prost.html.
- Draisma G. Lead time and overdiagnosis in prostate-specific antigen screening: importance of methods and context / Draisma G., Etzioni R., Tsodikov A., Mariotto A., Wever E., Gulati R., Feuer E. // J. Natl. Cancer Inst. – 2009 – V. 101 (6) – P. 374-383.
- Bolla M. External irradiation with or without long-term androgen suppression for prostate cancer with high metastatic risk: 10-year results of an EORTC randomised study / Michel Bolla, Geertjan Van Tienhoven, Padraig Warde et al. // Lancet Oncol. – 2010 – V. 11 (11) – P. 1066–1073.
- EAU Guidelines. Edn. presented at the EAU Annual Congress Barcelona 2019. ISBN 978-94-92671-04-2.
- Pilepich M. Androgen suppression adjuvant to definitive radiotherapy in prostate carcinoma – long-term results of phase III RTOG 85-31 / Pilepich M.V., Winter K., Lawton C.A., Krisch R.E., et al. // Int. J Radiat. Oncol. Biol. Phys. – 2005 – V. 61 (5) – P. 1285-1290.
- Vogelius I. Meta-analysis of the alpha/beta ratio for prostate cancer in the presence of an overall time factor: Bad news, good news, or no news? / Vogelius I.R., Bentzen S.M. // Int. J Radiat. Oncol. Biol. Phys. – 2013 – V. 85 (1) – P. 89-94.


