Сравнительная оценка резервных возможностей системы дыхания у курящих и некурящих
Автор: Сегизбаева Марина Оразовна, Александрова Нина Павловна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Нормальная и патологическая физиология
Статья в выпуске: 3, 2013 года.
Бесплатный доступ
В исследовании с участием 24 чел., 12 из которых имели табачную зависимость и стаж курения от 3 до 25 лет, измеряли силовые и скоростные параметры дыхания, а также оценивали динамику насыщения крови кислородом в тесте с 20-секундной задержкой дыхания. Максимальная сила сокращений инспираторных мышц, оцениваемая по величине инспираторного ротового давления при выполнении маневра Мюллера, была ниже в группе курящих. Значения пиковой скорости вдоха и выдоха также были ниже у курящих испытуемых по сравнению с некурящими. Временная кислородная десатурация гемоглобина (снижение насыщения гемоглобина кислородом), вызванная 20-секундной задержкой дыхания на выдохе, была в 2,5 раза больше у курильщиков по сравнению с контрольной группой (p
Табачная зависимость, сила инспираторных мышц, произвольное апноэ, десатурация
Короткий адрес: https://sciup.org/14112913
IDR: 14112913
Текст научной статьи Сравнительная оценка резервных возможностей системы дыхания у курящих и некурящих
Введение. Известно, что хроническая табачная интоксикация организма курильщиков ведет к постепенному развитию различных патологических процессов на клеточном, тканевом, органном и системном уровнях и их клинических проявлений в разных формах [1]. Табачные токсины наносят повреждения практически всем органам и тканям организма человека. Курение является важнейшим фактором риска развития и причиной возникновения широкого спектра заболеваний и патологических изменений у человека: в первую очередь это болезни респираторной системы, а также сердечно-сосудистые заболевания, злокачественные новообразования и многие другие патологические процессы
[2–4]. Результаты современных исследований убедительно свидетельствуют о неблагоприятном влиянии курения на эпителий бронхов. В результате курения снижается устойчивость бронхов и легких к воздействию неблагоприятных факторов, что приводит к активизации бронхо-легочной инфекции [5]. Кроме того, выраженное воздействие токсинов табачного дыма на сурфактант может способствовать спадению альвеол и возникновению ателектазов [4, 5]. Однако коварной особенностью курения является длительное и незаметное развитие клинических проявлений последствий табачной интоксикации: на протяжении многих лет у лиц со стойкой табачной зависимостью не возникают жалобы и беспокойство [1]. В связи с этим раннее выявление функциональных нарушений в работе различных систем и органов у лиц, имеющих табачную зависимость, приобретает особое значение для своевременного оказания им адекватной и эффективной медицинской помощи. Поэтому разработка, обоснование и внедрение в клиническую практику различных методов, позволяющих осуществлять раннюю диагностику бронхо-легочных нарушений, являются чрезвычайно важными для предупреждения более серьезной патологии, стимуляции прекращения курения для пациента и начала лечебных мероприятий в практической медицине.
Цель исследования. Проведение сравнительной оценки функциональных резервов респираторной системы у курящих и некурящих испытуемых для выявления ранних признаков нарушений функции дыхания, обусловленных табакокурением, на основе измерения силовых и скоростных параметров инспираторных мышц, а также исследования динамики насыщения крови кислородом в тесте с 20-секундной задержкой дыхания на выдохе.
Материалы и методы. В исследовании принимали участие 24 испытуемых в возрасте от 19 до 45 лет, 12 из которых были отнесены к контрольной группе (некурящих), а 12 имели стойкую табачную зависимость и стаж курения от 3 до 25 лет. Все участвующие в исследовании испытуемые не имели серьезных хронических бронхо-легочных и сердечно-сосудистых заболеваний и не были подвержены респираторным инфекциям в течение последних двух месяцев до обследования. В процессе исследования сравнивали силовые и скоростные параметры дыхания испытуемых контрольной группы (12 чел.: 6 мужчин и 6 женщин) и группы курящих (12 чел.: 6 мужчин и 6 женщин). С помощью аппарата PowerBreath KH1 (UK) определяли величину максимального инспираторного давления (MIP), отражающего силу сокращений всех инспираторных мышц, а также проводили измерение пиковой скорости вдоха (PIF). Определение пиковой скорости форсированного выдоха осуществляли посредством пикфлоуриметра MINI WRIGHT STANDART
(МicroMedical, UK). Испытуемых подробно инструктировали и обучали правильному выполнению маневра Мюллера, осуществлению форсированного вдоха и выдоха с использованием указанных приборов. После выполнения ряда ознакомительных и обучающих маневров испытуемых тестировали. Они последовательно производили 5 максимальных инспираторных усилий с интервалом не менее 1 мин. В том случае, если воспроизводимость показателя MIP была не менее 10 %, в расчет принималось наибольшее из достигнутых значений. После этого испытуемые выполняли тесты с регистрацией пиковой скорости вдоха и выдоха. Лучшее значение из зарегистрированных результатов было взято для статистических расчетов. Исследования были проведены в положениях стоя, сидя и лежа на спине.
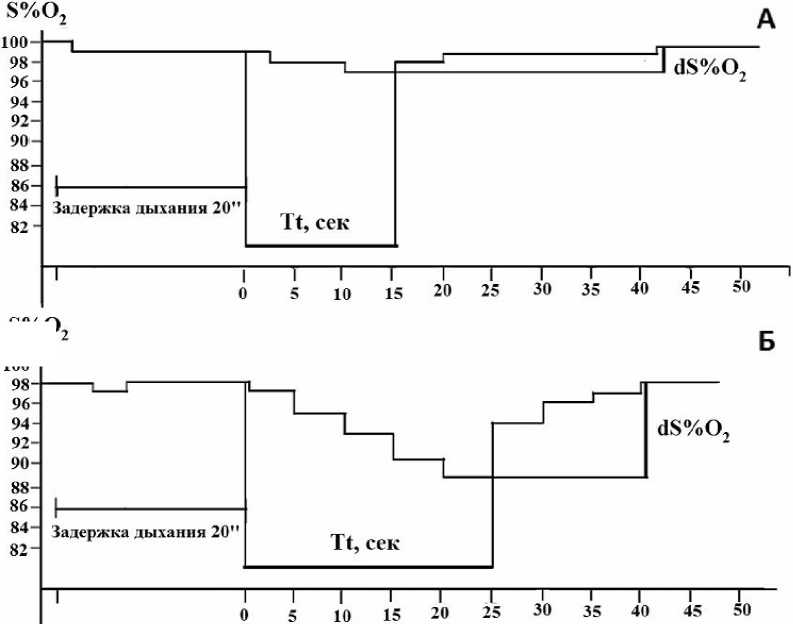
В следующей серии исследований производили мониторирование содержания кислорода в артериальной крови методом пульсок-симетрии до, во время и после произвольного апноэ. Для регистрации насыщения артериальной крови кислородом использовался портативный пульсоксиметр ONYX 9500 (Nonin Medical Inc, USА). После достижения устойчивых значений насыщения гемоглобина кислородом (SaO 2 ) испытуемому предлагалось сделать два глубоких вдоха и на уровне спокойного выдоха (ФОЕ – функциональная остаточная емкость) задержать дыхание на 20 с. По истечении этого времени испытуемый делал глубокий вдох и далее продолжал дышать в свободном режиме. С момента задержки дыхания и в течение 1 мин после первого глубокого вдоха каждые 5 с регистрировали значения сатурации гемоглобина с дисплея пульсоксиметра. Оценивали максимальный уровень временного снижения насыщения гемоглобина кислородом (d%SaO 2 ), произошедшего вследствие произвольного апноэ, а также время между глубоким вдохом после задержки дыхания и началом восстановления насыщения гемоглобина кислородом (T t ).
Статистическая обработка полученных данных производилась с помощью программы Microsoft Exel. Вычислялась средняя величина регистрируемых параметров и ошиб- ка средней. Для сравнения данных использовался параметрический критерий Стьюдента. Различия считали статистически значимыми при р<0,05.
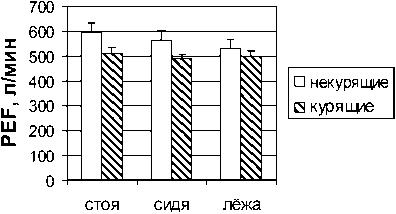
Результаты и обсуждение. Результаты наших исследований показали выраженное снижение пиковой скорости форсированного выдоха (PEF) в группе курящих мужчин и женщин по сравнению с некурящими (рис. 1). У обследованных курящих мужчин пиковая скорость выдоха была снижена на 14 (р<0,05), 13 (р<0,05) и 6 % в положениях стоя, сидя и лежа относительно контрольной группы испытуемых. У курящих женщин было выявлено снижение данного показателя на 12, 7 и 9 % соответственно в разных положениях тела по отношению к результатам некурящих женщин. И если в группе курящих мужчин не было обнаружено значимых изменений в величине пиковой скорости форсированного вдоха (PIF), то в группе курящих женщин величины этого показателя были снижены на 26 (р<0,05), 20 (р<0,05) и 19 % в положениях стоя, сидя и лежа относительно контроля (рис. 2).
Мужчины
Женщины
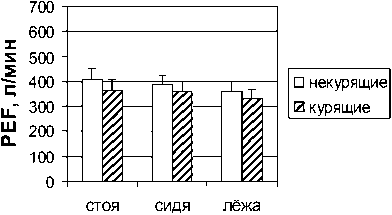
Рис. 1. Пиковая скорость экспираторного потока (PЕF)
у некурящих и курящих мужчин и женщин в положениях стоя, сидя и лежа
Мужчины
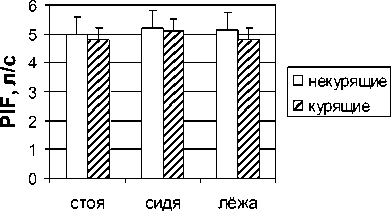
Женщины
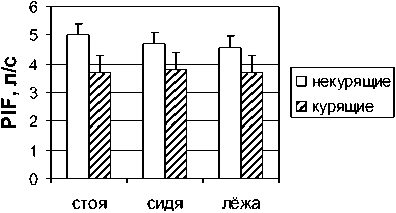
Рис. 2. Пиковая скорость инспираторного потока (PIF) у некурящих и курящих мужчин и женщин в положениях стоя, сидя и лежа
Снижение пиковых скоростей форсированных вдоха и выдоха у курящих обследуемых может быть связано с увеличенным сопротивлением дыхательных путей, которое возрастает из-за снижения их проходимости [4, 5]. Затруднение проходимости мелких, средних и крупных бронхов у курильщиков наступает вследствие следующих причин. Прежде всего это чрезмерная секреция слизи слизистыми железами бронхов из-за раздражения их табачным дымом. У 52 % курящих была выявлена гипертрофия бронхиальных желез, продуцирующих слизь [5]. Кроме того, табачный дым изменяет химический со- став и консистенцию слизи, которая становится более вязкой. Наряду с избыточной продукцией бронхиального секрета, у курильщиков наблюдается снижение мукоцилиарного клиренса. Скопление увеличенного количества слизи повышенной вязкости и измененного состава при снижении транспортной функции ресничек приводит к закупорке бронхов, особенно малого диаметра, к нарушению аэрации альвеол, оксигенации крови, перерастяжению альвеол с последующим развитием эмфиземы легких [9]. Кроме того, у курящих наблюдается воспалительный отек слизистой оболочки бронхов, что также приводит к обструктивным изменениям дыхательных путей. Длительное курение вызывает усиленное разрастание эпителия слизистой оболочки бронхов [5]. Другим важным механизмом, способствующим повышению резистивного сопротивления дыхательных путей у курящих, является развитие бронхоспазма, который провоцируется раздражением ирритантных рецепторов блуждающих нервов в бронхах. Раздражению рецепторов блуждающих нервов способствует хронический воспалительный процесс в слизистой оболочке бронхов с последующей атрофией слизистой оболочки и обнажением рецепторов [5].
Результаты нашего исследования показали, что измерение пиковых скоростей форсированного вдоха и выдоха может быть одним из ранних диагностических методов выявле- ния обструктивной патологии респираторной системы курильщиков. Эти простые неинвазивные тесты позволяют с достаточно высокой точностью определять начальные обструктивные изменения дыхательных путей курильщика, производить сравнительный анализ с должными величинами и оценивать степень обструкции воздухоносных путей. Повторные измерения этих показателей через определенные промежутки времени дают возможность в динамике оценивать изменение проходимости бронхов и принимать превентивные меры по предупреждению более серьезных нарушений бронхо-легочной системы.
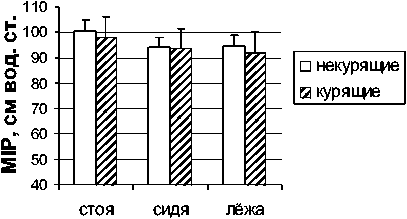
Измерение максимального инспираторного давления, отражающего силу сокращений всех мышц, участвующих в акте вдоха, выявило четкую тенденцию к снижению значений этого параметра у курящих мужчин в различных положениях тела (рис. 3). Исследование максимального инспираторного давления у женщин показало выраженное снижение максимальной силы сокращений инспираторных мышц в группе курящих во всех положениях тела по сравнению с некурящими. И хотя эти различия не были статистически значимы, линия тренда была направлена в сторону снижения MIP в группе курящих женщин. Кроме того, значения MIP были значительно снижены в положениях сидя и лежа по отношению к положению стоя.
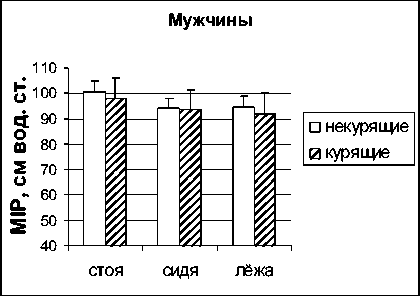
Рис. 3. Максимальное инспираторное давление (MIP) у некурящих и курящих мужчин и женщин в положениях стоя, сидя и лежа
Мужчины
Литературные сведения, касающиеся влияния курения на силу сокращений дыхательных мышц, весьма малочисленны. Существуют данные о достоверном увеличении силы инспираторных и, особенно, экспираторных мышц у курильщиков с длительным стажем курения [8]. В то же время этими же авторами установлено, что выносливость инспираторных мышц у курильщиков снижена по сравнению с некурящими. На основе полученных результатов авторы делают заключение, что хроническое курение может увеличивать силу дыхательных мышц, но снижать их выносливость. С одной стороны, увеличение силы инспираторной мускулатуры может быть объяснено ее ежедневной «тренировкой» вследствие преодоления добавочного резистивного сопротивления дыханию из-за ухудшения проходимости воздухоносных путей, а также в процессе многократного выкуривания сигарет. Однако с другой стороны, известны и такие неблагоприятные последствия длительного воздействия табачной интоксикации на организм, как атрофия скелетной мускулатуры, к которой относится и вся дыхательная. Подтверждением снижения резервных силовых возможностей инспираторных мышц при длительном курении является ослабление их выносливости, оцениваемое на основе специально разработанных тестов [8]. Кроме того, недавно было показано достоверное снижение силы скелетной мускулатуры у курильщиков, а также крыс, подвергавшихся длительной экспозиции табачного дыма [10]. На основе результатов проведенного исследования авторы делают заключение, что вызванный табачным дымом оксидативный стресс оказывает прямое воздействие на структуру сократительных белков скелетных мышц. Повреждающее действие свободных радикалов на мышечные протеины может способствовать потере мышечной массы и дисфункции скелетной и дыхательной мускулатуры у курильщиков и пациентов с хроническими обструктивными заболеваниями легких. Учитывая, что резуль- таты исследований силовых характеристик респираторной системы курильщиков неоднозначны и разнонаправлены, целесообразно дальнейшее изучение влияния табачной зависимости на силовые параметры системы дыхания и ее резервные возможности с привлечением большого количества испытуемых. Важным моментом будет являться оценка силы и выносливости дыхательных мышц у курящих и некурящих мужчин и женщин в зависимости от возраста, антропометрических параметров, общей физической подготовленности, а также длительности табачной зависимости.
Средние исходные значения насыщения гемоглобина крови кислородом у некурящих и курящих обследуемых, измеренные методом пульсоксиметрии, составили соответственно 98,4±0,7 и 97,0±0,6 %. Исходные значения сатурации артериальной крови у курильщиков были незначительно меньше, чем у некурящих обследуемых. Однако истинные значения насыщения гемоглобина кислородом у курящих могут быть значительно ниже, так как пальцевой пульсоксиметр не дифференцирует содержание оксигемоглобина (гемоглобина, насыщенного кислородом) и карбоксигемоглобина (гемоглобина, связанного с окисью углерода, или угарным газом) в связи с одинаковой окраской этих соединений. Из литературных источников известно, что количество карбоксигемоглобина у некурящих и курящих испытуемых составляет 0,34±0,13 и 2,82±1,44 % соответственно [7]. Оценка результатов теста показала, что временная кислородная десатурация гемоглобина dSpO 2 , вызванная 20-секундной произвольной задержкой дыхания на выдохе, была в 2,5 раза больше у курильщиков по сравнению с некурящими испытуемыми, составив 4,0±0,6 vs 1,6±0,7 %. (рис. 4, 5). Кроме того, время между глубоким вдохом после произвольного апноэ и началом восстановления насыщения гемоглобина кислородом в группе курящих было почти 2 раза больше, чем у некурящих обследуемых.
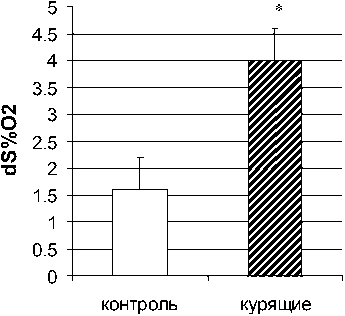
Рис. 4. Средние значения временной кислородной десатурации гемоглобина крови, вызванной произвольной 20-секундной задержкой дыхания на выдохе, у некурящих и курящих испытуемых (* – p<0,05 по сравнению с контролем)
s%o
Рис. 5. Характерные изменения временной кислородной десатурации гемоглобина крови, вызванной произвольной 20-секундной задержкой дыхания на выдохе, у некурящего (А) и курящего (Б) испытуемых
10(H
Таким образом, наши данные показали, что индуцированная задержкой дыхания временная кислородная десатурация у курящих достоверно выше, чем у некурящих испытуемых c нормальными спирометрическими данными. Вероятно, более выраженная артериальная кислородная десатурация у ку- рильщиков может быть одним из последствий нарушений легочной функции. Основными факторами, влияющими на развитие артериальной кислородной десатурации во время апноэ, могут быть следующие: 1) нарушение вентиляционно-перфузионных отношений во время апноэ; 2) внутригрудной объем газа при апноэ; 3) величина сердечного выброса; 4) длительность апноэ; 5) исходная концентрация кислорода во вдыхаемой газовой смеси; 6) потребление кислорода в покое [11]. В недавно опубликованной работе [7] было установлено, что нарушение вентиляционно-перфузионных отношений при апноэ может быть одной из основных причин выраженной кислородной десатурации у курильщиков. Авторы показали высокую корреляционную зависимость между dSpO2 и cоотношением объема закрытия (остаточного объема) к жизненной емкости легких. Увеличение доли остаточного объема легких в таком соотношении обычно указывает на неравномерность вентиляции участков легких из-за характерных для курильщиков нарушений проходимости периферических дыхательных путей [6, 12, 14]. Сниженные исходные значения SpO2 у курящих испытуемых по сравнению с некурящими также поддерживают такое предположение. Кроме того, нарушение легочной перфузии, вызванное повреждением эндотелия вследствие токсического действия табачного дыма, также может быть одним из механизмов, вносящих вклад в развитие увеличенной кислородной десатурации у курильщиков после произвольного апноэ. Феномен транзиторной артериальной десатурации достаточно часто встречается во время эпизодов сонного апноэ у тучных обследуемых [11, 13]. Развитие артериальной кислородной десатурации возможно и актуально не только во время эпизодов сонного апноэ, но также и в различных ситуациях у бодрствующего человека. Эпизоды апноэ различной длительности могут иметь место в повседневной жизни человека, например во время умывания лица, кашля, глотания, плавания, ныряния и т.д. Результаты нашего исследования указывают на то, что во время любой задержки дыхания курильщики подвергаются большему риску развития гипоксемии, чем некурящие. В том случае, если курящий пациент страдает ишемической болезнью сердца, церебральным артериосклерозом и/или пульмонологическими заболеваниями, риск развития гипоксемии на фоне эпизодов апноэ различного генеза возрастает многократно.
Таким образом, используемый в нашем исследовании тест с оценкой насыщения гемоглобина крови кислородом во время произвольной задержки дыхания может быть полезен для выявления ранних нарушений газообмена в легких у курильщиков во время профилактических осмотров или на первичных приемах практикующего врача. Разъяснение потенциально серьезных изменений в легких на основе результатов теста может способствовать более эффективному и обоснованному отказу от курения у пациентов с разным стажем табачной зависимости. Профилактическая разъяснительная работа с привлечением конкретных результатов обследования курящего пациента должна являться основанием и стимулом для прекращения курения, для оздоровления и закаливания организма, ведения здорового образа жизни.
Заключение. Результаты проведенного исследования позволяют заключить, что длительное воздействие на организм человека токсичных соединений табачного дыма снижает силовые и скоростные параметры респираторной системы, а также увеличивает транзиторную кислородную десатурацию гемоглобина, обусловленную произвольным апноэ на выдохе. Увеличенная десатурация и снижение скорости восстановления насыщения гемоглобина кислородом у курящих испытуемых могут являться следствиями нарушений газообмена в легких. Полученные данные свидетельствуют о том, что измерение максимальной силы сокращений инспираторных мышц, пиковой скорости выдоха и вдоха, а также оценка степени десатурации гемоглобина и времени восстановления насыщения крови кислородом после произвольного апноэ могут являться адекватными неинвазивными методами для раннего выявления нарушений функции респираторной системы у курящих пациентов.
-
1. Левшин В. Ф. Курение и табакизм: патогенез, диагностика и лечение / В. Ф. Левшин. – М. : Анахарсис, 2005. – 124 с.
-
2. Сахарова Г. М. Воздействие курения табака на организм / Г. М. Сахарова // Медицина: болезни органов дыхания. – 2004. – № 1 (4). – С. 14–16.
-
3. Смирнов В. К. Клиника и терапия табачной зависимости / В. К. Смирнов. – М., 2000. – 96 с.
-
4. Федосеев Г. Б. Курение и заболевание легких / Г. Б. Федосеев. – Л., 1984. – 32 с.
-
5. Федосеев Г. Б. Мелочи жизни? Аутопатогения и здоровье / Г. Б. Федосеев, В. В. Дунаевский. – СПб. : Наука, 1992. – 168 с.
-
6. A four-year follow-up study of lungmechanics in smokers / R. P. Corbin [et al.] // Am. Rew. Respir. Dis. – 1979. – Vol. 120. – P. 293–304.
-
7. A new breath-holding test may noninva-sively reveal early lung abnormalities caused by smoking and/or obesity / H. Inoue [et al.] // Chest. – 2009. – Vol. 136. – P. 545–553.
-
8. Сhen H. I. Effect of chronic smoking on respiratory muscle function / H. I. Сhen // Chin. J. Physiol. – 1988. – Vol. 31, № 1. – P. 53–62.
-
9. Chrétien J. Harmful effects of tobacco smoke / J. Chrétien // Bull. Eur. Physiopathol. Respir. – 1981. – Vol. 17, № 2. – P. 135–144.
-
10. Cigarette smoke-induced oxidative stress: A role in chronic obstructive pulmonary disease skeletal muscle disfunction / E. Barreiro [et al.] // Am. J. Respir. Crit. Care Med. – 2010. – Vol. 152, № 4. – P. 477–488.
-
11. Fletcher E. C. The rate of fall of arterial oxyhemoglobin saturation in obstructive sleep apnea / E. C. Fletcher, C. Costarangos, T. Miller // Chest. – 1989. – Vol. 96. – P. 717–722.
-
12. Noninvasive assessment of airway alterations in smokers: the small airways revisited / S. Verbanck [et al.] // Am. Respir. Crit. Care Med. – 2004. – Vol. 170. – P. 414–419.
-
13. Sleep apnea, hypopnea and oxygen desaturation in normal subjects / A. J. Block [et al.] // N. Engl. J. Med. – 1979. – Vol. 300. – P. 513–517.
-
14. The nature of small-airway obstruction in chronic obstructive pulmonary disease / J. C. Hogg [et al.] // N. Engl. J. Med. – 2004. – Vol. 350. – P. 2645–2653.
COMPARATIVE EVALUATION OF RESERVE CAPACITYOF RESPIRATORY SYSTEM IN SMOKERS AND NONSMOKERS
M.O. Segizbaeva, N.P. Aleksandrova
Pavlov Institute of Physiology PAS, St. Petersburg
Список литературы Сравнительная оценка резервных возможностей системы дыхания у курящих и некурящих
- Левшин В. Ф. Курение и табакизм: патогенез, диагностика и лечение/В. Ф. Левшин. -М.: Анахарсис, 2005. -124 с.
- Сахарова Г. М. Воздействие курения табака на организм/Г. М. Сахарова//Медицина: болезни органов дыхания. -2004. -№ 1 (4). -С. 14-16.
- Смирнов В. К. Клиника и терапия табачной зависимости/В. К. Смирнов. -М., 2000. -96 с.
- Федосеев Г. Б. Курение и заболевание легких/Г. Б. Федосеев. -Л., 1984. -32 с.
- Федосеев Г. Б. Мелочи жизни? Аутопатогения и здоровье/Г. Б. Федосеев, В. В. Дунаевский. -СПб.: Наука, 1992. -168 с.
- A four-year follow-up study of lung-mechanics in smokers/R. P. Corbin [et al.]//Am. Rew. Respir. Dis. -1979. -Vol. 120. -P. 293-304.
- A new breath-holding test may noninvasively reveal early lung abnormalities caused by smoking and/or obesity/H. Inoue [et al.]//Chest. -2009. -Vol. 136. -P. 545-553.
- Сhen H. I. Effect of chronic smoking on respiratory muscle function/H. I. Сhen//Chin. J. Physiol. -1988. -Vol. 31, № 1. -P. 53-62.
- Chrétien J. Harmful effects of tobacco smoke/J. Chrétien//Bull. Eur. Physiopathol. Respir. -1981. -Vol. 17, № 2. -P. 135-144.
- Cigarette smoke-induced oxidative stress: A role in chronic obstructive pulmonary disease skeletal muscle disfunction/E. Barreiro [et al.]//Am. J. Respir. Crit. Care Med. -2010. -Vol. 152, № 4. -P. 477-488.
- Fletcher E. C. The rate of fall of arterial oxyhemoglobin saturation in obstructive sleep apnea/E. C. Fletcher, C. Costarangos, T. Miller//Chest. -1989. -Vol. 96. -P. 717-722.
- Noninvasive assessment of airway alterations in smokers: the small airways revisited/S. Verbanck [et al.]//Am. Respir. Crit. Care Med. -2004. -Vol. 170. -P. 414-419.
- Sleep apnea, hypopnea and oxygen desaturation in normal subjects/A. J. Block [et al.]//N. Engl. J. Med. -1979. -Vol. 300. -P. 513-517.
- The nature of small-airway obstruction in chronic obstructive pulmonary disease/J. C. Hogg [et al.]//N. Engl. J. Med. -2004. -Vol. 350. -P. 2645-2653.


