Сравнительная оценка результатов коронарного шунтирования в сочетании с методом экстракардиальной ревакуляризации миокарда у пациентов с диффузным поражением венечного русла
Автор: Борщев Г.Г., Миминошвили Л.Г., Зайниддинов Ф.А., Катков А.А., Ульбашев Д.С.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.19, 2024 года.
Бесплатный доступ
ИБС занимает главенствующее место среди сердечно-сосудистых причин смерти населения в РФ и во всем мире. У некоторых пациентов с ИБС проведение полной хирургической реваскуляризации затруднено из-за диффузного поражения коронарного русла, малого диаметра сосудов, выраженного кальциноза стенок артерий, дистального стенотически-окклюзионного поражения, высокого риска осложнений и тяжести клинического состояния по причине других сопутствующих заболеваний. Эффективность лечения таких больных до сих пор остается низкой. С целью преодоления этой проблемы Ю.Л. Шевченко разработал и внедрил в клиническую практику методику хирургической стимуляции экстракардиальной васкуляризации миокарда «ЮрЛеон». В настоящее время существуют ее разные модификации, позволяющие улучшить результаты лечения пациентов. Цель: сравнительная оценка результатов коронарного шунтирования, дополненного методикой ЮрЛеон II и ЮрЛеон III. Материалы и методы. В ретроспективное исследование включено 180 пациентов с диффузным поражением коронарного русла (мужчин — 127 (71%), женщин — 53 (29%) в возрасте от 50 до 70 лет, средний возраст — 65,6±4,65 лет), которые проходили лечение в Клинике грудной и сердечно-сосудистой хирургии имени Святого Георгия ФГБУ «НМХЦ имени Н.И. Пирогова» Минздрава России. Пациенты разделены на три группы: I группа (n = 60) — после коронарного шунтирования (КШ) (контрольная группа); II группа (n = 60) — после КШ, дополненного методикой ЮрЛеон II; III группа (n = 60) — после КШ, дополненного методикой ЮрЛеон III. Оценивалось клиническое состояние больных, данные ЭхоКГ, однофотонной эмиссионной компьютерной томографии миокарда, синхронизированной с ЭКГ (синхро-ОФЭКТ) и показатели качества жизни (опросник SF-36). Результаты. В отдаленном послеоперационном периоде во II и III группах по сравнению с I группой отмечено статистически значимое снижение функционального класса стенокардии (1 [1–2], 1 [1–2] против 2 [2–2], p<0,05); увеличение фракции выброса левого желудочка (59[54-62]% (II группа), 59[55-63]% (III группа) по сравнению с контрольной — 50 [47-53]%, p<0,05). По данным сцинтиграфии миокарда отмечено снижение показателя Summed Rest Score (4[3-7] балла (II группа), 4[2-8] балла (III группа) против 11[6-18] баллов (I группа), p<0,05); уменьшение показателя Summed Thickening Score (8[5-11] баллов (II группа), 7[5-8] баллов (III группа) по сравнению с контрольной — 10[8-14] баллов, p<0,05). Обследуемые больные через 12-36 месяцев после операции отличались по показателям качества жизни (SF-36): PF (74[66-80] балла (I группа), 86[80-92] баллов (II группа), 84 [78-90] балла (III группа), p<0,05); RP (76[70-82] баллов (I группа), 90[85-95] баллов (II группа), 92 [88-96] балла (III группа), p<0,05); BP (80[75-85] баллов (I группа), 90[85-95] баллов (II группа), 92[86-98] балла (III группа), p<0,05); PH (46[42-50] баллов (I группа), 58[54-62] баллов (II группа), 60[56-64] баллов (III группа), р<0,05). Заключение. Коронарное шунтирование, дополненное методом хирургической стимуляции экстракардиальной реваскуляризации у пациентов с ИБС и диффузным поражением коронарного русла, улучшает клиническое состояния больных, их качество жизни, повышает фракцию выброса левого желудочка, его перфузию и позволяет обеспечить дополнительное кровоснабжение миокарда в отдаленном послеоперационном периоде.
ИБС, диффузное поражение, реваскуляризация, неоангиогенез, ЮрЛеон
Короткий адрес: https://sciup.org/140307062
IDR: 140307062 | DOI: 10.25881/20728255_2024_19_2_19
Текст научной статьи Сравнительная оценка результатов коронарного шунтирования в сочетании с методом экстракардиальной ревакуляризации миокарда у пациентов с диффузным поражением венечного русла
Диффузное атеросклеротическое поражение коронарных артерий, выраженное изменение дистального русла, кальциноз и малый диаметр венечных сосудов у пациентов с ИБС осложняют техническое выполнение хирургической реваскуляризации миокарда, увеличивают количество послеоперационных осложнений, уменьшают выживаемость [1–5]. В целом качество жизни таких больных низкое, а медикаментозная терапия недостаточно эффективна [5]. В последние десятилетия количество пациентов с диффузным поражением венечного русла увеличивается, а их лечение по-прежнему остается ведущей проблемой современной кардиохирургии [6]. По данным многих исследований рутинное выполнение коронарного шунтирования (КШ) у таких пациентов малоэффективно и связанно с неполной реваскуляризацией [1; 5; 7]. Существует высокая вероятность ранней окклюзии трансплантата из-за плохого дистального кровотока, что приводит к периоперационным осложнениям с длительной потребностью в фармакологической и механической поддержке, а также к возможному летальному исходу [8].
Раньше такие пациенты считались неоперабельными, в настоящее время развиваются реконструктивные методики с выполнением эндартерэктомии и использованием микрохирургической техники [9]. Однако результаты подобного лечения зависят от опыта хирурга, а выполнение эндартерэктомии связано с увеличением риска периоперационного инфаркта миокарда и, как следствие, смерти от кардиальных причин в связи с тромбозом артерии в деэндотелизированном участке [10]. Многообещающими казались результаты использования трансмиокардиальной лазерной реваскуляризации миокарда (ТМЛР), предложенной M. Mirhoseini и M. Cayton ещё в 1981 г. [11], однако в более поздних исследованиях эти взгляды изменились [12; 13].
В 2007 г. Ю.Л. Шевченко внедрен в клиническую практику метод индукции непрямой реваскуляризации миокарда из околосердечных источников ( Патент на изобретение RU №2758024С1. Заявка №2021105731 ). Многими экспериментальными и клиническими исследованиями, подтверждена эффективность и безопасность подобного комплексного лечения больных ИБС с диффузным поражением коронарных артерий [14–18]. В статье продемонстрированы результаты дополнения КШ одной из основных модификаций методики ЮрЛеон в сравнении с изолированным выполнением прямой реваскуляризации у пациентов с диффузным поражением коронарного русла.
Материалы и методы
В ретроспективное исследование включено 180 пациентов с диффузным поражением коронарного русла (127 (71%) мужчин, 53 (29%) женщины, в возрасте от 50 до 70 лет, средний возраст — 65,6±4,65 лет), которые прохо- дили лечение в Клинике грудной и сердечно-сосудистой хирургии имени Св. Георгия ФГБУ «НМХЦ имени Н.И. Пирогова» Минздрава России.
Критерии включения в исследование:
-
• стенокардия напряжения III–IV ФК;
-
• резистентность к традиционной медикаментозной терапии и отсутствие возможности для эндоваскулярной реваскуляризации миокарда;
-
• отсутствие гемодинамически значимой патологии клапанного аппарата сердца;
-
• диффузное атеросклеротическое поражение коронарных артерий (задействовано два и более сегмента одной магистральной артерии, общей протяженностью поражения более 50% всей длины сосуда при наличии гемодинамически значимого сужения просвета и малым диаметром дистального русла (менее 2 мм));
-
• фракция выброса левого желудочка (ФВ ЛЖ) менее 50%.
Критерии невключения:
-
• аневризма ЛЖ;
-
• необходимость кардиальной ресинхронизирующей терапии;
-
• почечная и печеночная недостаточность;
-
• наличие тромбоза ЛЖ или предсердия;
-
• наличие онкозаболеваний.
Пациенты разделены на три группы, статистически значимо не различающиеся между собой (Табл. 1):
-
I группа (n = 60) — после КШ (контрольная группа);
-
II группа (n = 60) — после КШ, дополненного методикой ЮрЛеон II (КШ+ЮрЛеон II);
Табл. 1. Клинико-демографическая характеристика пациентов
|
Показатель |
Группа I n = 60 |
Группа II n = 60 |
Группа II n = 60 |
Значения p (критерий Краскела- Уоллиса) |
|
Пол, n (%) Мужской Женский |
41(69) 19(31) |
44(74) 16(26) |
42(70) 18(30) |
0,062 0,723 |
|
Средний возраст, лет (M±SD) |
64,8±4,2 |
66,7±4,8 |
65,8±5,7 |
0,122 |
|
Инфаркт миокарда в анамнезе, n (%) |
28(47) |
31(52) |
30(50) |
0,054 |
|
ФК стенокардии, n (%) III IV |
43(72) 17(28) |
45(76) 15(24) |
42(71) 18(29) |
0,093 0,081 |
|
SYNTAX Score, баллы (M±SD) |
29,4±5,6 |
31,2±3,4 |
30,3±4,8 |
0,322 |
|
Данные эхокардиографии |
||||
|
ФВ, % (Me [Q1–Q3]) |
40 [35-45] |
39 [36-44] |
40 [36-45] |
0,655 |
|
Данные сцинтиграфии миокарда |
||||
|
SRS, баллы (Me [Q1–Q3]) |
21 [19-22] |
19 [17-22] |
20 [18-21] |
0,605 |
|
STS, баллы (Me [Q1–Q3]) |
21 [20-23] |
22 [19-24] |
21 [19-24] |
0,899 |
Примечание : ЛЖ — левый желудочек; ФВ — фракция выброса;
ФК — функциональный класс; SRS — Summed Rest Score;
STS — Summed Thickening Score.

Борщев Г.Г., Миминошвили Л.Г., Зайниддинов Ф.А. и др.
СРАВНИТЕЛЬНАЯ ОЦЕНКА РЕЗУЛЬТАТОВ КОРОНАРНОГО ШУНТИРОВАНИЯ В СОЧЕТАНИИ С МЕТОДОМ ЭКСТРАКАРДИАЛЬНОЙ РЕВАКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ДИФФУЗНЫМ ПОРАЖЕНИЕМ ВЕНЕЧНОГО РУСЛА
III группа (n = 60) — после КШ, дополненного методикой ЮрЛеон III (КШ+ЮрЛеон III).
Методика ЮрЛеон II
До операции выполняется заготовка обогащённой тромбоцитами плазмы крови пациента методом однократного центрифугирования. На интраоперационном этапе создается липидно-фибриновая матрица (источник мезенхимальных стволовых клеток и стимуляторов неоангиогенеза) по разработанной оригинальной методике. Проводится механическая обработка эпикарда и перикарда абразивным материалом с целью создания асептического воспаления. Полученная липидно-фибриновая матрица фиксируется на эпикарде. На 2 сутки в перикардиальную полость вводится стерильный дренажный аспират, полученный в течение первых 12 часов после операции и содержащий факторы стимуляции неоангиогенеза (Рис. 1).
Методика ЮрЛеон III
На интраоперационном этапе проводится обработка перикарда и эпикарда абразивным материалом (специальной перчаткой), выполняется субтотальная пери-кардэктомия, формируется медиастинальный жировой лоскут и фиксируется на поверхности сердца. На 2 сутки после операции через дополнительный перикардиальный дренаж вводится стерильный дренажный аспират, полученный в течение первых 12 часов после реваскуляризации и содержащий факторы стимуляции неоангиогенеза (Рис. 2).
Учитывались данные исследований, проведенных перед реваскуляризацией миокарда и в послеоперационном периоде через 6, 12, 24, 36 месяцев. Оценивались жалобы, данные анамнеза, клиническое состояние больных, результаты трансторакальной ЭхоКГ, синхронизированной с электрокардиограммой однофотонной эмиссионной компьютерной томографии миокарда с 99mTc-технетрилом (синхро-ОФЭКТ). Для изучения качества жизни был применен опросник SF-36.
Статистический анализ
Статистические расчеты проведены в программе Statistica 12 (StatSoft). Оценено соответствие данных нормальному распределению (критерии Шапиро-Уилка, Колмогорова-Смирнова). Показатели описательной статистики включали число наблюдений (n), среднее значение (М), стандартное отклонение (SD), медиану (Ме), нижний и верхний квартили [Q1–Q3]. При распределении, близком к нормальному, использован однофакторный дисперсионный анализ. В случаях, когда распределение отличалось от нормального, анализ выполнялся с помощью непараметрических критериев: Фридмана для связанных выборок, U-критерия Краскела-Уоллиса для независимых. Различия считали статистически значимыми при p<0,05.
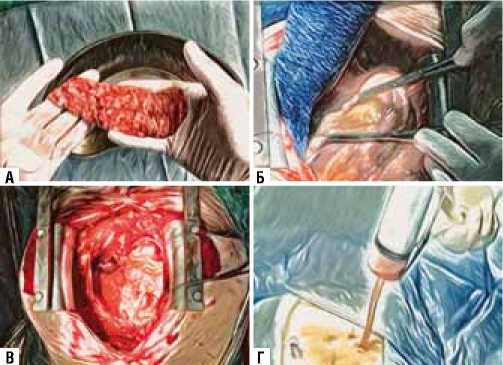
Рис. 1. Техника выполнения методики ЮрЛеон II. А — формирование липидно-фибриновой матрицы; Б — абразивная обработка перикарда и эпикарда; В — позиционирование и фиксация липидно-фибриновой матрицы на сердце; Г — введение стерильного дренажного аспирата в перикардиальную полость на 2 сутки после операции.
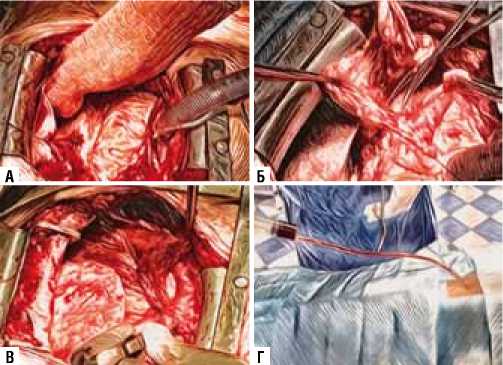
Рис. 2. Техника выполнения методики ЮрЛеон III. А — абразивная обработка перикарда и эпикарда; Б — формирование медиастинального жирового лоскута и субтотальная перикардэктомия; В — фиксация медиастинального жирового лоскута на сердце; Г — введение стерильного дренажного аспирата в перикардиальную полость на 2 сутки после операции через специальный дренаж.
Результаты
У всех пациентов отмечено улучшение клинического состояния в послеоперационном периоде. Через 6 месяцев ФК стенокардии уменьшился во всех группах с 3[3–4] до 2[2–2] (p<0,01). Через год отмечены статистические различия между группами: в I группе ФК стенокардии не изменился — 2[2–2], во II и III группах отмечено улучшение клинического состояния — 1[1–2] (p<0,01). В отдалённые сроки после операции в контрольной группе, по сравнению с другими, наблюдалась отрицательная динамика — увеличение ФК (через 36 месяцев: 2[2–2] класс (I группа), 1[1–2] класс (II группа), 1[1–2] класс (III группа), p<0,05), чаще отмечались случаи возврата стенокардии (Табл. 2).
Табл. 2. Изменение ФК стенокардии напряжения, (Me [Q1–Q3])
|
Сроки |
I группа |
II группа |
III группа |
Значение р между группами |
Значение р внутри групп |
|
Исходно |
3 [3–4] |
3 [3–4] |
3 [3–4] |
I–II–III 0,722; I–II 0,432; II–III 0,825; I–III 0,722 (критерий Краске-ла–Уоллиса) |
I <0,05 II <0,05 III <0,05 (критерий Фридмана) |
|
6 мес. |
2 [2–2] |
2 [2–2] |
2 [2–2] |
I–II–III 0,321; I–II 0,214 II–III 0,528; III 0,345 (критерий Краске-ла–Уоллиса) |
|
|
12 мес. |
2 [1–2] |
1 [1–2] |
1 [1–2] |
I–II–III <0,05; I–II <0,05 II–III 0,438; I–III <0,05 (критерий Краске-ла–Уоллиса) |
|
|
24 мес. |
2 [1–2] |
1 [1–2] |
1 [1–2] |
I–II–III <0,05; I–II <0,05 II–III 0,802; I–III <0,05 (критерий Краске-ла–Уоллиса) |
|
|
36 мес. |
2 [2–2] |
1 [1–2] |
1 [1–2] |
I–II–III <0,05; I–II <0,05 II–III 0,858; I–III <0,05 (критерий Краске-ла–Уоллиса) |

Изменение ФВ ЛЖ (по данным эхокардиографии)
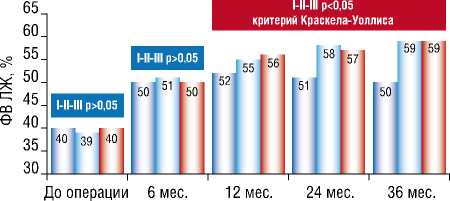
Исходно показатели всех групп пациентов статистически значимо не различались (p = 0,655, критерий Краскела–Уоллиса). В течение 6 месяцев у исследуемых отмечено увеличение ФВ ЛЖ в I группе с 40[35–45]% до 50[46–52]% (p<0,01), во II группе — с 39[36–44]% до 51[47–54]% (p<0,01), в III группе — с 40[36–45]% до 50[46–54]% (p<0,01). Между группами за этот период статистически значимых различий не выявлено. Однако в отдаленном послеоперационном периоде (12–36 месяцев) показатели различались: во II и III группах ФВ ЛЖ статистически значимо увеличилась до 59[54–62]% и 59[55–63]%, соответственно; в контрольной группе ФВ ЛЖ через 36 месяцев после операции составила 50[47–53]% (p<0,05, критерий Краскела–Уоллиса) (Рис. 3).
Изменение перфузии и сократительной функции миокарда ЛЖ (по данным синхро-ОФЭКТ)
Показатели всех групп пациентов до операции не отличались (p = 0,605, критерий Краскела–Уоллиса). Отмечается значимое снижение SRS при контрольном исследовании в течение 6 месяцев: в I группе с 21[19–22] до 10[8–13] баллов (p<0,01), во II группе — с 19[17–22] до 9[7–11] баллов (p<0,01), в III группе — с 20[18–21] до 10[8–12] баллов (p<0,01). В отдаленном послеоперационном периоде (12–36 месяцев) отмечены статистически значимые различия. Через 36 месяцев во II и III группах выявлено улучшение перфузии, показатель SRS снизился до 4[3–7] и 4[2–8] баллов, соответственно, (p<0,01), что значимо отличалось от результатов I группы — 11[6–18] баллов (p<0,05, критерий Краскела–Уоллиса) (Рис. 4).
При оценке показателя сегментного систолического утолщения миокарда (STS), демонстрирующего сокра-
Сроки
I || I группа II группа ■ I III группа
Рис. 3. Динамика ФВ ЛЖ в группах (по данным ЭхоКГ).
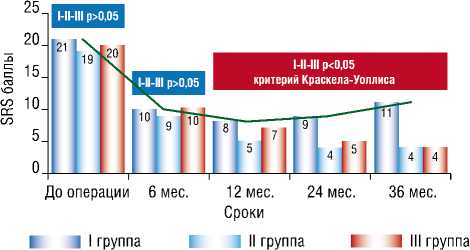
Рис. 4. Динамика SRS в группах (по данным синхро-ОФЭКТ).
тительную способность миокарда ЛЖ, оказалось, что исходно группы были сопоставимы по этому показателю (p = 0,899, критерий Краскела-Уоллиса). В течение 6 мес. после реваскуляризации у пациентов отмечена положительная динамика: в I группе снижение показателя STS с 21[20–23] до 12[10–13] баллов (p<0,01), во II группе — с 22[19–24] до 10[7–13] баллов (p<0,01), в III группе — с 21[19–24] до 8[7–12] баллов (p<0,01). Подобно предыдущим показателям отличия между группами выявлены в отдаленные сроки. Так, в течение 36 месяцев наблюдения STS изменился в I группе до 10[8–14] баллов, во II группе — до 8[5–11] баллов (p<0,01), в III группе — до 7[5–8] баллов (p<0,05, критерий Краскела–Уоллиса) (Рис. 5).
При определении и оценке объема гибернирован-ного миокарда в исследуемых группах, оказалось, что в отдаленные сроки (12–36 месяцев) в I группе выявлено 24[20–29]%, во II группе — 9[5–12]%, в III группе — 10[5–15]% гибернированных зон миокарда ЛЖ.
Оценка качества жизни
Выявлено улучшение качества жизни (согласно опроснику SF–36) у пациентов всех групп. Значимые различия отмечены по следующим показателям:
-
• «Физическое функционирование» (PF): в I группе выявлено увеличение с 28[22–34] до 74[66–80] баллов (p<0,01), во II группе — с 26[20–32] до 86[80–92] баллов (p<0,01), в III группе — с 27 [21–33] до 84 [78–90] баллов (p<0,01);

Борщев Г.Г., Миминошвили Л.Г., Зайниддинов Ф.А. и др.
СРАВНИТЕЛЬНАЯ ОЦЕНКА РЕЗУЛЬТАТОВ КОРОНАРНОГО ШУНТИРОВАНИЯ В СОЧЕТАНИИ С МЕТОДОМ ЭКСТРАКАРДИАЛЬНОЙ РЕВАКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ДИФФУЗНЫМ ПОРАЖЕНИЕМ ВЕНЕЧНОГО РУСЛА
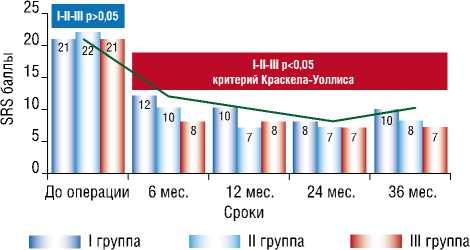
Рис. 5. Динамика STS в группах (по данным синхро-ОФЭКТ).
-
• «Ролевое функционирование, обусловленное физическим состоянием» (RP): в I группе — с 16[10–22] до 76[70–82] баллов (p<0,01), во II группе — с 17[10–24] до 90[85–95] баллов (p<0,01), в III группе — с 15 [10–20] до 92 [88–96] баллов (p<0,01);
-
• «Интенсивность боли» (BP): в I группе — с 24[16–32] до 80[75–85] баллов (p <0,01), во II группе — с 22 [14–30] до 90[85–95] баллов (p<0,01), в III группе — с 25 [20–30] до 92[86–98] баллов (p<0,01).
Выявлено статистически значимое различие между группами по общему показателю качества жизни («Физический компонент здоровья» PH) через 12–36 месяцев после реваскуляризации: 46[42–50] баллов в I группе, 58[54–62] баллов во II группе, 60[56–64] баллов в III группе (p<0,05, критерий Краскела-Уоллиса).
Обсуждение
В настоящее время нет достаточной доказательной базы и общепринятых национальных рекомендаций по хирургическому лечению пациентов с диффузным поражением коронарного русла. Коронарная эндартероэкто-мия в некоторых случаях позволяет получить удовлетворительные результаты лечения больных, которым невозможно добиться полной реваскуляризации другими методами [9], но важно отметить, что эта методика связана с высоким риском развития инфаркта миокарда в перио-перационном периоде, причинами которого, возможно, является активация коагуляционного каскада из-за отсутствия эндотелия на ранних сроках, а также пролиферация миоцитов и соединительной ткани в более позднем периоде, поэтому после эндартерэктомии необходимо строго следовать рекомендациям по антитромбоци-тарной терапии [19].
С момента первых публикаций ТМЛР стала предметом серьезных споров из-за противоречивых результатов эффективности и безопасности ее применения, а также отсутствия объяснений возможных механизмов реваскуляризации. Наблюдаемое во многих исследованиях улучшение клинического состояния пациентов, их качества жизни подвержено высокому риску систематической ошибки и может быть объяснено с точки зрения эффекта плацебо [12]. По данным многих исследо- ваний проведение ТМЛР не влияет на увеличение перфузии и функции миокарда [20–22]. Различий в выживаемости пациентов после выполнения этой методики в сравнении с контрольной группой обнаружено не было, а в некоторых наблюдениях отмечается даже увеличение послеоперационной летальности, поэтому риски, связанные с проведением ТМЛР, перевешивают потенциальную пользу [23]. По мнению ряда ученых, качество доказательств эффективности методики считается низким [12].
В проведенном Meier P. с соавт. мета-анализе 12 исследований с участием 6529 пациентов сделаны выводы, что развитые коллатерали играют важнейшую защитную роль и снижают риск смерти. Так, у пациентов с хорошо развитым внутри- и внесердечным коллатеральным кровотоком риск смерти уменьшался на 36% [24]. Поэтому возможность стимуляции формирования дополнительных коллатералей особенно необходима у пациентов с диффузным поражением коронарных артерий, при невозможности полной прямой реваскуляризации без риска осложнений.
Введение в клиническую практику Ю.Л. Шевченко хирургического метода индукции экстракардиальной реваскуляризации миокарда «ЮрЛеон» открыло новые возможности для лечения больных с диффузным поражением коронарного русла [5].
В нашем исследовании отмечается значимое улучшение клинического состояния, качества жизни и увеличение ФВ ЛЖ у пациентов после дополнения КШ методикой ЮрЛеон в отдаленном послеоперационном периоде по сравнению с контрольной группой. Увеличение показателей сократимости обусловлено значимым улучшением перфузии и восстановлением гибернированного миокарда за счет дополнительного экстракардиального кровоснабжения, особенно в тех зонах, где шунтирование не было выполнено по разным причинам.
Сравнивая между собой модификации одного хирургического метода стимуляции экстракардиальной реваскуляризации миокарда, предложенного Ю.Л. Шевченко, следует отметить, что значимых различий в их эффективности не выявлено, все исследуемые результаты были сопоставимы, однако ЮрЛеон II — технически более сложный метод и требует дополнительного времени для создания липидно-фибринового матрикса (Табл. 3).
Концентрат факторов свертывания крови и тромбоцитов, который находится в липидно-фибриновой матрице приводит к ускорению процессов тромбообразования в зоне хирургической агрессии в ближайшем послеоперационном периоде, способствуя снижению кровоточивости повреждённых тканей и, соответственно, уменьшению отделяемого по дренажам. У пациентов с диффузным поражением коронарного русла и прогнозируемой большой кровопотерей (поздняя отмена антитром-боцитарной терапии перед хирургическим вмешательством, экстренная операция, бимаммарное шунтирова-
Табл. 3. Сравнение техники выполнения двух разных модификаций метода хирургической стимуляции непрямой реваскуляризации
|
Этапы |
ЮрЛеон II |
ЮрЛеон III |
|
Дооперационный |
Заготовка обогащённой тромбоцитами плазмы крови |
– |
|
Интраоперационный |
Извлечение жировой ткани из переднего средостения и эпикарда. Обработка перикарда и эпикарда абразивным материалом. Формирование и фиксация липидно–фибринового матрикса к сердцу. Установка дополнительного перикардиального дренажа |
Обработка перикарда и эпикарда абразивным материалом. Формирование медиастинального жирового лоскута с субтотальной пери-кардэктомией. Установка дополнительного перикардиального дренажа. |
|
Послеоперационный |
Введение на 2 сутки после операции дренажного аспирата, содержащего факторы роста сосудов. |
Введение на 2 сутки после операции дренажного аспирата, содержащего факторы роста сосудов. |
ние, наличие других рисков кровотечений), КШ целесообразно дополнять методикой ЮрЛеон II с применением липидно-фибриновой матрицы.
Ограничениями данного исследования является отсутствие рандомизации, ослепления, а также одноцентровой и ретроспективный характер наблюдения. Отсутствовала возможность анализа данных всех пациентов в установленные сроки, часть пациентов выбыла из исследования. При выявлении новых экстракарди-альных источников существует проблема визуализации, в исследование не включены морфологические данные подтверждения формирования новых экстракардиаль-ных коллатералей. В настоящее время необходимо продолжение исследований.
Заключение
Стимуляция экстракардиального неоангиогенеза при проведении КШ имеет большое значение для обеспечения дополнительного кровоснабжения миокарда в долгосрочном послеоперационном периоде, параллельно с уже сформированными прямыми сосудистыми анастомозами. Достоверно лучшие показатели сократимости и перфузии миокарда, стабильно высокое качество жизни больных в отдаленном послеоперационном периоде позволяют считать КШ, дополненное методикой ЮрЛеон II и ЮрЛеон III, операцией выбора у пациентов с ИБС и диффузным коронарным атеросклерозом.
Список литературы Сравнительная оценка результатов коронарного шунтирования в сочетании с методом экстракардиальной ревакуляризации миокарда у пациентов с диффузным поражением венечного русла
- Акчурин Р.С., Ширяев А.А., Васильев В.П., и др. Диффузное поражение коронарных артерий в коронарной хирургии (аналитический обзор) // Клиническая и экспериментальная хирургия. Журнал имени академика Б.В. Петровского. — 2018. — №6(4). — С.75-81. doi: 10.24411/2308-1198-2018-14011.
- Белаш С.А., Барбухатти К.О. Реконструктивные операции при диффузном коронарном атеросклерозе без эндартерэктомии // Инновационная медицина Кубани. — 2019. — №15(3). — С.53-61. doi: 10.35401/2500-0268-2019-15-3-53-61.
- Белаш С.А., Барбухатти К.О., Шевченко С.С. и др. Отдаленные результаты реваскуляризации миокарда в сочетании с эндартерэктомией при диффузном коронарном атеросклерозе // Грудная и сердечно-сосудистая хирургия. — 2021. — №3(63). — С.188-194. doi: 10.24022/0236-2791-2021-63-3-188-194.
- Курбанов С.К., Власова Э.Е., Саличкин Д.В. и др. Госпитальные и годичные результаты коронарного шунтирования при диффузном поражении коронарных артерий // Кардиологический вестник. — 2019. — №14(1). — С.60-66. doi: 10.17116/Cardiobulletin20191401160.
- Шевченко Ю.Л., Борщев Г.Г. Экстракардиальная реваскуляризация миокарда у больных ИБС с диффузным поражением коронарного русла. — М.: Издательство НМХЦ им. Н.И. Пирогова, 2022.
- Brown RA, Shantsila E, Varma C, et al. Epidemiology and pathogenesis of diffuse obstructive coronary artery disease: the role of arterial stiffness, shear stress, monocyte subsets and circulating mircoparticles. Ann Med. 2016; 48(6): 444-455. doi: 10.1080/07853890.2016.1190861.
- Lozano I, Capin E, de la Hera JM, et al. Diffuse Coronary Artery Disease Not Amenable to Revascularization: Long-term Prognosis. Rev Esp Cardiol (Engl Ed). 2015; 68(7): 631-3. doi: 10.1016/j.rec.2015.02.013.
- Ramasubrahmanyam G, Panchanatheeswaran K, Varma Kalangi TK, et al. Surgical management of diffusely diseased coronary arteries. Indian J Thorac Cardiovasc Surg. 2019; 35(3): 453-460. doi: 10.1007/s12055-018-0776-2.
- Ширяев А.А., Акчурин Р.С., Васильев В.П., и др. Годовые результаты коронарного шунтирования у пациентов с диффузным поражением коронарных артерий // Кардиология и сердечно-сосудистая хирургия. — 2021. — №14(5). — С.413 419. doi: 10.17116/ kardio202114051413.
- Nishigawa K, Fukui T, Yamazaki M, et al. Ten-Year Experience of Coronary Endarterectomy for the Diffusely Diseased Left Anterior Descending Artery. Ann Thorac Surg. 2017; 103(3): 710-716. doi: 10.1016/j.athoracsur. 2016.11.028.
- Mirhoseini M, Cayton M. Revascularization of the heart by laser. J. Microsurg. 1981; 2: 253-260.
- Briones E, Lacalle JR, Marin-Leon I, et al. Transmyocardial laser revascularization versus medical therapy for refractory angina. Cochrane Database Syst Rev. 2015; 2015(2): CD003712. doi: 10.1002/14651858.CD003712.
- Schofield PM, McNab D. National Institute for Health and Clinical. NICE evaluation of transmyocardial laser revascularisation and percutaneous laser revascularisation for refractory angina. Heart. 2010; 96(4): 312-313. doi: 10.1136/hrt.2009.185769.
- Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С. Отдаленные результаты коронарного шунтирования, дополненного хирургической стимуляцией экстракардиальной васкуляризации миокарда, у пациентов с диффузным поражением коронарного русла // Комплексные проблемы сердечно-сосудистых заболеваний. — 2023. — №12(1). — С.160-171. doi: 10.17802/2306-1278-2023-12-1-160-171.
- Shevchenko YuL, Borshchev GG, Ulbashev DS. Surgical technique of angiogenesis stimulation (extracardial myocardial revascularization) in patients with coronary artery disease. Cardiology and Cardiovascular Medicine. 2022; 6: 529-535. doi: 10.26502/fccm.92920295.
- Шевченко Ю.Л., Байков В.Ю., Борщев Г.Г. и др. Миниинвазивная торакоскопическая техника стимуляции экстракардиальной васкуляризации миокарда методом ЮрЛеон при диффузном поражении коронарного русла при ИБС // Вестник НМХЦ им. Н.И. Пирогова. — 2022. — Т.17. — №2. — С.103-106. doi: 10.25881/ 20728255_2022_17_2_103.
- Shevchenko YuL, Borshchev GG. Effect of extracardial myocardial revascularization on long-term results of surgical treatment of patients with coronary heart disease. The 12th Annual International Congress of Cardiology-2023. Lisbon, Portugal. 17-19 July 2023.
- Шевченко Ю.Л. Влияние экстракардиальной реваскуляризации миокарда (методика ЮрЛеон) на отдаленные результаты хирургического лечения пациентов с ишемической болезнью сердца // Кардиологический вестник. — 2023. — №18. — С.164.
- Heo W, Min HK, Kang DK, et al. Long Segmental Reconstruction of Diffusely Diseased Left Anterior Descending Coronary Artery Using Left Internal Thoracic Artery with Extensive Endarterectomy. Korean J Thorac Cardiovasc Surg. 2015; 48(4): 285-288. doi: 10.5090/kjtcs.2015.48.4.285.
- van der Sloot JA, Huikeshoven M, Tukkie R, et al. Transmyocardial revascularization using an XeCl excimer laser: results of a randomized trial. Ann Thorac Surg. 2004; 78(3): 875-882. doi: 10.1016/ j.athoracsur.2004.02.073.
- Iwanski J, Knapp SM, Avery R, et al. Clinical outcomes meta-analysis: measuring subendocardial perfusion and efficacy of transmyocardial laser revascularization with nuclear imaging. J Cardiothorac Surg. 2017; 12(1): 37. doi: 10.1186/s13019-017-0602-8.
- Tasse J, Arora R. Transmyocardial revascularization: peril and potential. J Cardiovasc Pharmacol Ther. 2007; 12(1): 44-53. doi: 10.1177/ 1074248406297640.
- Peterson ED, Kaul P, Kaczmarek RG, et al. From controlled trials to clinical practice: monitoring transmyocardial revascularization use and outcomes. J Am Coll Cardiol. 2003; 42(9): 1611-1616. doi: 10.1016/j.jacc.2003.07.003.
- Meier P, Hemingway H, Lansky AJ, et al. The impact of the coronary collateral circulation on mortality: a meta-analysis. Eur Heart J. 2012; 33(5): 614-621. doi: 10.1093/eurheartj/ehr308.


