Сравнительная оценка влияния нулевой и традиционной обработки на биологическую активность агрочерноземов Ставропольского края
Автор: Кутовая О.В., Тхакахова А.К., Семенов М.В., Чернов Т.И., Ксенофонтова Н.А., Железова А.Д., Гаджиумаров Р.Г., Стукалов Р.С., Иванова Е.А., Никитин Д.А.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Рубрика: Статьи
Статья в выпуске: 100, 2019 года.
Бесплатный доступ
С помощью метода посева на элективные питательные среды оценена численность и активность таксономических (бактерии, актиномицеты, микромицеты) и функциональных (азотфиксаторы, аммонификаторы, денитрификаторы амилолитики, целлюлолитики) групп микроорганизмов в агрочерноземах Ставропольского края под влиянием различных систем обработки почвы - прямого посева (no-till) и вспашки с оборотом пласта (традиционная обработка). Анализы проводили для вариантов с озимой пшеницей, кукурузой, подсолнечником и соей при внесении/отсутствии минеральных удобрений. Традиционная обработка почвы для большинства сельскохозяйственных культур приводит к росту активности аэробных аммонификаторов, целлюлолитиков, денитрификаторов, актиномицетов и микромицетов. Технология no-till, в свою очередь, повышает интенсивность анаэробных целлюлолитиков и азотфиксаторов, аэробных диазотрофов и амилолитиков. Наиболее отзывчивой культурой, под которой увеличивалась биологическая активность практически всех групп микроорганизмов на полях no-till, стала кукуруза, тогда как озимая пшеница повышала численность микроорганизмов при вспашке. Применение минеральных удобрений повышало биологическую активность почвы под подсолнечником при прямом посеве, в то время как при традиционной обработке значения данного параметра увеличивались на фоне отсутствия минеральных удобрений.
Численность кое, целлюлолитики, амилолитики, азотфиксаторы, денитрификаторы, бактерии, актиномицеты, микроскопические грибы, нулевая и традиционная обработка почвы
Короткий адрес: https://sciup.org/143168539
IDR: 143168539 | УДК: 579.26:631.46 | DOI: 10.19047/0136-1694-2019-100-159-189
Текст научной статьи Сравнительная оценка влияния нулевой и традиционной обработки на биологическую активность агрочерноземов Ставропольского края
Обработка почвы значительно определяет ее физические, химические и агрономические свойства (Delgado, Gómez, 2016). В зависимости от используемой системы механической обработки меняется структура почвы, ее плотность, порозность, водно- воздушный и тепловой режимы, что оказывает влияние на аэрацию и общую продуктивность гумусовых горизонтов. Уровень аэрации, в свою очередь, сказывается на преобладании тех или иных функциональных групп микроорганизмов, влияющих на формы и запасы биогенных элементов в почве, определяя при этом питание растений и в конечном итоге качество и количество получаемого урожая (Shukla et al., 2017).
Поскольку биологические свойства почвы прямо или косвенно влияют на выход сельскохозяйственной продукции, необходим анализ данных показателей в результате длительного применения той или иной технологии обработки почвы (Liu et al., 2016) . Микробиологические показатели часто используют в целях биоиндикации, поскольку прокариоты и микромицеты наиболее чутко откликаются на большинство воздействий, которым подвергаются почвы (Anderson, 2003) . Важно понимать, что разные типы обработки почвы создают порой диаметрально противоположные условия для сохранения влаги и доступности в ней кислорода (Trojan, Linden, 1998) , что определяет преобладание аэробных или анаэробных групп микроорганизмов. Их соотношение может служить индикатором степени насыщенности почвы атмосферным воздухом, парциального давления кислорода, а также интенсивности таких важных биологических процессов, как азотфиксация, аммонификация (минерализация азота), нитратредукция и другие (Добровольская и др., 2015; Кутовая и др., 2016, 2018; Marinkovic et al., 2018) . Традиционная обработка почвы с использованием вспашки с оборотом пласта резко усиливает интенсивность некоторых негативных, с точки зрения агропочвоведения, микробиологических процессов (минерализацию азота и углерода), однако данных о влиянии технологии no-till на их сбалансированность в столь важных для сельского хозяйства почвах как черноземы, практически нет (Беляева, 2013) .
Цель работы – изучение влияния длительного применения технологии прямого посева (no-till) на биологическую активность в агрочерноземах Ставропольского края.
ОБЪЕКТЫ И МЕТОДЫ
Исследования проводили с образцами агрочерноземов, отобранных на территории опытного хозяйства ФГБНУ “СевероКавказский ФНАЦ” Шпаковского района Ставропольского края (45°07′48″ с. ш.; 42°01′39″ в. д.) . Почва опытного участка – чернозем обыкновенный среднемощный слабогумусированный тяжелосуглинистый, сформировавшийся на лёссовидных карбонатных суглинках (Гаджиумаров, 2018). Пахотный горизонт характеризуется низким содержанием гумуса – 3.87% и нитратного азота (в момент отбора – 11.9 мг/кг), средним количеством подвижного фосфора – 18.7 мг/кг (по Мачигину) и средней обеспеченностью обменным калием – 245 мг/кг. Реакция почвенного раствора нейтральная – рН = 6.32. Вниз по профилю значения всех показателей постепенно уменьшаются: гумус – до 0.65% в горизонте С (126–175 см); N-NO 3 – до 0.5 мг/кг; Р 2 О 5 – до 3.4 мг/кг; К 2 О – до 155 мг/кг; щелочность увеличивается в нижних слоях до рН = 8.3. Почвы опытных полей 7 лет возделывали с помощью традиционной обработки (вспашки с оборотом пласта) и по технологии прямого посева no-till. Повторность опыта трехкратная, площадь делянок 300 м2 (50 м × 6 м), учетная – 90 м2. Для полей обоих типов обработки вносили минеральные удобрения (N 60 P 60 K 60 ) перед посевом (175 кг/га нитроаммофоски) и с помощью сеялки при посеве (200 кг/га нитроаммофоски). Плотность почвы полей перед уборкой урожая в слое 0–10 см с традиционной обработкой составляла 1.23 г/см3, тогда как для полей no-till – 1.24 г/см3. Анализы проводили для вариантов с сельскохозяйственными культурами (озимая пшеница, кукуруза, подсолнечник, соя) при внесении/отсутствии минеральных удобрений. Контролем служила необрабатываемая залежная почва вблизи опытных полей. Отбор образцов проводили из слоя 0–10 см в октябре 2018 г. в 3-кратной повторности с необходимыми мерами по предотвращению контаминации (табл. 1). До анализов образцы хранились при температуре +4 °С.
Таблица 1. Список образцов, отобранных для микробиологического анализа
Table 1. List of samples taken for microbiological analysis
|
Обработка почвы |
Культура |
Удобрения |
|
кукуруза |
– + |
|
|
Минимальная, прямой посев |
соя |
– + |
|
(no-till) |
озимая пшеница |
+ |
|
подсолнечник |
– + |
|
|
кукуруза |
— + |
|
|
Традиционная |
соя |
— + |
|
(вспашка с оборотом пла- |
||
|
ста) |
озимая пшеница |
+ |
|
подсолнечник |
— + |
|
|
Залежь |
разнотравье |
— |
Микробиологический посев.
Определение численности и активности экологотрофических групп микроорганизмов проводили методом посева на питательные среды: мясопептонный агар (МПА – для аммонификаторов и сапротрофных бактерий), крахмалоаммиачный агар (КАА – для амилолитиков), голодный агар (ГА – для олиготро-фов), среду Чапека (ЧА – для оценки обилия сапротрофных микроскопических грибов), среду Гетчинсона (с бумажными дисками – для аэробных микромицетов целлюлозолитиков) (Теппер и др., 2005) ; активность азотобактера оценивали по обрастанию почвенных комочков на среде Эшби (Теппер и др., 2005) ; методом предельных разведений (Практикум по микробиологии…, 1976) на жидких средах учитывали анаэробные азотфиксаторы (среда Виноградского), микроорганизмы группы нитратного дыхания (среда ГНД) (Ильина, Фомина, 1983) , анаэробные целлюлозолитики – на среде Гетчинсона с бумажными полосками фильтровальной беззольной бумаги. Количественные показатели на жидких средах представлены в наиболее вероятном количестве клеток микроорганизмов (ККМ) в единице объема суспензии – 1 мл. Повторность каждого варианта посева пятикратная. Для приготовления почвенной суспензии брали 5 г свежей почвы и суспендировали в 50 мл стерильной дистиллированной воды. Десорбцию клеток микроорганизмов от почвенных частиц осуществляли путем обработки почвенной суспензии на вортексе “MSV-3500” (Латвия) при скорости 3500 об/мин в течение 10 мин. Для подавления роста бактерий в питательные среды Чапека и Гетчинсона добавляли порошок стрептомицина (100 мг/л).
В таблице 2 указаны составы питательных сред, используемых для микробиологического посева, разведения почвенной суспензии и сроки учета микроорганизмов. Статистическую обработку результатов проводили в программах STATISTICA 10.0 и Microsoft Excel 2016.
Таблица 2. Состав твердых и жидких сред, используемых для микробиологического посева Table 2. Composition of solid and liquid media used for microbiological culture
|
Название среды |
Состав среды на 1000 мл H 2 O |
Показатель разведения почвенной суспензии |
Объем суспензии для посева |
Сроки учета, сутки |
|
МПА |
Пептон сухой ферментированный – 10.0 г; экстракт мясной – 11.0 г; NaCl – 5.0 г; агар – 15.0 г. |
3–5 |
100 мкл |
3 |
|
КАА |
Крахмало-аммиачный агар К 2 HPO 4 – 1.0 г; (NH 4 ) 2 SO 4 – 2.0 г; MgSO 4 – 1.0 г; NaCl – 1.0 г; CaCO 3 – 3 г; растворимый крахмал – 10; агар – 20 г. |
3–5 |
100 мкл |
3, 5 |
|
Среда Гетчинсона |
К 2 HPO 4 – 1.0 г; CaCl 2 – 0.1 г; MgSO 4 – 0.3 г; NaCl – 0.1 г; FeCl 3 – 0.01 г; NaNO 3 – 2.50 г; CaCO 3 – 10 г; агар– 20 г. После застывания среды в чашках Петри перед посевом на поверхность среды кладут стерильную фильтровальную бумагу в качестве источника целлюлозы |
1–3 |
1 мл |
7, 14, 21 |
|
Среда Чапека |
КН 2 PO 4 – 1.0 г; MgSO 4 – 0.5 г; NaNO 3 – 3.0 г; KCl – 0.5 г; сахароза – 30 г; FeSO 4 – 0.01 г; агар – 20 г. Перед разливом по чашкам Петри в колбу с горячей средой добавляют стрептомицин. |
2–4 |
200 мкл |
7, 14, 21 |
|
Название среды |
Состав среды на 1000 мл H 2 O |
Показатель разведения почвенной суспензии |
Объем суспензии для посева |
Сроки учета, сутки |
|
Голодный агар |
Агар – 20 г |
3–5 |
100 мкл |
7, 14, 21 |
|
Среда Эшби |
КН 2 PO 4 – 0.2 г; MgSO 4 – 0.2 г; NaCl – 0.2 г; K 2 SO 4 – 0.1 г; CaCO 3 – 3.0 г; маннит – 10-15 г; агар – 20 г. |
По 25 комочков обрастания на 2 чашки Петри готовят из 2 г почвы с увлажнением стерильной водой |
10 |
|
|
Жидкая среда Виноградск ого |
K 2 HPO 4 – 0.5 г; MgSO 4 – 0.5 г; глюкоза – 15 г; NaCl – следы; FeSO 4 – следы; MnSO 4 – следы; в каждую пробирку перед разливом среды добавляют CaCO 3 на кончике шпателя. |
2–6 |
1 мл |
3, 6, 10, 14 |
|
Жидкая среда ГНД |
КН 2 Р0 4 – 1,0 г; молочная кислота (80%) – 0.6 г; яблочная кислота – 0.5 г; C 2 H 3 O 2 Na – 0.5 г; мясопептонный бульон – 100 мл; FeCl 3 – 0.02 г; NaOH – 1.0 г; бромтимоловый синий – 10.0 мл. |
2–11 |
1 мл |
3, 6, 10, 14 |
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Микробиологические посевы
1. Азотфиксаторы
Среди живых существ только некоторые из прокариот, азотфиксаторы (диазотрофы), способны переводить молекулярный азот из воздуха в соединения, доступные для большинства организмов. Благодаря диазотрофам фиксированный азот может переходить в почвенное органическое вещество, увеличивая почвенное плодородие (Добровольская и др., 2015) . Результаты активности аэробных азотфиксаторов представлены на рисунке 1.1.
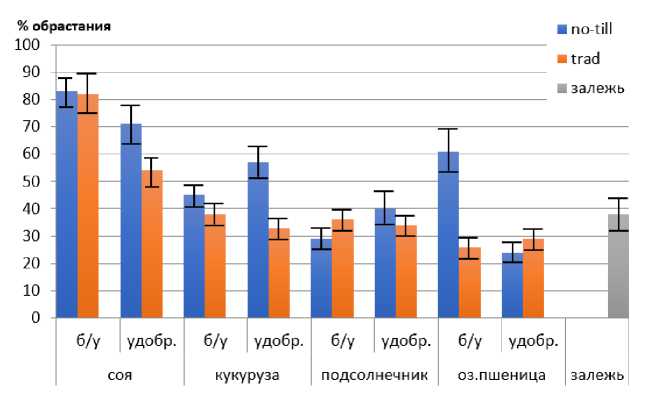
Рис. 1.1. Численность аэробных азотфиксаторов Azotobacter (среда Эшби) на опытах Северо-Кавказского ФНАЦ под разными культурами с применением минеральных удобрений и без них.
Fig. 1.1. Number of aerobic nitrogen fixers Azotobacter (Ashby medium) in the experiments of the North Caucasus FNAC under different crops with and without mineral fertilizers.
Минимальные значения обнаружены в образцах почвы под озимой пшеницей и подсолнечником, а максимальные – под соей, причем несколько большие значения характерны для полей с минимальной обработкой no-till. Исключение составляет удобренный вариант озимой пшеницы и вариант подсолнечника без удобрений. Результаты согласуются с литературными источниками, демонстрирующими низкую долю аэробных азотфиксаторов под зерновыми, а высокую – под бобовыми культурами (Кожемяков и др., 2004; Добровольская и др., 2015; Geddes et al., 2015). Увеличение доли азотфиксаторов может косвенно свидетельствовать о повышении содержания в данных вариантах доступных для растений форм азота и, как следствие, сравнительно большим плодородием почв.
Количество анаэробных азотфиксаторов в исследованных образцах изменялось от 8.9 × 102 до 8.3 × 106 КОЕ/г почвы (рис. 1.2).
Ig КОЕ/г почвы
■ no-till
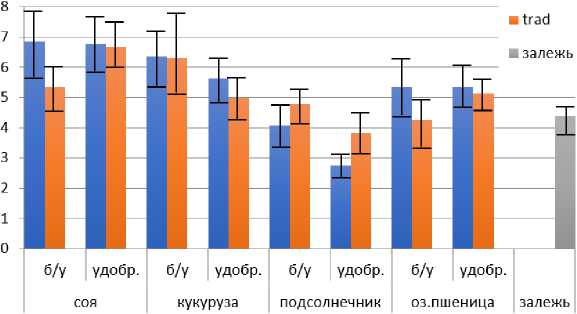
Рис. 1.2. Численность анаэробных азотфиксаторов (среда Виноградского) на опытах Северо-Кавказского ФНАЦ под разными культурами с применением минеральных удобрений и без них.
Fig. 1.2. The number of anaerobic nitrogen fixers (Vinogradskiy's medium) in the experiments of the North Caucasus FNAC under different crops with and without mineral fertilizers.
Минимальными показателями характеризуются варианты под подсолнечником при использовании no-till и внесении удобрений, а максимальными – под культурами сои и кукурузы вне зависимости от обработки почвы и наличия удобрений. Это можно объяснить мощной стержневой корневой системой подсолнечника, проникающей на глубину до 1.5–3 м, которая обеспечивает значительную аэрацию (Gregory, 2007; Delgado, Gómez, 2016). Необходимо также отметить, что культивируемые анаэробные азотфиксаторы, к которым относятся микроорганизмы рода Clostridium, более активны в вариантах с минимальной обработкой почвы no-till, за исключением подсолнечника.
2. Аммонификаторы
При аммонификации происходит минерализация азота из органических соединений, большая часть которого становится доступной растениям (Добровольская и др., 2015) . Количество микроорганизмов этой неспецифической экологической группы является показателем интенсивности минерализации азота в почве (Vlasova et al., 2015; Marinkovic et al., 2018) .
Численность КОЕ аммонифицирующих бактерий на МПА в разных вариантах колебалась от 4.9 × 106 до 7.2 × 107 КОЕ/г почвы (рис. 2а), что соответствует результатам исследователей Ставропольского НИИСХ (Фаизова и др., 2013), а также данным по другим черноземным почвам (Кутовая и др., 2018). Минимум аммонифицирующих бактерий выявлен для вариантов полей с применением технологии no-till под кукурузой и подсолнечником без удобрений, а максимум – для полей с традиционной обработкой под кукурузой и озимой пшеницей без удобрений. Прослеживается общая тенденция уменьшения численности аммонификаторов при использовании минимальной обработки почвы, причем активность приближается к показателям образцов залежи, где процессы более консервативны, направлены на сохранение энергии и гумусовых веществ (Шарков, 2011). В большей степени этот процесс прослеживается под кукурузой, озимой пшеницей и подсолнечником без удобрений. Технология обработки почвы не повлияла на численность бактерий на среде МПА из образцов под соей. Эта сельскохозяйственная культура содержит много белка (Marinkovic et al., 2018), являющегося подходящим питательным субстратом для аммонификаторов независимо от локализации растительных остатков – на поверхности почвы в случае no-till или запаханными в толщу обрабатываемого горизонта в случае вспашки. В зависимости от наличия/отсутствия удобрений численность аммонификаторов меняется незначительно (рис. 2). Внесение удобрений увеличило их активность в несколько раз под соей и более чем на порядок – под подсолнечником в системе минимальной обработки.
3. Денитрификаторы
Экологическая группа денитрификаторов приводит к восстановлению нитратов до закиси азота или молекулярного азота. Данный процесс обычно происходит при уменьшении содержания кислорода в почве (например, при снижении интенсивности обработки почвы) и приводит к потерям азота, что снижает уровень почвенного плодородия (Добровольская и др., 2015) .
Для учета микроорганизмов группы нитратного дыхания выбран интегральный показатель, включающий в себя несколько факторов колониального роста: помутнение среды, изменение цвета (рН), эмиссия газа (Ильина, Фомина, 1983). Численность денитрификаторов для всех исследованных образцов сохраняла относительно высокий уровень вне зависимости от культуры, типа обработки почвы и внесения удобрения (рис. 3). Сходные результаты представлены коллегами (Кутовая и др., 2016). Максимальные значения характерны для делянок под подсолнечником, обрабатываемого по технологии no-till без удобрений. Значения показателей ниже, чем в остальных вариантах лишь в контроле на залежи и варианте “кукуруза – no-till – без удобрения”, что может быть связано с низким содержанием нитратов в указанных вариантах. Практически на всех точках отбора, кроме делянок с подсолнечником, процесс денитрификации снижен при использовании технологии no-till, по сравнению с традиционной обработкой почвы. Таким образом, можно предположить, что бóльшие потери азота могут происходить при использовании вспашки с оборотом пласта. Однако возделываемая культура также влияет на интенсивность развития денитрификаторов (Graf et al., 2016; Wang et al., 2017). Значительное содержание соединений с анионом NO3- в почве, а также низкое парциальное давление кислорода приводит к инициации микроорганизмов группы нитратного дыхания и ак- тивной денитрификации, что способствует потерям азота из почвы (Graf et al., 2016; Wang et al., 2017).
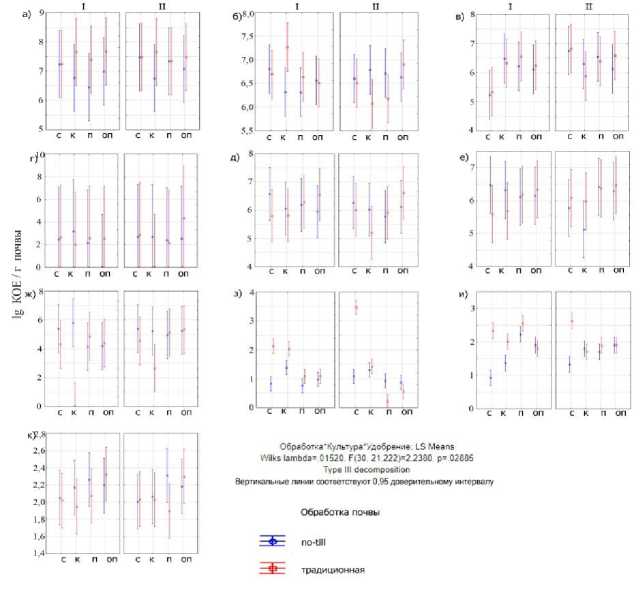
Рис. 2. Дисперсионный анализ численности КОЕ микроорганизмов различных эколого-трофических групп в зависимости от типа обработки почвы (no-till, традиционная), внесения удобрений ( I – без удобрений, II – с расчетной дозой удобрений) и сельскохозяйственной культуры ( с – сои, к – кукурузы, п – подсолнечника, оп – озимой пшеницы): а ) – бактерий на среде МПА, б ) – бактерий на среде КАА, в ) – актиномицетов на среде КАА, г ) – микромицетов на среде КАА, д ) – бактерий на среде ГА, е ) – актиномицетов на среде ГА, ж ) – микромицетов на среде ГА, з ) – микромицетов на среде Чапека, и ) – микромицетов на среде Гетчинсона, к ) – количество анаэробных целлюлозолитиков.
Fig. 2. Dispersion analysis of CFU number of microorganisms of various ecological and trophic groups depending on the type of tillage (no-till, traditional), fertilization ( I – without fertilizers, II – with a calculated dose of fertilizers) and agricultural crop ( с – soybean, к – corn, п – sunflower, оп – winter wheat): а ) – bacteria grown on the meat infusion agar, б ) – bacteria grown on starch-and-ammonia agar, в ) – actinomycetes grown on starch-and-ammonia agar, г ) – micromycetes grown on starch-and-ammonia agar, д ) – bacteria grown on water agar, е ) – actinomycetes grown on water agar, ж ) – micromy-cetes grown on water agar, з ) – micromycetes grown on Czapek's agar, и ) – micromycetes grown on Getchinson's medium, к ) – quantity of anaerobic cellulolytic bacteria.
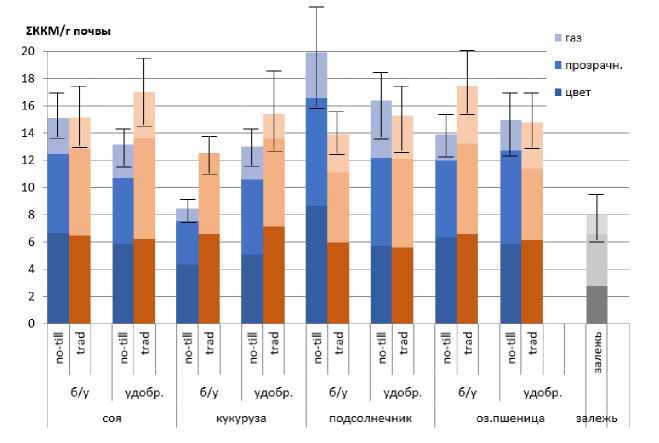
Рис. 3. Численность денитрификаторов (среда ГНД) на опытах СевероКавказского ФНАЦ под разными культурами с применением минеральных удобрений и без них.
Fig. 3. Number of denitrifiers (Nitrate Breathing Group medium, NBG medium) in the North Caucasus FNAC experiments under different crops with and without mineral fertilizers application.
4. Олиготрофные микроорганизмы
Органическое вещество в почве представлено остатками организмов, специфическими гумусовыми веществами и неспецифическими соединениями, в состав которых входят аминокислоты, белки, углеводы, моно- и полисахариды, лигнин, органические кислоты, липиды и многие другие соединения (Lehmann, Kleber, 2015) . Органическое вещество распространено весьма неравномерно вследствие гетерогенности почвы. Часто оно недоступно для микроорганизмов из-за отсутствия достаточного количества влаги или необходимых ферментов (Методы…, 1992) . Поэтому значительная часть почвенных микроорганизмов является оли-готрофами (Методы…, 1992; Добровольская и др., 2015) . Часть из них способны усваивать целлюлозу и лигнин, разлагая их до более легкогидролизуемых соединений и гумусоподобных веществ, поэтому оценка их численности важна для сельскохозяйственной микробиологии (Тихонович, Круглов, 2006) .
Большее количество КОЕ олиготрофных бактерий, культивируемых на среде ГА, в образцах составило от 9.8 × 104 до 5.7 × 106 КОЕ/г почвы, вне зависимости от сельскохозяйственной культуры, типа обработки почвы и внесения удобрений (рис. 2д). Такие значения достаточно высоки по сравнению с данными, полученными ранее для черноземной зоны (Кутовая и др., 2016) . Достоверные различия обнаружены под озимой пшеницей, независимо от внесения удобрений: бактерий на ГА вырастало гораздо больше при использовании традиционной технологии, незначительное увеличение бактерий в вариантах при вспашке отмечено и под подсолнечником. Под культурами сои и кукурузы существенно увеличена активность олиготрофных бактерий в технологии прямого посева.
Многие актиномицеты являются олиготрофами (Зенова и др., 2011) , их обилие и таксономический состав в почвах сельскохозяйственного использования часто зависит от возделываемых растений. Численность актиномицетов на ГА колебалась от 104 КОЕ/г почвы под кукурузой в системе no-till без удобрений до 107 КОЕ/г почвы под соей без удобрений также в системе no-till (рис. 2е).
Согласно результатам дисперсионного анализа, численность олиготрофных актиномицетов (рис. 2е) примерно одинакова в почвах под подсолнечником и озимой пшеницей и практически не меняется ни под воздействием обработки, ни при наличии минеральных удобрений. Тогда как под соей и кукурузой максимальные значения обнаружены при прямом посеве без внесения удобрений, а применение удобрений кардинально изменило картину – численность актиномицетов уменьшилась для полей no-till и увеличилась для пашни. Вероятно, отсутствие удобрений и недостаток элементов питания приводят к преобладанию олиготрофов, использующих растительные остатки на поверхности почвы в системе no-till.
Многие роды почвенных микроскопических грибов проявляют в сообществе олиготрофную стратегию (Мирчинк, 1988; Domsch et al., 2007) , поэтому их численность в большинстве проанализированных вариантов на ГА была весьма значительной и достигала 105–106 КОЕ/г почвы (рис. 2ж). Однако в образцах, отобранных под кукурузой в варианте с традиционной обработкой и внесением удобрений, количество грибных зачатков не превышало 102 КОЕ/г почвы, а без удобрений они обнаружены единично. Другие исследователи показывали снижение обилия микроскопических грибов в почве при традиционной обработке (Irawan et al., 2017; Schmidt et al., 2019) . В настоящих исследованиях вспашка с оборотом пласта повлияла на уменьшение количества микромице-тов только под соей и кукурузой. В варианте с озимой пшеницей значимым фактором является применение минеральных удобрений: в случаях их отсутствия количество микроскопических грибов уменьшается как в вариантах со вспашкой, так и без нее, что также согласуется с литературными данными (Fu et al., 2019) .
Количество КОЕ олиготрофных микромицетов достоверно выше только в варианте с кукурузой при технологии no-till (рис. 2ж), особенно без удобрений. Зачастую численность микромице-тов повышается в почве при внесении удобрений (Семенов и др., 2019). Увеличение численности микромицетов для делянок под соей при технологии прямого посева может быть связано с повышенным уровнем азота, продуцируемого бактериальными симбионтами бобовых (Marinkovic et al., 2018). Обилие олиготрофной микобиоты под озимой пшеницей, вероятно, обусловлено сокращением численности копиотрофов при недостатке азота и других элементов питания для данных делянок, что подтверждается увеличением их численности при внесении минеральных удобрений почти на порядок независимо от технологии обработки почвы.
Экологическая роль микроскопических грибов в почве многогранна. Благодаря широкому набору ферментов данные организмы могут разлагать достаточно большой спектр органических веществ, при этом скорость данного процесса существенно превышает таковую по сравнению с бактериями в аэробных условиях. Процессы преобразования растительных остатков в почвенное органическое вещество и гумус также во многом определяются деятельностью микроскопических грибов (Мирчинк, 1988; Garrett, 2016) .
Общая численность культивируемых микромицетов в посевах исследованных почв (для индивидуального образца) на среде Чапека относительно невелика и составляла до 3.2 × 103 КОЕ/г почвы (рис. 2з). Наибольшее количество КОЕ отмечено в образцах с традиционной обработкой под культурами сои вне зависимости от внесения удобрений и кукурузы без удобрений. По-видимому, это может быть связано с культурой-предшественником на данных делянках, часто определяющей интенсивность развития микроорганизмов в полях (Teotia et al., 2016) . Предшественником кукурузы в данном случае является подсолнечник, а сои – кукуруза, это пропашные культуры, оставляющие после уборки на поле достаточное количество пожнивных остатков, при запашке которых микромицеты могут активно развиваться (Grebenikova et al., 2018) . На 2–3 порядка меньше численность культивируемых микроскопических грибов в остальных исследуемых вариантах полей. Минимум микромицетов отмечен для полей пшеницы и подсолнечника, особенно для почв, подвергающихся воздействию традиционной обработки с удобрениями. Отсутствие удобрений повлияло на увеличение численности микромицетов под всеми культурами на делянках с традиционной обработкой почвы. Отметим, что численность микроскопических грибов в целом ниже на среде Гетчинсона (в среднем от 0.6 × 102 КОЕ/г почвы, рис. 2и), чем на среде Чапека (в среднем 7.1 × 102 КОЕ/г почвы, рис. 2з).
Сапротрофный блок микромицетов в исследованных образцах представлен типичными почвенными родами: Acremonium Aspergillus, Aureobasidium, Cadophora, Coniothyrium, Cuninghamella, Epicoccum, Eurotium, Geotrichum, Metarhizium, Monilia, Mortierella Mucor, Paecilomyces, Penicillium, Pseudogymnoas, Rhizopus, Sarocladium, Talaromyces, Trichoderma, Umbellopsis и другими . Эта группа микроскопических грибов широко специализирована и может одинаково хорошо разлагать разнообразные типы субстрата – как сложные полисахариды (лигнин, целлюлозу и др.), так и легкодоступные органические вещества (сахара, аминокислоты и др.). В результате деятельности сапро-трофных микромицетов разлагается большая часть отмерших растительных и животных остатков (Domsch et al., 2007) , происходит минерализация органических веществ и образование гумуса, увеличивающего плодородие почвы (Garrett et al., 2016; Irawan et al., 2017) .
Фитопатогенные микромицеты, несмотря на широкую видовую представленность, были минорным компонентом сообщества, поскольку обладали крайне низкой численностью на грани погрешности (от 2.0 × 101 до 8.0 × 101 КОЕ/г почвы). Они представлены видами: Alternaria tenuissima, Cladosporium spp., Cochliobolus lunatus, Fusarium poae, F. solani, Humicola fuscoatra, Phoma exhigua, Ph. herbarum, Stachybotrytis chartarum, Verticillium tenerum. Фитопатогенные микромицеты являются естественным компонентом любой почвы, в том числе природной, поэтому обнаружены в минимальных количествах практически во всех вариантах полевого опыта независимо от технологии обработки, внесения удобрений и выращиваемой культуры.
5. Амилолитические микроорганизмы
Крахмал – один из наиболее распространенных полисахаридов в почве, содержащийся в значительных количествах в таких сельскохозяйственных растениях как кукуруза, картофель и другие (Wang et al., 2015). Судьба растительных остатков этих культур для агрочерноземов не вполне ясна (Семенов и др., 2015). Не известно, насколько полно и быстро они разлагаются, находясь на поверхности почвы или будучи запаханными в слое агрочернозе- ма (Турусов и др., 2017). Для изучения этого вопроса исследовалась численность амилолитических микроорганизмов в образцах почвы.
Общая численность бактерий в различных вариантах на среде КАА варьировала в пределах одного порядка (рис. 2б). Максимальная численность амилолитиков (3.6 × 107 КОЕ/г почвы) отмечена в варианте под кукурузой при традиционной обработке и без внесения удобрений. Уменьшение количества амилолитиков отмечали на полях, обрабатываемых по традиционной технологии с внесением удобрений под соей, подсолнечником и особенно под кукурузой (1.3 × 106 КОЕ/г почвы), в последнем варианте численность микроорганизмов данной группы приближалась к таковой (минимальной) в фоновом биотопе – залежи (8.1 × 105 КОЕ/г почвы). По-видимому, снижение количества представителей данной эколого-трофической группы может быть обусловлено токсическим действием минеральных удобрений (Geisseler, Scow, 2014) под всеми культурами, кроме озимой пшеницы. Любопытно, что отрицательное действие удобрений на микроорганизмы-амилолитики при использовании минимальной обработки почвы нивелировано под всеми культурами, кроме пшеницы, где наблюдается небольшое стимулирующее действие, и численность бактерий, культивируемых на среде КАА, несколько возростала. Подобный эффект отмечался в других исследованиях (Geisseler, Scow, 2014) .
Дисперсионный анализ выявил достоверно большую численность амилолитических бактерий в варианте поля, обработанного традиционно без удобрений под кукурузой и в поле no-till с удобрениями также под кукурузой (рис. 2б). Данный факт можно объяснить тем, что в остатках кукурузы содержится достаточно много крахмала (Wang et al., 2015) , являющегося субстратом для данной эколого-трофической группы микроорганизмов.
Среди бактерий-амилолитиков значительную долю составляли актиномицеты, играющие, благодаря мицелию, важную роль в формировании структуры почвы (Зенова и др., 2011; Добровольская и др., 2015). Их численность в различных вариантах на среде КАА варьировала в пределах трех порядков – от 1.0 × 104 до 4.4 × 107 КОЕ/г почвы (рис. 2в). Минимум выявлен в образцах почвы с делянок сои без удобрений вне зависимости от технологии обработки почвы. Максимальная численность актиномицетов отмечена также под соей, но на полях с внесением удобрений. Также увеличение численности актиномицетов при внесении минеральных удобрений наблюдалось на делянках с подсолнечником при технологии no-till и с озимой пшеницей при вспашке. При выращивании пшеницы по технологии no-till эффекта от удобрений не наблюдали. Подобные закономерности для полей с обилием растительных остатков (мульчи) показаны и другими исследователями (Fu et al., 2019). Количество актиномицетов уменьшилось при внесении удобрений на полях с кукурузой независимо от способа обработки почвы, а также на делянках с подсолнечником при традиционной вспашке. Таким образом, не наблюдается четкой корреляции со способами обработки почвы и внесением удобрений, как показано в других исследованиях (Семенов и др., 2019), а наиболее значимым фактором выступают биологические особенности возделываемой культуры и ее корневой системы.
Судя по результатам дисперсионного анализа, численность амилолитических актиномицетов во всех вариантах под всеми культурами, кроме сои, практически одинакова и не связана с исследуемыми факторами (рис. 2). Имеются лишь тенденции к увеличению численности актиномицетов на полях с традиционной обработкой почвы под соей, подсолнечником и озимой пшеницей без внесения удобрений, а также на полях no-till под кукурузой без удобрений и под кукурузой и подсолнечником с удобрениями.
Численность микромицетов на среде КАА во всех исследованных образцах низка, и не превышает в среднем 103–104 КОЕ/г почвы, в большинстве образцов составляет 102 КОЕ/г почвы (рис. 2г). Максимальные значения численности микроскопических грибов, способных разлагать крахмал, соответствуют делянкам с кукурузой под минимальной обработкой без удобрений. Такое явление можно объяснить практически полным отсутствием фитопато-генных микромицетов для кукурузы, содержащей много крахмала (Wang et al., 2015) . В остальных случаях на делянках no-till под соей, подсолнечником и озимой пшеницей минеральные удобрения увеличивали численность микромицетов. Показаны сходные результаты для полей с обилием растительной мульчи (Fu et al.,
2019) . В образцах фонового биотопа залежи микромицетов-амилолитиков не выявлено.
6. Целлюлолитические микроорганизмы
Дисперсионный анализ для амилолитических микромице-тов, так же как для актиномицетов, этой эколого-трофической группы не выявил достоверной разницы между рассматриваемыми вариантами, кроме единственного резкого превышения численности культивируемой микобиоты для поля под озимой пшеницей, обработанного традиционно независимо от удобрений (рис. 2г).
Целлюлоза – самый распространенный полисахарид в природе. Его запасы на полях, обрабатываемых по технологии no-till, могут быть весьма велики (Кирюшин, 2013; Железова и др., 2017; Кутовая и др., 2018) . Однако преобладают ли на них фитопатоген-ные микроорганизмы или остатки быстро разлагаются типичными целлюлолитиками в агрочерноземе, не известно (Железова и др., 2017) .
Аэробное целлюлолитическое сообщество исследованных образцов на селективной среде Гетчинсона представлено практически исключительно микроскопическими грибами Chaetomium globosum , Doratomyces stemonitis , Oideodendron sp., Rhizopus stolonifer , Trichoderma spp. Их общая численность мала во всех образцах – до 3.0 × 102 КОЕ/г почвы (рис. 2и). Максимум аэробных целлюлолитиков выявлен в посевах образцов почвы с делянок под соей, возделываемой по традиционной технологии вне зависимости от удобрений, а также в образцах почвы с делянок под подсолнечником без удобрений независимо от системы обработки почвы. Низкая целлюлолитическая активность в аэробных условиях может быть обусловлена относительно высоким содержанием в почве более питательных органических веществ – растительных остатков и корневых экссудатов, менее энергозатратных при их разложении и использовании микроорганизмами, а также удобрений, действующих токсично на часть целлюлозолитиков.
Целлюлолитическая активность в анаэробных условиях минимальна для образцов с делянок, где выращивали сою и кукурузу (рис. 2к). После уборки этих культур на полях остается мало растительных остатков, что, по-видимому, снижает численность и активность в почве штаммов, разлагающих клетчатку (Кутовая и др., 2016). Более высокие значения деградации целлюлозы для notill, где верхние слои почвы менее аэрированы (Кирюшин, 2013; Кутовая и др., 2018), подтверждают данную гипотезу. Напротив, в почве под подсолнечником при отборе образцов выявлено значительное количество мульчи, что, в свою очередь, стимулировало развитие целлюлолитических микроорганизмов (Fu et al., 2019). Стоит отметить сравнительно большую величину анаэробной целлюлолитической активности на полях, обработанных по технологии no-till, практически во всех вариантах под всеми культурами, кроме озимой пшеницы. Такая закономерность может быть объяснена увеличением числа анаэробных зон и значительным количеством растительных остатков в почвах, обработанных по технологии no-till (Кирюшин, 2013.)
ЗАКЛЮЧЕНИЕ
Тип обработки почвы существенно влияет на биологическую активность черноземов и во многом определяет их агрономические свойства. Традиционная обработка почвы, по сравнению с no-till, приводит к увеличению численности аэробных аммонификаторов и целлюлолитиков, превращающих азот и углерод в доступную для растений форму. На вспаханных полях, по сравнению с минимально обработанными делянками, более активен процесс денитрификации, в результате которого происходит потеря азота из почвы. Также при этом типе почвенной обработки увеличивается количество актиномицетов, особенно при использовании минеральных удобрений, что связано со способностью большинства этих микроорганизмов развиваться в условиях повышенной концентрации солей. Кроме того, многие актиномицеты почв умеренной климатической зоны устойчивы к повышенным температурам и высушиванию почвы, поэтому в вариантах с традиционной обработкой они получили преимущество в росте. И напротив, минимальная технология обработки почвы, по сравнению со вспашкой, повышает активность анаэробных целлюлолитиков. На полях, обрабатываемых по технологии прямого посева, наблюдается максимальная численность азотфиксаторов, развивающихся как в аэробных, так и в анаэробных условиях, а также амилолити- ков (особенно в вариантах с внесением удобрений), способных использовать для роста не только белковые, но и минеральные формы азота непосредственно из почвы.
Численность всех культивируемых микроорганизмов при длительном применении традиционной вспашки несколько увеличивается, что связано с лучшей аэрированностью пахотного горизонта. При этом поля, возделываемые с использованием традиционных приемов, содержат сравнительно меньшую долю фитопато-генных микромицетов, чем поля, где применяется no-till, что является важным для сельского хозяйства. Вместе с тем прямой посев, по сравнению со вспашкой, создает в почве большее количество микрозон с преимущественно анаэробными условиями и может нести риски вспышек фитопатогенных инфекций по сравнению с полями, обрабатываемыми традиционно. С другой стороны, повышение биологического разнообразия делает исследуемую почву под прямым посевом более устойчивой к факторам внешней среды, а уменьшение активности некоторых групп микроорганизмов приближает свойства почвы к консервативным природным черноземным почвам.
Полученные данные позволяют получить информацию о выраженности и направленности почвенно-биологических процессов в агрочерноземах в условиях применения технологии no-till при выращивании основных сельскохозяйственных культур. Показано, что биологическая активность практически всех групп микроорганизмов возрастает под кукурузой при технологии прямого посева, а под озимой пшеницей – при традиционной вспашке. Культура подсолнечника оказалась самой восприимчивой к внесению минеральных удобрений. Биологическая активность возрастала во вспаханных почвах в основном при отсутствии удобрений, тогда как для полей с применением технологии прямого посева их внесение не вызвало падение численности, а в вариантах с подсолнечником даже увеличило ее. Полагаем, что это может быть вызвано большим количеством углерода от растительных остатков, при обилии азота из удобрений на полях no-till.
Соотношения групп микроорганизмов можно использовать для оценки степени аэробных/анаэробных условий среды обитания в почвах степной зоны в условиях минимизации их обработки.
БЛАГОДАРНОСТЬ
Работа выполнена при поддержке Российского Научного Фонда, проект № 19-16-00053. Также благодарим д.с-х.н. Белоброва В.П. и д.с-х.н. Дридигера В.К. за помощь в выборе и характеристике объектов исследования.
Список литературы Сравнительная оценка влияния нулевой и традиционной обработки на биологическую активность агрочерноземов Ставропольского края
- Беляева О.Н. Система no-till и ее влияние на доступность азота почв и удобрений: обобщение опыта // Земледелие. 2013. № 7. С. 16-18.
- Добровольская Т.Г., Звягинцев Д.Г., Чернов И.Ю., Головченко А.В., Зенова Г.М., Лысак Л.В., Манучарова Н.А., Марфенина О.Е., Полянская Л.М., Степанов А.Л., Умаров М.М. Роль микроорганизмов в экологических функциях почв // Почвоведение. 2015. № 9. С. 1087-1087. DOI: 10.7868/S0032180X15090038
- Железова С.В., Акимов Т.А., Белошапкина О.О., Березовский Е.В. Влияние разных технологий возделывания озимой пшеницы на урожайность и фитосанитарное состояние посевов (на примере полевого опыта Центра точного земледелия РГАУ-МСХА им. КА Тимирязева) // Агрохимия. 2017. № 4. С. 65-75.
- Зенова Г.М., Манучарова Н.А., Звягинцев Д.Г. Экстремофильные и экстремотолерантные актиномицеты в почвах разных типов // Почвоведение. 2011. № 4. С. 457-478.
- Ильина Т.К., Фомина О.М. Авторское свидетельство № 113328а от 30.06.83. "Питательная среда для культивирования почвенных микроорганизмов".
- Кирюшин В.И. Проблема минимизации обработки почвы: перспективы развития и задачи исследований // Земледелие. 2013. № 7. С. 3-6.
- Кожемяков А.П., Проворов Н.А., Завалин А.А., Шотт П.Р. Оценка взаимодействия сортов ячменя и пшеницы с ризосферными ростстимулирующими бактериями на различном азотном фоне // Агрохимия. 2004. № 3. С. 33-40.
- Кутовая О.В., Тхакахова А.К., Чевердин Ю.И. Влияние поверхностного переувлажнения на биологические свойства лугово-черноземных почв Каменной Степи // Бюллетень Почвенного института им. В.В. Докучаева. 2016. Вып. 82. С. 56-70.
- DOI: 10.19047/0136-1694-2016-82-56-70
- Кутовая О.В., Гребенников А.М., Тхакахова А.К., Исаев В.А., Гармашов В.М., Беспалов В.А., Чевердин Ю.И., Белобров В.П. Изменение почвенно-биологических процессов и структуры микробного сообщества агрочерноземов при Разных способах обработки почвы // Бюллетень Почвенного института имени В.В. Докучаева. 2018. Выпю 92. С. 35-61.
- DOI: 10.19047/0136-1694-2018-92-35-61
- Методы почвенной микробиологии и биохимии. Под ред. Д.Г. Звягинцева. М.: Изд-во МГУ, 1991. 304 с.
- Мирчинк Т.Г. Почвенная микология. М.: Изд-во Московского университета, 1988. 220 с.
- Практикум по микробиологии / Под ред. Егорова Н.С. М.: Изд-во Моск. ун-та, 1976. 307 с.
- Семенов В.М., Когут Б.М., Степанов А.Л., Мамонтов В.Г. Почвенное органическое вещество. 2015. 233 с.
- Семенов М.В., Никитин Д.А., Степанов А.Л., Семенов В.М. Структура бактериальных и грибных сообществ ризосферного и внекорневого локусов серой лесной почвы // Почвоведение. 2019. № 3. С. 355-369.
- DOI: 10.1134/S0032180X19010131
- Теппер Е.З., Шильникова В.К., Переверзева Г.И. Практикум по микробиологии. М.: Дрофа. 2005. 256 с.
- Тихонович И.А., Круглов Ю.В. Микробиологические аспекты плодородия почвы и проблемы устойчивого земледелия // Плодородие. 2006. № 5. С. 9-12.
- Турусов В.И., Гармашов В.М., Нужная Н.А. Засоренность посевов при разных приемах и системах основной обработки почвы в севообороте // Защита и карантин растений. 2017. № 9. С. 19-21.
- Фаизова В.И., Цховребов В.С., Калугин Д.В., Никифорова А.М. Влияние распашки черноземов Центрального Предкавказья на численность аммонификаторов // Вестник АПК Ставрополья. 2013. № 4. С. 198-202.
- Шарков И.Н. Концепция воспроизводства гумуса в почвах // Агрохимия. 2011. № 12. С. 21-27.
- Anderson T.H. Microbial eco-physiological indicators to asses soil quality // Agriculture, Ecosystems & Environment. 2003. Vol. 98 (1-3). P. 285-293.
- Anderson R.L. Diversity and No-till: keys for pest management in the U/S/ Great Plains // Weed Science. 2008. Vol. 56. P. 141-145.
- Delgado A., Gómez J.A. The soil. Physical, chemical and biological properties // Principles of Agronomy for Sustainable Agriculture. Springer, Cham. 2016. P. 15-26.
- Domsch K.H., Gams W., Anderson T.-H. Compendium of soil fungi, 2nd taxonomically revised edition by W. Gams. Eching: IHW-Verlag, 2007. 627 р.
- Fu X., Wang J., Sainju U.M., Zhao F., Liu W. 2019. Soil microbial community and carbon and nitrogen fractions responses to mulching under winter wheat // Applied Soil Ecology. Vol. 139. P. 64-68.
- Garrett S.D. Soil fungi and soil fertility: an introduction to soil mycology. Elsevier: Pergamon press, 2016. 147 p.
- Geddes B.A., Ryu M.H., Mus F., Costas A.G., Peters J.W., Voigt C.A., Poole P. Use of plant colonizing bacteria as chassis for transfer of N2-fixation to cereals // Current opinion in biotechnology. 2015. Vol. 32. P. 216-222.
- Geisseler D., Scow K.M. Long-term effects of mineral fertilizers on soil microorganisms - A review // Soil Biology and Biochemistry. 2014. Vol. 75. P. 54-63.
- Graf D.R., Zhao M., Jones C.M., Hallin S. Soil type overrides plant effect on genetic and enzymatic N2O production potential in arable soils // Soil Biology and Biochemistry. 2016. Vol. 100. P. 125-128.
- Grebenikova N., Korshunov A., Savchenko I., Marques M. Root rot grain crops on Cereals caused by the phytopathogenic fungi / MATEC Web of Conferences. EDP Sciences. 2018. Vol. 245. No. 11006.
- DOI: 10.1051/matecconf/201824511006
- Gregory P. Plant roots. John Wiley & Sons, Limited. 2007. 318 p.
- Irawan B., Afandi A., Hadi S. Effects of saprophytic microfungi application on soil fertility based on their decomposition properties // Journal of Applied Biological Sciences. 2017. Vol. 2. P. 15-19.
- Lehmann J., Kleber M. The contentious Nature of soil organic matter // Nature. 2015. Vol. 528 (7580). P. 60-68.
- Liu H., Crawford M., Carvalhais L.C., Dang Y.P., Dennis P.G., Schenk P.M. Strategic tillage on a Grey Vertosol after fifteen years of no-till management had no short-term impact on soil properties and agronomic productivity // Geoderma. 2016. Vol. 267. P. 146-155.
- Marinkovic J., Bjelic D., Tintor B., Miladinovic J., Dukic V., Dorđevic V. Effects of soybean co-inoculation with plant growth promoting rhizobacteria in field trial // Romanian Biotechnological Letters. 2018. Vol. 23 (2). No. 13401.
- Schmidt R., Mitchell J., Scow K. Cover cropping and no-till increase diversity and symbiotroph: saprotroph ratios of soil fungal communities // Soil Biology and Biochemistry. 2019. Vol. 129, P. 99-109.
- Shukla S.K., Yadav R.L., Awasthi S.K., Gaur A. Soil microbial biomass nitrogen, in situ respiration and crop yield influenced by deep tillage, moisture regimes and N nutrition in sugarcane-based system in subtropical India // Sugar Tech. 2017. Vol. 19 (2). P. 125-135.
- Teotia P., Kumar V., Kumar M., Shrivastava N., Varma A. Rhizosphere Microbes: Potassium Solubilization and Crop Productivity - Present and Future Aspects. In: Potassium solubilizing microorganisms for sustainable agriculture. Springer, New Delhi. 2016. P. 315-325.
- Trojan M.D., Linden D.R. Macroporosity and hydraulic properties of earthworm-affected soils as influenced by tillage and residue management // Soil Science Society of America Journal. 1998. Vol. 62 (6). P. 1687-1692.
- Vlasova O.I., Perederieva V.M., Volters I.A., Tivikov A.I., Trubacheva L.V. Change in microbiological activity under the effect of biological factors of soil fertility in the central fore-caucasus chernozems // Biol Med (Aligarh). 2015. Vol. 7:5.
- Wang S., Li C., Copeland L., Niu Q., Wang, S. Starch retrogradation: A comprehensive review // Comprehensive Reviews in Food Science and Food Safety. 2015. Vol. 14 (5). P. 568-585.
- Wang Y., Li C., Tu C., Hoyt G.D., DeForest J.L., Hu S. Long-term no-tillage and organic input management enhanced the diversity and stability of soil microbial community // Science of The Total Environment. 2017. Vol. 609. P. 341-347.


