Сравнительная оценка влияния средств с антиоксидантным действием на терапевтическую эффективность химиолучевой терапии и оксидантный статус у мышей
Автор: Сипров А.В., Вашуркина И.М., Масягин В.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Клиническая фармакология
Статья в выпуске: 4 т.8, 2012 года.
Бесплатный доступ
Мексидол, мелаксен, оксидантный статус, химиолучевая терапия
Короткий адрес: https://sciup.org/14917651
IDR: 14917651
Текст статьи Сравнительная оценка влияния средств с антиоксидантным действием на терапевтическую эффективность химиолучевой терапии и оксидантный статус у мышей
Адрес: 430031, г. Саранск, ул. Косарева, 35, кв. 79.
Тел.: 88342351310.
лечении ухудшают отдаленные результаты противоопухолевой терапии [1]. Разработка подходов, способствующих реализации максимально возможной специфической активности широко применяемых в клинике цитостатических методов терапии, осуществляется по разным направлениям, в том числе путем снижения токсичности посредством использования антитоксических модификаторов. В клинической онкологии все более прочные позиции занимает поддерживающая терапия, позволяющая не только предупредить или уменьшить проявления нежелательных побочных эффектов лекарственной и лучевой терапии, но и в значительной степени уменьшить степень проявления тяжелых осложнений, обусловленных распространенным опухолевым процессом [2]. Не менее важным является тот факт, что в процессе злокачественного роста происходит изменение показателей антиокислительной активности и окислительного статуса опухоли, что может отражаться на органах и тканях организма. Судя по данным литературы, свободнорадикальное окисление играет решающую роль в процессах возникновения и развития опухоли [3–5]. С учетом патогенетической значимости активации свободнорадикальных реакций в развитии опухолевого процесса и многих осложнений противоопухолевой терапии [6, 7] исследуется эффективность применения препаратов, обладающих антиоксидантным действием, с различным механизмом и уровнем воздействия на процессы перекисного окисления липидов в качестве антитоксических модификаторов. Вместе с тем сведения о влиянии таких средств на специфическую активность химио- и лучевой терапии в сравнительном аспекте неоднозначны и немногочисленны.
Методы. Эксперименты выполнены на 95 мышах-самках линии С57Bl/6 массой 20–22 г разводки питомника НЦБМТ РАМН «Столбовая». Экспериментальные животные содержались в стандартных условиях вивария Мордовского государственного университета при естественном световом режиме на стандартной диете, свободном доступе к воде и пище. Все манипуляции с животными проводились в соответствии с правилами, принятыми Европей- ской конвенцией по защите позвоночных животных, используемых для экспериментальных и иных научных целей (Страсбург, 1986). Суспензию клеток карциномы легкого Льюис (КЛЛ) (1 млн клеток в растворе Хенкса) перевивали внутримышечно в область бедра. Животные были распределены на 4 группы. Дизайн исследований представлен в табл. 1. Облучение животных проводили с помощью аппарата АГАТ-Р1. На 22-е сутки эксперимента животных выводили из опыта под эфирным наркозом.
Материалами исследования явились кровь и различные ткани и органы (печень, первичный опухолевый узел и легкие) мышей. Эффективность лечения оценивали по объему и массе первичного опухолевого узла, антиметастатический эффект — по среднему числу поверхностных легочных метастазов на одно животное и индексу ингибирования метастазирования (ИИМ) [8]. Для оценки изменений состояния процессов перекисного окисления липидов (ПОЛ) в сыворотке крови определяли уровень малонового диальдегида (МДА), Fe-МДА (в реакции с тиобарби-туровой кислотой (ТБК) с использованием набора реактивов для определения ТБК-активных продуктов фирмы «Агат-Мед» (Москва) по стандартной методике, включающей инкубацию с ТБК исследуемой пробы, экстракцию продуктов реакции бутанолом и спектрофотометрическое измерение их содержания) и активность каталазы [9], а в гомогенатах органов (печени, первичного опухолевого узла) — содержание МДА, Fe-МДА, активность каталазы и суперок-сиддисмутазы (СОД) [10].
При статистической обработке результатов исследования определяли показатели средних арифмети-
Таблица 1
Дизайн исследований
|
Группы животных |
Режим эксперимента |
|
Интактные животные (n=15) |
Опухолевые клетки КЛЛ не вводили, лучевая и лекарственная терапия не проводилась |
|
1-я — опухолевый штамм КЛЛ (контроль) (n=20) |
1·106 опухолевых клеток КЛЛ внутримышечно |
|
2-я — КЛЛ, циклофосфан, лучевая терапия КЛЛ+ЦФ+ЛТ (n=20) |
1·106 опухолевых клеток КЛЛ внутримышечно, циклофосфан внутрибрюшинно в дозе 60 мг/кг 2 раза с интервалом 120 ч, начиная с 7-х суток после имплантации опухолевых клеток за 20–30 мин до облучения, лучевая терапия локально на область первичного опухолевого узла в дозе 2 г 2 раза с интервалом 120 ч (СОД 4 г), начиная с 7-х суток эксперимента |
|
3-я — КЛЛ, циклофосфан, лучевая терапия, мелаксен 45 мг/кг — КЛЛ+ЦФ+ЛТ+ мелаксен (n=20) |
Так же, как и во 2-й группе, мелаксен внутримышечно в дозе 45 мг/кг ежедневно, начиная с 7-х суток после имплантации опухолевых клеток, в течение 14 суток |
|
4-я — КЛЛ, циклофосфан, лучевая терапия, мексидол 50 мг/кг — КЛЛ+ЦФ+ЛТ+ мексидол (n=20) |
Так же, как и во 2-й группе, мексидол внутримышечно в дозе 50 мг/кг ежедневно, начиная с 7-х суток эксперимента, в течение 14 суток |
Таблица 2
Показатели антиметастатической эффективности сочетанного применения химиолучевой терапии, мелаксена и мексидола у мышей с карциномой легкого Льюис, (M±m)
|
Группа |
Животные с метастазами, % |
Среднее число метастазов |
ИИМ, % |
|
КЛЛ |
100 |
95,7 ±8,2 |
- |
|
КЛЛ+ЦФ+ЛТ |
100 |
8,17 ±2,2 р1<0,05 |
91,4 |
|
КЛЛ+ЦФ+ЛТ+мелаксен |
83,3 |
8,17 ±3,5 р1<0,05 |
91,4 |
|
КЛЛ+ЦФ+ЛТ+мексидол |
100 |
6,28 ±2,3 р1<0,05 |
93,4 |
Примечание:р1 — достоверность различий рассчитана по отношению к группе КЛЛ.
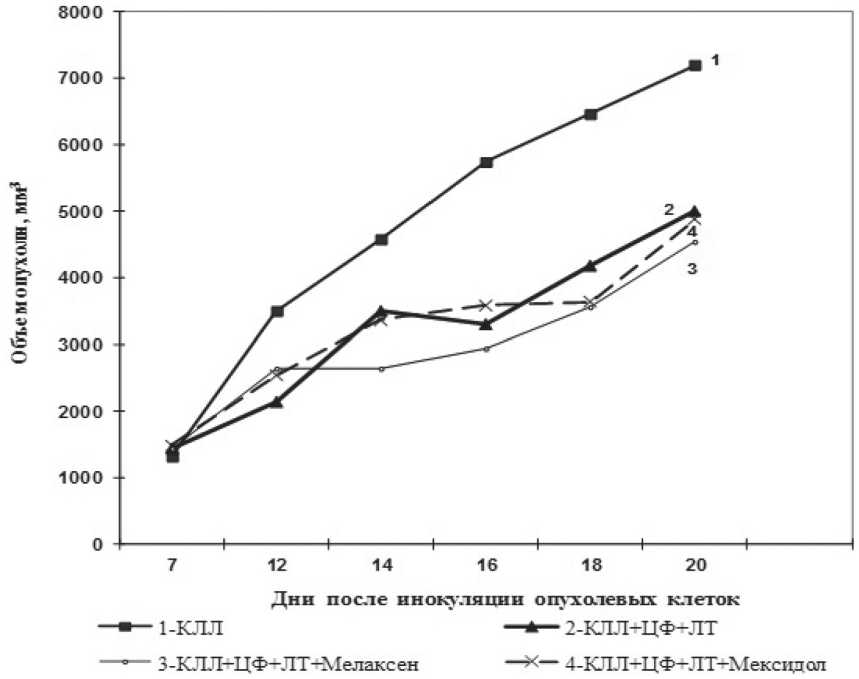
Динамика роста карциномы легкого Льюис у мышей при сочетанной химиолучевой терапии с мелаксеном и мексидолом
ческих значений (M), стандартных ошибок средних арифметических (m), индекс ингибирования метастазирования рассчитывали в процентах. Нормальность распределения проверяли с использованием теста Колмогорова — Смирнова. При условии соответствия нормальности распределения достоверность полученных различий сопоставляемых величин оценивали с использованием t-критерия Стьюдента. При несоответствии нормальности распределения достоверность различий оценивали с использованием U-критерия Манна — Уитни. Различия считали достоверными при р<0,05.
Результаты. Исследование противоопухолевого эффекта от сочетанного воздействия химиолучевой терапии и лечения мелаксеном показало, что торможение роста первичного опухолевого узла не отличалось от такового показателя в группе с химиолучевой терапией без введения мелаксена, за исключением 14-х суток наблюдения, где объем опухолевого узла был достоверно меньше (рисунок). Препарат сравнения мексидол также не влиял на торможение роста первичного опухолевого узла.
В конце эксперимента (на 22-е сутки) масса первичного опухолевого узла в группе ЦФ+ЛТ снизилась с 9,18±0,19 г (в контроле) до 6,97±0,18 г (р<0,05). В группах с сочетанным применением химиолучевой терапии с мелаксеном и мексидолом масса первичного опухолевого узла не отличалась от таковой в группе ЦФ+ЛТ и составила 7,24±0,3 и 7,28±0,17 г соответственно.
В группе мышей, получавших только ЦФ+ЛТ, ИИМ составил 91,4%, при этом практически не уменьшалась частота метастазирования по сравнению с нелечеными животными (табл. 2). У мышей, получавших химиолучевую терапию в сочетании с мелаксеном, равно как и с мексидолом, ИИМ и частота метастазирования не отличались от таковых в группе ЦФ+ЛТ (см. табл. 2).
При оценке состояния процессов перекисного окисления липидов у животных установлено, что в группе с химиолучевой терапией (ЦФ+ЛТ) в сыво- ротке крови достоверно снижался уровень МДА на 31 % и повышалась активность каталазы в 2,8 раза (на 276,5%) по сравнению с контролем. У животных с сочетанным применением химиолучевой терапии и мелаксена концентрация МДА в сыворотке крови снижалась на 53,3% (р<0,01) и повышалась активность каталазы также в 2,8 раза (на 276,5%) (р<0,001) по отношению к контролю. В группе с мек-сидолом содержание МДА достоверно снижалось на 38,2%, активность каталазы повышалась в 3,3 раза (на 333,4%) в сравнении с контролем (табл. 3).
В печени у животных в группе ЦФ+ЛТ отмечалось снижение уровня МДА и Fe-МДА на 41,8 и 78,2% соответственно (р<0,001), снижение активности каталазы на 79,5% (до уровня показателя у интактных животных), а также активности СОД на 24,5% (р<0,05) по отношению к контролю (см. табл. 3). При этом активность СОД была достоверно ниже на 31 % и по сравнению с интактными мышами. В группе ЦФ+ЛТ+мелаксен регистрировалось достоверное снижение концентрации МДА на 51,5% и повышение активности каталазы в 3,3 раза (на 331 %) по сравнению с группой ЦФ+ЛТ, а также снижение активности СОД по отношению к контролю и интактным животным на 39,5 и 44,7% соответственно (см. табл. 3). При совместном использовании химиолучевой терапии и мексидола концентрация МДА достоверно снижалась, а активность каталазы повышалась на 35,7 и 337% (в 3,4 раза) соответственно по сравнению с группой ЦФ+ЛТ, однако активность СОД не отличалась от таковой у интактных животных.
В ткани опухолевого узла у животных группы ЦФ+ЛТ отмечалось достоверное увеличение концентрации МДА в 2,2 раза (на 218%), снижение содержания Fe-МДА и активности каталазы на 48,5 и 68,5% соответственно, повышение активности СОД в 2,5 раза (на 245,5%) (см. табл. 3). При комбинированном применении химиолучевой терапии и ме-лаксена содержание МДА достоверно возрастало на 98,2%, а активность каталазы снижалась на 60,7%, что не отличалось от соответствующих показателей в
Таблица 3
Влияние комбинированного применения химиолучевой терапии и мелаксена на процессы перекисного окисления липидов у мышей с карциномой легкого Льюис, (M±m)
|
Показатель |
Субстрат |
Интактные животные |
Экспериментальные группы |
|||
|
КЛЛ (контроль) |
КЛЛ+ЦФ+ЛТ |
КЛЛ+ЦФ+ЛТ+ мексидол |
КЛЛ+ЦФ+ЛТ+ мелаксен |
|||
|
МДА |
Сыворотка |
3,52±0,38 |
6,1±0,44 р1<0,01 |
4,2±0,74 р2<0,05 |
3,77±0,45 р2<0,01 |
2,85±0,55 р2<0,01 |
|
Печень |
8,7±0,96 |
18,4±0,93 р1<0,001 |
10,7±1,17 р2<0,001 |
6,88±1,07 р 2,3 <0,05 |
5,18±0,76 р 2,3 <0,01 |
|
|
Опухолевый узел |
- |
5,04±0,62 |
10,99±2,21 р2<0,01 |
12,6±1,02 р2<0,001 |
9,99±2,79 р2<0,05 |
|
|
Fe-МДА |
Сыворотка |
4,69±0,48 |
4,6±0,6 |
3,68±0,67 |
5,3±0,52 |
4,2±0,66 |
|
Печень |
8,82±1,64 |
23,9±2,28 р1<0,001 |
5,2±1,04 р2<0,001 |
5,89±0,88 р2<0,001 |
5,99±0,87 р2<0,001 |
|
|
Опухолевый узел |
- |
9,4±0,88 |
4,84±0,77 р2<0,01 |
3,6±0,92 р2<0,01 |
8,4±1,38 р4<0,05 |
|
|
каталаза |
Сыворотка |
0,4±0,08 |
0,17±0,01 р2<0,05 |
0,47±0,07 р2<0,01 |
0,56±0,08 р2<0,001 |
0,47±0,05 р2<0,001 |
|
Печень |
0,19±0,02 |
0,78±0,03 р1<0,001 |
0,16±0,03 р2<0,001 |
0,7±0,07 р1,3<0,001 |
0,69±0,05 р1,3<0,001 |
|
|
Опухолевый узел |
- |
0,89±0,02 |
0,28±0,05 р2<0,001 |
0,5±0,04 р 2,3 <0,01 |
0,35±0,05 р 2,4 <0,05 |
|
|
СОД |
Печень |
39,4±2,93 |
35,87±0,48 |
27,17±3,83 р 1,2 <0,05 |
28,54±4,67 |
21,77±2,65 р 1,2 <0,01 |
|
Опухолевый узел |
- |
13,4±1,2 |
46,3±6,67 р2<0,01 |
3,27±0,95 р2,3<0,001 |
3,49±0,63 р2,3<0,001 |
|
Примечание: р1 — достоверность различий рассчитана по отношению к интактным животным; р2 — к группе КЛЛ; р3 — к группе КЛЛ+ЦФ+ЛТ; р4 — к группе КЛЛ+ЦФ+ЛТ+мексидол.
группе ЦФ+ЛТ. При этом концентрация Fe-МДА не отличалась от таковой в контроле, а активность СОД резко снижалась и была на 74% меньше, чем в контрольной группе, и на 92,5% меньше, чем в группе ЦФ+ЛТ (см. табл. 3). При сочетанном применении хи-миолучевой терапии и мексидола концентрация МДА и Fe-МДА не отличалась от таковой в группе ЦФ+ЛТ, а активность каталазы возрастала на 78,5% (р<0,01), однако оставалась ниже, чем в контроле, на 43,8% (р<0,01). Активность СОД не отличалась от таковой в группе с мелаксеном и была достоверно ниже на 75,6% по сравнению с контролем и на 93% по отношению к группе ЦФ+ЛТ (см. табл. 3).
Обсуждение. Результаты проведенного исследования показали, что мелаксен и мексидол не снижали противоопухолевый эффект химиолучевой терапии. Антиметастатический эффект химиолучевой терапии при применении мелаксена и мексидола также не снижался. При оценке состояния процессов ПОЛ отмечалась активация свободнорадикальных процессов у животных с опухолевым процессом, в пользу чего свидетельствовало повышение содержания МДА как в печени, так и в сыворотке крови, причем в печени регистрировалось повышение активности каталазы, которое, вероятно, носило компенсаторный характер, а в сыворотке крови активность каталазы снижалась, отражая депрессию антиоксидантной системы на организменном уровне в целом. Химиолу-чевая терапия, ограничивая опухолевую прогрессию, снижала интенсивность процессов свободнорадикального окисления у животных, что проявлялось в достоверном снижении уровня МДА в сыворотке крови и в печени и сохранении активности каталазы на уровне показателя интактных животных. Лишь в печени отмечалось снижение активности СОД. Однако в опухолевом узле отмечались противоположные изменения: активация процессов ПОЛ с увеличением содержания МДА и снижением активности каталазы, при этом активность СОД повышалась. Применение мелаксена, равно как и мексидола, с химиолучевой терапией позволило эффективнее предупредить активацию процессов ПОЛ у животных, что подтверждалось достоверным снижением уровня МДА и повышением активности каталазы в печени по сравнению с использованием одной химиолучевой терапии. Однако мексидол эффективнее мелаксена препятствовал снижению активности СОД в печени. В опухолевом узле мелаксен и мексидол не только не угнетали интенсифицированную активность свободнорадикальных реакций, но и достоверно снижали активность СОД по сравнению как с группой ЦФ+ЛТ, так и с контролем на фоне повышенного содержания МДА, что согласуется с данными об избирательном действии антиоксидантов на метаболизм нормальных тканей [11]. Однако при использовании мексидола, в отличие от мелаксена, отмечалось некоторое повышение активности каталазы в опухолевом узле. Полученные нами данные служат экспериментальным обоснованием дальнейшего детального изучения эффективности применения мелаксена и антиоксидантов разных классов в качестве средств вспомогательной терапии при онкопатологии и расширяют представление о фармакодинамике мелаксена.
Заключение. Таким образом, мелаксен и мекси-дол в равной степени не снижают терапевтической эффективности химиолучевой терапии. Мелаксен и мексидол в целом в сопоставимой степени предупреждают активацию процессов ПОЛ у животных при химиолучевой терапии, однако в печени мекси-дол эффективнее мелаксена корригирует активность СОД. Мелаксен и мексидол не снижают интенсифицированной активности свободнорадикальных процессов в опухоли.
Список литературы Сравнительная оценка влияния средств с антиоксидантным действием на терапевтическую эффективность химиолучевой терапии и оксидантный статус у мышей
- Черниченко А. В., Филимонов А. В. Химиолучевая терапия немелкоклеточного рака легкого//Практическая онкология. 2008. Т.9, № 1. С. 16-20
- Константинова М.М. Новые поддерживающие средства (противорвотные, бисфосфонаты, колониестимулиру-ющие факторы)//Практическая онкология. 2002. Т.З, № 4. С. 309-319
- Выраженность процессов перекисного окисления ли-пидов и антиоксидантный потенциал у больных с распространенным раком яичников в динамике полихимиотерапии/В. А. Лебедева, С. В. Пушкарев, И. Д. Сафронов, А. Н. Трунов//Сибирский онкологический журнал. 2007. № 2 (22). С. 42-45
- Окислительный стресс: патологические состояния и заболевания/Е. Б. Меньщикова, Н.К. Зенков, В.З. Панкин [и др.]. Новосибирск, 2008. 284 с.
- Окислительная модификация белков и липидов плазмы крови больных раком легкого/Р. Н. Белоногов, Н. М. Титова, Ю.А. Дыхно [и др.]//Сибирский онкологический журнал. 2009. № 4 (34). С. 48-51
- Состояние про-и антиоксидантной активности сыворотки крови у крыс с карциносаркомой Walker-256/А. В. Ефремов, Е. В. Овсянко, Д. Д. Цырендоржиев [и др.]//Сибирский онкологический журнал. 2009. № 4 (34). С. 58-60
- Активация процессов липопероксидации -типовой процесс дестабилизации биомембран клеток при неоплазиях различной локализации/А. А. Свистунов, Н.П. Чеснокова, В.Ю. Барсуков [и др.]//Саратовский научно-медицинский журнал. 2010. Т. 6, № 2. С. 267-270
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ/под общ. ред. проф. Р. У. Хабриева. М.: Медицина, 2005. 832 с.
- Метод определения активности каталазы/М.А. Коро-люк, А. И. Иванова, И. Г. Майорова [и др.]//Лаб. дело. 1988. № 1. С. 16-18
- Чевари С, Чаба И., Секей Й. Роль супероксиддисму-тазы в окислительных процессах клетки и метод определения ее в биологических материалах//Лаб. дело. 1985. № 11. С. 678-681
- Горожанская Э.Г., Патютко Ю.И., Сагайдак И. В. Роль альфа-токоферола и ретинола в коррекции нарушений перекисного окисления липидов больных со злокачественными опухолями печени//Вопросы онкологии. 1995. Т. 41, № 1. С. 47-51.


