Сравнительное исследование деструкции монохлорфенолов в водном растворе ультрафиолетовым излучением эксиламп
Автор: Филиппова Н.И., Матафонова Г.Г., Павлова Э.Т., Батоев В.Б.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2011 года.
Бесплатный доступ
Проведено сравнительное исследование прямого фотолиза и комбинированной обработки в присутствии пероксида водорода 2-хлорфенола (2-ХФ) и 4-хлорфенола (4-ХФ) в модельных водных растворах ультрафиолетовым излучением KrCl-(222 нм) и XeBr- (282 нм) эксиламп при различных исходных значениях рН.
Монохлорфенолы, прямой фотолиз, деструкция, ультрафиолетовая эксилампа, пероксид водорода, водный раствор
Короткий адрес: https://sciup.org/148180182
IDR: 148180182 | УДК: 544.52
Текст научной статьи Сравнительное исследование деструкции монохлорфенолов в водном растворе ультрафиолетовым излучением эксиламп
Как известно, хлорфенолы (ХФ) являются токсичными органическими загрязнителями водных экосистем, включенными Агентством по охране окружающей среды США (US EPA) в список 126 приоритетных поллютантов [1]. Водные объекты хозяйственно-питьевого и культурно-бытового водопользования в РФ, имеющие рыбохозяйственное значение, нормируются 2-хлорфенол, 2,4-дихлорфенол, 2,4,6-трихлорфенол (4 класс опасности) и пентахлорфенол (2 класс опасности) [2, 3]. ХФ токсичны для живых организмов, обладают потенциальной канцерогенной и мутагенной активностью и очень низким концентрационным порогом, вызывающим неприятный запах и вкус воды (до 0,1 мкг/л). Комбинированные окислительные процессы (АОР – advanced oxidation processes), широко используемые для удаления ХФ из водных сред, постоянно совершенствуются, и разработка новых комбинированных методов остается актуальной и в настоящее время.
В большинстве работ по применению АОР на основе ультрафиолетового излучения (например, фото-Фентона, УФ-облучения в присутствии пероксида водорода, диоксида титана, озона) в качестве его источников традиционно используются ртутные лампы низкого и среднего давления, имеющие широкий спектр излучения. В настоящее время одними из наиболее перспективных УФ-источников для применения в АОР являются современные эксимерные и эксиплексные лампы, излучающие в узкой полосе [4, 5]. Ранее при исходных значениях рН раствора исследована кинетика фотолиза 4-ХФ KrCl-эксилампой [6], выявлена более высокая эффективность прямого фотолиза 4-ХФ этой же лампой по сравнению с энзиматической деструкцией пероксидазой соевых бобов [7]. Проведено сравнительное исследование эффективности прямого фотолиза и комбинированной обработки 4-ХФ при исходном рН с участием Н 2 О 2 при использовании KrCl-эксилампы в статических условиях [8]. Нами ранее выявлены закономерности прямого фотолиза XeBr-эксиламой 2-хлорфенола (2-ХФ), 4-ХФ и 2,4-дихлорфенола (2,4-ДХФ) в водном растворе при исходных значениях рН [9]. Вместе с тем анализ литературы свидетельствует о недостаточности данных по применению АОР для удаления ХФ из водных сред с использованием узкополосного УФ-излучения эксиламп в зависимости от рН среды.
Целью данной работы является сравнительное исследование прямого фотолиза и комбинированной обработки в присутствии пероксида водорода монохлорфенолов в водных растворах УФ-излучением KrCl- и XeBr-эксиламп при различных исходных значениях рН.
Материалы и методы
Для исследования были взяты 2-ХФ и 4-ХФ (Merck, чистота >98%), гексацианоферрат (II) калия и 4-аминоантипирин (Sigma-Aldrich, чистота 99%), пероксид водорода (33%). В качестве источника УФ-излучения использовали XeBr- (282 нм) или KrCl-эксилампу (222 нм) (Институт сильноточной электроники СО РАН). Облучаемый раствор исследуемого ХФ при исходной концентрации 20 мг/л и рН 2, 11 или 5,5–5,6 циркулировал со скоростью 13,8 л/ч при комнатной температуре 23–25°С через три кварцевые трубки, расположенные у выходного окна эксилампы, и подавался в резервуар, служащий для отбора проб. Эффективная освещенность, создаваемая XeBr- и KrCl-эксилампой на выходной плоскости окна в зоне расположения трубок, измерена ранее с помощью фотодетектора (Hamamatsu Photonics KK) и составила 11,2 и 4,1 мВт/cм2 соответственно.
Остаточную концентрацию 2- и 4-ХФ в процессе деструкции определяли колориметрическим методом по реакции с 4-аминоантипирином [10]. Исходную величину рН раствора доводили до 2 или 11 внесением раствора H2SO4 или NaOH и контролировали с помощью иономера И-16. При комбинированной обработке Н 2 О 2 вносился в раствор непосредственно перед облучением в стехиометрическом количестве (1:13). Концентрацию Н2О2 определяли методом перманганатометрии [11]. Электронные спектры поглощения растворов ХФ регистрировали на спектрофотометре Agilent 3843 UV-VIS (США).
Результаты и их обсуждение
Прямой фотолиз
Линейные зависимости соотношения логарифма остаточной концентрации (С) и исходной концентрации (С 0 ) ХФ от продолжительности облучения растворов при рН 5.5–5.6 (исходная величина рН растворов), 2 и 11 свидетельствуют о том, что реакция прямого фотолиза подчиняется уравнению реакции первого порядка (рис. 1), что согласуется с результатами предыдущих работ [9, 12, 13]. Как видно из рисунка 1 и таблицы 2, максимальные константы скорости псевдопервого порядка и минимальные периоды полураспада найдены для 2-ХФ при облучении XeBr-эксилампой при рН 11, а для 4-ХФ – при рН 2 и рН 5,6.
Как известно, при рН < рКа ХФ в водном растворе находятся, преимущественно, в молекулярной форме, а при рН > рК а – в диссоциированной форме, при этом диссоциированные формы (анионы) считаются более реакционноспособными, чем молекулярные [14]. Как видно из табл. 1, при рН 11 в УФ спектрах поглощения ХФ наблюдается батохромный сдвиг максимумов полос в средне- и длинноволновой области, характерный для образования анионных форм.
Для сравнения полученных результатов с литературными данными по прямому фотолизу ХФ излучением при других длинах волн и интенсивностях были оценены квантовые выходы фотолиза (φ) по первому порядку согласно [15] (табл. 2).
Рассчитанные значения φ для анионов 2-ХФ и молекул 4-ХФ при λ = 282 нм значительно выше (φ 282 ), чем для молекул 2-ХФ и анионов 4-ХФ. Это согласуется с литературными данными по фотолизу при 296 нм 2-ХФ (φ = 0,03–0,04 для молекул и 0,20–0,30 для анионов) [16-18]. Согласно данным [16], средний квантовый выход фотолиза 4-ХФ равен 0,25 в интервале рН от 1 до 13 при облучении на λ = 254 нм или 296 нм (ртутная лампа среднего и высокого давления). Как видно из табл. 2, величина φ282 для молекул 4-ХФ в два раза выше, чем приведенное выше значение. Квантовый выход при 222 нм сопоставим с найденным ранее при фотолизе молекул 4-ХФ ртутной лампой высокого давления (0,017), излучающей в широком спектре 238–579 нм с максимумами при 254, 313 и 366 нм [19]. Фотолиз же анионов 4-ХФ характеризовался наименьшим квантовым выходом.
Продолжительность облуче ния ( мин )
0 5 10 15 20 25 30
0 5 10 15 20 25 30
2- ХФ (KrCl)
0,5
я
-1
♦ pH 2
о pH 5.5-5.6
оpH 11
-1,5
0 5 10 15 20 25 30
|
0 < |
to о 1— v ° О о v * Q |
--------------------------------1------------------------------- о |
-------------------------------1-------------------------------------------------------------- |
|
|
-0,5 -1 |
♦ |
о |
о |
|
|
-1,5 |
о |
♦ |
||
|
-2 |
4- ХФ (KrCl) |
о |
0 |
|
|
-2,5 |
Рис. 1. Динамика прямого фотолиза 2- и 4-хлорфенола при различных рН среды XeBr-(282 нм) и KrCl-(222 нм) эксилампами в проточном фотореакторе. [ХФ] 0 = 20 мг/л
Таблица 1
Cпектральные характеристики хлорфенолов в водных растворах
|
Хлорфенол |
λmax, нм |
рН исх |
Форма |
ελmax, М ·см |
|
2-ХФ |
223 |
2 и 5.5 |
Молекулярная |
3788 |
|
274 |
2 и 5.5 |
Молекулярная |
1958 |
|
|
237 |
11 |
Анионная |
8242 |
|
|
293 |
11 |
Анионная |
3733 |
|
|
4-ХФ |
225 |
2 и 5.6 |
Молекулярная |
8599 |
|
280 |
2 и 5.6 |
Молекулярная |
1609 |
|
|
244 |
11 |
Анионная |
12056 |
|
|
298 |
11 |
Анионная |
2599 |
Таблица 2
Константы скорости псевдопервого порядка k , периоды полураспада t 1/2 и квантовые выходы фотолиза φ 2- и 4-хлорфенола XeBr- (282 нм) и KrCl- (222 нм) эксилампами при различных рН среды
|
Хлорфенол |
рН исх |
λ, нм |
ε λ , М-1·см-1 |
k , мин-1 |
t1/2, мин |
φ |
|
2-ХФ |
2 |
222 |
4288 |
2.7 × 10-2 |
25.7 |
0.020 |
|
5.5 |
222 |
4253 |
2.9 × 10-2 |
23.9 |
0.022 |
|
|
11 |
222 |
4860 |
3.8 × 10-2 |
18.2 |
0.025 |
|
|
2 |
282 |
1519 |
6.4 × 10-2 |
10.8 |
0.039 |
|
|
5.5 |
282 |
1498 |
6.0 × 10-2 |
11.6 |
0.037 |
|
|
11 |
282 |
2440 |
5.3 × 10-1 |
1.3 |
0.202 |
|
|
4-ХФ |
2 |
222 |
7662 |
7.2 × 10-2 |
9.6 |
0.030 |
|
5.6 |
222 |
8185 |
8.8 × 10-2 |
7.9 |
0.034 |
|
|
11 |
222 |
4739 |
2.5 × 10-2 |
27.7 |
0.017 |
|
|
2 |
282 |
1436 |
7.6 × 10-1 |
0.9 |
0.484 |
|
|
5.6 |
282 |
1545 |
8.1 × 10-1 |
0.9 |
0.480 |
|
|
11 |
282 |
1458 |
1.8 × 10-1 |
3.9 |
0.116 |
Длина волны 282 нм практически соответствует длинноволновому максимуму поглощения молекул 4-ХФ (280 нм), обусловленного электронным переходом из основного состояния S 0 в S 2 (πσ*), частично локализованного на связи C-Cl [20]. Поэтому полагаем, что при облучении на λ = 282 нм в молекуле 4-ХФ легко происходит отщепление атома хлора с образованием основных интермедиатов – гидрохинона и п-бензохинона, что было подтверждено нами ранее хромато-масс-спектрометрическим анализом [9]. Молекулы 2-ХФ труднее подвергаются прямому фотолизу, чем молекулы 4-ХФ, в силу образования межмолекулярных водородных связей между атомом Cl в ортопозиции и водородным атомом ОН-группы другой молекулы. Кроме того, возможно образование внутримолекулярных водородных связей, а также связей с молекулами воды [13].
Фотолиз анионов 2-ХФ и молекул 4-ХФ излучением на λ = 222 нм сопровождался значительно более низким квантовым выходом по сравнению с соответствующими величинами φ282. Несмотря на то, что излучение KrCl-эксилампы попадает в область максимумов коротковолнового поглощения молекул ХФ (табл. 2), переходы с высокоэнергетических возбужденных электронных состояний, вероят- но, не приводят к разрыву связей, а реализуются в других эффектах, например, в безызлучательных процессах [24]. Напротив, излучение с λ = 282 нм эффективно поглощается низкоэнергетическими электронно-возбужденными состояниями молекул 4-ХФ и анионов 2-ХФ и 2,4-ДХФ, приводящих к разрыву связей.
Комбинированная обработка УФ / Н 2 О 2
Как известно, в результате прямого фотолиза Н2О2 генерируются реакционноспособные ОН радикалы:
Н 2 О 2 — 2 ОН°(1)
Кроме того, скорость фотолиза Н2О2 зависит от рН и увеличивается в щелочной среде в результате депротонирования молекул с максимальной скоростью при рН, равным рК а [21]:
Н 2 О 2 → НО 2 –+ H+ pK a = 11.6 (2)
НО2- Jh- OH° + O°- (3)
Как ожидалось, скорости прямого фотолиза Н 2 О 2 (рН 2, 6 и 11) при 222 нм были выше, чем при 282 нм, вследствие более высокого коэффициента поглощения Н 2 О 2 при данной длине волны. Максимальная скорость разложения наблюдалась при рН 11.
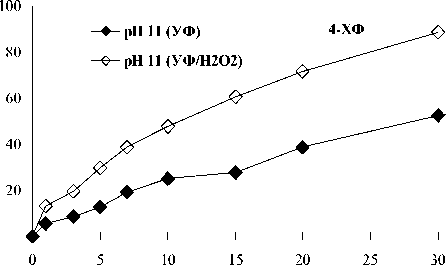
На рис. 2 представлены результаты комбинированной обработки 2- и 4-ХФ в присутствии H 2 O 2 при облучении KrCl-эксилампой.
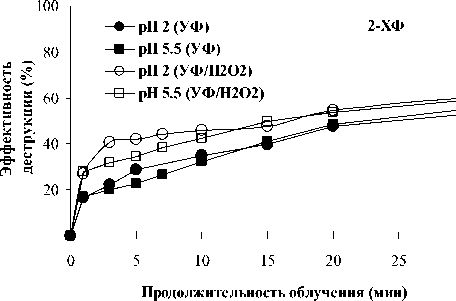
Рис. 2. Сравнительная эффективность деструкции 2- и 4-хлорфенола при прямом фотолизе и комбинированной обработке в присутствии пероксида водорода KrCl-эксилампой. [ХФ] : [H2O2] = 1:13
Установлено, что эффективность деструкции 2-ХФ увеличивалась при рН 2 и исходных рН растворов, тогда как при рН 11 эффективность комбинированной обработки была сопоставимой с прямым фотолизом. Это согласуется с результатами ранних работ по УФ/Н 2 О 2 обработке 2-ХФ в статическом реакторе с использованием ртутной лампы низкого давления (254 нм) при рН 2,5 и 9,5 ([2-ХФ] 0 = 51,4 мг/л, [2-CP] : [H 2 O 2 ] = 1 : 10) [22] и рН 3–11 ([2-ХФ] 0 = 197,1 мг/л, [2-CP] : [H 2 O 2 ] = 1 : 5) [23]. Дальнейшее ингибирование скорости деструкции 2-ХФ в сильнокислой среде может быть обусловлено действием HSO4– ионов как «ловушки» ОН радикалов [24]:
HSO 4 –+ OH° → SO 4 °– + H 2 O (4)
Напротив, преимущество комбинированной обработки было очевидным для анионов 4-ХФ в щелочной среде (рис. 2). Известно, что ОН-группа (активатор) и заместитель атом Cl (дезактиватор) являются орто- и пара-ориентантами в реакции электрофильного замещения. Причем орто-положение является более активным для атаки ОН-радикалами, чем пара-положение, в силу сильного +М эффекта ОН-группы (+M > -I) [13, 25]. В молекуле или анионе 4-ХФ имеется больше свободных ортоположений для потенциальной атаки ОН-радикалами: две позиции активированы ОН(О-)-группой и две – атомом Cl (+M < -I). Это позволяет предположить, что два свободных орто - положения в анионе 4-ХФ (активированных O- группой) являются более чувствительными для замещения электрофильными ОН-радикалами, чем в молекуле 4-ХФ (активированных ОН-группой). Это вызвано повышенной электронной плотностью в этих положениях в силу +M и +I эффектов O--группы.
Тем не менее динамика УФ/Н2О2 деструкции молекул 4-ХФ (при рН 2 и 5,6) и анионов 2-ХФ (при рН 11) была сопоставимой с соответствующей при прямом фотолизе. Возможно, в этих случаях при участии ОН-радикалов утилизируются в большей степени промежуточные продукты, образующиеся как при прямом фотолизе, так и при радикальном окислении. Полученный результат для молекул 4-ХФ согласуется с данными сравнительного исследования деструкции KrCl-эксилампой при исходном рН раствора ([4-ХФ]0=100, 250 мг/л, [4-ХФ] : [H2O2] = 1 : 25) [8] и ртутной лампой высокого давления при рН 2 в статических условиях ([4-ХФ]0 = 38,6 мг/л, [4-ХФ] : [H2O2] = 3 : 5) [26].
При использовании XeBr эксилампы (282 нм) скорости комбинированной деструкции молекулярной и анионной форм 2- и 4-ХФ были сопоставимы со скоростью прямого фотолиза. Очевидно, в результате низкого поглощения H2O2 при 282 нм вклад ОН-радикалов был незначительным и субстрат разлагался, главным образом, за счет прямого фотолиза.
Выводы
-
1. В условиях наших экспериментов максимальные скорости и квантовые выходы прямого фотолиза достигались при использовании XeBr-эксилампы (282 нм) для молекулярной формы 4-ХФ и анионной формы 2-ХФ.
-
2. Эффект комбинированной обработки по скорости разложения исходного хлорфенола наблюдался только при использовании KrCl-эксилампы (222 нм). Максимальная эффективность комбинированного окисления по сравнению с прямым фотолизом достигнута для анионов 4-ХФ.


