Сравнительное исследование трех типов протезов, изготовленных методом электроспиннинга в эксперименте in vitro и in vivo
Автор: Попова Ирина Владимировна, Степанова А.О., Сергеевичев Д.С., Акулов А.Е., Захарова И.С., Покушалов А.А., Лактионов П.П., Карпенко А.А.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Сосудистая хирургия
Статья в выпуске: 4 т.19, 2015 года.
Бесплатный доступ
Цель Изготовить и исследовать сосудистые протезы малого диаметра (менее 6 мм) методом электроспиннинга. Материалы и методы Разработали протокол изготовления сосудистых протезов методом электроспиннинга, из растворов синтетических полимеров и смесей синтетических полимеров с желатином, в том числе протокол изготовления малопроницаемого внутреннего слоя. In vitro и in vivo выполнили сравнительные испытания протезов. Исследовали прочность на передавливайие и прорыв нитью, устойчивость к разлохмачиванию слоев, совместимость с нативной артерией. Оценили время гемостаза при имплантации протезов, состоящих из различных комбинаций полимеров, а также их биосовместимость в различные сроки наблюдения. Результаты Протезы сосудов, изготовленные методом электроспиннинга с малопроницаемым внутренним слоем, обладают достаточной прочностью на разрыв нитью, высокой стабильностью в условиях гидродинамической нагрузки, не разлохмачиваются при разрезании и формируют плотный контакт с нативной артерией. Гистологическая оценка показала активное ремоделирование протезов сосудов: формирование характерной для кровеносного сосуда внутренней выстилки, среднего слоя из коллагена, эластина, гладкомышечных клеток и синтетических волокон, а также наружной соединительнотканной капсулы без признаков активного воспаления. Определение клеточных маркеров методом иммуногистохимии демонстрирует более интенсивное накопление гладкомышечных клеток в протезе из поликапролактона по сравнению с остальными исследуемыми протезами. Протезы из поликапролактона с желатином и малопроницаемым внутренним слоем и такие же протезы, внутренний слой которых изготовлен из сополимера молочной и гликолевой кислот с желатином и содержит малопроницаемый слой (полилактид-ко-гликолид с желатином и малопроницаемым внутренним слоем), быстрее по сравнению с протезами из чистого поликапролактона формируют эндотелиальную выстилку. Однако протезы, содержащие слой из полилактида-ко-гликолида, с течением времени теряют клеточный компонент, по-видимому, в связи с биодеградацией полилактида-ко-гликолида. Протез из поликапролактона с желатином и малопроницаемым внутренним слоем характеризуется способностью к ограниченному накоплению гладкомышечных клеток и постепенному заселению эндотелиальными клетками. Выводы Сравнение разных типов протезов, изготовленных с помощью электроспиннинга, позволило выявить варианты полимерной композиции и структуры трансплантата, которые обеспечивают их наилучшую био- и гемосовместимость. Разработанный нами протез сосуда из поликапролактона с мало проницаемым внутренним слоем можно рекомендовать для дальнейшей клинической апробации.
Электроспиннинг, поликапролактон, полилактид-ко-гликолид, малопроницаемый внутренний слой, неоинтима, иммуногистохимия, биосовместимость, сосудистый протез, имплантация
Короткий адрес: https://sciup.org/142140705
IDR: 142140705
Текст научной статьи Сравнительное исследование трех типов протезов, изготовленных методом электроспиннинга в эксперименте in vitro и in vivo
Болезни системы кровообращения стабильно являются основными причинами общей смертности и инвалидности населения [1–3]. Создание сосудистого протеза малого диаметра – актуальный вопрос ангиохирургии, что обусловлено дефицитом собственных сосудов для замещения пораженных участков артерий и вен [4, 5]. Применение биологических и синтетических протезов приводит к тромбозу, гиперплазии неоинтимы, поддержанию воспаления и требует постоянной антикоагулянтной терапии [6–8].
Новое направление протезирования кровеносных сосудов – метод электроспиннинга, позволяющий создать протез сосуда с требуемыми физико-химическими характеристиками, включая скорость его деградации. Пористая структура способствует активной миграции клеток в стенку протеза, формированию питающей кровеносной сети и внутреннего эндотелиального слоя, в отличие от протезов из политетрафторэтилена [9, 10]. Одновременное использование полимеров разного природного происхождения, лекарственных средств, высокомолекулярных соединений позволяет не только повысить способность к адгезии и пролиферации клеток, но и тромборезистентность и антибактериальные свойства таких заменителей сосудов [11, 12].
Цель исследования – разработка протокола изготовления протезов сосудов из смесей синтетических и биологических полимеров, в том числе и с непроницаемым для клеток крови внутренним слоем, оценка их физико-механических, биологических свойств и определение варианта протеза, рекомендуемого для клинической апробации.
Материал и методы
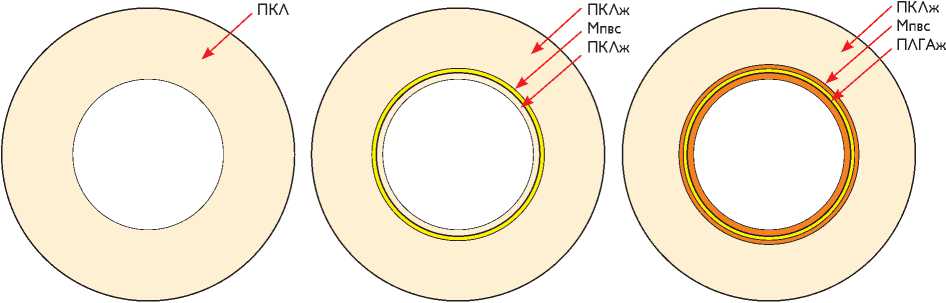
В рамках исследования изготовлены следующие варианты протезов сосудов (рис. 1).
-
1. Протез из поликапролактона (ПКЛ). Использовали раствор (7%, w/v) поликапролактона (Sigma, США, кат. № 44074-5G) в 1,1,1,3,3,3-гексафторизопропаноле (Sigma, США, кат. № 105228-100G, гексафторизопропанол).
-
2. Протез из поликапролактона с желатином кожи свиньи (Sigma, США, кат. № G2500-100G) и малопроницаемым внутренним слоем. Для введения желатина в состав полимерной нити предварительно готовили растворы синтетических полимеров и белка. Для получения 5% раствора синтетического полимера ПКЛ (5%, w/v): в 6 мл гексафторизопропанола растворили 350 мг ПКЛ и перемешали при комнатной температуре, затем перед электроспиннингом добавляли 1 мл 10% раствора желатина, растворенного в гексафторизопропаноле.
-
3. Протез из поликапролактона с желатином и внутренним слоем из полилактида-ко-гликолида (ПЛГА, Lactel, США, кат. № 1132-63-01) с желатином и малопроницаемым внутренним слоем. Использовали заранее приготовленные растворы полимеров: ПЛГА (10%, w/v), ПКЛ (5%, w/v) в гексафторизопропаноле, добавляли 10% раствор желатина (w/w).
Для создания малопроницаемого внутреннего слоя сначала наносили 10% от требуемого объема раствора (ПКЛ с желатином для протеза 2-го типа; ПЛГА с желатином для протеза 3-го типа). Затем останавливали процесс электроспиннинга и поверх слоя волокон наносили 0,044 мл нагретого до 37 °С 2% водного раствора желатина, распределяя его равномерно по поверхности протеза. Далее процесс электроспиннинга возобновляли в прежнем режиме (ПКЛ с желатином для протезов 2-го и 3-го типов). По завершении электроспиннинга протезы, содержащие желатин, инкубировали в растворе, содержащем 0,05 М гидрокарбоната натрия (NaHCO3) pH 9,0 в течение 5 мин, затем 2 ч в 2% растворе глутарового альдегида (Sigma, США, кат № G5882) в этом же буфере. По окончании инкубации в реакционную смесь вносили 1/10 объема 0,1 М раствора, содержащего глицин (Sigma, США, кат № G8898), оттитрованный соляной кислотой (глицин/HCl) до рН 9,0, инкубировали в течение 20 мин, затем помещали протез в раствор боргидрида натрия (NaBH4) (Sigma, США, кат № 71320) в концентрации 4 мг/мл и инкубировали еще 20 мин. Заготовку протеза сосудов отмывали от избытка реагентов трехкратной сменой апирогенной дистиллированной воды (по 5 мин, 5–10 мл на один протез/одну смену), один раз апи-рогенной дистиллированной водой (получена на установке aurium 611VF, Sartorius, США) с 2% глицерином (Sigma, США, кат № G8898). Готовые протезы сосудов высушивали в установке для вакуумной сушки в стерильных условиях. Общий объем раствора синтетических полимеров, затраченный на один протез, равен 0,5 мл.
Стендовые испытания
Структуру поверхности материалов исследовали с помощью сканирующей электронной микроскопии. Для этого образцы контрастировали напылением 10 нм золота и регистрировали изображение на электронном микроскопе JSM-6460 LV (Jeol, Япония). Эту часть работы выполняли в Отделе физико-химических методов исследования Института катализа им. Г.К. Борескова СО РАН.
Прочность на передавливание измеряли путем сдавливания протеза (1 см длиной, увеличение нагрузки с шагом в 2 г) до контакта стенок протеза между двумя параллельными поверхностями с оптическим контролем (микроскоп МИР-2, увеличение х 15).
а бв
Рис. 1. Варианты протезов: а – протез из поликапролактона; б – протез из поликапролактона с желатином и малопроницаемым внутренним слоем; в – протез из поликапролактона с желатином с внутренним слоем из полилактида-ко-глико-лида с желатином и малопроницаемым внутренним слоем
Для измерения прочности материала на прорыв нитью один край фиксировали, второй край на расстоянии 2 мм от конца протеза прошивали монофиламентной полипропиленовой нитью с диаметром 15 мкм (диаметр иглы 170 мкм) и к петле прикладывали увеличивающийся груз (с шагом 10 г). Прочностью считали максимальную нагрузку, при которой еще не наблюдается деформация/прорыв протеза.
Гидродинамические испытания протезов сосудов проводили на установке, состоящей из гидравлического и электронного блоков управления клапанами. Клапаны принудительно открывают и закрывают поток жидкости, что позволяет имитировать гидравлическую нагрузку, испытываемую сосудом в организме. Протезы испытывали путем приложения 500 000 циклов нагрузки давлением 100–200 мм рт. ст., после чего измеряли проницаемость протезов для воды и их диаметр.
Исследование на экспериментальных животных
Исследование на животных проводили, соблюдая «Правила работы с использованием экспериментальных животных» (приказ Министерства здравоохранения СССР от 12.08.1977 № 755 и приложения к приказу Министерства здравоохранения СССР № 565 от 04.10.1977). Крысам линии Wistar (n = 45) с ноября 2013 г. по июнь 2014 г. выполнили операции по замене участка брюшной аорты по ранее указанной нами технике имплантации [13].
Для оценки влияния типа протеза на степень кровопотери и длительность операции выполнили фиксацию времени гемостаза (время от снятия зажимов с аорты до прекращения кровотечения из области проколов иглой).
Гистология и иммуногистохимическое исследование
На сроке наблюдения 2, 4 и 20 нед. выполнили забор исследуемых трансплантатов. Трансплантаты фиксировали в 10% формалине на фосфатном буфере (Sigma, № кат. P4417-100TAB, США), после чего изготавливали серийные поперечные криосрезы с толщиной 10 мкм, используя криостат Microm HM-550 (Carl Zeiss, Германия). До момента окраски красителями срезы хранили в холодильной камере при температуре –18 °С.
Для гистологического исследования препараты окрашивали гематоксилином (Biovitrum, Россия) и эозином (Bio-Optica, Италия, № кат. 05-11007); методом фон Косса (Bio-Optica, Италия, № кат. 04-170801); методом Пикро – Маллори (Bio-Optica, Италия, № кат. 04-021822,), после чего высушивали и заключали под покровное стекло при помощи среды Bio Mount (Bio-Optica, Италия, № кат. 05-BM500). Анализ полученных материалов осуществляли с помощью микроскопа AxioVision FL-40 с программным пакетом AxioVision 3.1 (Carl Zeiss, Германия).
Для иммуногистохимического исследования препараты протезов и срезов протезов фиксировали в 4% растворе формальдегида (Sigma, США), инкубировали (только для

в


Рис. 2. Структура протезов сосудов, изготовленных методом электроспиннинга: а – по данным световой микроскопии, микроскоп SteReo Discovery V12, увеличение 56 (Zeiss, Germany); по данным сканирующей электронной микроскопии (LEO-1430, Jeol, Япония): б – вид изнутри; в – вид сбоку
препаратов протезов) в растворе 20% сахарозы в течение 1 ч и 30% растворе сахарозы в течение ночи, пермеабилизо-вали в растворе детергента Triton Х-100 в течение 1 ч (0,1% – для препаратов протезов, 1% – для срезов протезов). Им-мунофлуоресцентное окрашивание антителами к характерным маркерным белкам выполняли согласно рекомендациям производителя. Мы использовали антитела: anti-CD31 (Аbcam, США, № кат. ab64543 ), anti- α -sma (Dako, США, № кат. M0851), anti-collagen I (Аbcam, США, № кат. ab34710), anti-fibronectin (Аbcam, США, № кат. ab6328), anti-CD90 (Millipore, США, № кат. MAB1406), Alexa Fluor 568 goat anti-mouse IgG1 (Life Technologies, США, № кат. A21124), Alexa Fluor 488 goat anti-mouse IgG1 (Life Technologies, США, № кат. A21121), Alexa Fluor 568 goat anti-mouse IgG2a (Life Technologies, США, № кат. A21134), Alexa Fluor 568 goat anti-mouse IgG (H+L) (Life Technologies, США, № кат. A11031), Alexa Fluor 488 goat anti-mouse IgG (H+L) (Life Technologies, США, № кат. A11029).
Окраску изолектином (Isolectin GS-IB4 from Griffonia simplicifolia, США) Alexa Fluor® 594 Conjugate (Life
Technologies, США, № кат. I21413) проводили согласно протоколу фирмы-производителя. Готовые препараты заключали в среду Vectashield mounting medium with DAPI (Vector laboratories, США) и анализировали с помощью лазерного сканирующего инвертированного флуоресцентного микроскопа Zeiss LSM710. Изображения обрабатывали при помощи программного обеспечения ZEN (Carl Zeiss, Германия). Статистическую обработку данных проводили с использованием программы Microsoft Office Excel 2010 и программного пакета Statistica 6.0, достоверность различия рассчитывали по U-критерию Манна – Уитни и принималась при p<0,05.
Результаты
По результатам сканирующей электронной микроскопии выявили, что изготовленные матриксы из ПКЛ состоят из волокон диаметром в среднем 1 мкм и образуют между собой поры размером 6,6 мкм (рис. 2)
Прочность протезов на передавливание составила не менее 20±2 г силы, а прочность на прорыв нитью – не менее
|
Таблица 1 Распределение |
животных по |
полу в группах |
|
|
Показатели, |
1 группа, |
2 группа, |
3 группа, |
|
n (%) |
n = 15 |
n = 15 |
n = 15 |
|
Самка |
5 (33,3) |
7 (46,7) |
9 (60,0) |
|
Самец |
10 (66,7) |
8 (53,3) |
6 (40,0) |
Представлено среднее значение
160±20 г силы для всех типов протезов. При исследовании влияния гидродинамических нагрузок – более 500 000 циклов с перепадами давления физраствора 100–200 мм рт. ст. – обнаружено, что протезы с мпвс не изменяют параметров проницаемости, равно как и структуры, то есть слои не распадались на волокна. Таким образом, протезы такого типа демонстрируют высокую функциональную стабильность.
Имплантировали протезы в инфраренальный отдел аорты 45 крысам, среди них 21 (46,7%) самка и 24 (53,3%) самца (табл. 1).
При оценке длительности операции более высокие показатели обнаружили при протезировании трансплантата из поликапролактона с желатином и малопроницаемым внутренним слоем, что связано с анатомическими особенностями и небольшими техническими затруднениями при выделении магистральных сосудов у животных этой группы, однако отличие не было статистически значимым. Время гемостаза и степень пропитывания протеза кровью были значительно меньше у протезов, содержащих малопроницаемый внутренний слой (табл. 2).
Интраоперационная оценка качества изготовленных протезов показала, что они устойчивы к разлохмачиванию при отрезании части ножницами. В трансплантатах с малопроницаемым внутренним слоем нет кровопотери через проколы атравматическими иглами и нитями (Primelen 8.0), в отличие от протезов без такого слоя. При формировании анастомоза не определяется подворачивания краев трансплантата, а об- ласть соединения протеза с нативной артерией представлена в виде плотного контакта. Все типы исследуемых протезов сохраняют свою цилиндрическую форму на протяжении имплантации, однако при сдавливании пинцетом пропитанный физраствором протез из поликапролактона с желатином и малопроницаемым внутренним слоем из полилакти-да-ко-гликолида увеличивает свою податливость, в отличие от протезов, не содержащих полилактид-ко-гликолид, что, по-видимому, связано с более жесткой структурой слоя из полилактида-ко-гликолида.
В момент забора экспериментальных протезов в одном случае мы выявили трансплантат в группе поликапролактона с желатином и малопроницаемым внутренним слоем с наличием пристеночного тромба (подтверждено гистологически). С помощью операционного микроскопа OPMI PICO (Carl Zeiss, Германия) обнаружили, что участок повреждения имел овальную форму зоны уплотнения внутренней выстилки бордово-коричневого цвета (наличие организованного плотного тромба), занимающей 1/3 длины дистальной части трансплантата по задней поверхности. Измененный участок не сообщался с внутренним просветом протеза и не распространялся на его толщу, а также не имел свежих тромботических наложений. Вероятно, это связано не с тромбогенностью протеза, а с технической погрешностью хирургического вмешательства (например грубая манипуляция пинцетом в зоне анастомоза).
С помощью окраски препаратов гемотоксилином и эозином, по фон Коссу, Пикро – Маллори согласно срокам наблюдения можно выделить некоторую этапность вживления протезов (рис. 3).
В момент первичного набухания, которое определяется на второй неделе, гистологически выявляются свежие форменные элементы крови (эритроциты) в толще протеза, при этом их обнаруживают только во внутреннем слое протезов с малопроницаемым внутренним слоем; в наружной части стенки они практически отсутствовали. По мере увеличения сроков наблюдения происходило уменьшение количества
Таблица 2 Время операции и окклюзии аорты в группах
|
Показатели |
Общее время операции, мин |
Время окклюзии аорты, мин |
Время гемостаза, мин |
|
1 группа: протез из поликапролактона |
103±3,4 |
55,8±1,4 |
9,2±0,35 |
|
2 группа: протез из поликапролактона с желатином и малопроницаемым внутренним слоем |
112,4±2,6 |
58,8±1,4 |
5,6±0,3 |
|
3 группа: протез из поликапролактона с желатином и малопроницаемым внутренним слоем из полилактида-ко-гликолида |
103,8±3 |
57,4±1,5 |
5,4±0,26 |
|
р |
>0,05 |
>0,05 |
<0,05 |
Представлено среднее значение ± ошибка среднего
Пропитывание стенки протеза компонентами крови
(первичное набухание) 2-я нед. наблюдения
Постепенное уменьшение толщи протеза, начало формирования внутренней выстилки
4-я нед. наблюдения
Увеличение толщины внутренней выстилки за счет накопления клеточных
компонентов и волокон 20-я нед. наблюдения

Рис. 3. Этапы вживления экспериментальных протезов в артериальную позицию свежих эритроцитов, при этом к 20-й неделе они не обнаружены в протезах с мпвс и в единичном количестве выявлены в протезах из поликапролактона.
При окраске гемотоксилином и эозином и по Пикро – Маллори мы выявлили, что образование наружного соеди-нительно-тканного слоя с четкими характерными компонентами и питающими его кровеносными сосудами наиболее выражено у протезов, содержащих мпвс на всех сроках наблюдения. Их внутренняя выстилка имела вид тонкого компактного ровного слоя, без резких границ с поверхностью синтетического материала и плавно переходящего с нативной артерии на протез, в отличие от протезов, не имеющих такого слоя (рис. 4).
Окраска по методу фон Косса позволила оценить степень минерализации ткани, то есть выявить выпавшие в ткани нерастворимые фосфаты кальция. На всех сроках наблюдения во внутреннем слое определяется небольшое количество фосфатов кальция, причем у протезов из поликапролактона с желатином и малопроницаемым внутренним слоем и протезов из поликапролактона с желатином и малопроницаемым внутренним слоем из полилактида-ко-глико-лида зона ограничена малопроницаемым внутренним слоем, а у протеза из поликапролактона отмечалось распространение и на более наружную часть протеза.
При выполнении иммуногистохимического исследования на второй неделе наименьшее количество клеток на внутренней поверхности выявили в структуре протезов 2-го типа, в протезах из ПКЛ наблюдали значительное накопление клеток, а в протезах 3-го типа внутренняя выстилка представляла собой слои клеток разной толщины. По мере увеличения сроков наблюдения количество гладкомышечных клеток и степень их проникновения в толщу протеза прогрессивно увеличивалось. Наибольшее количество мар- керов эндотелиальных (CD31) и гладкомышечных клеток (а-SMA) обнаружили на четвертой неделе у протеза из поликапролактона с желатином и малопроницаемым внутренним слоем из полилактида-ко-гликолида. Однако на 20-й неделе содержание эндотелиальных (CD31) маркеров значительно снижалось, что, скорее всего, связано с деградацией полимера (ПЛГА), которая приводила к деструкции внутреннего слоя и потере клеточного компонента внутренней выстилки. В толще исследуемых протезов на 20-й неделе отмечали повышенную концентрацию гладкомышечных клеток (а-SMA), что свидетельствует о формировании сократительного слоя сосуда и/или неоинтимы [9]. Протез из ПКЛ с увеличением сроков наблюдения характеризовался прогрессирующим накоплением количества гладкомышечных клеток во внутреннем слое, что характерно для растущей неоинтимы [10]. Протез ПКЛ с желатином и мпвс демонстрировал небольшое количество гладкомышечных клеток и постепенное формирование тонкого внутреннего слоя с наличием эндотелиальных клеток (рис. 5). Как описано в литературе, у всех типов протезов формирование внутреннего слоя происходило в большей степени путем миграции клеток с нативной артерии на трансплантат. При этом отмечался достаточно плотный контакт «конец в конец» между сосудами.
На четвертой неделе количество маркеров межклеточного матрикса (фибронектин, коллаген) определяется в малом количестве у всех экспериментальных протезов, однако на 20-й неделе наибольшее количество выявлено в протезе из поликапролактона с желатином и малопроницаемым внутренним слоем из полилактида-ко-гликолида. В протезе 1-го типа коллаген и фибронектин представлены в большей концентрации (межклеточная локализация матрикса), чем в протезе 2-го типа (с тенденцией к внутриклеточной локализации).
а
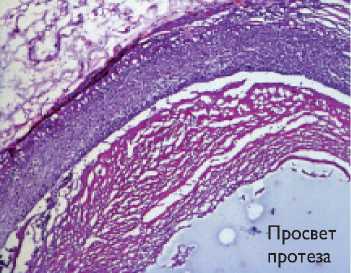
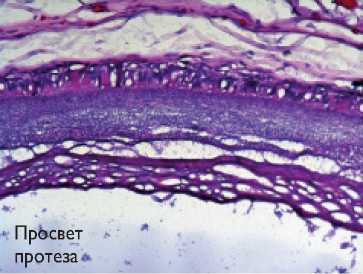
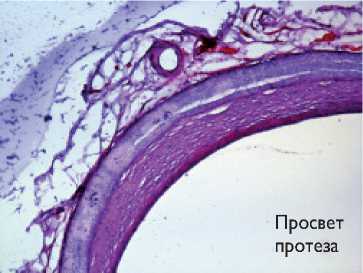
Рис. 4. Окраска гемотаксилином и эозином сосудистых протезов, 20-я неделя наблюдения, микроскоп AxioVision FL-40, увеличение х 100: а – протез из поликапролактона; б – протез из поликапролактона с желатином и малопроницаемым внутренним слоем; в – протез из поликапролактона с желатином и малопроницаемым внутренним слоем из полилакти-да-ко-гликолида
Обсуждение
В многочисленных публикациях отмечено, что создание надежного длительно функционирующего сосудистого протеза малого диаметра (менее 6 мм) – актуальная задача сосудистой хирургии [1, 2, 9].
Несмотря на большое количество экспериментальных и теоретических исследований, касающихся способов изготовления протезов кровеносных сосудов методом электроспиннинга, положительных результатов их клинического использования нет. Некоторые авторы изготавливают протезы сосудов, используя одновременно свойства электроспининга и электроспрея, другие путем центробежного литья с последующей укладкой волокон, полученных электроспиннингом, а третьи делают акцент на формировании коаксильных волокон, то есть имеющих в своей структуре ядро и оболочку [14–16]. Отсутствие системного подход к исследованию свойств материалов и интерпретации результатов, в соответствии с требованиями регламентирующих документов, вызывает трудности по оптимизации конструкции и технологии изготовления таких протезов. Большинство исследователей поддерживают формирование трансплантатов из нескольких слоев по примеру нативной артерии, однако нет данных о стабильности материала в условиях гидродинамической нагрузки, а также оценки хирургического качества конструкций [9, 10, 17].
В данном исследовании разработан оригинальный протокол изготовления протезов сосудов с малопроницаемым внутренним слоем, показатели которых не уступают по прочностным и биологическим характеристикам протезам, которые применяются в повседневной клинической практике. Протезы легко поддаются рассечению в любом направлении, сохраняют первоначальную форму, что позволяет интраоперационно создавать как прямой, так косой тип анастомозов. Подобранная полимерная композиция, включающая биополимер – желатин, позволяет сохранять функциональные свойства протеза в кровеносном русле, при этом не вызывает чрезмерного увеличения толщины внутреннего слоя длительное время. Введение в со-
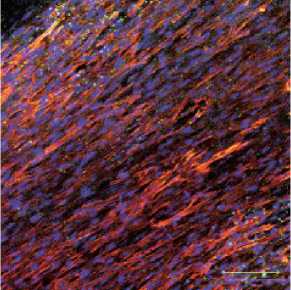
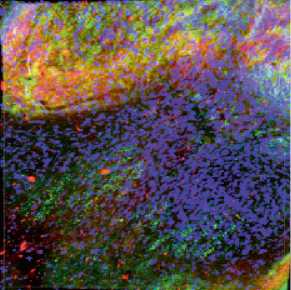
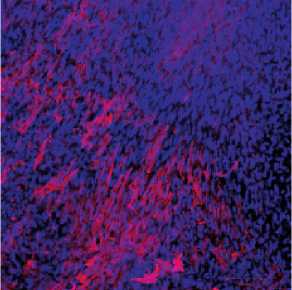
Рис. 4. Иммуногистохимическое исследование на 20-й неделе наблюдения, красный– маркер гладкомышечных клеток (αSMA), зеленый – эндотелиальный маркер (CD31): а – протез из поликапролактона; б – протез из поликапролактона с желатином и малопроницаемым внутренним слоем; в – протез из поликапролактона с желатином и малопроницаемым внутренним слоем из полилактида-ко-гликолида став протеза сосуда малопроницаемого внутреннего слоя позволило повысить его герметичность, снизить время гемостаза интраоперационно.
Известно, что показатели скорости кровотока в трансплантате влияют на его функциональную состоятельность в отдаленном периоде наблюдения. Чем быстрее и объемнее поток крови в сосуде, тем менее продолжителен контакт ее компонентов с его поверхностью и тем меньше возможности отложений толстого слоя фибрина. Ранее мы указывали хорошую проходимость протезов, изготовленных по нашему протоколу [13]. В этом исследовании мы подтвердили, что протезы с мпвс обладают хорошей гемосовместимостью и биосовместимостью. При гистологическом исследовании это выражается в постепенном их заполнении структурными элементами, характерными для кровеносного сосуда.
Протезы, содержащие во внутреннем слое полилак-тид-ко-гликолид и имеющие мпвс, более эффективно заселялись эндотелиальными клетками (уже на 4-й недели), однако в связи с быстрой деградацией полимера значительно теряли их с течением времени. В связи с чем мы не рекомендуем включать синтетически полимер (ПЛГА) в качестве самостоятельного внутреннего слоя протеза, так как это затягивает процесс образования неоинтимы. Сравнение исследуемых типов протезов показало, что протез из ПКЛ с желатином и мпвс интегрирует с артериальной стенкой, не склонен к формированию неоинтимы, а постепенно формирует внутреннюю выстилку при сохранении достаточного внутреннего просвета.
Выводы
-
1. Разработанный протокол изготовления протезов с малопроницаемым внутренним слоем позволяет интраоперационно снизить время гемостаза и сохранить длительную функциональную стабильность конструкции в условии пульсирующего потока крови.
-
2. Протезы, изготовленные методом электроспиннинга, сохраняют форму и обладают приемлемыми физическими характеристиками, что позволяет хирургу без усилий формировать различные типы анастомозов с нативной артерией.
-
3. При имплантации протезов, изготовленных с помощью электроспиннинга, не следует позиционировать зажим на протезе или цеплять его пинцетом, особенно в зоне анастомоза, так как это может привести к тромбозу или аневризме.
-
4. Протезы сосудов из поликапролактона с желатином и малопроницаемым внутренним слоем обладают биосовместимостью и тромборезистентностью, не склонны к формированию обширной неоинтимы и кальцификации.
Исследование выполнено при поддержке гранта Российского научного фонда (проект № 14-15-00493). Авторы заявляют об отсутствии конфликта интересов.
Список литературы Сравнительное исследование трех типов протезов, изготовленных методом электроспиннинга в эксперименте in vitro и in vivo
- Danaei G., Ding E.L., Mozaffarian D., Taylor В., Rehm J., Murray C.J., Ezzati M. The preventable causes of death in the United States: comparative risk assessment of dietary, lifestyle, and metabolic risk factors//PLoS Med. 2009. Vol. 6. № 4. P. e1000058.
- Покровский A.B., Гонтаренко В.Н. Состояние сосудистой хирургии в России в 2012 году. М.: Российское общество ангиологов и сосудистых хирургов, 2013. 95 с.
- Чернявский А.М., Едемский А.Г., Чернявский М.А., Виноградова Т.Е. Гибридные технологии при хирургическом лечении сочетанного атеросклеротического поражения коронарных и сонных артерий//Патология кровообращения и кардиохирургия. 2013. № 1. С. 45-50.
- Veith F.J., Moss C.M., Sprayregen S., Montefusco C. Preoperative saphenous venography in arterial reconstructive surgery of the lower extremity//Surgery. 1979. Vol. 85. № 3. P. 253-256.
- Klinkert P., Post P.N., Breslau P.J., van Bockel J.H. Saphenous vein versus PTFE for above-knee femoropopliteal bypass: a review of the literature II Eur. J. Vase. Endovasc. Surg. 2004. Vol. 27. P. 357-362.
- Rossi G., Munteanu F.D., Padula G., Carillo F.J., Lord J.W. Nonanastomotic aneurysms in venous homologous grafts and bovine heterografts in femoropopliteal bypasses//Am. J. Surg. 1976. Vol. 132. P. 358-362.
- Rychlik I.J. Davey P., Murphy J., O'Donnell M.E. A meta-analysis to compare Dacron versus polytetrafluroethylene grafts for abov knee femoropopliteal arterybypass//J. Vase. Surg. 2014. Vol. 60. № 2. P. 506-515.
- Anderson J.M. Inflammatory response to implants. ASAIO Trans. 1988. Vol. 34. P. 101-7.
- Mugnai D., Tille J.C., Mrowczynski W., de Valence S., Montet X., Moller M., Walpoth B.H. Experimental noninferiority trial of synthetic small-caliber biodegradable versus stable vascular grafts. II Journal of Thoracic and Cardiovascular Surgery. 2013. Vol. 146. P. 400-407.
- de Valence S., Tille J.-C., Mugnai D., Mrowczynski W, Gurny R., Moller M., Walpoth B.H. Long term performance of polycaprolactone vascular grafts in a rat abdominal aorta replacement model Original Research//Article Biomaterials. 2012. Vol. 33. P. 38-47.
- Hashi C.K., Derugin N.,Janairo R.R., Lee R., Schultz D., Lotz J., Li S. Antithrombogenic Modification of Small-Diameter Microfibrous Vascular Grafts//Arteriosclerosis, Thrombosis, and Vascular Biology. 2010. Vol. 30. P. 1621-1627.
- Luong-Van E., Griundahl L., Chua K.N., Leong K.W., Nurcombe V., Cool S.M. Controlled release of heparin from poly(e-caprolactone) electrospun fibers//Biomaterials. 2006. Vol. 27. P. 2042-50.
- Попова И.В., Степанова А.О., Плотникова Т.А., Сергеевичев Д.С., Акулов А.Е., Покушалов А.А., Лактионов П.П., Карпенко А.А. Изучение проходимости сосудистого протеза, изготовленного методом электроспиннинга//Ангиология и сосудистая хирургия. 2015. № 2. С. 136-142.
- Zhang Y., Huang Z.M., Xu X., Lim С.Т., Ramakrishna S. Preparation of core-shell structured PCL-r-gelatin Ы-component nanofibers by coaxial electrospinning//Chemistry of Materials. 2004. Vol. 16. № 18. P. 3406-3409.
- Hasan A., Memic A., Annabi N., Hossaind M., Paula A., Dokmecia M.R., Dehghanie F., Khademhosseini A. Electrospun scaffolds for tissue engineering of vascular grafts//Acta Biomaterialia. 2014. Vol. 10. P. 11-25.
- Uttayarat P., Perets A., Li M., Pimton P., Stachelek S.J., Alferiev l„ Composto R.J., Levy R.J., Lelkes P.l. Micropatterning of three-dimensional electrospun polyurethane vascular grafts//Acta Biomaterialia. 2010. Vol. 6. P. 4229-4237.
- Han F., Jia X., Dai D., Yang X., Zhao J., Zhao Y„ Fan Y., Yuan X. Performance of a multilayered small-diameter vascular scaffold dual-loaded with VEGF and PDGF//Biomaterials. 2013. Vol. 34. P. 7302-13.


