Сравнительное изучение комплексных порошкообразных препаратов для регенерации мягких тканей
Автор: Бабушкина И.В., Гладкова Е.В., Мамонова И.А., Белова С.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Дерматовенерология
Статья в выпуске: 3 т.13, 2017 года.
Бесплатный доступ
Цель: сравнительный анализ регенеративной активности порошкообразных препаратов для местного лечения повреждений мягких тканей, разработанных на основе наночастиц меди и серебра в сравнении с традиционными присыпками, содержащими антибиотики в условиях экспериментальной условно-асептической раны. Материал и методы. Исследование проведено на 80 белых крысах с экспериментальной условно-асептической раной. Использованы: наночастицы меди и серебра, полученные плазмохимическим методом, стерильный крахмал, оксид цинка, банеоцин. Применены планиметрические и бактериологические методы исследования. Результаты. Лечение разработанными препаратами в сравнении с традиционными препаратами, содержащими антибиотики, обеспечило более эффективное протекание репаративных процессов, о чем свидетельствовали данные планиметрических показателей. Заключение. Разработанные препараты за счет выраженного антибактериального действия обеспечивают надежную профилактику вторичного инфицирования раны, что является обязательным условием протекания процессов репаративной регенерации. Использование с этой целью наночастиц металлов позволяет исключить побочные действия, характерные для подобных препаратов, в состав которых входят антибиотики.
Антибиотики, медь, наночастицы, регенерация, серебро, экспериментальная рана
Короткий адрес: https://sciup.org/14918532
IDR: 14918532
Текст научной статьи Сравнительное изучение комплексных порошкообразных препаратов для регенерации мягких тканей
1 Введение. Существует обширная теоретическая основа и логическая обоснованность назначений препаратов для этапного лечения повреждений мягких тканей. Тем не менее продолжается рост заинтересованности в создании новых ранозаживляющих средств, что связано с многообразием форм раневых процессов, особенностями инфекционных осложнений, вызванных различными группами патогенных микроорганизмов [1].
Большинство стимуляторов влияют на регенерацию и репарацию поверхности кожи и применяются при длительно незаживающих ранах, трофических язвах, термических повреждениях, пролежнях. Регенеративные препараты стимулируют рост дермальной и соединительной ткани в зоне локального патологического процесса, а также оказывают противовоспалительное, антиоксидантное и антибактериальное действие. Антибактериальный эффект препаратов для регенерации тканей является наиболее значимым с точки зрения наличия потенциальной возможности микробной контаминации пораженных участков кожи.
Для лечения ран мягких тканей различной этиологии и локализации активно разрабатываются разнообразные формы препаратов для местного применения: мази на жиро- и водорастворимой основе, пено- и пленкообразующие аэрозоли, гидроколлоиды, раневые покрытия [2, 3].
В случаях острого или подострого течения воспаления, протекающего в поверхностных (покровных) тканях, оптимальным является использование лекарственной формы в виде присыпки (пудры). Особенно показаны данные лекарственные формы для лечения ран с обильной экссудацией. Присыпки представляют собой порошки, лечебный эффект которых зависит от степени дисперсности порошкообразной основы, определяющей выраженность дренирующего и сорбирующего эффектов. Кроме активных компонентов, оказывающих регенеративное, антибактериальное, противовоспалительное действие, в качестве порошкообразной основы эта группа препаратов содержит содержит тальк, крахмал, бентонит, ликоподий, белую глину [4].
В настоящее время в лечении повреждений мягких тканей широко используется комбинированный порошкообразный препарат банеоцин, имеющий в составе два антибиотика: бацитрацин и неомицин. Вспомогательным компонентом банеоцина является стерильный кукурузный крахмал, обладающий дренирующим и сорбционным эффектом. Широкий спектр антибактериального действия антибиотиков, входящих в состав банеоцина, позволяет назначать его без идентификации раневого возбудителя, что ускоряет начало лечения, но в то же время активно способствует селекции антибиотикорезистентных штаммов [4, 5].
В связи с многообразием вариантов течения раневого процесса мягких тканей возникает потребность в разработке новых комплексных препаратов, реализующих свои лечебные эффекты с учетом патофизиологических закономерностей развития той или иной формы патологии. Этим продиктовано возникновение новых технических решений.
Изучение биологической активности наночастиц меди и серебра доказало наличие ранозаживляющих
и антибактериальных свойств, что открывает возможность их использования для лечения повреждений мягких тканей [6]. Cочетание свойств наночаcтиц c высокой дренирующей и адсорбционной способностью порошкообразной основы, обеспечивающей адекватный влаго- и газообмен, дает возможность разработать новый класс препаратов, обладающих регенеративной и антибактериальной активностью [7, 8]. Актуальным представляется сравнительная оценка влияния местного применения разработанных комплексных препаратов из наночастиц меди и серебра в сочетании с порошкообразной основой на репарацию экспериментальной условно-асептической раны.
Антибиотики в большинстве случаев могут быть только дополнительным средством лечения повреждений мягких тканей, так как они способны замедлять заживление раны, подавляя воспалительную реакцию и угнетая иммунитет. Любые дозы антибиотиков могут вызвать аллергические реакции вплоть до анафилактического шока. Стремительное возрастание резистентности микроорганизмов к антибактериальным препаратам и антисептикам, используемым для местного лечения ран, способствует селекции антибиотикорезистентных штаммов [9].
Цель: сравнительное изучение разработанных комплексных порошкообразных препаратов с регенеративной и антибактериальной активностью на основе наночастиц меди и серебра и порошкообразных препаратов на основе антибиотиков в условиях экспериментальной условно-асептической раны.
Материал и методы. В данной работе использованы наночастицы меди и серебра (ТУ 1733-056-00209013-2008), синтезированные на плазмохимическом комплексе филиала ФГУП РФ «Государственный научно-исследовательский институт химии и технологии элементоорганических соединений» (ФГУП РФ ГНЦ ГНИИХТЭОС, г. Москва). Нанопорошки меди и серебра синтезированы из крупнодисперсного порошка посредством плазменной технологии, в основе которой лежит испарение сырья до ультрадисперсных частиц в плазменном потоке: меди 30–40 нм; серебра 30–70 нм.
Эксперимент проводился на 80 белых нелинейных крысах массой 170±20 г. Исследования проводились в соответствии с Хельсинкской декларацией 1975 г. и ее пересмотром в 1983 г. Животные содержались в индивидуальных клетках со свободным доступом к воде и пище. Все манипуляции проводились в рамках Правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах. Содержание животных, питание и уход за ними проводились согласно «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) от 06.04.1973», эвтаназия осуществлялась в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (приложение 3.4 к приказу МЗ СССР от 12.08.1977 №755), и не противоречили Женевской конвенции 1985 г. «О международных принципах биомедицинских исследований с использованием животных».
Модель полнослойной условно-асептической раны была получена на 80 экспериментальных животных следующим образом: после предварительной обработки кожи, в асептических условиях, под наркозом, на выбритом от шерсти участке в межло- паточной области иссекалась кожа с подкожной клетчаткой в виде квадрата 2х2 см (400 мм2) по контуру, предварительно нанесенным трафаретом.
Животные были разделены на четыре группы: группа сравнения 1 (экспериментальная рана заживала самостоятельно); группа сравнения 2 (на раневую поверхность наносили 300 мг препарата ба-неоцин); опытная группа 3 (на раневую поверхность наносили комплексный препарат с наночастицами меди и серебра); опытная группа 4 (на раневую поверхность наносили комплексный препарат с наночастицами меди и серебра и оксидом цинка).
В опытных группах и группах сравнения с экспериментальной раной после первичной обработки препараты наносили из расчета 300 мг препарата на 400 мм2 раневой поверхности, оставляли на 3–5 мин до адсорбции раневого экссудата препаратом и фиксации его на поверхности раны. При наличии раны с обильным экссудатом обработку повторяли по мере необходимости при появлении экссудата на поверхности раны (через 2–3 дня).
Во всех группах животных учитывали наличие и характер воспалительной реакции, состояние краев и дна раны, сроки очищения раны от некротических тканей и появления грануляций, сроки начала эпите-лизации ран. Изменения перечисленных признаков фиксировали и выражали количественно с учетом сроков лечения; планиметрические и бактериологические методы исследования ран использовали на третьи, 5, 7, 10 и 14-е сутки наблюдения.
Выделение и идентификация микроорганизмов происходили по общепринятой методике (приказ №535 МЗ СССР). Штаммы микроорганизмов выделяли из раневого отделяемого экспериментальных животных. Взятие материала осуществляли в асептических условиях стерильными тампонами Transport swab w/o medium (Citoswab, China), перед взятием материала края раны обрабатывали дезинфицирующем раствором. Высев исследуемого материала производили на селективные и диференци-ально-диагностические питательные среды: 5%-ный кровяной агар (основа агара Agar nutrient (Becton Dickinson, США)), среда Эндо (Endo Agar, Special (Hi Media, Индия)), желточно-солевой агар (основа агара Gelatin Mannitol Salt Agar (Staphylococcus agar №110) (Hi Media, Индия)), сахарный бульон (ГМФ-бульон (НИЦФ, Россия). Посевы инкубировали при температуре 37°С в течение 24 часов. После окончания инкубации изучали морфологические, культуральные и тинкториальные свойства микроорганизмов; для дифференциации бактерий проводили окраску по Граму (набор реагентов для окраски по Граму (ЭКОлаб, Россия)).
Микроорганизмы идентифицировали на микробиологическом анализаторе BD BBL™ Crystal™ AutoReader (Becton Dickinson, США) с применением панелей CrystalTM Enteric/Nonfermenter ID Kit (Becton Dickinson, США), CrystalTM Gram-Positive ID Kit (Becton Dickinson, США).
Для получения объективных показателей активности вторичного заживления ран вторичным натяжением использовали ряд планиметрических методов: изменение площади раны, скорость заживления раны (мм2/сут.). На рану помещалась стерильная пластинка полимера, на нее наносили контур раны, с помощью компьютерной программы подсчитывали площадь раны.
Скорость заживления раны определяли по формуле М. Г. Маркаряна и Г. Ц. Саркисяна:
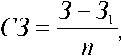
где СЗ — скорость заживления площади раны в сутки; З — исходная площадь раны; З1 — площадь ее к моменту измерения; n — количество суток.
Статистическая обработка данных проводилась с использованием пакета программ Microsoft Excel 2010 и Statistica 6.0. Проверку нормальности распределения количественных показателей выполняли с использованием критерия Колмогорова –Смирно-ва, коэффициентов асимметрии и эксцесса. Оценку различий между выборками проводили с использованием t-критерия Стьюдента, так как переменные соответствовали нормальному распределению. В анализе использованы следующие статистические показатели: n — число наблюдений; M — среднее арифметическое значение; m — среднеквадратическая ошибка; p — коэффициент достоверности. Различия считали статистически значимыми при p<0,05, что соответствует требованиям, предъявляемым к медико-биологическим исследованиям.
Результаты. Разработан ранозаживляющий препарат с регенеративной и антимикробной активностью для лечения повреждений мягких тканей, предупреждающий вторичное инфицирование и обладающий дренирующим и сорбционным свойствами. Составляющие компоненты препарата (наночастицы меди и серебра, а также стерильный кукурузный крахмал) и их количественное соотношение были подобраны экспериментально.
При нанесении препарата на раневую поверхность и взаимодействии с раневым экссудатом образуется гигроскопичная корочка, позволяющая изолировать раневую поверхность от проникновения внешней микрофлоры, обеспечивающая абсорбцию раневого экссудата, что является важным условием процесса регенерации. Препарат не предусматривает травматичного удаления с раневой поверхности и не формирует пленку на ее поверхности, обеспечивая свободный доступ кислорода к поврежденным клеткам тканей и ускоряя естественные процессы репарации раны.
Разработана также модификация данного порошкообразного препарата на основе наночастиц меди и серебра; задачей которой стало расширение диапазона применения при различных формах раневого процесса, сопровождающихся обильной экссудацией и инфицированных не только бактериями, но и грибами рода Candida . Препарат отличается от прототипа введением в состав оксида цинка, обладающего фунгицидным, выраженным адсорбирующим и противовоспалительным эффектами.
Задачей настоящего исследования было сравнительное изучение регенеративной активности двух разработанных порошкообразных препаратов на основе наночастиц меди и серебра и банеоцина, имеющего порошкообразную основу и сочетание двух антибиотиков широкого спектра действия в условиях условно-асептической раны.
Сроки регенерации раны, заживающей вторичным натяжением, определяются продолжительностью фаз раневого процесса, являются наиболее показательными клиническими характеристиками динамики заживления, проявляются в постепенном уменьшении, а затем в полном закрытии раневой поверхности. Изучение планиметрических характери-
Таблица 1
Динамика изменения площади условно-асептической раны
|
Группа животных |
Площадь раневой поверхности, M± |
||||
|
Срок исследования, сутки |
|||||
|
1-е |
3-и |
5-е |
7-е |
14-е |
|
|
Группа сравнения 1, n=20 |
487,8±12,8 |
678,7±18,4 |
785,2±14,9 |
564,7±19,2 |
186,3±15,7 |
|
Группа сравнения 2, n=20 |
497,3±10,7 |
402,3±8,6 |
362,5±18,1 |
143,74±15,4 |
67,5±18,9 |
|
Опытная группа 3, n=20 |
428,4±15,7 |
232,0±14,5 p =0,0000001 p33--12=0,0000001 |
135,8±19,6 p =0,0000001 p33--12=0,0000001 |
98,3±4,7 p =0,0000001 p33-1-2=0,007177 |
0,0 p=0,0000001 p=0,0000001 |
|
Опытная группа 4, n=20 |
398,2±18,5 |
167,7±15,9 p =0,0000001 p3-1=0,0000001 |
91,2±7,7 p =0,0000001 p3-1=0,0000001 |
15,0±2,1 p =0,0000001 p3-1=0,0000001 |
0,0 p=0,0000001 p=0,0000001 |
П р и м еч а н и е : p — уровень достоверности различий показателей опытных групп по отношению к группам сравнения.
стик является объективным показателем заживления раны.
У животных группы сравнения 1, рана которых заживала самостоятельно, площадь раневой поверхности сокращалась медленно, к 14-м суткам наблюдения полного заживления ран не наблюдалось у всех животных. Также в группе сравнения 1 у пяти животных с 3-х по 7-е сутки исследования площадь раны увеличилась на 32,8-46,9% по отношению к исходным показателям (табл. 1), отмечалось гнойное отделяемое. При бактериологическом исследовании у данных животных с раневой поверхности выделена и идентифицирована E. coli в количестве 5·106 КОЕ/ мл. Таким образом, наблюдалось вторичное инфицирование раны флорой кишечника животных, приводящее к увеличению раневой поверхности и замедлению регенерации раны.
У всех животных группы сравнения 2 раневая поверхность обрабатывалась банеоцином. В этой группе раневая поверхность на 5-е сутки наблюдения сократилась на 27,4%, полное заживление раны к 14-м суткам наступило только у 9% животных (см. табл. 1). В то же время следует отметить, что по результатам бактериологических исследований на протяжении всего периода наблюдения рана оставалась стерильной, вторичного инфицирования не наблюдалось, что свидетельствует о выраженном антибактериальном влиянии банеоцина.
В опытной группе 3, в которой раневую поверхность обрабатывали разработанным комплексным препаратом на основе наночастиц меди, серебра и порошкообразной основы (стерильный кукурузный крахмал), отмечали достоверно более активное уменьшение раневой поверхности по отношению к обеим группам сравнения на всех сроках наблюдения и полное заживление раны к 14-м суткам наблюдения у всех животных опытной группы 3 (см. табл. 1).
В опытной группе 4 раневую поверхность обрабатывали комплексным порошкообразным препаратом на основе наночастиц меди и серебра с добавлением оксида цинка (см. табл. 1). Уменьшение площади раневой поверхности также было достоверно выше, чем в обеих группах сравнения, и доказывало высокую регенеративную активность разработанных препаратов. На протяжении всего срока наблюдения бактериологические исследования подтверждали стерильность раневой поверхности.
Одной из основных планиметрических характеристик репаративной регенерации экспериментальной раны является скорость заживления ран (в мм2/сут.).
У животных группы сравнения 1, рана которых заживала естественным путем, до 5-х суток площадь раны не уменьшалась ввиду вторичного инфицирования аутофлорой кишечника, поэтому скорость заживления раны определить не представлялось возможным. Отмечали увеличение раневой поверхности на 32,8-46,9%. К 7-м суткам началось очищение раны от E. coli, вызвавшей вторичную контаминацию и препятствующей полноценной репаративной регенерации, поэтому отмечали увеличение скорости заживления раны, начиная с 7-х суток и к 14-м суткам она становилась максимальной, но полного заживления раны к 14-м суткам, как в опытных группах, не происходило (табл. 2).
Лечение банеоцином экспериментальной раны в группе сравнения 2 обеспечивало стабильную скорость заживления раны на протяжении всего периода наблюдения: 20,1–26,9 мм2/сут., что было обусловлено выраженным антибактериальным действием банеоцина и отсутствием вторичного инфицирования раны. Однако скорость заживления в этой группе была недостаточной для заживления раны к 14-м суткам, полное заживление раневой поверхности к этому сроку наступило только у 15 животных (см. табл. 2).
У животных опытной группы 3, раневую поверхность которых обрабатывали разработанным комплексным препаратом на основе наночастиц меди, серебра и порошкообразной основы (стерильный кукурузный крахмал), отмечали достоверно более высокую скорость заживления (p<0,001) по отношению к обеим группам сравнения. Максимальная скорость заживления наблюдалась на 5-е сутки наблюдения и составляла 98,7 мм2/сут. Скорость заживления раневой поверхности в этой группе была достаточной для полного заживление раны к 14-м суткам наблюдения у всех животных группы (см. табл. 2).
У животных, раневую поверхность которых обрабатывали разработанным модифицированным комплексным препаратом с введением в состав оксида цинка, скорость заживления раневой поверхности была максимально высокой уже на 5-е сутки наблюдения. К 7-м суткам эксперимента скорость заживления раны снизилась и достоверно не отличалась от показателей в группах сравнения. Это связано с тем, что у 16 животных опытной группы 4 уже произошло полное заживление ран, у четырех оставались раны небольшой площади, в то время как в группах сравнения к этому сроку только началось активное заживление раны. К 14-м суткам в опытной группе 4 раны
Скорость заживления условно-асептических ран
|
Группа животных |
Скорость заживления условно-асептических ран, мм2/сут, M± |
|||
|
Срок исследования, сутки |
||||
|
3-и |
5-е |
7-е |
14-е |
|
|
Группа сравнения 1, n=20 |
0,0 |
0,0 |
35,4±5,8 |
74,7±11,0 |
|
Группа сравнения 2, n=20 |
20,1±6,4 |
17,8±3,2 |
21,3±6,8 |
26,9±3,1 |
|
Опытная группа 3, n=20 |
34,5±5,8 |
98,7±6,7 |
61,3±7,1 |
0,0 |
|
p3-1=0,0000001 |
p =0,0000001 |
p =0,007671 |
p=0,0000001 |
|
|
p3-1=0,0000001 3-2 |
p3-1=0,000006 3-2 |
p=0,0000001 |
||
|
Опытная группа 4, n=20 |
46,3±8,9 p =0,0000001 p4-1 =0,048250 |
85,1±7,6 p =0,0000001 p4-1=0,0000001 |
39,5±8,1 |
0,0 p=0,0000001 p=0,0000001 |
П р и м еч а н и е : p — уровень достоверности различий показателей опытных групп по отношению к группам сравнения.
полностью зажили у всех животных, соответственно скорость заживления была равна нулю и достоверно (p<0,001) отличалась от высокой скорости заживления в группах сравнения в эти сроки (см. табл. 2). На протяжении всего срока наблюдения бактериологические исследования подтверждали стерильность раневой поверхности в обеих опытных группах.
Обсуждение . В работе проведен сравнительный анализ регенеративного действия двух разработанных порошкообразных препаратов на основе наночастиц меди и серебра по отношению к часто применяемому в практической медицине порошкообразному препарату на основе комбинации антибиотиков широкого спектра действия (банеоцину) в условиях экспериментальной условно-асептической раны. Проведенные планиметрические исследования (изменение площади раневой поверхности в динамике и скорость заживления раны) доказали, что разработанные препараты на основе наночастиц металлов и оксида цинка обладают более выраженным регенераторным эффектом, который является статистически достоверным (p<0,001). Анализ скорости заживления раневой поверхности наглядно показал, что наиболее активное заживление раневой поверхности под влиянием разработанных препаратов происходит в ранние сроки эксперимента — до 7-х суток наблюдения, что является важным для практического применения.
В качестве препарата сравнения был выбран порошкообразный препарат банеоцин с комбинацией антибиотиков в составе. Его регенеративное действие на экспериментальные раны было достоверно слабее, чем у разработанных препаратов, скорость заживления была постоянной на всех сроках наблюдения и оказалась недостаточной для полного восстановления повреждений к 14-м суткам наблюдения. Для обеспечения полноценной репаративной регенерации необходимо комплексное действие препарата, обязательно включающее антибактериальную активность. Наночастицы меди обладают высокой антимикробной активностью в отношении широкого спектра возбудителей раневой инфекции, что доказано рядом авторов и нашими предыдущими исследованиями [10]. У банеоцина антимикробное действие обеспечено комбинацией антибиотиков, что может оказывать отрицательное влияние на регенеративную активность препарата. Антибиотики, даже при местном применении, обладают рядом побочных действий, включающих аллергические эффекты, селекцию резистентных штаммов и, что особенно актуально при их местном использовании, вызывают подавление воспалительной реакции в ране и замедление репаративной регенерации. Вероятно, именно этот эффект мы и наблюдали в данном исследовании.
По результатам проведенных исследований доказано, что использование наночастиц меди, серебра и оксида цинка в составе комплексных порошкообразных препаратов для регенерации ран мягких тканей является более эффективным по сравнению с использованием антибиотиков, обладающих негативными свойствами, способными нарушать процессы репаративной регенерации. Отсутствие антибактериального компонента в составе комплексного препарата часто приводит к вторичному инфицированию и значительному замедлению заживления ран, что доказано исследованиями у животных группы сравнения 1.
Заключение. Исследования показали, что разработанные порошкообразные препараты на основе наночастиц меди, серебра и оксида цинка обладают регенерирующим и антимикробным действием и могут быть использованы при лечении повреждений мягких тканей. Регенеративное действие этих препаратов является более выраженным по сравнению с порошкообразными препаратами, содержащими антибиотики. Применение разработанных препаратов позволяет оптимизировать репаративную регенерацию, дает возможность не применять системную антимикробную терапию, предупреждает развитие побочных явлений и селекцию антибиотикорезистентных штаммов.
Список литературы Сравнительное изучение комплексных порошкообразных препаратов для регенерации мягких тканей
- Блатун Л.А. Местное медикаментозное лечение ран: проблемы и новые возможности их решения. Инфекция и антимикробная терапия 2011; 9(1): 25-29
- Богданец Л.И. Стимуляция ll-lll стадии регенерации венозных трофических язв гидроактивными раневыми покрытиями. Хирургия. Журн. им. Н.И. Пирогова 2014; 6:61-66
- Зорин В. Л., Зорина А. И., Черкасов В. Р. Анализ зарубежного рынка регенеративной медицины. Клеточная трансплантология и тканевая инженерия 2009; 3: 68-78
- Зорин A.H., Гузей Т.Н. Клинический опыт применения препарата банеоцин в терапии инфекционных поражений кожи. Клиническая дерматология и венерология 2005; 1: 65-67
- Притуло О. А. Клинический опыт применения препарата «Банеоцин» в наружной терапии бактериальных инфекций кожи. УкраТнський журнал дерматологи, венерологи, косметологи 2008; 2: 62-64
- Бабушкина И. В., Мамонова И.А., Гладкова Е.В. Этиологическая роль возбудителей хронического остеомиелита и влияние наночастиц меди на клинические штаммы Staphylococcus aureus. Вестник Пермского университета. Сер.: Биология 2014; 2: 52-56
- Мамонова И. А., Матасов М.Д., Бабушкина И. В. и др. Изучение физических свойств и биологической активности наночастиц меди. Российские нанотехнологии 2013; 8 (5-6): 25-29
- Бабушкина И. В., Чеботарева Е.Г., Бородулина Е.В. и др. Изучение влияния наночастиц металлов на чувствительность к антибиотикам клинических штаммов микроорганизмов. Вестник новых медицинских технологий 2011; 18 (3): 258-260
- Козлов P. С. Селекция резистентных микроорганизмов при использовании антимикробных препаратов: концепция «параллельного ущерба». Клиническая микробиология и антимикробная химиотерапия 2010; 12 (4): 284-294
- Бабушкина И. В., Дудакова Ю.С., Бородулин В. Б. и др. Антибактериальное действие наночастиц железа и меди на клинические штаммы Pseudomonas aeruginosa и Mycobacterium tuberculosis. Нано-техника 2009; 19: 69-71.


