Сравнительное изучение противоопухолевой активности липосомальных лекарственных форм препаратов производных нитрозоалкилмочевины
Автор: Ланцова А.В., Оборотова Н.А., Перетолчина Н.М., Полозкова А.П., Шпрах З.С., Шоуа И.Б., Барышников А.Ю.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 2 (14), 2005 года.
Бесплатный доступ
Лизомустин - оригинальный отечественный противоопухолевый препарат, хлорэтильное производное нитрозомочевины на основе L-гомоцитруллина, относится к группе нитрозоалкилмочевин (НАМ). БХНМ - 1,3-бис(2-хлорэтил)-1нитрозомочевина- воспроизведенная субстанция Кармустина (BiCNU). Препарат относится также к классу НАМ. Созданы пегилированные липосомы лизомустина и БХНМ, в составы которых включили ПЭГ-5000 или ПЭГ-2000-липиды. Противоопухолевая активность новых лекарственных форм изучена на модели экспериментальной опухоли мышей: лимфобластном лейкозе L-1210. Показано, что лизомустин в ПЭГ-5000 - липосомальной лекарственной форме (ЛЛФ-5000) в дозах от 125 до 250 мг/кг проявил максимальный противоопухолевый эффект в отношении лейкоза L-1210, при этом излечение животных составило 100 %, в то время как в ПЭГ-2000 - липосомальной лекарственной форме (ЛЛФ-2000) 100 % эффект получен лишь в дозе 175 мг/кг. БХНМ в ЛЛФ-5000 в дозах 40 и 45 мг/кг проявил максимальный терапевтический эффект, при этом излечение животных составило 100 %. Доза 50 мг/кг вызвала 100 % гибель животных из-за токсичности. При применении БХНМ в ЛЛФ-2000 форме 100% излечения не выявлено.
Короткий адрес: https://sciup.org/14054207
IDR: 14054207
Текст научной статьи Сравнительное изучение противоопухолевой активности липосомальных лекарственных форм препаратов производных нитрозоалкилмочевины
Лизомустин - 2-хлорэтилнитрозоуреидопроиз-водное аминокислоты лизин - относится к группе нитрозоалкилмочевин (НАМ) и представляет собой смесь двух изомеров (активного и малоактивного). Препарат синтезирован в Институте органического синтеза Уральского отделения РАН, лиофилизированная лекарственная форма для внутривенного введения разработана в ГУ РОНЦ им. Н.Н. Блохина РАМН. Клиническое изучение лизомустина показало эффективность препарата при мелкоклеточном раке легкого и меланоме кожи [1 ].
БХНМ -1,3 -бис(2-хлорэтил)-1 - нитрозомочевина — воспроизведенная субстанция Кармустина (BiCNU). Препарат синтезирован в лаборатории антиметаболитов Института химии Уральского отделения РАН. В ГУ РОНЦ им. Н.Н. Блохина разработана лекарственная форма данного препарата. Препарат относится к классу НАМ. В экспериментальных исследованиях высоко эффективен при опухолях мозга [3].
С целью увеличения селективности и пролонгирования противоопухолевого эффекта лизому-стина и БХНМ нами предпринята попытка создания новой лекарственной формы препарата в виде липосом. Липосомы - липидные везикулы, обладающие рядом достоинств. Благодаря своим коллоидным свойствам, контролируемым размерам, поверхнос- тным характеристикам, мембранотропности и биосовместимости липосомы рассматриваются как перспективные системы доставки препаратов в кровеносное русло. Универсальность свойств липосомального носителя обеспечивает широкие возможности его применения, особенно в химиотерапии рака, так как липосомы позволяют предотвратить быструю деградацию высокореактивных противоопухолевых препаратов в биологических субстратах организма [2].
Наряду с разработкой обычных липосом ("conventional"), в последние годы внимание ученых привлекают различные способы модификации поверхности липидных везикул с целью замедления захвата их клетками ретикулоэндотелиальной системы и пролонгирования времени циркуляции в кровотоке [4]. Известен способ видоизменения липосомальной поверхности полимерами с гибкой гидрофильной цепью. Для этого использовали синтетические липиды, коньюгированные с полиэтиленгликолем (ПЭГ). Включенные в липидный бислой молекулы ПЭГ способны создавать на мембране избыточное осмотическое давление, защищая тем самым липосомальные везикулы от опсонинов. Подобное покрытие позволяет липосомам дольше находиться в кровотоке, что повышает их противоопухолевую активность [5].
Цель настоящего исследования—изучить противоопухолевую активность лшюсомальных лекарственных форм Лизомустина и Бис(хлорэтил)нитро-зомочевины в зависимости от их состава.
Материалы и методы
Лизомустин-ФСП 42-0494-4519-03, ООО«АКА-ДЕМФАРМ».
Лизомустин лиофилизат для приготовления раствора для инъекций - ФСП 42-0105-0867-01, ООО ФИРМА «ГЛЕС».
БХНМ - 1,3-бис(2-хлорэтил)-1- нитрозомочевина - воспроизведенная субстанция Кармустина (BiCNU).
При проведении исследований использованы вспомогательные вещества, которые отвечали требованиям соответствующей нормативной документации: ГФ XI изданий, USP 24 NF 19, отдельных фармакопейных статей и ГОСТов.
-
1. Лецитин (Фосфотидилхолин) - Е-80 «Lipoid» (Германия).
-
2. Холестерин - «Lipoid» (Германия).
-
3. Кардиолипин - «Lipoid» (Германия).
-
4. Фосфотидилэтаноламинполиэтиленгликоль -2000 «Lipoid» (Германия).
-
5. Дистеароилфосфотидилэтаноламинполиэти-ленгликоль — 5000 — «Avanti Polar Lipids» (США).
-
6. Спирт этиловый 95 % - ФС 42-3072-00.
-
7. Антиоксидант- а-токоферол USP-NF (24).
-
8. Раствор глюкозы 5 % для инъекций.
-
9. Вода дистиллированная для инъекций, ФС 42-2620-98.
Упаковочный материал
Для упаковки липосомальных дисперсий использовали флаконы из дрота (стекло НС-1) вместимостью 20 мл (ТУ 64-2-10-87), которые укупоривали си-ликонированными резиновыми пробками по ИСО 8362-2 под обкатку алюминиевыми колпачками по ОСТ 64-009-86.
Приборы и аппаратура
В работе использовали вакуумный насос ВН-464А, испаритель ротационный ИР-1М, оборудование фирм «Миллипор» и «Nuclepore», прибор «На-носайзер» (Submicron Particle Sizer Nicomp 380, измеряющий размер наночастиц, США), мини-экструдер («Avanti Mini-Extruder» set № 610000, США).
-
1. Технологический метод получения пегилированных липосом Лизомустина
Малые однослойные пегилированные липосомы лизомустина получали гидратацией липидной пленки, образующейся после упаривания в вакууме спиртовых растворов липидов, 1% водным раствором субстанции лизомустина с последующей экструзией лшюсомальной дисперсии через поликарбонат-ные мембраны с уменьшающимся диаметром пор (1,2 мкм; 0,4 мкм; 0,2 мкм). В качестве липидной основы использовали лецитин (фосфотидилхолин), для стабилизации липидного бислоя и уменьшения "вытекания" включенного в липосомы препарата в липидную оболочку вводили холестерин и кардиолипин. Антиоксидант а-токоферол использовали для предотвращения перекисного окисления липидов. Для создания липосом с пролонгированным временем циркуляции в кровяном русле в составы липидных оболочек включали PEG 5000 DSPE и PEG 2000 РЕ.
-
2. Технологический метод получения пегилированных липосом БХНМ
Малые однослойные пегилированные липосомы БХНМ получали методом "обращения фаз". Субстанцию БХНМ вносили в хлороформную смесь липидов непосредственно перед первым вакуумным упариванием. Для создания липосом с пролонгированным временем циркуляции в кровяном русле в модельные смеси липидов включали PEG 5000 DSPE или PEG 2000 РЕ. Затем лшшдную пленку с дисперсией многослойных липосом БХНМ смывали эфиром и проводили повторное упаривание эфирной смеси под вакуумом. После водной регидратации липидной пленки липосомальную дисперсию пропускали через гомогенизатор, продавливая через поликар-бонатные мембраны с уменьшающимся диаметром пор (1,2 мкм; 0,4 мкм; 0,2 мкм).
-
3. Определение размера липосом
-
4. Биологический метод
Определение противоопухолевой активности новых липосомальных лекарственных форм Лизомус-тина и БХНМ проводили на экспериментальной модели опухоли мышей - лейкозе L-1210, мышах-гибридах BDF1, самцах.
Размер липосом определяли на спектрометре Nano-Sizer. Принцип работы прибора: определяется отраженный свет (под фиксированным углом) от совокупности частиц, суспендированных в водном растворителе. Интенсивность этого света колеблется во времени благодаря диффузии частиц. Существует четко определяемое характеристическое время жизни этих колебаний, которое обратно пропорционально диффузивности частиц. Далее просчитывается автокорреляционная функция флуктуирующей интенсивности и строится убывающая экспоненциальная кривая (зависимость от времени). После получения константы времени затухания г, рассчитывается диффузивность частиц. Наконец, с помощью уравнения Стокса-Энштейна рассчитывается радиус частиц:
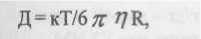
гдг К-кижтическаяюнстангаБольцмана(138х Ю^едк"1),
Т-температура (к = С°+273),
П t] -вязкость раствора (1,002 102для воды при20°С).
Все математические операции проводили на компьютере с помощью специальной программы. На экране автокорреляционного спектрометра наблюдали кривую распределения липосом по размерам частиц. Результат оценивали с помощью гауссовского анализа (обработка полученных данных методом наименьших квадратов - анализ по двум параметрам). Гауссовы популяции имели четко определяемый средний диаметр частиц. Однако этот подход используют только для простых распределений: симметричных унимодальных популяций. Аси-метричные унимодальные и бимодальные распределения невозможно интерпретировать с помощью гауссовского анализа. Единственным признаком наличия более сложного распределения является высокое и растущее значение квадратичного отклонения (А!2). Эти распределения оценивают с помощью никомповского анализа. Nicomp-анализ дает в результате 3 или 4 параметра, по которым можно судить о распределении липосом в образце (в %).
Лейкоз прививали внутрибрюшинно по 1,01,2 х 106 клеток/мышь в 0,3 мл среды 199. Лечение начинали через 48 ч после трансплантации опухоли. Препараты вводили внутрибрюшинно, однократно. Лизомустин в липосомальной лекарственной форме с PEG 5000 (состав 1) и с PEG 2000 (состав 2) (концентрация 10 мг/мл) вводили животным в дозах 100, 125,150,175,200,225 и 250 мг/кг. БХНМ в липосомальной лекарственной форме с PEG 5000 (состав 1) и с PEG 2000 (состав 2) (концентрация 2 мг/мл) - в дозахЗО, 35,40,45 и 50 мг/кг.
Терапевтический эффект оценивали по двум критериям: увеличению продолжительности жизни леченых животных (УПЖ, %) и излечению животных.
-
1. УПЖ вычисляли по формуле:
-
2. Излечение животных: n/п,, где п/п,- число излеченных мышей к общему числу животных в группе. Излеченными считали животных, не имею щих рецидивов заболевания после окончания лече ния в течение 2 мес и более.
СПЖо-СПЖк
УПЖ=------------------------хЮ0%,
СПЖк где СПЖ0 и СПЖк - продолжительность жизни испытуемых мышей в опытных и контрольных группах, соответственно.
Статистическую обработку полученных результатов проводили по критериям Стьюдента (параметрический) и Колмогорова - Смирнова (непараметрический).
Результаты и обсуждение
Как видно из табл. 1, лизомустин в ЛЛФ-5000 в
Получено два состава липосом с различными ПЭГ липидами. В результате разработки липосомальных лекарственных форм состава-1 Лизомустина и БХНМ в липидную мембрану включили PEG 5000 В8РЕ(ЛЛФ-5000),авсссгав-2-РШ2000РЕ(ЛЛФ-20(Ю).
Лизомустин - водорастворимый препарат, это позволило включить его во внутреннее водное пространство липосом. БХНМ хорошо растворим в органических растворителях, и поэтому был включен в липидный бислой.
В результате проведенных технологических исследований установлено оптимальное молярное соотношение компонентов, включенных в модельные составы липосомального лизомустина и БХНМ.
Состяв-1 (ЛЛФ-5000) для лизомустина: для БХНМ:
Лизомустин БХНМ
Лецитин Лецитин
Холестерин Холестерин
Кардиолипин Кардиолипин
Диете ароилфосфотидилэтаноламин
Дистеароилфосфотидилэтаноламин полиэтиленгликоль 5000 полиэтиленгликоль 5000
а-токоферол
а-токоферол
Состав-2
для лизомустина: Лизомустин
Лецитин
Холестерин Кардиолипин Кардиолипин Фосфотидилэтаноламин полиэтиленгликоль 2000 а-токоферол
(ЛЛФ-2000)
для БХНМ:
БХНМ
Лецитин
Холестерин
Фосфотидилэтаноламин полиэтиленгликоль 2000
а-токоферол
Первичную стандартизацию липосомалышх дисперсий проводили по следующим критериям качества: внешний вид, размер липидных везикул и противоопухолевая активность. Дисперсии липосом ли-зомустина и БХНМ по внешнему виду не различались - молочно-белые эмульсии, однородные, без расслоения.
При введении лизомустина в ЛЛФ-5000 сразу получены мелкие липосомы — 155 ±23 нм, поэтому в дальнейшем данные липосомы не измельчали экструзионным методом. Для ЛЛФ-2000 лизомустина первоначальный размер липосом составил 980 ± 34 нм, после экструзии —105 ± 30 нм. Размер липосом для БХНМ в ЛЛФ-5000 - 240 ± 28 нм, данные липосомы дополнительно не измельчали. Для БХНМ в ЛЛФ-2000 первоначальный размер составил 1535 ± 30 нм, после гомогенизации -140 ± 21 нм, соответственно.
В табл. 1 представлены результаты изучения противоопухолевой активности ПЭГ липосом лизомус-
Таблица I
Противоопухолевая активность липосомального лизомустииа на лейкозе L-1210
|
Группа опыта |
Доза, мг/кг, в/б х 1 раз |
УПЖ,% животных, погибших от лейкоза |
Излечение ЖИВОТНЫХ, П/П|. (%) |
|
ЛЛФ-5000 |
100 |
357(1/5) |
4/5(80) |
|
липосомальная |
125 |
—- |
6/6(100) |
|
лекарственная |
150 |
— |
5/5(100) |
|
форма |
175 |
— |
5/5(100) |
|
литомусгина |
200 |
— |
5/5(100) |
|
225 |
— |
5/5(100) |
|
|
250 |
— |
5/5(100) |
|
|
ЛЛФ-2000 |
100 |
178,5(2/5) |
3/5(60) |
|
липосомальная |
125 |
385,5(2/5) |
3/5(60) |
|
лекарственная |
150 |
386(1/5) |
4/5(80) |
|
форма |
175 |
* |
5/5(100) |
|
лизомустина |
200* |
— |
4/5(80) |
|
225* |
614(1/5) |
3/5(60) |
|
|
250* * |
- |
3/5(60) |
Примечание: Контроль 1 - нелеченые мыши, средняя продолжительность жизни мышей 7,3 дня; контроль 2 - мышам вводили пустые липосомы, средняя продолжительность жизни 7 дней.
• В данных группах 20 % мышей пали от токсичности.
♦* В данной группе 40 % мышей пали от токсичности.
Данные статистически достоверны, р<0,05 по отношению к контролю.
дозах от 125 до 250 мг/кг на мышах с лейкозом L-1210 проявил самый высокий терапевтический эффект. В указанных дозах излечение мышей составило 100 %. Гибели животных от токсичности не выявлено. Ли-зомустин в ЛЛФ-2000 излечивал 100 % животных с лейкозом только в дозе 175 мг/кг. В дозах 100; 125 и 150 мг/кг излечение животных составляло 60, 60 и 80 %, соответственно. Дозы 200 и 225 мг/кг — токсичны для 20 %, доза 250 мг/кг - для 40 % мышей.
Данные табл. 2 показывают, что БХНМ в ЛЛФ-5000 и ЛЛФ-2000, примененный в дозах 30-35 мг/кг, проявлял смешанный эффект, выраженный как увеличением продолжительности жизни, так и излечением части животных. БХНМ в ЛЛФ-5000 в дозах 40 и 45 мг/кг проявил максимальный терапевтический эффект, при этом излечение животных составило 100 %. Доза 50 мг/кг оказалась летальной для 100 % мышей. При применении БХНМ в ЛЛФ-2000 форме 100% излечения не выявлено. Частичное излечение животных (17 %) наблюдали в дозах 40-45 мг/кг, в дозе 50 мг/кг излечение животных увеличивалось до 33 %, однако оно сопровождалось гибелью 17 % мышей от токсичности.
Таблица 2
Противоопухолевая активность липосомального БХНМ на лейкозе L-1210
|
Группа опыта |
Доза, мг/кг, В/6Х1 раз |
УПЖ.% животных, погибших от лейкоза |
Излечение животных, п/П! (%) |
|
ЛЛФ-5000 |
30 |
160(6/6) |
— |
|
липосомальная |
35 |
111(3/5) |
2/5(40) |
|
лекарственная |
40 |
— |
6/6(100) |
|
форма БХНМ |
45 |
— |
5/5(100) |
|
50» |
—. |
— |
|
|
ЛЛФ-2000 |
30 |
104,9(5/6) |
1/6(17) |
|
липосомальная |
35 |
123,3(6/6) |
— |
|
лекарственная |
40 |
144(5/6) |
1/6(17) |
|
форма БХНМ |
45 |
166(5/6) |
1/6(17) |
|
50** |
124(3/6) |
2/6(33) |
Примечание: контроль 1 - нелеченые мыши, средняя продолжительность жизни мышей 8,6 дня; контроль 2 - мышам вводили пустые липосомы, средняя продолжительность жизни 8,2 дня
-
•В данной группе 100 % мышей погибли от токсичности.
-
** В данной группе 17 % мышей погибли от токсичности.
Данные статистически достоверны, р < 0,05 по отношению к контролю.
Таким образом, проведенные исследования показали, что лизомустин и БХНМ в новой ЛЛФ-5000 оказались наиболее эффективными. Лизомустин, примененный в ЛЛФ-5000, позволяет расширить диапазон доз от 125 до 250 мг/кг, излечивающих 100 % животных без проявления токсичности. Как показали ранее проведенные исследования, лизомустин в лиофилизированной лекарственной форме излечивал 100%животныхслейкозомЬ-1210тольковдозах 150 и 175 мг/кг. БХНМ в ЛЛФ-5000 показала большую эффективность по сравнению с ЛЛФ-2000 БХНМ (100 % излечение в дозах 40-45 мг/кг).
Выводы
-
1. Разработаны новые лекарственные формы Ли-зомустина и БХНМ в виде пегилированных липосом.
-
2. Показан высокий противоопухолевый эффект лизомустина в ЛЛФ-5000 липосомах во всех тести руемых дозах (125-250 мг/кг).
-
3. Лизомустин в ЛЛФ-5000 является более эф фективной лекарственной формой, чем ЛЛФ-2000, и позволяет расширить диапазон терапевтических доз и снизить токсичность препарата.
-
4. БХНМ в ЛЛФ-5000 вызвала 100% излечение животных от лейкоза L-1210 в дозах 40 и 45 мг/кг.


