Сравнительное изучение ультраструктуры сперматозоидов в эпидидимальной, эякулированной и криоконсервированной сперме жеребцов
Автор: Атрощенко М.М., Калашников В.В., Брагина Е.Е., Зайцев А.М.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Криорезистентность сперматозоидов
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Криоконсервация спермы - важный прием сохранения генетических ресурсов животных. В коневодстве этот вопрос актуален в большей степени, чем в других отраслях животноводства, так как в настоящее время численность многих пород лошадей (особенно уникальных пород отечественной селекции) приближается к критическому уровню. Для ряда аборигенных пород из-за особенностей табунно-тебеневочной технологии содержания невозможно получение спермы для криоконсервации традиционным методом, и единственным экономически оправданным способом создания криобанков остается получение эпидимального семени. Технология получения и криоконсервации спермы производителей включает ряд критических этапов, характеризующихся снижением ее качества. К ним можно отнести процедуру взятия, разбавление, температурный шок при замораживании и оттаивании. В работе нами впервые проведено сравнительное изучение ультраструктуры эякулированных и эпидидимальных сперматозоидов у одних и тех же жеребцов, что исключило влияние особенностей организма разных особей на сопоставляемый признак. С использованием электронной микроскопии показано, что на всех этапах работы со спермой наиболее уязвимым органоидом были акросомы. Преобладающей патологией при получении и криоконсервации спермы оказалось отсутствие внутреннего содержимого акросом, что ведет к их ферментной недостаточности. Частота этой патологии в свежеполученной эпидидимальной сперме составила 12,4 %, в эякулированной - 14,0 %, после замораживания и оттаивания анализируемый показатель увеличивался практически двукратно, достигая соответственно 26,5 и 27,4 %. Доля спермиев со второй по распространенности патологией - деградацией акросомы (преждевременным высвобождением ферментов, растворяющих оболочку яйцеклетки, вследствие чего утрачивается способность сперматозоида к оплодотворению) при криоконсервации возрастала на 5,9 % (p
Жеребцы, электронная микроскопия, эпидидимальная сперма, эякулированная сперма, криоконсервация
Короткий адрес: https://sciup.org/142214025
IDR: 142214025 | УДК: 636.1:591.463.1:57.086.8 | DOI: 10.15389/agrobiology.2017.2.274rus
Текст научной статьи Сравнительное изучение ультраструктуры сперматозоидов в эпидидимальной, эякулированной и криоконсервированной сперме жеребцов
Искусственное осеменение кобыл свежеразбавленной, охлажденной и криоконсервированной спермой позволяет наиболее широко использовать генетический потенциал жеребцов (1). Метод криоконсервации спермы и технологии повышения репродуктивного статуса жеребцов-производителей важны при сохранении генетического разнообразия и селекционной работе в коневодстве. Преимущества криоконсервации очевидны: ее применение позволяет создавать банки спермы высокоценных производителей, в течение долгого времени сохранять генетический материал для селекции, транспортировать сперму на большие расстояния (2).
Для криоконсервации эякулированной спермы жеребцов разрабо-
∗ Исследования проводились при поддержке Российского научного фонда (проект ¹ 17-16-01109).
таны и успешно применяются различные технологии (3-5). Тем не менее, получение и криоконсервация спермы жеребцов-производителей включает ряд критических этапов, на которых качество спермы снижается (6). К ним можно отнести процедуру взятия, разбавление, температурный шок при замораживании и оттаивании. В ряде случаев объективно возникает необходимость в криоконсервации эпидидимального семени, например при гибели высокоценных жеребцов или травмах с неблагоприятным прогнозом к выздоровлению (7-9). Для некоторых уникальных аборигенных пород с табунно-тебен¸вочным содержанием использование эпидидимального семени — единственное экономически оправданное мероприятие при формировании криобанков.
Главная проблема при криоконсервации спермы — ее качество после оттаивания (10). В основном оно ухудшается вследствие уменьшения количества активных сперматозоидов с прямолинейно-поступательным движением, снижения выживаемости спермиев и их структурных нарушений. Морфология сперматозоидов, наряду с подвижностью и выживаемостью, относится к важнейшим показателям качества спермы (11). Увеличение доли аномальных половых клеток в эякуляте в разной степени связано с меньшей плодовитостью жеребцов (12-14). Вследствие ряда биологических особенностей таких сперматозоидов их оплодотворяющая способность снижена (15). Обычно сперму изучают с помощью световой микроскопии, что не позволяет выявить значительную часть ультраструктур-ных повреждений в сперматозоидах. При низкой фертильности жеребцов рекомендуется проводить дополнительные исследования спермы (16), в частности электронную микроскопию (17). На сегодняшний день это наиболее точный метод ультраструктурного анализа (18), применяемый для определения этиопатогенеза патозооспермии, функционального состояния сперматозоидов и диагностики нарушений в половых клетках вследствие криоконсервации.
Сперматозоиды из семявыносящих канальцев поступают в эпидидимис, где происходит их окончательное созревание и приобретается способность к оплодотворению (19-22). В придатках семенников в общей сложности содержатся от 15 до 25 млрд сперматозоидов (23, 24). Поэтому извлечение сперматозоидов из эпидидимиса позволяет получать достаточное количество половых клеток для искусственного осеменения как све-жеразбавленной, так и охлажденной и криоконсервированной спермой.
Подвижность, морфологию, целостность ДНК, жизнеспособность сперматозоидов в эякулированной и эпидидимальной сперме исследовали многие авторы (7, 24-26). Примененные нами впервые методические подходы позволили провести сравнительный анализ ультраструктуры половых клеток (при разных способах получения и после криоконсервации) на биологическом материале от одних и тех же жеребцов, что исключало влияние индивидуальных особенностей разных особей на сопоставляемый признак. Это дает новые знания о состоянии и сохранности органоидов при замораживании-оттаивании эпидидимальных и эякулированных сперматозоидов.
Целью настоящей работы было сравнение ультраструктуры сперматозоидов из эпидидимиса и эякулята, подвергнутых криоконсервации, и диагностика основных патологий органоидов.
Методика. Эякулированную сперму получали с интервалом 48 ч с помощью искусственной вагины у 5 жеребцов разных пород в возрасте от 5 до 8 лет (показатели спермы первых двух эякулятов после периода полового покоя при обработке данных не учитывали). Эякуляты оценивали по объему, содержанию, подвижности, морфологии (27), выживаемости сперматозоидов при температуре 2-4 °С, по времени сохранения их подвижности (3). При разбавлении спермы использовали лактозо-хелато-цитратно-желточную (ЛХЦЖ) среду в объемном соотношении 1:3 (3). Сперму замораживали в парах жидкого азота по стандартной технологии Всероссийского НИИ коневодства и хранили в жидком азоте при температуре -196 °С. После отбора эякулированного семени жеребцов кастрировали для получения эпидидимальной спермы, которую разбавляли и замораживали по той же технологии.
Для проведения электронной микроскопии нативные и криокон-сервированные образцы эякулированной и эпидидимальной спермы разводили изотоническим раствором NaCl в соотношении 1:10, добавляли фиксатор — 2,5 % раствор глутарового альдегида («Ted Pella Inc.», США), приготовленный на 0,1 М какодилатном буфере (pH 7,2) («Sigma», США), центрифугировали 15 мин при 1000 об/мин, удаляли надосадочную жидкость, осадок фиксировали тем же фиксатором, дофиксировали 1 % раствором осмиевой кислоты («Serva», Германия) и заливали в эпон («Fluka», Германия). Ультратонкие срезы получали на микротоме UltraCut III («Reichert Jung Optische Werke AG», Австрия), докрашивали водным раствором уранилацетата и цитратом свинца («Serva», Германия) и просматривали в электронном микроскопе Hitachi 700 (Япония). Общий вид сперматозоидов изучали при увеличении ½5000, акросомы, хроматин ядра и митохондрии — при ½16000-18000, аномалии аксонемы на поперечных срезах жгутиков — при ½20000-25000. В каждом образце анализировали не менее 150 половых клеток.
Данные обрабатывали общепринятыми методами вариационной статистики. В таблице представлены средние ( Х ) и стандартные ошибки средних ( х ). Достоверность различий определяли с помощью t -критерия Стьюдента. Статистически значимыми считались различия при p < 0,05.
Результаты . В полученных эякулятах объем в среднем составил 54,8±8,8 мл, содержание сперматозоидов — 184,5±23,7 млн/мл, активность — 4,4±0,3 балла, выживаемость при температуре 2-4 ° С — 125,2±8,4 ч; после криоконсервации активность снизилась до 1,8±0,2 балла, выживаемость — до 59,2±14,7 ч. Доля морфологически нормальных сперматозоидов в нативной сперме достигала 71,4±4,4 %, в криоконсервированной — 68,4±4,0 %.
Доля (%) сперматозоидов с нормальной морфологией в свежеполученной и криокон-сервированной эякулированной и эпидидимальной сперме жеребцов ( n = 5, Х ± х )
|
Морфологический признак |
Эпидидимальная сперма |
Эякулированная сперма |
||
|
при получении |
после оттаи вания |
при получении |
после оттаи вания |
|
|
Интактная головка |
76,1±4,2 |
64,4±6,1 |
73,6±4,2 |
57,2±7,3 |
|
Присутствие акросомы |
98,5±0,5 |
92,6±1,3 |
98,0±0,7 |
89,1±1,9 |
|
Нормальное положение акросомы |
99,2±0,8 |
98,2±1,6 |
98,4±0,7 |
91,8±3,7 |
|
Нормальная форма акросомы |
94,4±1,6 |
87,8±2,9 |
91,6±1,5 |
87,0±2,9 |
|
Компактное содержимое акросомы |
87,6±3,3 |
73,5±5,2 |
86,0±3,7 |
72,6±6,7 |
|
Нормальная форма ядра |
99,6±0,2 |
97,3±1,2 |
98,3±1,3 |
93,7±3,3 |
|
Нормальные митохондрии |
97,1±1,3 |
90,3±1,4 |
93,7±2,3 |
88,0±2,1 |
|
Нормальные аксонемы |
91,5±2,3 |
84,7±4,5 |
88,3±2,9 |
84,8±4,1 |
|
Нормальные наружные плотные фибриллы |
99,5±0,5 |
98,9±1,1 |
98,8±1,2 |
98,7±1,3 |
|
Нормальная фиброзная оболочка |
100 |
99,0±1,1 |
100 |
98,0±2,0 |
Использование эякулированной и эпидидимальной спермы от одних и тех же жеребцов позволило сравнить повреждения половых клеток после криоконсервации в зависимости от способа отбора образцов. Один из основных показателей качества спермы, определяемых с помощью 276
электронной микроскопии, — количество сперматозоидов с интактными головками (рис. 1), имеющими нормальные акросомы, форму и хроматин ядра (18). В эпидидимальной сперме доля таких сперматозоидов составила 76,1 %, после эякуляции — снижалась на 2,5 % (табл.). При замораживании-оттаивании эякулированной спермы число сперматозоидов с интактными головками уменьшалось еще на 16,4 % и составило в среднем 57,2 %. В криоконсервированной эпидидимальной сперме количество сперматозоидов с интактными головками (64,4 %) было на 7,2 % выше, чем в замороженной эякулированной.
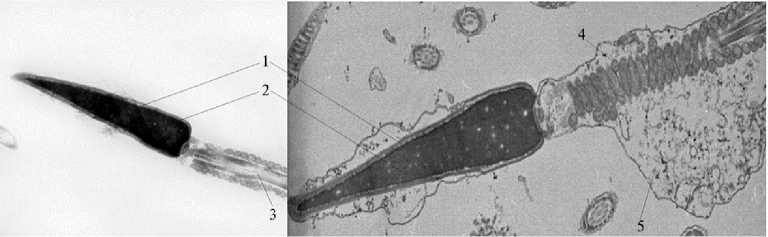
Рис. 1. Нормальный сперматозоид жеребца (слева) и сперматозоид с ассиметричной цитоплазматической каплей (справа) : 1 — акросома, 2 — хроматин, 3 — продольный срез через аксо-нему жгутика, 5 — цитоплазматическая капля. Электронный микроскоп Hitachi 700 (Япония), увеличение ½5000-25000.
Из патологий головок сперматозоидов при получении и криоконсервации спермы отмечали увеличение числа сперматозоидов с деградацией акросомы в результате преждевременной акросомной реакции, с гипоплазией акросомы (некомпактное содержимое акросомы), изменениями формы ядра, вакуолизацией хроматина.
В основном при криоконсервации как эякулированной, так и эпидидимальной спермы жеребцов повреждалась акросома (рис. 2, 3). В эпидидимальной сперме она присутствовала у 98,5 % сперматозоидов, в эякуляте и после замораживания-оттаивания доля сперматозоидов с прореагировавшей акросомой (с деградацией акросомы) возрастала на 9,4 %. При замораживании и последующем оттаивании количество сперматозоидов с деградацией акросомы в эпидидимальной сперме увеличивалось на 5,9 % (p < 0,05), в эякулированной — на 8,9 % (p < 0,01).
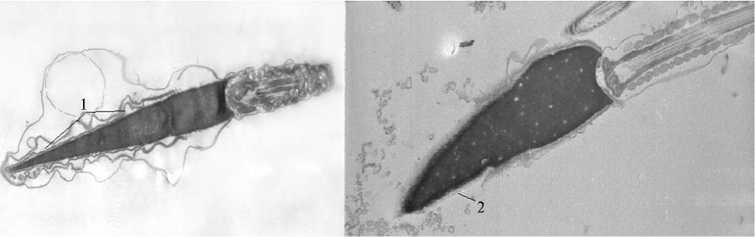
Рис. 2. Сперматозоид жеребца с «пустой» акросомой (слева) и сперматозоид с прореагировавшей акросомой (после прошедшей акросомной реакции) (справа) : 1 — акросома с электронно-прозрачным содержимым («пустая») и неровными контурами, 2 — остаточный материал прореагировавшей акросомы. Электронный микроскоп Hitachi 700 (Япония), увеличение ½16000-18000.
К наиболее распространенным патологиям при криоконсервации также относилось увеличение числа сперматозоидов с гипоплазией акро- сом и отсутствием содержимого (акросомы с электронно-прозрачным содержимым). В криоконсервированном эякуляте доля сперматозоидов с некомпактным содержимым акросомы возрастала на 13,4 %, после замораживания и оттаивания эпидидимальной спермы — на 14,1 %.
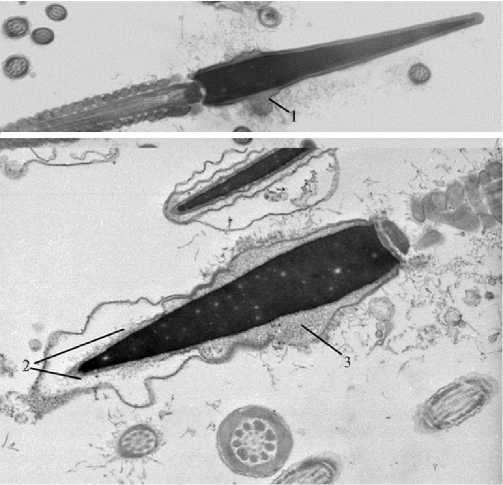
Рис. 3. Начальная стадия повреждения акросомы сперматозоида жеребца: 1 — зоны диффузного расширения акросомы с волокнистым содержимым, 2 — участок расширенной акро-сомы с электронно-прозрачным содержимым («пустая» ак-росома), 3 — участок расширенной акросомы с волокнистым содержимым. Электронный микроскоп Hitachi 700 (Япония), увеличение ½16000-18000.
Воздействие криоконсервации на ядро сперматозоидов было минимальным: изменения формы ядра отмечали при получении и криоконсервации спермы в среднем всего у 5,9 % клеток. В свежеполучен-ной сперме сперматозоиды с вакуолизированным хроматином ядра не встречались, после криоконсервации их выявили в небольшом количестве (от 1,6 до 6,1 %) в образцах от двух жеребцов.
В эпидидимальной сперме доля сперматозоидов с нормальными митохондриями составила 97,1 %, в эякуляте — 93,7 %. Таким образом, при получении спермы и ее первичной обработке число спер- матозоидов с поврежденными митохондриями увеличилось на 3,4 %, при криоконсервации — еще на 5,7 %, в результате митохондрии оказались повреждены у 9,1 % сперматозоидов. По росту числа аномалий митохон- дрий при криоконсервации эпидидимальной спермы по сравнению со све-жеполученной достоверность различий была достаточно высока (p < 0,05).
Морфологические аномалии аксонемы тесно взаимосвязаны с низкой фертильностью и бесплодием (27). Поэтому исследование целостности аксонем — один из обязательных этапов при электронно-микроскопическом исследовании эякулята. Аксонема как у эпидидимальных, так и у эякулированных сперматозоидов оказалась весьма устойчива к криоконсервации. От получения спермы до ее замораживания и последующего оттаивания число сперматозоидов с анормальной формой жгутика увеличивается на 6,7 %, что существенно ниже аналогичного показателя для повреждений митохондрий и особенно акросомы.
Наружные плотные фибриллы и фиброзная оболочка аксонемы сперматозоидов жеребцов тоже устойчивы к внешним воздействиям: как было показано, они практически не повреждаются ни при получении спермы, ни при замораживании-оттаивании.
В целом, результаты диагностики ультраструктурных аномалий в эпидидимальных и эякулированных спермиях продемонстрировали, что при получении спермы на искусственную вагину повреждения органоидов половых клеток минимальны, а основные структурные изменения происходят при криоконсервации. Подтверждение высокой сохранности эпиди- димальных сперматозоидов, а также их устойчивости к криоконсервации позволяет сделать позитивный прогноз по разработке и применению технологии криоконсервации эпидидимальной спермы жеребцов.
Итак, ультраструктурная целостность органоидов в половых клетках жеребцов в эпидидимальной сперме выше, чем в эякулированной, однако эти различия недостоверны. В меньшей степени ультраструктурные повреждения сперматозоидов происходят при получении спермы, в большей — в процессе ее криоконсервации. При замораживании и оттаивании как эпидидимальной, так и эякулированной спермы наиболее уязвима акросома сперматозоидов, менее чувствительны митохондрии, тогда как аксонема, наружные плотные фибриллы и фиброзная оболочка аксонемы достаточно устойчивы, а воздействие на ядро сперматозоидов минимально.
Список литературы Сравнительное изучение ультраструктуры сперматозоидов в эпидидимальной, эякулированной и криоконсервированной сперме жеребцов
- Науменкова В.А., Атрощенко М.М., Лебедева Л.Ф., Халилов Р.А., Рябова Т.Н. Изучение длительности сроков хранения семени жеребцов в состоянии анабиоза. Коневодство и конный спорт, 2013, 5: 15-17.
- Лебедева Л.Ф., Атрощенко М.М., Бурмистрова С.А. Основные факторы, влияющие на результативность осеменения кобыл спермой, криоконсервированной по российским и зарубежным технологиям. Сельскохозяйственная биология, 2015, 50(4): 476-485 ( ) DOI: 10.15389/agrobiology.2015.4.476rus
- Науменков А.И., Романькова Н.К. Лактозо-хелато-цитратно-желточный разбавитель спермы жеребца. В сб.: Теория и практика совершенствования пород лошадей (научные труды ВНИИК, Дивово), 1971, XXV: 128-132.
- Loomis P.R., Amann R.P., Squires E.L., Pickett B.W. Fertility of unfrozen and frozen stallion spermatozoa extended in EDTA-lactose-egg yolk and packaged in straws. J. Anim. Sci., 1983, 56(3): 687-693 ( ) DOI: 10.2527/jas1983.563687x
- Martin J.C., Klug E., Gunzel A.R. Centrifugation of stallion semen and its storage in large volume straws. J. Reprod. Fertil., 1979, 27: 47-51.
- Atroshchenko M.M., Bragina E.E. Change in the ultrastructure of stallion spermatozoa under the effect of cryopreservation. Russian Agricultural Sciences, 2011, 37(2): 175-178 ( ) DOI: 10.3103/S1068367411020029
- Guimarães T., Lopes G., Ferreira P., Leal I., Rocha A. Characteristics of stallion epididymal spermatozoa at collection and effect of two refrigeration protocols on the quality of the frozen/thawed sperm cells. Anim. Reprod. Sci., 2012, 136: 85-89 ( ) DOI: 10.1016/j.anireprosci.2012.10.028
- Parra-Forero L.Y., Mendoza G.D., Góngora A., López Fernández M.D.C., Cruz L.A., Montiel A.J., Kjelland M.E., García-Contreras A.D.C. Azteca breed horse epididymal sperm evaluation: a comparison of head, corpus and cauda sperm quality. Advances in Reproductive Sciences, 2015, 3: 57-65 ( ) DOI: 10.4236/arsci.2015.33007
- Roels K., Leemans B., Ververs C., Govaere J., Hoogewijs M., Van Soom A. Collection and freezing of equine epididymal spermatozoa. Vlaams Diergeneeskundig Tijdschrift, 2014, 83: 321-325.
- Magistrini M., Chanteloube Ph., Palmer E. Influence of season and frequent of ejaculation on production of stallion semen for freezing. J. Reprod. Fertil., 1987, Supp. 35: 127-133.
- Kenney R.M., Hurtgen J.P., Pierson R., Witherspoon D., Simons J. Manual for clinical fertility evaluation of the stallion. Journal of Society for Theriogenology, 1983, 9: 3-100.
- Bielanski W., Kaczmarski F. Morphology of spermatozoa in semen from stallions of normal fertility. J. Reprod. Fertil., 1979, Suppl. 27: 39-45.
- Hurtgen J.P., Johnson L.A. Fertility of stallions with abnormalities of the sperm acrosome. J. Reprod. Fertil., 1982, Suppl. 32: 15-20.
- Jasko D.J., Lein D.H., Foote R.H. Determination of the relationship between sperm morphologic classifications and fertility in stallions: 66 cases (1987-1988). J. Am. Vet. Med. Assoc., 1990, 197: 389-394.
- Angelopoulos T., Moshel Y.A., Lu L., Macanas E., Grifo J.A., Krey L.C. Simultaneous assessment of sperm chromatin condensation and morphology before and after separation procedures: effect on the clinical outcome after in vitro fertilization. Fertil. Steril., 1998, 69: 740-747.
- Colenbrander B., Gadella B.M., Stout T.A. The predictive value of semen analysis in the evaluation of stallion fertility. Reprod. Domest. Anim., 2003, 38(4): 305-311 ( ) DOI: 10.1046/j.1439-0531.2003.00451.x
- Pesch S., Bostedt H., Failing K., Bergmannc M. Advanced fertility diagnosis in stallion semen using transmission electron microscopy. Anim. Reprod. Sci., 2006, 91(3-4): 285-298 ( ) DOI: 10.1016/j.anireprosci.2005.04.004
- Брагина Е.Е., Абдумаликов Р.А., Курило Л.Ф., Шилейко Л.В. Электронно-микроскопическое изучение сперматозоидов человека и его роль в диагностике мужского бесплодия. Проблемы репродукции, 2000, 6: 62-71.
- Amann R., Hammerstedt R., Veeramachaneni D. The epididymis and sperm maturation: a perspective. Reproduction, Fertility and Development, 1993, 5: 361-381.
- Johnson L., Amann R., Pickett B. Maturation of equine epididymal spermatozoa. Am. J. Vet. Res., 1980, 41: 1190-1196.
- Auger J., Dadoune J.-P. Nuclear status of human sperm cells by transmission electron microscopy and image cytometry: changes in nuclear shape and chromatin texture during spermiogenesis and epididymal transit. Biol. Reprod., 1993, 49(1): 166-175.
- Cornwall G.A. New insights into epididymal biology and function. Hum. Reprod. Update, 2009, 15: 213-227 ( ) DOI: 10.1093/humupd/dmn055
- Bruemmer J.E. Collection and freezing of epididymal stallion sperm. The Veterinary clinics of North America: Equine Practice, 2006, 22: 677-682 ( ) DOI: 10.1016/j.cveq.2006.08.007
- Monteiro G., Papa F., Zahn F., Dellaqua J. Jr., Melo C., Maziero R., Avanzi B., Alvarenga M., Guasti P. Cryopreservation and fertility of ejaculated and epididymal stallion sperm. Anim. Reprod. Sci., 2011, 127: 197-201 ( ) DOI: 10.1016/j.anireprosci.2011.08.002
- Weiss R.R., Muradas P.R., Graneman L.C., Meira C. Freezing sperm from cauda epididymis of castrated stallions. Animal Reproduction Science, 2008, 107: 356 ( ) DOI: 10.1016/j.anireprosci.2008.05.133
- Garcia-Macias V., Martinez-Pastor F., Alvarez M., Garde J.J., Anel E., Anel L., de Paz P. Assessment of chromatin status (SCSA®) in epididymal and ejaculated sperm in Iberian red deer, ram and domestic dog. Theriogenology, 2006, 66: 1921-1930 ( ) DOI: 10.1016/j.theriogenology.2006.05.011
- Хаят С.Ш., Брагина Е.Е., Курило Л.Ф. Ультраструктурное исследование сперматозоидов у пациентов с астенозооспермией. Андрология и генитальная хирургия, 2012, 4: 54-61 ( ) DOI: 10.17650/2070-9781-2012-4-54-61


