Сравнительное экспериментальное исследование использования препаратов "TachoComb" и "Perclot" при резекции печени у свиней
Автор: Восканян С.Э., Каркищенко В.Н., Артемьев А.И., Колышев И.Ю., Шабалин М.В., Марисов Л.В.
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Предпосылки и цели: на данный момент существует большое количество доступных методов достижения гемостаза в хирургии печени, однако их эффективность для предотвращения развития билиарных осложнений не удовлетворяет хирургов. Материалы и методы: экспериментальное исследование было выполнено на 15 лабораторных мини-cвиньях мужского пола. Всем животным была выполнена однотипная резекция печени, после чего линия резекция покрывалась в группе 1 препаратом «TachoComb», в группе 2 препаратом «PerClot», в 3-ей группе резекция печени выполнялась при помощи диодного лазера. Результаты: основными параметрами исследования были кровотечение в раннем послеоперационном периоде, подтекание желчи с линии резекции печени, биодеградация препарата и выраженность спаечного процесса. Существенной разницы по первым двум параметрам в 3 группах получено не было. Ни одного случая подтекания желчи с линии резекции получено не было, однако в группе 1 и 2 наблюдалась ранняя деградация препарата, что сыграет негативную роль в предотвращении развития желчного свища. Результаты операции в группе 3 оказались более предпочтительными в отношении развития спаечного процесса. Выводы: препараты «Tachocomb», «PerClot» являются доступными и эффективными средствами для предотвращения послеоперационных кровотечений с линии резекции печени. Их эффект в отношении предотвращения желчных осложнений сомнителен.
Кровотечение, резекция печени, гемостаз, лазерная коагуляция
Короткий адрес: https://sciup.org/142211602
IDR: 142211602 | УДК: 615.47:616-085;
Текст научной статьи Сравнительное экспериментальное исследование использования препаратов "TachoComb" и "Perclot" при резекции печени у свиней
Современная хирургическая гепатология достигла больших успехов в разработке техник и принципов проведения сложных оперативных вмешательств на печени. Тем не менее не до конца ясными остаются ряд вопросов, имеющих принципиальное значение, — контроль кровотечения в ходе диссекции паренхимы печени, окончательный гемостаз и проблема билиостаза. Кровопотеря при диссекции паренхимы печени сопряжена с высокой частотой послеоперационных осложнений и госпитальной летальности [1, 2]. По данным S. Kubo и соавт., величина кровопотери составляет от 5 до 3000 мл, а Shirabe в выборке из 353 больных указывает на 1,4% (5 пациентов) случаев кровопотери более 5000 мл [3, 4]. Данные цифры не позволяются надеяться на неосложненное течение послеоперационного периода. H. Bismuth сделал сообщение о 51 случае резекции печени при опухолях сложной локализации в условиях тотальной сосудистой изоляции, подчеркивая исключительную важность предотвращения крупной потери крови при резекции печени [1]. J.D. Cunningham делает сходные выводы [5], предлагая использовать прием Прингла. Послеоперационная летальность, ранее традиционно высокая в хирургии печени по причине выраженной кровопотери [6], начиная с 90-х годов колеблется в пределах от 2 до 6% [7]. И если принципы «сосудистого кон- троля», строгого анатомического подхода, широкие возможности трансфузионной терапии, а также множество современных приборов («HydroJet»; «CUSA» и др.) позволяют в известных пределах контролировать кровопотерю, то проблема билио-стаза все еще остается нерешенной. Частота подтекания желчи («bile leakage» в иностранной литературе) с поверхности резецированной печения, по данным Yаmashita и соавт., в выборке из 781 пациента составляет от 3-4%, по данным Ishii H и соавт., в выборке из 247 пациентов достигает 10,5%, Leelawat и соавт. сообщают о частоте в 27%. Vladov и соавт. в ретроспективном исследовании 64 пациентов, которым была выполнена резекция ворот печени по поводу холангиокарциномы, сообщают о 25,6% послеоперационного подтекания желчи. Nanashima и со-авт. выполнили ретроспективное исследование 550 пациентов, которым за период с 1999 по 2011 год выполнялись резекции печени по различным показаниям. У 44 пациентов, что составляет 8% случаев, отмечалось подтекание желчи [8, 9, 10]. Формирование билиарного свища в послеоперационном периоде значительно удлиняет длительность пребывания больных в стационаре после оперативного лечения, увеличивает риск развития сопряженных осложнений и стоимость лечения [11, 12]. В этом свете поиск методов, позволяющих осуществлять гемо- и билиостаз поверхности резецированной печени, является более чем оправданным.
Материалы и методы
Представленное исследование носит экспериментальный характер. Ранее неоперированные 15 мини-свиней мужского пола массой 13 - 15 кг были разбиты на 3 группы. Каждому животному под анестезией препаратом «Золетил-100» 0,75 мл, посредством срединной лапаротомии — 5 - 7 см, была выполнена неанатомическая резекция части левой латеральной доли печени размерами в среднем 10 - 12 х 5 - 7 см при помощи биполярной коагуляции в месте, соответствующем паренхиме наибольшей толщины, которая составляла около 3 см. Подобный объем ге-патэктомии был выбран для того, чтобы минимизировать риск развития послеоперационной печеночной недостаточности. В ходе каждой операции в обязательном порядке визуализировалась ножка сегмента печени и, по-возможности, не лигировалась, то есть осуществлялся коагуляционный гемостаз. Продолжительность операций в среднем составила 15 - 20 минут от момента разреза до формирования последнего кожного шва. В случаях, когда коагуляционного гемостаза достигнуть не удавалось, применялось прошивание паренхимы печени мононитью 6/0.
В первой группе поверхность резекции печени покрывалась препаратом «TachoComb» (NYCOMED GmbH) (рис. 1). Во второй — резецированная поверхность печени обрабатывалась препаратом «PerClot» (CryoLife Inc.) (рис. 2). В третьей — линия резекции печени бесконтактным способом обрабатывалась диодным лазером с длиной волны 0,97 мкм «ЛСП-АЗОР». По окончанию операции брюшную полость промывали раствором антисептика (0,05% водный раствор хлоргекседина), после чего
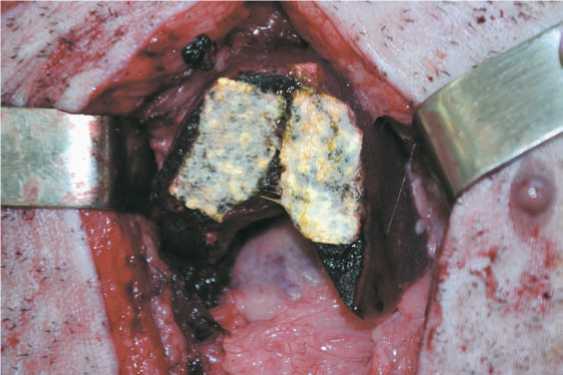
Рис. 1. Препарат «TachoComb», нанесенный на резецированную поверхность печени
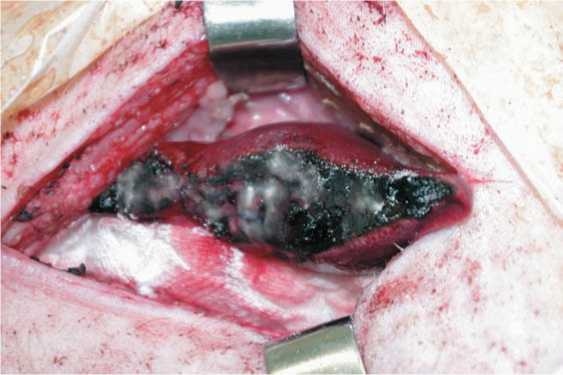
Рис. 2. Препарат «PerClot» после нанесения на линию резекции печени вводили 50 мл физиологического раствора и устанавливали дренаж. Антибиотикопрофилактика достигалась внутримышечным введением раствора цефалоспорина 3 поколения (0,5 г) до операции и на следующие сутки после операции. На первые сутки после операции животные возвращались к нормальной жизнедеятельности. На 5-е и 10-е сутки животным выполнялась диагностическая лапароскопия с целью уточнения сохранения гемостатичсекого средства к типичному времени открытия билиарных свищей и определения времени биодеградации препарата. Также на 10-е сутки после операции выполнялась биопсия края резекции печени с захватом зон некроза, некробиоза и здоровой паренхимы.
Результаты исследования
В ходе эксперимента все животные перенесли 3 повторные операции, летальных случаев не наблюдалось. По установленному дренажу ни в одном из случаев не наблюдались явления кровотечения или подтекания желчи. Воспалительных осложнений послеоперационной раны не наблюдалось.
В первой группе не наблюдались признаки кровотечения и/ или подтекания желчи. Обращал на себя внимание выраженный спаечный процесс между органами брюшной полости, передней брюшной стенкой и линией резекции печени, что потребовало в 1 случае на 10-е сутки конвертировать доступ в результате возникшего при разделении спаек кровотечения. На 5-е и 10-е сутки наблюдались лишь остаточные признаки сохранения препарата (табл. 1).
В группе 2 на 5-е сутки также не было выявлено признаков подтекания желчи или кровотечения в дренажном отделяемом. Однако у всех животных наблюдался спаечный процесс между линией резекции печени, кишечником и передней брюшной стенкой, наибольшей выраженности достигший к 10-м суткам, что в одном из случаев потребовало конверсии доступа. На 5-е сутки во 2-й группе в 3-х случаях уже наблюдалось полная деградация препарата на поверхности печени. На 10-е сутки препарат отсутствовал в 100% случаев (табл. 2).
При лапароскопии на 5-е и на 10-е сутки в группе 3 у всех животных наблюдался значительно менее выраженный спаечный процесс. Признаков кровотечения или подтекания желчи выявлено не было (табл. 3).
Результаты биопсии края печени, полученные на 10-е сутки после операции, во всех случаях выявили зоны: карбонизации, коагуляционного некроза, лимфоплазмоцитарной инфильтрации и капсулообразования и обратимых изменений гепатоцитов (рис. 3).
Обсуждение
Проблема достижения окончательного гемостаза в хирургии печени является предметом для соревнования фармацевтических корпораций, предлагающих все новые и новые препараты разного механизма действия. Наиболее известными в этом отношении гемостатическими средствами являются: «TachoComb», «TachoSil», «Sangustop» и др. В большинстве
Таблица 1
Результаты применения препарата TachoComb (группа 1)
|
Результаты |
5-е сутки |
10-е сутки |
||||||||
|
Номер животного |
Номер животного |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
|
|
Кровотечение после резекции печени |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Поступление желчи в дренаж |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Биодеградация препарата |
+/- |
+/- |
+/- |
+ |
+/- |
полная |
полная |
полная |
полная |
полная |
|
Выраженность спаечного процесса |
+ |
+ |
+ |
+ |
+ |
+++ (конверсия доступа) |
++ |
+++ |
++ |
+++ |
|
Инфекционные осложнения |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
|
Летальность |
— |
— |
— |
— |
— |
— |
— |
— |
— |
— |
Таблица 2
Результаты применения препарата PerClot (группа 2)
|
Результаты |
5-е сутки |
10-е сутки |
||||||||
|
Номер животного |
Номер животного |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
|
|
Кровотечение после резекции печени |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Поступление желчи в дренаж |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Биодеградация препарата |
полная |
+/- |
полная |
полная |
+/- |
полная |
полная |
полная |
Полная |
полная |
|
Выраженность спаечного процесса |
+ |
+ |
+ |
+ |
+ |
+++ |
+++ |
+++ (конверсия доступа) |
++ |
+++ |
|
Инфекционные осложнения |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Летальность |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
Таблица 3
Результаты резекции печени в группе 3
|
Результаты |
5-е сутки |
10-е сутки |
||||||||
|
Номер животного |
Номер животного |
|||||||||
|
1 |
2 |
3 |
4 |
5 |
1 |
2 |
3 |
4 |
5 |
|
|
Кровотечение после резекции печени |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Поступление желчи в дренаж |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Выраженность спаечного процесса |
+ |
+ |
+ |
+ |
+ |
++ |
+ |
++ |
+ |
++ |
|
Инфекционные осложнения |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
Летальность |
- |
- |
- |
- |
- |
- |
- |
- |
- |
- |
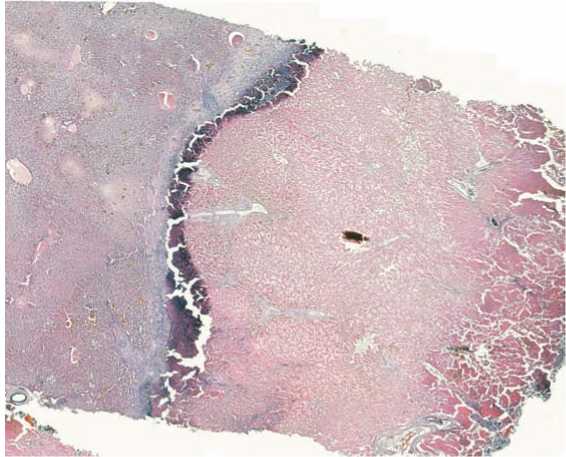
Рис. 3. В среднем толщина некротической зоны составляла 6951 мкм, зоны лимфоплазмоцитарной инфильтрации - 523 мкм. На микрофотографии хороша заметен лимфоцитарный вал с признаками образования соединительнотканной капсулы. Гепатоциты, прилегающие к линии резекции, бедны гликогеном, вакуолизированы, дистрофичны, что наиболее выражено в удаленных от центральных вен участках ткани печени случаев механизм действия основан на использовании пластины, состоящей из коллагена с включенными в нее факторами свертывания крови, которые при контакте с кровью запускают коагуляционный каскад. В других случаях пластины содержат компоненты фибринового клея или же другие полимерные препараты, образующие на поверхности резецированного органа коагуляционную площадку.
Проведенные серии работ по изучению эффективности препаратов в своем большинстве указывают на высокую клиническую эффективность [13 - 17]. Значимое экспериментальное исследование провела группа ученых под руководством
G. Martis, использовавшим тот же препарат при резекции печени, почки, селезенки и поджелудочной железы у собак [9]. Полученные результаты также говорят о высокой эффективности гемостатического средства. Множество исследований проводятся с целью сравнения свойств и качеств препаратов. Например, мультицентровое рандомизированное сравнительное исследование препаратов «Veriset» и «TachoComb», выявившее гемостатические преимущества первого. Несомненно, подобные исследования несут полезную для клинициста информацию, но все же в большей степени продиктованы конкуренцией в фармацевтической отрасли [17].
Ряд крупных исследований признают превосходство фибриновых аппликаторов над установками типа «PlasmaJet» и аргоновой коагуляцией. Например, работа А. Frilling, представляющая собой проспективное исследование более 100 случаев резекции печени с достижением окончательного гемостаза аргоновой коагуляцией, выявившая безусловную практическую пользу препарата «TachoSil» [18]. Тем не менее билиостатиче-ским эффектом, согласно ряду публикаций, подобные препараты не обладают [13]
Несколько другим механизмом действия обладает препарат «PerClot» (CryoLife Inc.) Изделие представляет собой мелкодисперсный порошок, который рекомендуется при помощи специального аппликатора рассыпать на требуемой поверхности (например, резецированная поверхность печени) и орошать физиологически раствором. В основе препарата лежат полисахаридные смеси, которые при контакте с водой превращаются в подобие клейстера. В нашем эксперименте, препарат давал положительную качественную реакцию на крахмал. Количество публикаций по применению данного препарата в хирургии крайне мало. В ресурсе PubMed представлена лишь одна экспериментальная работа, посвященная заживлению кожных ран у крыс [10], также в свободном доступе присутствует статья об использовании препарата для заживления костного повреждения [19]. Тем не менее авторы препарата указывают на широкий спектр применения, что обусловило включением его в группу сравнения в нашей работе.
Как видно выше, в ходе эксперимента результаты каждого из двух препаратов в отношении гемо- и билиостаза оказались одинаковыми — признаков подтекания желчи или послеоперационного кровотечения ни на 5, ни на 10-е сутки выявлено не было. Однако ряд факторов, на наш взгляд существенных, все же обращают на себя внимание. Длительное сохранении препарата на поверхности печени является принципиальным для предотвращения формирования желчных свищей. 3 - 5 сутки согласно классификации Brisbane являются сроком открытия желчного свища, формирующегося по причины резорбции зоны коагуляционного некроза и обнажения желчного протока. При этом при формировании свища класса D источником подтекания желчи становятся слепые и несвязанные с желчным деревом протоки, выносящие желчь из участков здоровой паренхимы печени, что не может быть установлено при помощи теста с метиленовым синим. Таким образом, наиболее важным аспектом в достижении билиостаза путем применения аппликаторов является плотное приращение его к поверхности печени. Ключевую же роль в достижении билиостаза играют механические свойства наносимого препарата, а в достижении гемостаза — скорее каскад химических превращений. В группах с препаратами «TachoComb» и «PerClot» выявлены лишь остаточные признаки сохранения препарата на 10-е сутки, хотя производители указывают на начало рассасывания препарата ко 2-ой неделе. При попытке отделения пластины «TachoComb» от поверхности коагуляционного некроза наблюдалось отрывание препарата с некротизированным участком паренхимы печени и обнажение здоровой паренхимы. Гемостатическое средство «PerClot» при нанесении создавало пленку на поверхности печени толщиной в 2 - 3 мм. На 5 и 10-е сутки в нашем исследовании препарата на поверхности печени обнаружено не было. В третьей группе использованное термическое воздействие лазером приводило к образованию участков коагуляционного некроза с обугливанием, что создавало герметичное наружное покрытие, препятствовавшее возможности формирования желчного свища.
В результате проведенного исследования нам удалось показать, что предлагаемые препараты являются достаточно эффективными в достижении окончательного гемостаза при соблюдении условия достижения первичного гемостаза электрокоагуляцией. При этом значительной разницы между группами с препаратами и лазером не наблюдалось по параметрами гемо- и билиостаза. В отношении предотвращения развития желчных свищей эффективность препаратов-аппликаторов до конца не ясна, а их ранняя в нашем исследовании резорбция скорее всего сыграет негативную роль. Для более точной оценки применимости и клинической эффективности необходимо проведение более крупных экспериментальных исследований на лабораторных животных и человеке.
-
1. Bismuth H. Major hepatic resection under total vascular exclusion // Annals of Surgery. 1989. Vol. 210. P. 13–19.
-
2. Fabrizio Romano, Mattia Garancini, Fabio Uggeri, Luca Degrate, Luca Nespoli, Luca Gianotti, Angelo Nespoli, and Franco Uggeri Bleeding in Hepatic Surgery: Sorting through Methods to Prevent It // Hepatopancreatobiliary Surgery. 2012. Vol. 2012. P. 1 - 12.
-
3. Kubo S., Takemura S., Yamamoto S., Hai S., Ichikawa T., Kodai S., Hiroji S., Shuto T., Hirohashi K., Tanaka H. Risk factors for massive blood loss during liver resection for hepatocellular carcinoma in patients with cirrhosis // Hepatogastroenterology. 2007. Vol. 54(75). P. 830 - 833.
-
4. Shirabe K., Kajiyama K., Harimoto N., Tsujita E., Wakiyama S., Maehara Y. Risk factors for massive bleeding during major hepatectomy // World Journal of Surgery. 2010. Vol. 34(7). P. 1555 - 1562.
-
5. Cunningham J.D., Fong Y., Shriver C., Melendez J., Marx W.L., Blumgart L.H. One hundred consecutive hepatic resections. Blood loss, transfusion, and operative technique // Achieves of Surgery. 1994. Vol. 122(10). P. 1050 - 1056.
-
6. Foster J.H., Berman M.M. Solid liver tumors // Major Problems of Clinical Surgery. 1977. Vol. 22(1). P. 342.
-
7. Belghiti J., Hiramatsu K., Benoist S. Seven hundred forty-seven hepatectomies in the 1990s: an update to evaluate the actual risk of liver resection // Journal of the American College of Surgeons. 2000. Vol. 191(1). P. 38–46.
-
8. Ishii H., Ochiai T,. Murayama Y., Komatsu S., Shiozaki A., Kuriu Y., Ikoma H., Nakanishi M., Ichikawa D., Fujiwara H., Okamoto K., Kokuba Y., Sonoyama T., Otsuji E. Risk factors and management of postoperative bile leakage after hepatectomy without bilioenteric anastomosis // Digestive Surgery. 2011. Vol. 28(3). P. 198 - 204.
-
9. Martis G., Mikó I., Szendröi T., Kathy S., Kovács J., Hajdu Z . Results with collagen fleece coated with fibrin glue (TachoComb). A macroscopical and histological experimental study // Acta Chirurgica Hungarica. 1997. Vol. 36(1-4). P. 221 - 222.
-
10. Wang Y., Xu M., Dong H., Liu Y., Zhao P., Niu W., Xu D., Ji X., Xing C., Lu D., Li Z. Effects of PerClot® on the healing of full-thickness skin wounds in rats // Acta Histochemica. 2012. Vol. 114(4). P. 311 - 317.
-
11. Guillaud A., Pery C., Campillo B., Lourdais A., Laurent S. Boudjema Incidence and predictive factors of clinically relevant bile leakage in the modern era of liver resections // HPB (Oxford). 2013. Vol. 15(3). P. 224 - 229.
-
12. Englesbea M.J., Dimicka J., Mathura A., Adsa Y., Wellinga T. H., Pelletiera S. J., Heidta D. G., Mageea J. C., Sunga R. S., Puncha J. D., Hantob
D. W. and D. A. Campbell, Jr. Who Pays for Biliary Complications Following Liver Transplant? A Business Case for Quality Improvement // American Journal of Transplantation. 2006. Vol. 6 - 12. P. 2978–2982.
-
13. Bunatian A.G., Zavenian Z.S., Bagmet N.N., Shatverian G.A., Skipenko O.G. Problems of hemostasis and hermetic properties in liver resections with application of fibrin-collagen substance // Khirurgiia. 2003. Vol. 9. P. 18 - 23.
-
14. Di Carlo I., Pulvirenti E., Toro A., Ardiri A., Bertino G. Localized fluid collection after carrier-bound fibrin sealant application on liver: complication or proof of efficacy? A long-term clinical observational study // Hepatogastroenterology. 2011. Vol. 58(107 - 108). P. 937 - 942.
-
15. Katkhouda N., Friedlander M., Darehzereshki A., Mason RJ., Zehetner J., Moazzez A., Chan LS., Kiyabu M., Kirkman E., Kirkman P., Ravari F., Degnera E., Drangsholt S., Khalaf1 N. Argon Beam Coagulation versus Fibrin Sealant for Hemostasis Following Liver Resection: A Randomized Study in a Porcine Model // Hepatogastroenterology. 2013. Vol. 60(125). P. 1110 - 1116.
-
16. Moench C., Bechstein WO., Hermanutz V., Hoexter G., Knaebel H.P. Comparison of the collagen haemostat Sangustop® versus a carrier-bound fibrin sealant during liver resection; ESSCALIVER-Study // Trials Journal. 2010. Vol. 11(109). P. 1 - 7.
-
17. Öllinger R., Mihaljevic A.L., Schuhmacher C., Bektas H., Vondran F., Kleine M., Sainz-Barriga M., Weiss S., Knebel P., Pratschke J., Troisi R.I. A
multicentre, randomized clinical trial comparing the Veriset™ haemostatic patch with fibrin sealant for the management of bleeding during hepatic surgery // HPB (Oxford). 2013. Vol. 15(7). P. 548 - 558.
-
18. Frilling A., Stavrou GA., Mischinger H., de Hemptinne B., Rokkjaer M., Klempnauer J., Thörne A., Gloor B., Beckebaum S., Ghaffar M.F., Broelsch C.E. Effectiveness of a new carrier-bound fibrin sealant versus argon beamer as haemostatic agent during liver resection: a randomised prospective trial // Langenbeck’s Archives of Surgery. 2005. Vol. 390(2). P. 114 - 120.
-
19. Niu Wen., Liu Yi., Zhang Bo., Luo Ying., Liu Man-ling., Li Zhi-chao Effects of an absorbable polysaccharide hemostat PerClot® on fracture healing of the cranial bone // Journal of Clinical Rehabilitative Tissue Engineering Research. 2010. Vol. 14(34). P. 6351 - 6354.
-
20. Komatsu K., Fujii A., Higami T. Haemostatic fleece (TachoComb) to prevent intrapleural adhesions after thoracotomy: a rat model // The Journal of Thoracic and Cardiovascular Surgery. 2007. Vol. 55(6). P. 385 - 390.
Колышев Илья Юрьевич – хирург Центра хирургии и онкологии Федерального Медицинского Биофизического центра им. А.И. Бурназяна ФМБА России
Адрес: 123098, г. Москва, ул. Маршала Новикова, дом 23.
«TACHOCOMB» AND «PERCLOT» APPLICATION AGENTS IN BOVINE LIVERRESECTION. EXPERIMENTAL STUDY
S. E. VOSKANYAN1, V. N. KARKISCHENKO2, A. I. ARTEMIEV1, I. YU. KOLYSHEV1, M. V. SHABALIN1,L. V. MARISOV3
1Federal Medical and Biophysical Center of FMBA, Moscow, Russia2Biomedical technologies research center of FMBA, Svetlye Gory, Moscow region, Russia 3Sechenov First Moscow State Medical University, Moscow, Russia
Список литературы Сравнительное экспериментальное исследование использования препаратов "TachoComb" и "Perclot" при резекции печени у свиней
- Bismuth H. Major hepatic resection under total vascular exclusion//Annals of Surgery. 1989. Vol. 210. P. 13-19.
- Fabrizio Romano, Mattia Garancini, Fabio Uggeri, Luca Degrate, Luca Nespoli, Luca Gianotti, Angelo Nespoli, and Franco Uggeri Bleeding in Hepatic Surgery: Sorting through Methods to Prevent It//Hepatopancreatobiliary Surgery. 2012. Vol. 2012. P. 1-12.
- Kubo S., Takemura S., Yamamoto S., Hai S., Ichikawa T., Kodai S., Hiroji S., Shuto T., Hirohashi K., Tanaka H. Risk factors for massive blood loss during liver resection for hepatocellular carcinoma in patients with cirrhosis//Hepatogastroenterology. 2007. Vol. 54(75). P. 830-833.
- Shirabe K., Kajiyama K., Harimoto N., Tsujita E., Wakiyama S., Maehara Y. Risk factors for massive bleeding during major hepatectomy//World Journal of Surgery. 2010. Vol. 34(7). P. 1555-1562.
- Cunningham J.D., Fong Y., Shriver C., Melendez J., Marx W.L., Blumgart L.H. One hundred consecutive hepatic resections. Blood loss, transfusion, and operative technique//Achieves of Surgery. 1994. Vol. 122(10). P. 1050-1056.
- Foster J.H., Berman M.M. Solid liver tumors//Major Problems ofClinical Surgery. 1977. Vol. 22(1). P. 342.
- Belghiti J., Hiramatsu K., Benoist S. Seven hundred forty-sevenhepatectomies in the 1990s: an update to evaluate the actual risk of liverresection//Journal of the American College of Surgeons. 2000. Vol. 191(1).P. 38-46.
- Ishii H., Ochiai T,. Murayama Y., Komatsu S., Shiozaki A., Kuriu Y.,Ikoma H., Nakanishi M., Ichikawa D., Fujiwara H., Okamoto K., KokubaY., Sonoyama T., Otsuji E. Risk factors and management of postoperativebile leakage after hepatectomy without bilioenteric anastomosis//DigestiveSurgery. 2011. Vol. 28(3). P. 198-204.
- Martis G., Mikó I., Szendröi T., Kathy S., Kovács J., Hajdu Z. Resultswith collagen fleece coated with fibrin glue (TachoComb). A macroscopicaland histological experimental study//Acta Chirurgica Hungarica. 1997.Vol. 36(1-4). P. 221-222.
- Wang Y., Xu M., Dong H., Liu Y., Zhao P., Niu W., Xu D., Ji X., Xing C.,Lu D., Li Z. Effects of PerClot® on the healing of full-thickness skin woundsin rats//Acta Histochemica. 2012. Vol. 114(4). P. 311-317.
- Guillaud A., Pery C., Campillo B., Lourdais A., Laurent S. BoudjemaIncidence and predictive factors of clinically relevant bile leakage inthe modern era of liver resections//HPB (Oxford). 2013. Vol. 15(3).P. 224-229.
- Englesbea M.J., Dimicka J., Mathura A., Adsa Y., Wellinga T. H.,Pelletiera S. J., Heidta D. G., Mageea J. C., Sunga R. S., Puncha J. D., Hantob14D. W. and D. A. Campbell, Jr. Who Pays for Biliary Complications Following Liver Transplant? A Business Case for Quality Improvement//American Journal of Transplantation. 2006. Vol. 6-12. P. 2978-2982.
- Bunatian A.G., Zavenian Z.S., Bagmet N.N., Shatverian G.A., Skipenko O.G. Problems of hemostasis and hermetic properties in liver resections with application of fibrin-collagen substance//Khirurgiia. 2003. Vol. 9. P. 18-23.
- Di Carlo I., Pulvirenti E., Toro A., Ardiri A., Bertino G. Localized fluid collection after carrier-bound fibrin sealant application on liver: complication or proof of efficacy? A long-term clinical observational study//Hepatogastroenterology. 2011. Vol. 58(107-108). P. 937-942.
- Katkhouda N., Friedlander M., Darehzereshki A., Mason RJ., ZehetnerJ., Moazzez A., Chan LS., Kiyabu M., Kirkman E., Kirkman P., Ravari F.,Degnera E., Drangsholt S., Khalaf1 N. Argon Beam Coagulation versusFibrin Sealant for Hemostasis Following Liver Resection: A RandomizedStudy in a Porcine Model//Hepatogastroenterology. 2013. Vol. 60(125).P. 1110-1116.
- Moench C., Bechstein WO., Hermanutz V., Hoexter G., Knaebel H.P.Comparison of the collagen haemostat Sangustop® versus a carrier-boundfibrin sealant during liver resection; ESSCALIVER-Study//Trials Journal.2010. Vol. 11(109). P. 1-7.
- Öllinger R., Mihaljevic A.L., Schuhmacher C., Bektas H., Vondran F.,Kleine M., Sainz-Barriga M., Weiss S., Knebel P., Pratschke J., Troisi R.I. Amulticentre, randomized clinical trial comparing the Veriset™ haemostatic patch with fibrin sealant for the management of bleeding during hepatic surgery//HPB (Oxford). 2013. Vol. 15(7). P. 548-558.
- Frilling A., Stavrou GA., Mischinger H., de Hemptinne B., Rokkjaer M., Klempnauer J., Thörne A., Gloor B., Beckebaum S., Ghaffar M.F., Broelsch C.E. Effectiveness of a new carrier-bound fibrin sealant versus argon beamer as haemostatic agent during liver resection: a randomised prospective trial//Langenbeck’s Archives of Surgery. 2005. Vol. 390(2). P. 114-120.
- Niu Wen., Liu Yi., Zhang Bo., Luo Ying., Liu Man-ling., Li Zhi-chao Effects of an absorbable polysaccharide hemostat PerClot® on fracture healing of the cranial bone//Journal of Clinical Rehabilitative Tissue Engineering Research. 2010. Vol. 14(34). P. 6351-6354.
- Komatsu K., Fujii A., Higami T. Haemostatic fleece (TachoComb) to prevent intrapleural adhesions after thoracotomy: a rat model//The Journal of Thoracic and Cardiovascular Surgery. 2007. Vol. 55(6). P. 385-390.


