Сравнительные результаты различных принципов этапной гибридной реваскуляризации миокарда у пациентов с предварительным стентированием венечных артерий и эндоваскулярной коррекцией венечного русла после коронарного шунтирования
Автор: Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.19, 2024 года.
Бесплатный доступ
Обоснование: Этапная гибридная реваскуляризация миокарда (ГРМ) является эффективным методом лечения больных ИБС. В настоящий момент не определен оптимальный порядок выполнения хирургического и эндоваскулярного этапов вмешательства в рамках ГРМ у пациентов с атеросклеротическим поражением КА. Цель: Сравнить ближайшие и отдаленные результаты этапной ГРМ в объеме коронарного шунтирования (КШ) с предшествующим стентированием КА и ЧКВ с последующим КШ. Методы: На ретроспективной основе в исследование включено 97 больных ИБС, которым была проведена этапная ГРМ в ФГБУ «НМХЦ им. Н.И. Пирогова» МЗ РФ с 2014 по 2020 гг. В I группе 48 пациентам было выполнено КШ с последующим ЧКВ (КШ+ЧКВ); во II группе 49 больным сначала было проведено стентирование КА, затем — КШ (ЧКВ+КШ). Средний временной промежуток между 1 и 2 этапами ГРМ составил 87,5±10,6 дней, общий период наблюдения — 36,9±5,8 месяцев. Результаты: Группа КШ+ЧКВ показала несколько более оптимальные 3-летние результаты по сравнению с когортой ЧКВ+КШ в отношении РИМ (20,1% против 24,5%, p = NS) и НЦП (18,5% против 22,3%, p = NS). Число зарегистрированных случаев НВТ у пациентов I и II групп было сходным — 23,1% против 24,0% (p = NS). Частота ИМ, ОНМК, смерти от всех причин достоверно не отличалась в обеих группах и составила 3 (6,3%), 2 (4,2%) и 3 (6,1%), и 3 (6,1%), 3 (6,3%) и 2 (4,1%) случаев в I и II когорте, соответственно (p = NS). Общий удельный вес MACE через 36,9±5,8 мес наблюдения составил 16,7% против 16,3% у пациентов КШ+ЧКВ и ЧКВ+КШ (p = NS). Заключение: Подход к ГРМ с выполнением КШ первым этапом перед ЧКВ показывает несколько большую эффективность и обеспечивает аналогичную безопасность по сравнению со стратегией «ЧКВ до КШ».
Ишемическая болезнь сердца, гибридная реваскуляризация миокарда, коронарное шунтирование, чрескожное коронарное вмешательство
Короткий адрес: https://sciup.org/140307066
IDR: 140307066 | DOI: 10.25881/20728255_2024_19_2_4
Текст научной статьи Сравнительные результаты различных принципов этапной гибридной реваскуляризации миокарда у пациентов с предварительным стентированием венечных артерий и эндоваскулярной коррекцией венечного русла после коронарного шунтирования
Инвазивная прямая реваскуляризация миокарда (ПРМ) — высокоэффективный способ лечения больных ИБС, который позволяет снизить функциональный класс стенокардии напряжения (СН) и, при определенных условиях, не только увеличить продолжительность жизни пациентов, но и улучшить ее качество [1]. Методы ПРМ давно закрепились в мировой и отечественной врачебной практике, доказав свое превосходство над изолированным применением оптимальной медикаментозной те-

Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ рапии [1]. Чрескожное коронарное вмешательство (ЧКВ) и коронарное шунтирование (КШ), являясь альтернативными способами инвазивной коррекции поражений венечного русла, имеют свои преимущества и недостатки.
К преимуществам ЧКВ относятся: малая инвазив-ность оперативного вмешательства, короткий восстановительный период, низкий риск инфекционных осложнений, отсутствие потребности в наркотизации пациента. Среди недостатков эндоваскулярной реваскуляризации КА можно отметить более высокую частоту развития неблагоприятных сердечно-сосудистых событий (MACE) в отдаленном периоде после вмешательства у больных с анатомически тяжелым поражением венечного русла и сахарным диабетом (СД) [2; 3].
В свою очередь, КШ позволяет обеспечить хорошие отдаленные резутаты операции у больных ИБС с комор-бидной патологией и стволовым, трехсосудистым поражением КА с высоким баллом шкалы Syntax и Syntax II, а также увеличить выживаемость пациентов с низкой фракцией выброса ЛЖ (ФВ) [1–3]. К недостаткам технологии КШ можно отнести необходимость проведения эндотра-хеального наркоза и экстракорпорального кровообращения в ряде ситуаций, риск кровопотери и отсутствие возможности выполнения максимальной реваскуляризации миокарда из-за анатомических особенностей коронарного русла [4].
Методом, объединяющим преимущества и нивелирующим недостатки обоих способов ПРМ, явилась гибридная реваскуляризация миокарда (ГРМ). ГРМ подразумевает выполнение доступного объема шунтирования КА преимущественно без применения экстракорпорального кровообращения и с обязательным формированием маммаро-коронарного анастомоза (МКШ) левой внутренней грудной артерии (ЛВГА) с ПНА. Иные поражения КА корректируются с помощью ЧКВ с использованием стентов с лекарственным покрытием (СЛП) одномоментно (в условиях гибридной операционной) или в несколько этапов. Основным предиктором позднего достижения комбинированной конечной точки MACE больными после КШ является использование анастомоза ЛВГА-ПНА. 20-летние результаты наблюдения демонстрируют повышение выживаемости пациентов с применением ВГА на 4,4 года дольше, чем при использовании только венозных трансплантатов; меньшее количество повторных операций, поздних инфарктов, ранних рецидивов стенокардии, а также более низкими показатели летальности [5; 6].
Так, выполнение КШ с использованием только ЛВГА в бассейне ПНА («aorta no-touch technique») или с дополнительным осуществлением минимального объема венозного шунтирования позволяет значимо снизить потребность в экстракорпоральном кровообращении, уменьшить риск кровопотери, длительность оперативного вмешательства и количество послеоперационных осложнений [7]. Эндоваскулярная реваскуляризация других бассейнов КА обеспечивает хорошие отдаленные результаты в отношении реци- дива ишемии (РИМ) и MACE, избавляя от необходимости расширения объема хирургических манипуляций при КШ.
Проведение одномоментной ГРМ возможно только в ограниченном количестве кардиохирургических стационаров, оснащенных гибридной операционной. Этапная ГРМ остается эффективной стратегией, обеспечивающей необходимый результат у больных ИБС, обладающей, однако, малой доказательной базой [8; 9; 10]. При этом не определены преимущества и недостатки подходов к этапной ГРМ с предварительным ЧКВ перед КШ и хирургической реваскуляризацией миокарда с последующим стентированием КА. В данной работе мы поставили перед собой задачу сравнить между собой обе методики ПРМ.
Материалы и методы
На ретроспективной основе в исследование было включено 97 пациентов с атеросклеротическим поражением КА, которым была проведена этапная ГРМ. КШ было выполнено в отделении сердечно-сосудистой хирургии, ЧКВ — в отделении рентгенохирургических методов диагностики и лечения Клиники грудной и сердечно-сосудистой хирургии им. Св. Георгия НМХЦ им. Н.И. Пирогова с 2014 по 2020 гг. Пациенты были разделены на 2 группы: в I группу вошли больные ИБС, которым в рамках ГРМ в качестве первого этапа реваскуляризации было выполнено КШ с последующим ЧКВ (КШ+ЧКВ); во II — больные, которым сначала было проведено стентирование КА, затем — коронарное шунтирование (ЧКВ+КШ).
По клинической характеристике пациенты обеих групп между собой достоверно не отличались, за исключением частоты стенокардии напряжения ФК IV (p = 0,02) (Табл. 1). Возраст больных в первой и второй группе в среднем составил 63,3±4,2 и 62,8±5,1 лет соответственно, среди испытуемых преобладали мужчины (66,7% и 69,4%). ОИМ в анамнезе имели 10 (20,8%) и 14 (28,6%) больных, средняя ФВ в группах КШ+ЧКВ и ЧКВ+КШ была 52,8±4,9% и 51,1±5,3%. Большинство па-
Табл. 1. Клиническая характеристика больных
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
p |
|
|
Возраст, годы (M±SD) |
63,3±4,2 |
62,8±5,1 |
NS |
|
|
Мужской пол, n (%) |
32 (66,7) |
37 (69,4) |
NS |
|
|
Курение, n (%) |
34 (70,8) |
37 (75,5) |
NS |
|
|
Артериальная гипертензия, n (%) |
41 (85,4) |
39 (79,6) |
NS |
|
|
ХОБЛ, n (%) |
27 (56,3) |
32 (65,3) |
NS |
|
|
ФВ, % (M±SD) |
52,8±4,9 |
51,1±5,3 |
NS |
|
|
ХСН, n (%) |
6 (12,5) |
7 (14,3) |
NS |
|
|
СД, n (%) |
11 (22,9) |
9 (18,4) |
NS |
|
|
ОИМ в анамнезе, n (%) |
10 (20,8) |
14 (28,6) |
NS |
|
|
ОНМК в анамнезе, n (%) |
3 (6,3) |
2 (4,1) |
NS |
|
|
Мультифокальный атеросклероз, n (%) |
4 (8,3) |
3 (6,1) |
NS |
|
|
ФК СН |
ФК II, n (%) |
7 (14,6) |
10 (20,4) |
NS |
|
ФК III, n (%) |
36 (75,0) |
39 (79,6) |
NS |
|
|
ФК IV, n (%) |
5 (10,4) |
0 (0) |
<0,05 |
|

Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ циентов в обеих группах страдали СН ФК III (75% больных КШ+ЧКВ и 79,6% испытуемых в группе II).
У 48 больных первой группы при первичной КАГ было выявлено 189 поражений КА, в группе II (n = 49) — 201 значимый стеноз (p = NS). По частоте выявления поражений различных анатомических локализаций больные обеих групп достоверно не отличались (p = NS). У всех пациентов были зарегистрированы гемодинамически значимые стенозы ПНА — 48 (28,2%) и 39 (27,8%) поражений в I и II группах, соответственно. Поражение ствола ЛКА встречалось у 5 (10,4%) больных КШ+ЧКВ и 6 (12,2%) испытуемых с первичным ЧКВ. Основные стволы ОА и ПКА были стенозированы в 19 (11,2%), 22 (12,5%) и 32 (18,8%), 30 (17,0%) случаях в группах с первичным и вторичным КШ, соответственно. В первой и второй когортах частота выявления поражения ЗМЖА при правовенечном и сбалансированном типе коронарного кровоснабжения составила 8,8% против 10,2% (Табл. 2). Все пациенты имели поражение двух и более основных стволов эпикардиальных артерий.
На дооперационном этапе селективная многопроекционная коронароангиография выполнялась на ангиографической установке Toshiba Infinix (Япония) по стандартному протоколу с оценкой полученных результатов двумя независимыми специалистами. Для диагностики ишемии миокарда 73 (88%) пациентам выполнялись нагрузочные пробы. Однофотонная эмиссионная томография миокарда синхронизированная с ЭКГ с 99mТс-технетрилом (Синхро-ОФЭКТ) у 60 (72,3%) больных проводилась по стандартному протоколу: нагрузка-покой. Стресс-ЭхоКГ с физической нагрузкой — у 13 (15,7) больных.
Всем исследуемым пациентам до реваскуляризации была назначена ацетилсалициловая кислота (АСК) (100 мг/сут.) для пожизненного приема. Анти-тромбоцитарная терапия также включала клопидогрел (нагрузочная доза 300 мг, если не принимался ранее; далее 75 мг/сут. в течение 12 мес.). Послеоперационная медикаментозная терапия в обязательном порядке включала статины, ингибиторы ангиотензинпревращающего фермента либо блокаторы рецепторов ангиотензина II, и соответствовала актуальным клиническим рекомендациям.
Критериями включения в исследование явились: стабильная ИБС II–IV ФК; ишемия миокарда, доказанная при помощи нагрузочных проб; двух- и трехсосудистое атеросклеротическое поражение КА с промежуточным и высоким баллом по шкале анатомического риска Syntax.
Критерии исключения из исследования: больные ИБС с сочетанным гемодинамически значимым поражением КА и клапанов сердца, аневризмой ЛЖ, требующей реконструкции, выраженной недостаточностью функции почек, печени, онкологической патологией.
Целью настоящего исследования стало сравнение ближайших и отдаленных результатов этапной гибридной реваскуляризации миокарда в объеме коронарного шунтирования с предшествующим стентированием КА и ЧКВ с последующим КШ.
Табл. 2. Ангиографическая характеристика больных
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
p |
|
|
Всего поражений, n (%) |
170 (100,0) |
176 (100,0) |
NS |
|
|
Ствол ЛКА n (%) |
5 (2,9) |
6 (3,4) |
NS |
|
|
Система ПНА |
ПНА, n (%) |
48 (28,2) |
49 (27,8) |
NS |
|
ДА, n (%) |
21 (12,4) |
23 (13,1) |
NS |
|
|
ИМА, n (%) |
2 (1,2) |
2 (1,1) |
NS |
|
|
Система ОА |
ОА, n (%) |
19 (11,2) |
22 (12,5) |
NS |
|
АТК, n (%) |
12 (7,1) |
11 (6,3) |
NS |
|
|
ЗБВ, n (%) |
5 (2,9) |
4 (2,3) |
NS |
|
|
ЗМЖА, n (%) |
5 (2,9) |
7 (4,0) |
NS |
|
|
Система ПКА |
ПКА, n (%) |
32 (18,8) |
30 (17,0) |
NS |
|
ЗБВ, n (%) |
6 (3,5) |
4 (2,3) |
NS |
|
|
ЗМЖА, n (%) |
15 (8,8) |
18 (10,2) |
NS |
|
|
Поражение B2/C, n (%) |
21 (43,8) |
19 (38,8) |
NS |
|
|
Syntax Score, значение (M±SD) |
27,8±5,23 |
28,2±6,1 |
NS |
|
Результаты исследования
Всего в первой и второй группе больным на I этапе ГРМ было скорректировано 87 (51,2%) и 76 (43,2%) поражений КА, соответственно. Больным КШ+ЧКВ выполнялось КШ с наложением 87 (100%) шунтов, из которых 47 (54%) представляли собой маммарные, а 40 (46%) — аутовенозные кондуиты. Шунтирование ПНА с формированием анастомоза ЛВГА-ПНА проводилось 47 (97,9%) испытуемым, 1 пациенту осуществлено КШ ПНА с использованием аутовены по причине гипоплазии ВГА. Всего было сформировано 40 дистальных анастомозов с использованием аутовены: ДА — 10 (11,5%), ИМА — 1 (1,1%), 13 (14,9%) — в системе ОА, 15 (17,2%) — в системе ПКА.
Во второй группе на I этапе ГРМ было имплантировано 125 (100%) стентов. Длина стентированного участка в среднем составила 22,7±7,4 мм, диаметр имплантированного стента — 2,93±0,63 мм. Большинству пациентов запланированный объем ЧКВ был выполнен за один этап эндоваскулярного вмешательства, количество этапов составило 1,37±0,5. Рентгенохирургическая реваскуляризация ПНА и ствола ЛКА целенаправленно не проводилась. ДА и ИМА были стентированы в 15 (8,5%) и 2 (1,1%) случаях, соответственно. При эндоваскулярной реваскуляризации бассейна ОА было выполнено КС в зоне 27 (35,5%) пораженных сегментов КА, при ЧКВ в бассейне ПКА — 32 (42,1%) стенозов.
Продолжительность операции КШ в I группе в среднем составила 271,2±56,9 мин., интраоперационная кровопотеря — 479,5±73,1 мл. Потребность в инотропной и вазопрессорной поддержке возникла у 9 (18,8%) и 26 (54,2%), соответственно. Большинству пациентов (n = 37, 77,1%) реваскуляризация была выполнена на работающем сердце. Продолжительность ЧКВ во II группе была 108,4±36,7 мин., вмешательство осуществлялось трансрадиально у 38 (77,6%) пациентов.
В раннем послеоперационном периоде потребность в инотропной и вазопрессорной поддержке составила 10,4% и 45,8%, соответственно. Кровотечение, которое

Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ
Табл. 3. Результаты I этапа гибридной реваскуляризации
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
p |
|
Скорректировано поражений, n (%) |
86 (51,2) |
76 (43,2) |
NS |
|
Маммаро-коронарное шунтирование, n (%) |
47 (54,0) |
– |
|
|
Венозные шунты, n (%) |
39 (46,0) |
– |
|
|
Имплантировано СЛП, n (%) |
– |
125 (100,0) |
|
|
Длина стентированного участка, мм (M±SD) |
– |
22,7±7,4 |
|
|
Диаметр имплантированного стента, мм (M±SD) |
– |
2,93±0,63 |
|
|
Количество этапов ЧКВ (M±SD) |
– |
1,37±0,5 |
Локализация формирования дистального анастомоза и установки СЛП
На втором этапе ГРМ в группе I было имплантировано 76 (100,0%) СЛП при эндоваскулярной коррекции 53 (31,2%) коронарных поражений против 125 (100,0%) стентов у пациентов ЧКВ+КШ (p<0,05). Длина стентированного участка в среднем составила 16,4±6,1 мм, диаметр стента — 2,75±0,78. Больные I когорты в среднем перенесли достоверно меньше этапов ЧКВ по сравнению с пациентами ЧКВ+КШ — 1,15±0,56 против 1,37±0,5 (p<0,05). Частота стентирования ДА, ОА и ЗМЖА была достоверно меньше в группе КШ+ЧКВ по сравнению со второй группой — 10 (5,9%) против 5 (2,8%), 10 (5,9%) против 15 (8,5%) и 1 ( 0,6%) против 10 (5,7%), соответственно (p<0,05).
На этапе КШ во II когорте была проведена хирургическая коррекция 74 (42,0%) стенозов венечного русла. В процессе КШ было наложено 49 (27,8%) маммаро-коронарных анастомозов. Достоверно реже по сравнению с группой ЧКВ+КШ проводилась реваскуляризация диагональных ветвей ПНА — 5 (2,8%) против 10 (5,9%) (p<0,05), частота аутовенозного шунтирования других КА в обеих группах не отличалась (p = NS) (Табл. 6).
По интраоперационной характеристике КШ и ЧКВ пациенты обеих групп между собой достоверно не отличались (p = NS) (Табл. 7).
Табл. 4. Интраоперационная характеристика вмешательства I этапа ГРМ
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n=49) |
p |
Коронарное шунтирование
|
Продолжительность оперативного вмешательства, мин. (M±SD) |
271,2±56,9 |
– |
|
|
Экстракорпоральное кровообращение, n (%) |
9 (18,8) |
– |
|
|
Инотропная поддержка, n (%) |
9 (18,8) |
– |
|
|
Вазопрессорная поддержка, n (%) |
26 (54,2) |
– |
|
|
Интраоперационная кровопотеря, мл (M±SD) |
479,5±73,1 |
– |
Чрескожное коронарное вмешательство
|
Продолжительность оперативного вмешательства, мин. (M±SD) |
– |
108,4±36,7 |
|
|
Трансрадиальный доступ, n (%) |
– |
38 (77,6) |
Табл. 5. Характеристика периоперационного периода I этапа ГРМ
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
|
Средняя кровопотеря за 1–е сутки, мл (M±SD) |
544,4±162,9 |
– |
|
Гемотрансфузия, n (%) |
12 (25,0) |
– |
|
Среднее время послеоперационной ИВЛ, час (M±SD) |
5,9±3,02 |
– |
|
Среднее время пребывания в ОРИТ, час (M±SD) |
25,7±5,99 |
10,8±3,1 |
|
Инотропная поддержка, n (%) |
5 (10,4) |
– |
|
Вазопрессорная поддержка, n (%) |
22 (45,8) |
– |
|
Послеоперационное кровотечение, n (%) |
1 (2,1) |
– |
|
Периоперационный ОИМ, n (%) |
1 (2,1) |
1 (2,0) |
|
ОНМК, n (%) |
– |
– |
|
Послеоперационная летальность, n (%) |
– |
– |
|
Послеоперационный койко-день, (M±SD) |
12,9±6,74 |
3,1±0,1 |
По характеристике периоперационного периода больные обеих групп также между собой достоверно не отличались (p = NS). Ранний послеоперационный период во второй когорте осложнился развитием летального крупноочагового ОИМ, связанного с острым тромбозом шунта ЛВГА-ПНА.
После второго этапа ГРМ у 45 (93,8%) больных I группы и 46 (93,9%) пациентов II группы была клиника стенокардии напряжения 0-I ФК (p = NS). У 2 (4,2%) и 3 (6,1%) испытуемых I и II когорты резидуальная ишемия миокарда была клинически представлена СН II функционального класса, соответственно (p = NS).
В течение 36,9±5,8 мес. наблюдения РИМ несколько чаще регистрировался во второй группе — 10,4% против 12,2%, 16,6% против 18,3% и 20,1% против 24,5% на 1, 2 и 3 году наблюдения, соответственно, однако различия были недостоверны (p = NS) (Табл. 9).
В группе КШ+ЧКВ в первой трети периода наблюдения в 6 (11,1%) случаях развился бинарный РВС и в 4 (10,3%) — НВТ; по показаниям было выполнено стентирование 9 (16,7%) поражений КА и 1 (2,6%) эндоваскулярная реконструкция ВШ. К концу периода наблюдения в I когорте было дополнительно накоплено 3 (5,6%) случая РВС, 1 (1,9%) случай рецидива РВС,
Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ
Табл. 6. Результаты II этапа гибридной реваскуляризации
|
Показатель |
Группа I КШ+ЧКВ (n = 48) 170 |
Группа II ЧКВ+КШ (n = 49) 176 |
p |
|
Скорректировано поражений, n (%) |
140 (82,4) |
150 (85,2) |
NS |
|
Маммаро-коронарное шунтирование, n (%) |
47 (27,6) |
49 (27,8) |
NS |
|
Венозные шунты, n (%) |
39 (22,9) |
25 (14,2) |
<0,05 |
|
Имплантировано СЛП, n (%) |
76 (100,0) |
125 (100,0) |
<0,05 |
|
Длина стентированного участка, мм (M±SD) |
16,4±6,1 |
22,7±7,4 |
<0,05 |
|
Диаметр имплантированного стента, мм (M±SD) |
2,75±0,78 |
2,93±0,63 |
<0,05 |
|
Количество этапов ЧКВ (M±SD) |
1,15±0,56 |
1,37±0,5 |
<0,05 |
Локализация формирования дистального анастомоза
|
Ствол ЛКА n (%) |
– |
– |
|
|
Система ПНА ПНА, n (%) |
48 (28,2) |
49 (27,8) |
NS |
|
ДА, n (%) |
10 (5,9) |
5 (2,8) |
<0,05 |
|
ИМА, n (%) |
1 (0,6) |
0 (0) |
NS |
|
Система ОА ОА, n (%) |
– |
– |
|
|
АТК, n (%) |
7 (4,1) |
4 (2,3) |
NS |
|
ЗБВ, n (%) |
2 (1,2) |
0 (0) |
NS |
|
ЗМЖА, n (%) |
4 (2,4) |
4 (2,3) |
NS |
|
Система ПКА ПКА, n (%) |
– |
– |
|
|
ЗБВ, n (%) |
1 (0,6) |
1 (0,6) |
NS |
|
ЗМЖА, n (%) |
14 (8,2) |
11 (6,3) |
NS |
Локализация зоны установки СЛП
|
Ствол ЛКА n (%) |
1 (0,6) |
– |
NS |
|
Система ПНА ПНА, n (%) |
– |
– |
|
|
ДА, n (%) |
10 (5,9) |
15 (8,5) |
<0,05 |
|
ИМА, n (%) |
0 (0) |
2 (1,1) |
NS |
|
Система ОА ОА, n (%) |
8 (4,7) |
14 (8,0) |
<0,05 |
|
АТК, n (%) |
5 (2,9) |
6 (3,4) |
NS |
|
ЗБВ, n (%) |
2 (1,2) |
4 (2,3) |
NS |
|
ЗМЖА, n (%) |
1 (0,6) |
3 (1,7) |
NS |
|
Система ПКА ПКА, n (%) |
22 (12,9) |
19 (10,8) |
NS |
|
ЗБВ, n (%) |
4 (2,4) |
3 (1,7) |
NS |
|
ЗМЖА, n (%) |
1 (0,6) |
10 (5,7) |
<0,05 |
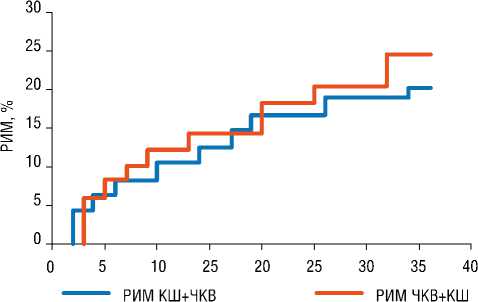
Рис. 1. Рецидив ишемии миокарда. Метод Каплана-Майера.
5 (12,8%) случаев НВТ, по поводу которых была проведена интервенционная реваскуляризация КА в 8 (14,8%) случаях и реканализация окклюзии ВШ у 1 (2,6%) пациента.
Табл. 7. Интраоперационная характеристика вмешательства II этапа ГРМ
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
p |
Коронарное шунтирование
|
а |
271,2±56,9 |
281,5±52,2 |
NS |
|
Экстракорпоральное кровообращение, n (%) |
9 (18,8) |
7 (14,3) |
NS |
|
Инотропная поддержка, n (%) |
9 (18,8) |
11 (22,4) |
NS |
|
Вазопрессорная поддержка, n (%) |
26 (54,2) |
25 (51,0) |
NS |
|
Интраоперационная кровопотеря, мл (M±SD) |
479,5±73,1 |
461,9±85,9 |
NS |
Чрескожное коронарное вмешательство
|
Продолжительность оперативного вмешательства, мин. (M±SD) |
117,4±29,6 |
108,4±36,7 |
NS |
|
Трансрадиальный доступ, n (%) |
33 (68,8) |
38 (77,6) |
NS |
Табл. 8. Характеристика периоперационного периода II этапа ГРМ
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ n = 49) |
p |
Коронарное шунтирование
|
Средняя кровопотеря за 1–е сутки, мл (M±SD) |
544,4±162,9 |
538±178,8 |
NS |
|
Гемотрансфузия, n (%) |
12 (25,0) |
14 (28,6) |
NS |
|
Среднее время послеоперационной ИВЛ, час (M±SD) |
5,9±3,02 |
5,7±3,21 |
NS |
|
Среднее время пребывания в ОРИТ, час (M±SD) |
25,7±5,99 |
24,4±5,64 |
NS |
|
Инотропная поддержка, n (%) |
5 (10,4) |
5 (10,2) |
NS |
|
Вазопрессорная поддержка, n (%) |
22 (45,8) |
24 (49,0) |
NS |
|
Послеоперационное кровотечение, n (%) |
1 (2,1) |
1 (2,0) |
NS |
|
Периоперационный ОИМ, n (%) |
1 (2,1) |
1 (2,0) |
NS |
|
ОНМК, n (%) |
– |
– |
NS |
|
Послеоперационная летальность, n (%) |
– |
1 (2,0) |
NS |
|
Послеоперационный койко-день, (M±SD) |
12,9±6,74 |
12,5±5,78 |
NS |
Чрескожное коронарное вмешательство
|
Среднее время пребывания в ОРИТ, час (M±SD) |
10,9±3,05 |
10,8±3,1 |
NS |
|
Периоперационный ОИМ, n (%) |
– |
1 (2,0) |
NS |
|
ОНМК, n (%) |
– |
– |
NS |
|
Послеоперационная летальность, n (%) |
– |
– |
NS |
|
Послеоперационный койко-день, (M±SD) |
3,0±0,1 |
3,1±0,1 |
NS |
Во II группе на 1 году наблюдения было выполнено 13 (17,1%) стентирований КА по поводу 10 (13,2%) случаев бинарного РВС и 3 (12%) случаев НВТ. К концу периода наблюдения дополнительно была проведена реконструкция КА в 9 (11,8%) случаях, в 1 (1,3%) из которых ЧКВ выполнялось в целях коррекции рецидива РВС в средней трети периода наблюдения. Рентгенохирургическое вмешательство на ВШ было проведено 1 (2%) больному II группы (Рис. 2).
К концу периода наблюдения число ИМ, ОНМК, смерти от всех причин достоверно не отличалось в обеих группах и составило 3 (6,3%), 2 (4,2%) и 3 (6,1%),

Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ
Табл. 9. Отдаленные осложнения гибридной реваскуляризации
|
Показатель |
Группа I КШ+ЧКВ (n = 48) |
Группа II ЧКВ+КШ (n = 49) |
p |
РИМ
|
1 год, n (%) |
5 (10,4) |
6 (12,2) |
NS |
|
2 года, n (%) |
8 (16,6) |
9 (18,3) |
NS |
|
3 года, n (%) |
10 (20,1) |
12 (24,5) |
NS |
НЦП
|
1 год, n (%) |
6 (11,1) |
10 (13,2) |
NS |
|
2 года, n (%) |
8 (14,8) |
13 (17,1) |
NS |
|
3 года, n (%) |
10 (18,5) |
17 (22,3) |
NS |
НВТ
|
1 год, n (%) |
4 (10,3) |
3 (12,0) |
NS |
|
2 года, n (%) |
7 (17,9) |
5 (20,0) |
NS |
|
3 года, n (%) |
9 (23,1) |
6 (24,0) |
NS |
ИМ
|
1 год, n (%) |
2 (4,2) |
2 (4,1) |
NS |
|
2 года, n (%) |
2 (4,2) |
2 (4,1) |
NS |
|
3 года, n (%) |
3 (6,3) |
3 (6,1) |
NS |
ОНМК
|
1 год, n (%) |
1 (2,1) |
1 (2,0) |
NS |
|
2 года, n (%) |
1 (2,1) |
2 (4,1) |
NS |
|
3 года, n (%) |
2 (4,2) |
3 (6,1) |
NS |
Летальный исход
|
1 год, n (%) |
1 (2,1) |
1 (2,0) |
NS |
|
2 года, n (%) |
2 (4,2) |
2 (4,1) |
NS |
|
3 года, n (%) |
3 (6,3) |
2 (4,1) |
NS |
MACE
Обсуждение
ГРМ занимает все более прочное место в кардиохирургической практике, обладая преимуществами КШ и ЧКВ и будучи лишенной многих их недостатков. Этапная ГРМ представляется эффективной стратегией подхода к реваскуляризации для кардиохирургических стационаров, не оснащенных гибридной операционной. В ряде ситуаций выполнение максимальной реваскуляризации при КШ лимитировано рядом объективных причин, что определяет потребность в проведении ЧКВ перед хирургической коррекцией поражений КА или после шунтирования. ЧКВ также является неотъемлемым компонентом многоэтапного лечения больных ИБС, перенесших КШ, в силу достаточно высокой частоты выявления РИМ и дисфункции венозных кондуитов в послеоперационном периоде.
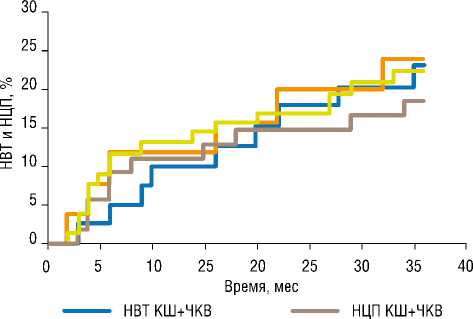
НВТ чкв+кш ----- нцпчкв+кш
Рис. 2. Несостоятельность венозных шунтов и стентированных участков. Метод Каплана-Майера.
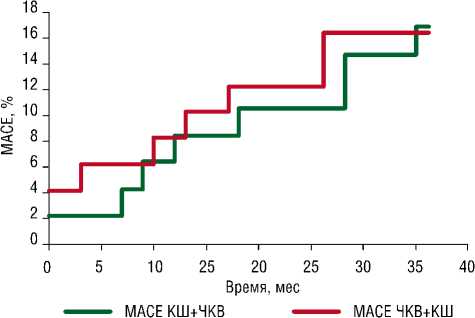
Рис. 3. Неблагоприятные сердечно-сосудистые события. Метод Каплана–Майера.
В настоящем исследовании была проанализирована эффективность и безопасность ГРМ с КШ в качестве первого и второго этапа оперативного лечения больных ИБС. Все больные имели поражение двух и более основных эпикардиальных артерий. В качестве хирургического доступа при КШ у всех пациентов использовалась стандартная срединная стернотомия. У подавляющего большинства больных КШ было выполнено без использования экстракорпорального кровообращения — 81,3% в группе КШ+ЧКВ против 85,7% в группе ЧКВ-КШ (p = NS). По продолжительности оперативного вмешательства (КШ), частоте применения инотропной и вазопрессорной поддержки, а также объему интраоперационной кровопотери разницы выявлено не было (p = NS).
Выполнение КШ или ЧКВ в качестве первого этапа ГРМ приводило к достоверно большему объему запланированной реваскуляризации (исключая бассейн ПНА) соответствующим методом. Так, в группе ЧКВ+КШ было наложено 39 (22,9%) венозных шунтов и установлено 76 стентов против 25 (14,2%) ВШ и СЛП у больных ЧКВ+КШ (p<0,05). При этом, во II когорте средний диаметр установленного стента и длина стентированного

Шевченко Ю.Л., Ермаков Д.Ю., Вахрамеева А.Ю., Баранов А.В.
СРАВНИТЕЛЬНЫЕ РЕЗУЛЬТАТЫ РАЗЛИЧНЫХ ПРИНЦИПОВ ЭТАПНОЙ ГИБРИДНОЙ РЕВАСКУЛЯРИЗАЦИИ МИОКАРДА У ПАЦИЕНТОВ С ПРЕДВАРИТЕЛЬНЫМ СТЕНТИРОВАНИЕМ ВЕНЕЧНЫХ АРТЕРИЙ И ЭНДОВАСКУЛЯРНОЙ КОРРЕКЦИЕЙ ВЕНЕЧНОГО РУСЛА ПОСЛЕ КОРОНАРНОГО ШУНТИРОВАНИЯ участка также были достоверно больше (16,4±6,1 мм и 2,75±0,78 мм против 22,7±7,4 мм и 2,93±0,63 мм, соответственно, p<0,05), что связано с большей частотой реваскуляризации проксимальных сегментов КА и потребности в эндоваскулярной коррекции венечных артерий на всем протяжении зоны поражения (атеросклеротической бляшки). Также больные II группы чаше переносили более 1 этапа ЧКВ — 1,15±0,56 против 1,37±0,5 эпизода эндоваскулярной реваскуляризации (p<0,05).
Необходимо отметить, что частота дисфункции ВШ к концу периода наблюдения несколько превалировала над НЦП, при этом в группе КШ+ЧКВ разность между данными параметрами была выше, чем во II когорте — 18,5% НЦП и 23,1% НВТ против 22,3% НЦП и 24% НВТ (p = NS). Так, применение СЛП II и III поколения в нашем исследовании не уступало или обеспечивало несколько большую эффективность реваскуляризации в отдаленном периоде после ЧКВ по сравнению с венозным шунтированием не-ПНА бассейнов венечного русла.
По частоте периоперационных MACE и периоперационной характеристике в целом больные двух когорт ожидаемо не отличались (p = NS). Частота регистрации дисфункции венозных шунтов в отдаленном периоде наблюдения была одинакова в группах КШ+ЧКВ и ЧКВ+КШ — 23,1% против 24%, соответственно, (p = NS). Удельный вес НЦП недостоверно превалировал во II когорте — 17 (22,3%) случаев против 10 (18,5%) (p = NS), что также предположительно связано с большей средней протяженностью стентированного участка. Клиника РИМ также недостоверно чаще отмечалась у больных группы ЧКВ+КШ к 3 году наблюдения — 24,5% против 20,1% (p = NS), что связано с несколько большей частотой НЦП.
Число неблагоприятных сердечно-сосудистых событий через 36 месяцев достоверно не отличалось — 8 (16,7%) случаев в группе ЧКВ+КШ против 8 (16,3%) случаев MACE во второй когорте (p = NS). Удельный вес ОНМК составил 2 (4,2%) и 3 (6,1%), ИМ — 3 (6,3%) и 3 (6,1%), летальных исходов — 3 (6,3%) и 2 (4,1%) в группе КШ+ЧКВ и ЧКВ+КШ, соответственно, (p = NS).
Заключение
Исходя из полученных результатов исследования, можно сделать следующие выводы:
-
1. Гибридная реваскуляризация сердца выполнением коронарного шунтирования с формированием маммарно-коронарного анастомоза с передней нисходящей артерией преимущественно без экстракорпорального кровообращения, перед эндоваскулярной коррекцией, по сравнению со стратегией «ЧКВ перед КШ», показывает несколько более оптимальные 3-летние результаты в отношении рецидива ишемии миокарда (20,1% против 24,5%, p = NS) и частоты бинарного рестеноза (18,5% против 22,3%, p = NS).
-
2. Гибридная реваскуляризация сердца выполнением коронарного шунтирования с формированием
МКШ преимущественно без ИК первым этапом до ЧКВ и эндоваскулярной реваскуляризацией КА перед КШ одинаково безопасны для больных ИБС и не показывают достоверной разницы в частоте развития сердечно-сосудистых осложнений и смерти от всех причин через 3 года после оперативного вмешательства (16,7% против 16,3%, p = NS).
Список литературы Сравнительные результаты различных принципов этапной гибридной реваскуляризации миокарда у пациентов с предварительным стентированием венечных артерий и эндоваскулярной коррекцией венечного русла после коронарного шунтирования
- Lawton JS, Tamis-Holland JE, Bangalore S, Bates ER, Beckie TM, et al. 2021 ACC/AHA/SCAI Guideline for Coronary Artery Revascularization: A Report of the American College of Cardiology/American Heart Association Joint Committee on Clinical Practice Guidelines. Circulation. 2022; 145(3): 18-114. doi: 10.1161/CIR.0000000000001038.
- Thuijs DJ, Kappetein AP, Serruys PW, Mohr FW, et al. SYNTAX Extended Survival Investigators. Percutaneous coronary intervention versus coronary artery bypass grafting in patients with three-vessel or left main coronary artery disease: 10-year follow-up of the multicentre randomised controlled SYNTAX trial. Lancet. 2019; 394(10206): 1325-1334. doi: 10.1016/S0140-6736(19)31997-X.
- Brener SJ, Alapati V, Chan D, Da-Wariboko A, Kaid Y, Latyshev Y, et al. The SYNTAX II Score Predicts Mortality at 4 Years in Patients Undergoing Percutaneous Coronary Intervention. J Invasive Cardiol. 2018; 30(8): 290-294.
- Ганюков В.И., Кочергин Н.А., Шилов А.А., Тарасов Р. С., Козырин К.А., Прокудина Е.С. и др. Рандомизированное исследование гибридной коронарной реваскуляризации в сравнении со стандартными аортокоронарным шунтированием и многососудистым стентированием: 5 летние результаты исследования HREVS // Кардиология. — 2023. — №63(11). — С.57-63. doi: 10.18087/cardio.2023.11.n2475.
- Шевченко Ю.Л., Борщев Г.Г., Ульбашев Д.С., Землянов А.В. Выбор кондуитов в коронарной хирургии // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2019. — Т.14. — №1. — С.97-104. doi: 10.25881/BPNMSC.2019.69.57.019.
- Шевченко Ю.Л., Ермаков Д.Ю., Марчак Д.И. Дисфункция коронарных шунтов и стентов после хирургическоий реваскуляризации миокарда больных ИБС: патогенез, факторы риска и клиническая оценка // Вестник Национального медико-хирургического центра им. Н.И. Пирогова. — 2022. — Т.17. — №3. — С.94-100. doi: 10.25881/20728255_2022_17_3_94.
- Algoet M, Oosterlinck W, Balkhy HH. Reply to: Anaortic With No Touch to the Aorta Is a Central Technique to Decrease Invasiveness of CABG. Innovations (Phila). 2023; 18(3): 296. doi: 10.1177/15569845231168615.
- Nenna A, Nappi F, Spadaccio C, et al. Hybrid coronary revascularization in multivessel coronary artery disease: a systematic review. Future Cardiol. 2022; 18(3): 219-234. doi: 10.2217/fca-2020-0244.
- Hannan EL, Wu Y, Cozzens K, Sundt TM, et al. Hybrid Coronary Revascularization Versus Conventional Coronary Artery Bypass Surgery: Utilization and Comparative Outcomes. Circ Cardiovasc Interv. 2020; 13(10): e009386. doi: 10.1161/CIRCINTERVENTIONS.120.009386.
- Giambruno V, Jones P, Khaliel F, Chu MW, et al. Hybrid Coronary Revascularization Versus On-Pump Coronary Artery Bypass Grafting. Ann Thorac Surg. 2018; 105(5): 1330-1335. doi: 10.1016/j.athoracsur.2017.11.019.


