Сравнительный анализ биологических эффектов селективного агониста глюкокортикоидного рецептора CPDA на клеточные линии рака молочной железы различных молекулярных подтипов
Автор: Жидкова Екатерина Михайловна, Кузин Константин Александрович, Тилова Лейла Расуловна, Савинкова Алена Валерьевна, Борисова Ольга Игоревна, Лаврова Мария Дмитриевна, Максимова Варвара Павловна, Кирсанов Кирилл Игоревич, Якубовская Марианна Геннадиевна, Лесовая Екатерина Андреевна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и клинические исследования
Статья в выпуске: 6 т.16, 2017 года.
Бесплатный доступ
Глюкокортикоиды (GC) широко применяются в терапии рака молочной железы (РМЖ) в качестве средств сопроводительной терапии для снижения побочных эффектов цитостатических препаратов. При этом GС могут проявлять собственное про- или антипролиферативное действие на клетки РМЖ, в зависимости от их молекулярно-биологического подтипа, что, в свою очередь, может улучшать или ухудшать прогноз терапии. Кроме того, применение GC ведет к развитию побочных эффектов. Реализация биологического действия GC осуществляется путем активации глюкокортикоидного рецептора (GR) по двум механизмам: транс-репрессии, обусловливающей терапевтических эффект GC, и трансактивации, с которой связаны побочные эффекты, резистентность к цитотоксическим препаратам, а также прогрессия и метастазирование РМЖ. Ранее в нашей лаборатории было показано, что соединение класса селективных агонистов глюкокортикоидного рецептора (SEGRA) Compound A (CpdA) проявляет GR-зависимый противоопухолевый эффект на моделях гемобластозов in vitro, не запуская при этом механизм транс-активации GR. Цель исследования - изучение биологической активности CpdA в отношении РМЖ с различными молекулярными характеристиками на клеточных моделях in vitro. В ходе работы было показано антипролиферативное действие CpdA на клетки РМЖ различных молекулярно-биологических подтипов и его способность вызывать транс-репрессию GR-зависимых генов, не вызывая транс-активации. Сравнительный анализ эффектов CpdA и дексаметазона показал, что SEGRA потенциально являются более безопасными и эффективными препаратами как для использования в качестве средств поддерживающей терапии, так и для возможного адъюванта при проведении химиотерапии.
Молекулярные подтипы рака молочной железы, глюкокортикоиды, селективные агонисты глюкокортикоидного рецептора
Короткий адрес: https://sciup.org/140254006
IDR: 140254006 | УДК: 618.19-006.66:577-29 | DOI: 10.21294/1814-4861-2017-16-6-41-46
Текст научной статьи Сравнительный анализ биологических эффектов селективного агониста глюкокортикоидного рецептора CPDA на клеточные линии рака молочной железы различных молекулярных подтипов
Глюкокортикоиды (GC) широко используются в клинической практике, в том числе при лечении онкологических заболеваний. В терапии рака молочной железы (РМЖ) GC применяют в качестве адъювантов для расширения терапевтических интервалов и снижения побочных эффектов цитотоксических препаратов. Однако длительное применение GC может вызвать резистентность к противоопухолевым препаратам и способствовать прогрессии и метастазированию РМЖ [1].
Биологические эффекты GC реализуются посредством активации глюкокортикоидного рецептора (рис. 1). Терапевтические эффекты GC реализуются через ДНК-независимую трансрепрессию, приводящую к аресту клеточного цикла и гибели опухолевых клеток. Развитие побочных эффектов опосредовано запуском механизма трансактивации, для которого необходима димеризация GR [2–4]. Селективные агонисты GR, такие как Compound A, блокируют способность рецептора к димеризации и избирательно запускают в клетках механизм трансрепрессии [3–5]. Ранее нами и другими исследователями было показано, что данное соединение проявляет GR-зависимый противоопухолевый эффект in vitro и in vivo на моделях острого лимфобластного лейкоза, рака простаты и др. [4–7].
Цель исследования – изучение антипроли-феративной активности, трансрепрессорного и трансактивационного потенциала селективного агониста глюкокортикоидного рецептора (CpdA) на клеточных моделях РМЖ различных подтипов in vitro в сравнении с дексаметазоном.
Материал и методы
Клеточные культуры. Клеточные линии аденокарциномы человека MCF-7, MDA-MB-231, MDA-MB-453 и клетки эпителия молочной железы человека HBL-100 культивировали в стандартной среде DMEM («ПанЭко», Россия), содержащей 10 % эмбриональную сыворотку телят, пенициллин
(50 ед/мл) и стрептомицин (50 ед/мл) («ПанЭко», Россия) при 37 ° С в атмосфере 5 % СО 2 .
Определение кинетики пролиферации. Клетки (плотность посева 5000 кл/мл) культивировали в течение 10 сут в присутствии CpdA, дексаметазона (Dex) («KRKA», Словения) в концентрациях 0–10 мкМ, или растворителя (0,01 % ДМСО). Подсчет клеток проводили каждые 48 ч с помощью камеры Горяева.
Проточная цитофлуориметрия. Распределение клеток по фазам клеточного цикла после 24 ч обработки 100 мкМ CpdA/Dex исследовали с помощью метода проточной цитофлуориметрии с окраской йодистым пропидием (PI), как описано ранее [7].
Количественная полимеразная цепная реакция, сопряженная с обратной транскрипцией (ОТ-ПЦР). Реакцию обратной транскрипции, количественный ПЦР-анализ в режиме реального времени и оценку изменения экспрессии исследуемой мРНК проводили, как описано ранее [8]. Праймеры для амплификации были сконструированы с помощью базы данных Primer-Bank и пакета программ Oligo 6. Последовательности использованных праймеров для RPL27 F: ACCGCTACCCCCG-CAAAGTG, R: CCCGTCGGGCCTTGCGTTTA; INOS F: CGGCCATCACCGTGTTCCCC, R: TGCAGTCGAGTGGTGGTCCA; FKBP51 F : GAATGGTGAGGAAACGCCGAT, R: TGC-CAAGACTAAAGACAAATGGT; CCND1 F: GCTGGAGCCCGTGAAAAAGA, R: CTC-CGCCTCTGGCATTTTG; CCND2 F: CTACCTTCCGCAGTGCTCCTA, R: CCCA-GCCAAGAAACGGTCC; CCND3 F: TACCCGCCATCCATGATCG, R: AGGCAGTC-CACTTCAGTGC; COX2 F: CCGGGTACAATCG-CACTTAT, R: GGCGCTCAGCCATACAG.
Статистическая обработка данных. Все эксперименты выполнены в трех повторах. Средние значения и среднеквадратичные отклонения рассчитывали с помощью пакета программ Microsoft
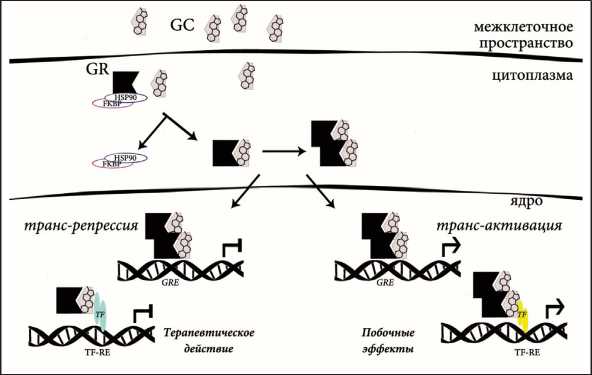
Рис. 1. Механизмы активации глюкокортикоидного рецептора.
Примечание: GC – глюкокортикоид, GR – глюкокортикоидный рецептор, TF – фактор транскрипции, RE – респонсивный элемент
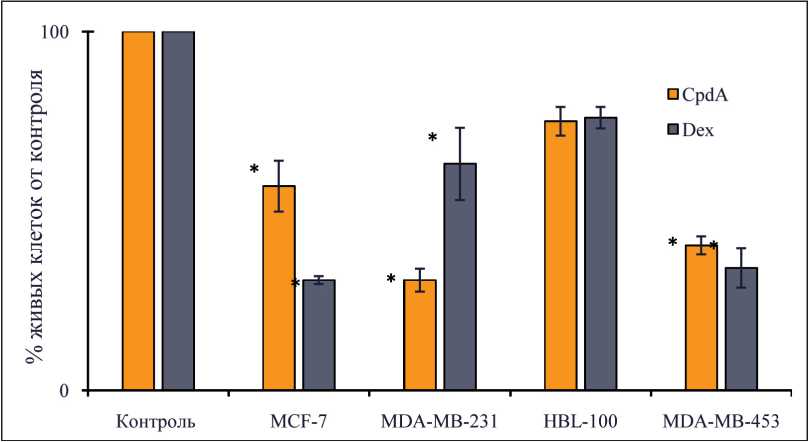
Рис. 2. Число жизнеспособных клеток на 10-е сут обработки (за 100 % принято число клеток в контрольных лунках). Примечание: * – различия статистически значимы по сравнению с группой контроля (р<0,05)
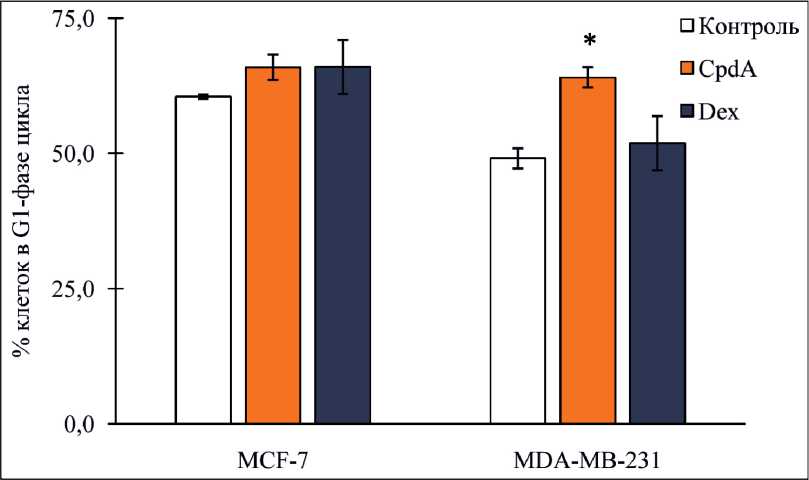
Рис. 3. Относительное число (%) клеток MCF-7 и MDA-MB-231 в G1-фазе клеточного цикла. Клетки культивировали с Dex, CpdA или растворителем в течение 24 ч. Анализ проводили методом проточной цитофлуориметрии, с окрашиванием PI.
Примечание: * – различия статистически значимы по сравнению с группой контроля (р<0,05)
Excel. Для определения статистической значимости выявленных различий использовали парный двухвыборочный t-тест Стьюдента для средних.
Результаты и обсуждение
Для проведения исследования были выбраны 3 клеточные линии РМЖ различных подтипов: MCF-7 (люминальный А), MDA-MB-231 (базальноподобный), MDA-MB-453 (HER2-положительный); а также линия HBL-100 (ER-отрицательные клетки эпителия молочной железы).
Антипролиферативный эффект CpdA на клетки РМЖ. Было показано, что эффекты CpdA и Dex заметно различаются для клеточных линий РМЖ различных подтипов (рис. 2). Эффект CpdA на клетки MDA-MB-231 оказался в два раза сильнее эффекта на клетки люминального подтипа РМЖ, в то время как дексаметазон проявил наиболее выраженное действие на клетки линии MCF-7. Для клеточных линий HER2-положительного подтипа не наблюдается существенных различий в эффектах CpdA и Dex.
Влияние CpdA на клеточный цикл. Известно, что глюкокортикоиды подавляют клеточное деление, вызывая клеточный арест лимфоидных клеток и остеобластов за счет снижения уровня D-циклинов [3, 8]. Нами было показано, что CpdA, наравне с дексаметазоном, тормозит клеточное деление, индуцируя арест клеток линий MCF-7 и MDA-MB-231 в G1-фазе (рис. 3).
Трансрепрессорный и трансактивационный потенциал CpdA. Для оценки запуска трансактивации нами был выбран ген FKBP51 (FK506 Binding Protein 51). Показано, что CpdA, в отличие от классических GC, не проявляет трансактивационного потенциала в клетках MCF-7 и слабо индуцирует транс-активационный механизм в клетках MDA-MB-231. В то же время CpdA индуцирует запуск трансрепрессии на уровне, близком к дексаметазону. Этот эффект более выражен в клетках люминального подтипа РМЖ, чем базальноподобного (рис. 4).
Заключение
CpdA, как и дексаметазон, обладает антипро-лиферативным эффектом на клетки различных подтипов РМЖ, а также подавляет экспрессию
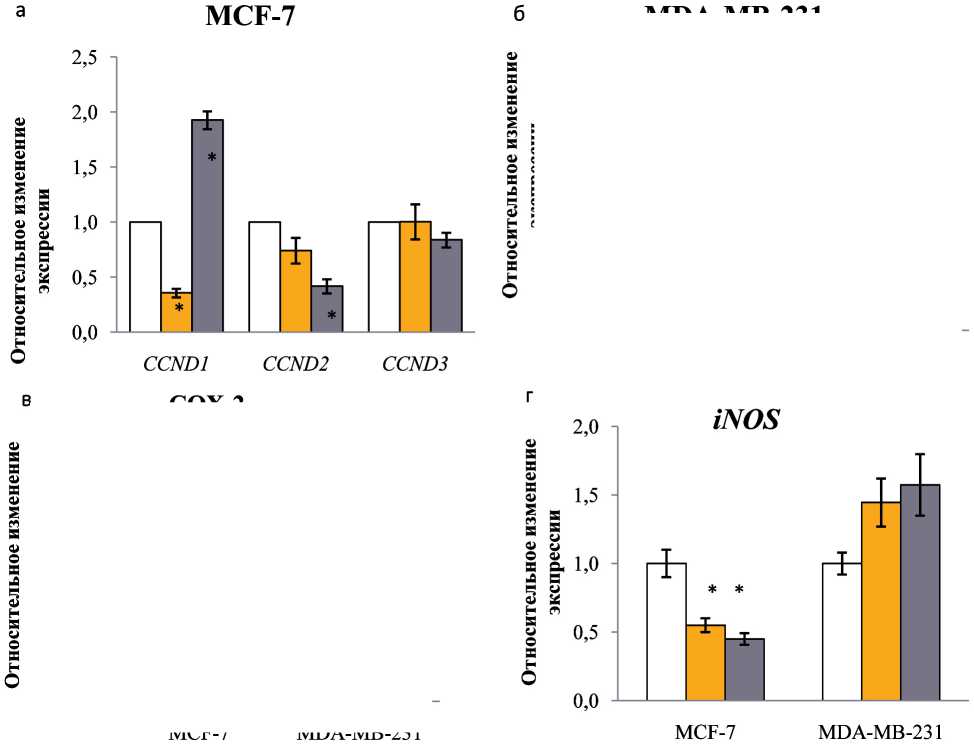
Рис. 4. Влияние Dex и CpdA на экспрессию циклинов (а, б), COX-2 (в) и iNOS (г) в клетках MCF-7 и MDA-MB-231. Клетки инкубировали с Dex, CpdA или растворителем в течение 4 ч. Уровень экспрессии определяли методом ОТ-ПЦР. Количество ПЦР-продуктов нормализовали по количеству ПЦР-продукта рибосомного белка L27 (Rpl27).
Примечание: * – различия статистически значимы по сравнению с группой контроля (р<0,05)
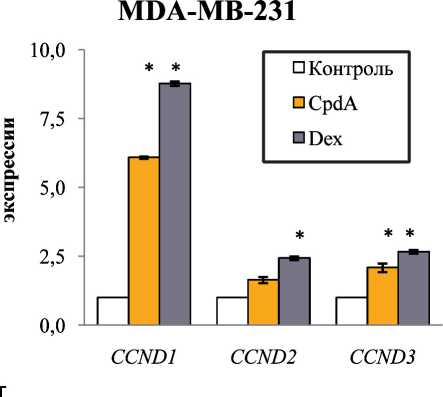
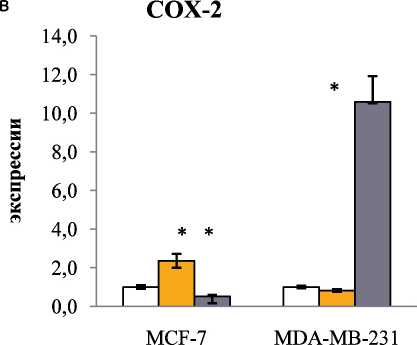
генов, CCND1,2 и iNOS в клетках MCF-7. Важно, что эффекты CpdA для клеток различных подтипов РМЖ заметно отличаются: CpdA обладает максимальным антипролиферативным эффектом на клетки базальноподобного подтипа РМЖ. Полученные результаты являются основанием для дальнейшего изучения SEGRA (в частности, CpdA)
Список литературы Сравнительный анализ биологических эффектов селективного агониста глюкокортикоидного рецептора CPDA на клеточные линии рака молочной железы различных молекулярных подтипов
- Lippman M., Bolan G., Huff K. The effects of glucocorticoids and progesterone on hormone-responsive human breast cancer in long-term tissue culture. Cancer Res. 1976 Dec; 36 (12): 4602-9.
- Adcock I.M. Molecular mechanisms of glucocorticosteroid actions. Pulm Pharmacol Ther. 2000; 13 (3): 115-26. DOI: 10.1006/pupt.2000.0243
- Schäcke H., Rehwinkel H. Dissociated glucocorticoid receptor ligands. Curr Opin Investig Drugs. 2004 May; 5(5): 524-8.
- Lesovaya E., Yemelyanov A., Swart A.C., Swart P., Haegeman G., Budunova I. Discovery of Compound A - a selective activator of the glucocorticoid receptor with anti-inflammatory and anti-cancer activity. Oncotarget. 2015 Oct 13; 6 (31): 30730-44. DOI: 10.18632/oncotarget.5078
- Lesovaya E.A., Yemelyanov A.Y., Kirsanov K.I., Yakubovskaya M.G., Budunova I.V. Antitumor effect of non-steroid glucocorticoid receptor ligand CpdA on leukemia cell lines CEM and K562. Biochemistry (Mosc). 2011 Nov; 76 (11): 1242-52. DOI: 10.1134/S000629791111006X
- Moran T.J., Gray S., Mikosz C.A., Conzen S.D. The glucocorticoid receptor mediates a survival signal in human mammary epithelial cells. Cancer res. 2000 Feb 15; 60 (4): 867-72.
- Савинкова А.В., Тилова Л.Р., Борисова О.И., Жидкова Е.М., Кузин К.А., Кирсанов К.И., Белицкий Г.А., Будунова И.В., Якубовская М.Г., Лесовая Е.А. Противоопухолевый эффект энантиомеров CpdA in vitro на модели острого лимфобластного лейкоза. Российский биотерапевтический журнал. 2017; 16 (1): 61-9. DOI: 10.17650/1726-9784-2017-16-1-61-69
- Sánchez I., Goya L., Vallerga A.K., Firestone G.L. Glucocorticoids reversibly arrest rat hepatoma cell growth by inducing an early G1 block in cell cycle progression. Cell Growth Differ. 1993 Mar; 4 (3): 215-25.


