Сравнительный анализ биоразнообразия эндофитных микроорганизмов яровой твердой пшеницы на разных фазах роста и развития растений
Автор: Долгов А.Р., Уткин Д.В., Хачатуров Э.Г., Поливанов Д.А., Щербакова Н.Е., Карлов М.В., Касаткин М.Ю., Степанов С.А., Шутарева Г.И.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Изучено биоразнообразие видового состава эндофитных микроорганизмов яровой твердой пшеницы, выделенных в разные фазы роста и развития растений. В работе использовали семена и растения на разных фазах вегетации сортов саратовской селекции: ‘Саратовская золотистая', ‘Луч 25' и ‘Памяти Васильчука'. Взятие проб растений с апреля по июнь 2023 г. осуществлялось с сортоиспытательного участка Федерального аграрного научного центра Юго-Востока. Эндофитные микроорганизмы выделяли из семян и органов растений (корни, листья, стебли, колосья) после поверхностной стерилизации и гомогенизации. Идентификацию выделенных микроорганизмов осуществляли бактериологическими методами и с использованием MALDI ToF-масс-спектрометрии. В результате проведенных исследований выделено 30 штаммов бактерий, принадлежащих родам Pantoea, Enterobacter, Citrobacter, Pseudomonas, Bacillus и Staphylococcus. Отмечено изменение видового состава микроорганизмов в процессе онтогенеза растений, связанного с активацией, колонизацией и селективным преимуществом отдельных видов микроорганизмов. Выделенные штаммы эндофитных микроорганизмов являются перспективными для создания биопрепаратов с целью повышения устойчивости растений к абиотическим и биотическим факторам.
Triticum durum, яровая твердая пшеница, эндофитные микроорганизмы, фенологические фазы
Короткий адрес: https://sciup.org/147244920
IDR: 147244920 | УДК: 581.522 | DOI: 10.17072/1994-9952-2024-2-165-175
Текст научной статьи Сравнительный анализ биоразнообразия эндофитных микроорганизмов яровой твердой пшеницы на разных фазах роста и развития растений
Из более двадцати видов пшеницы основное значение в производстве имеют два вида – мягкая и твердая, причем яровой пшенице принадлежит одно из ведущих мест в зерновом балансе. Зерновые имеют очень широкую экологическую амплитуду и пластичность, т. е. могут возделываться в различных климатических и почвенных зонах. Пшеница твёрдая ( Triticum durum Desf.) – одна из древнейших продовольственных культур. В России посевы твердой пшеницы сконцентрированы в основном в степных и лесостепных районах Поволжья, Южного Урала, Западной Сибири и Алтайского края. По сравнению с мягкой пшеницей, ареал распространения твердой пшеницы ограничен из-за меньшей степени адаптивности и пластичности. В частности, у сортов, относящихся к виду твердой пшеницы, продолжительность фаз развития значительно меньше варьирует, чем у мягкой пшеницы [Куперман, 1984]. В то же время эта культура, по сравнению с мягкой пшеницей, более устойчива к грибковым заболеваниям. Одна из главных причин сокращения посевов твёрдой пшеницы в Поволжье – более высокая требовательность к условиям выращивания, особенно к уровню влагообеспеченности, в связи с тем, что она обладает меньшей устойчивостью к жаре и засухе [Васильчук, 2001].
В настоящее время все больший интерес вызывает изучение взаимоотношений микроорганизмов с другими организмами и побуждает как к выявлению фундаментальных основ симбиоза микроорганизмов с высшими растениями, так и к поиску новых путей практического применения этих знаний в области сельского хозяйства [Васильева и др., 2019]. Как известно, растения могут обеспечить индивидуальный микробиом, избирательно пропуская необходимые микроорганизмы в эндосферу. Выявлено, что некоторые микроорганизмы повышают устойчивость растений к абиотическим факторам (засуха, оводнение, засоление, содержание тяжелых металлов в почве) вследствие изменения уровня выработки соответствующих фитогормонов [Васильева и др., 2019]. В связи с этим представляется актуальным изучение специфической микробиоты сельскохозяйственной культуры пшеницы для повышения ее стрессоустой-чивости к различным неблагоприятным факторам с использованием биологических препаратов на основе эндофитных микроорганизмов. Эндофитами считают микроорганизмы, которые колонизируют внутренние ткани растений, не вызывая патологических изменений и не оказывая отрицательного влияния на его развитие [Чеботарь и др., 2015]. Известно, что эндофитные микроорганизмы оказывают влияние на рост растения-хозяина. Также важным свойством эндофитов является защита растений от фитопатогенов, осуществляемая либо с помощью синтеза веществ противомикробного действия, либо через индукцию устойчивости к факторам патогенности. Эндофиты защищают растение не только от воздействия биотических факторов, но могут способствовать адаптации растений и к негативному влиянию абиотических факторов. Разнообразие эндофитных микроорганизмов демонстрирует сложную сеть взаимодействий с растениями-хозяевами, поскольку они колонизируют органы растений на определенных фазах их роста и развития [Bashir, Iqbal, Hasnain, 2020].
В настоящее время имеется ограниченная информация о разнообразии и видовом составе бактерий эндосферы яровой твердой пшеницы, практически отсутствуют данные о сортоспецифических особенностях и изменении видового состава в процессе роста и развития растений. Большинство работ посвящено изучению эндофитов в тканях и органах мягкой пшеницы [Robinson et al., 2015; Comby et al., 2017; Сар- варова и др., 2018; Сарварова, 2021]. Установлено, что состав эндофитного бактериального сообщества в пшенице (Triticum aestivum) зависит от типа ткани и стадии развития растения, а также доступности питательных веществ в почве. Ранее из семян твердой пшеницы были выделены эндофиты преимущественно рода Bacillus и изучена их фунгицидная активность [Щербаков, Заплаткин, Чеботарь, 2013].
Данное исследование предпринято с целью проведения сравнительного анализа биоразнообразия эндофитных микроорганизмов, выделенных в разные фазы роста и развития трех районированных в России сортов яровой твердой пшеницы. Изучение структуры бактериального сообщества яровой твердой пшеницы и их прогностических функций позволит предложить их дальнейшее использование в качестве биоинокулянтов для повышения урожайности сельскохозяйственных культур и устойчивости к болезням.
Объект и методы исследования
В работе использовали семена и растения на разных фазах вегетации яровой твердой пшеницы ( Triticum durum Desf.) сортов ‘Саратовская золотистая’, ‘Луч 25’ и ‘Память Васильчука’, созданных селекционерами Федерального государственного бюджетного научного учреждения «Федеральный аграрный научный центр Юго-Востока» (ФГБНУ «ФАНЦ Юго-Востока», Саратов). Указанные сорта отличаются более высоким адаптивным потенциалом по сравнению с сортами из международных научных центров ИКАРДА (Сирия, Кения), СИММИТ (Мексика) [Васильчук, 2001]. Они являются более засухоустойчивыми и высокоурожайными среди сортов твердой пшеницы саратовской селекции, формируют крупное зерно с высоким содержанием каротиноидов и клейковины. Сорт ‘Саратовская золотистая’ по содержанию каротиноидов превосходит все сорта яровой твердой пшеницы. С его участием получены два других сорта – ‘Луч 25’ и ‘Памяти Васильчука’. Для сорта ‘Луч 25’ характерна устойчивость к прорастанию в колосе на корню, что связано с низкой активностью фермента α-амилазы в зерне. Сорт ‘Памяти Васильчука’ устойчив к ряду заболеваний – бурой пятнистости, мучнистой росе, пыльной головне.
Основные наблюдения и учет проводили в мелкоделяночных опытах на полях пристанционного селекционного севооборота ФГБНУ «ФАНЦ Юго-Востока», повторность опытов трёхкратная. Посев производили ручным аппаратом конструкции Одесского селекционно-генетического института семенами, взятыми из средней части колоса. Норма высева, принятая в производственных посевах Саратовской обл., составляла 400 семян на 1 м2. Обработка полей полностью соответствовала агротехническим требованиям, предъявляемым в зоне для возделывания яровой пшеницы. Взятие образцов растений осуществляли с апреля по июнь 2023 г. в разные фенологические фазы морфогенеза [Куперман, 1984]: фазу прорастание-первый лист – на 11-й день после посева семян, фазу выход в трубку – стеблевание – на 35-й день после прорастания семян, фазу колошение-начало цветения – на 60-й день после прорастания семян (рис. 1, 2).
Почва селекционного севооборота ФГБНУ «ФАНЦ Юго-Востока» отличается высоким плодородием и значительным содержанием питательных веществ. Средние значения этих величин составляют: азот – 0.29%, фосфор (Р 2 О 5 ) – 0.12%; калий (К 2 О) – 1.05%. Почва представляет собой легкоглинистый южный чернозем, содержащий 2.55% гумуса и имеющий рН от 6.8 до 7.2 [Медведев, 2001]. Ранее Д.М. Успано-вой с соавт. [2022] было показано присутствие в указанном типе почв 31 вида гетеротрофных бактерий 15 родов, включая представителей Bacillus, Pseudomonas, Staphylococcus и др.
Климат Саратова – умеренно-континентальный с длительной умеренно холодной зимой и жарким засушливым летом. Среднемесячная температура апреля 2023 г. составляла +12ºС (среднесуточные показатели +4 … +21ºС), мая – +20ºС (среднесуточные показатели +11 … +26ºС), июня – +21ºС (среднесуточные показатели +14 … +25ºС). Норма осадков в апреле ‒ 46 мм, в мае – 37 мм, в июне – 59 мм.

Рис. 1. Растения яровой твердой пшеницы на опытном поле в фазу прорастание – первый лист [Spring durum wheat plants in the experimental field in the germination phase – the first leaf]

Рис. 2. Растения яровой твердой пшеницы в фазу выход в трубку – стеблевание: А – ‘Саратовская золотистая’, Б – ‘Луч 25’, В – ‘Памяти Васильчука’
[Plants of spring durum wheat in the tube – stemming phase: A – Saratov golden, B – Ray 25, C – Memory of Vasilchuk]
Для получения изолятов эндофитных бактерий использовали следующую методику. Семена и части растений общей массой 1 г промывали в стерильном физиологическом растворе для удаления посторонних частиц [Щербаков, 2013] (рис. 3). Затем образцы выдерживали в течение 15 мин в смеси 3%-ной перекиси водорода и 96%-ного этилового спирта (1:1) для удаления поверхностной эпифитной микрофлоры [Широких и др., 2008]. Образцы трехкратно отмывали от перекиси и спирта в стерильном физиологическом растворе и помещали в стерильные керамические ступки. Для контроля качества поверхностной стерилизации физраствор из последней серии высевали на поверхность питательного ГРМ агара (ФБУН ГНЦ ПМБ, Оболенск). К растительному материалу добавляли 10 мл стерильного физраствора и перетирали пестиком до получения однородной кашеобразной массы [Щербаков, 2013]. Полученную массу методом последовательных серийных разведений высевали на поверхность ГРМ агара (ФБУН ГНЦ ПМБ, Оболенск).
Рис. 3. Образцы растений яровой твердой пшеницы [Samples of spring durum wheat plants]
Контроль стерильности проводили высевом смывов с поверхности растительных сегментов на среды того же состава и методом отпечатков. Культивирование осуществляли при температуре 28ºС в течение 24–48 ч. Подсчитывали количество колониеобразующих единиц (КОЕ) в каждой чашке и пересчитывали их количество на 1 г сырой массы растений. Для определения физиолого-биохимических особенностей бактериальных клеток были выбраны признаки, которые в соответствии с Руководством Берджи по систематике архей и бактерий [Whitman, 2015] важны для установления систематического положения бактерий.
В результате проведенных исследований из семян и органов растений выделено 30 штаммов эндофитных бактерий. Биохимическую идентификацию полученных изолятов проводили с использованием Руководства Берджи по систематике архей и бактерий [Whitman, 2015] и on-line определителя ABIS [Advanced Bacterial…, 2024]. Верификацию и определение неидентифицированных видов осуществляли с помощью метода MALDI-ToF масс-спектрометрии. Для этого из суточной культуры микроорганизмов с одной колонии изготавливали белковые экстракты с использованием этанола, муравьиной кислоты и 80%-ной трифторуксусной кислоты. Экстракцию проводили в соответствии с МУ 4.2.3.733-21. В качестве матрицы использовали насыщенный водный раствор α-циано-4-гидроксикоричной кислоты, ацетонитрила и 5%-ной трифторуксусной кислоты. Сбор спектров производился в автоматическом режиме на масс-спектрометре Microflex™ LT MALDI-TOF (Bruker Daltonics, Германия) с использованием программы Flex Control (ver. 3.3). Полученные масс-спектры анализировали в программе Biotyper 3 (Bruker Daltonics, Германия). Таксономическое положение исследованных изолятов определяли на основании значения индекса соответствия (score value, SV).
Статистическую обработку полученных данных осуществляли с применением общепринятых статистических методов в программе Microsoft Office Excel (Microsoft, США). После установления видовой принадлежности штаммов определяли индекс их встречаемости (R) среди изученных сортов пшеницы. При сравнительном анализе видового разнообразия микроорганизмов, определении различий их состава между сортами растений использовали коэффициент сходства (коэффициент Жаккара, K J ) – отношение числа общих видов для двух выборок к общему числу видов без учета общих видов.
Результаты и их обсуждение
Биоразнообразие эндофитов яровой твердой пшеницы
Ранее было показано, что в семенах и тканях мягкой пшеницы содержатся бактериальные эндофиты преимущественно рода Bacillus [Сарварова и др., 2018], а также Pseudomonas, Enterobacter [Сарварова, 2021]. M. Comby с соавторами [Comby et al., 2017] выделили из растений мягкой пшеницы эндофиты, принадлежавшие к 9 родам бактерий, в том числе Bacillus , Pseudomonas , Pantoea .
Нами впервые выделены эндофиты у яровой твердой пшеницы сортов саратовской селекции. Всего из семян и органов растений трех сортов яровой твердой пшеницы выделено 30 штаммов эндофитных микроорганизмов, принадлежащих к 8 видам, 6 родам бактерий (табл. 1). Из них 21 штамм (70%) принадлежали к грамотрицательным бактериям родов Pantoea , Enterobacter , Citrobacter , Pseudomonas типа Pseu-domonadota и 9 штаммов (30%) ‒ к грамположительным бактериям родов Bacillus и Staphylococcus типа Bacillota.
Таблица 1 Таксономическое положение выделенных эндофитных микроорганизмов
[Taxonomic position of isolated endophytic microorganisms]
|
Вид |
Количество штаммов (% от общего количества) |
Семейство |
Порядок |
Класс |
Тип |
|
Pantoea agglomerans |
8 (26.7%) |
Erwiniaceae |
Enrterobac-teriales |
Gammaproteobacteria |
Pseudo-monadota |
|
Enterobacter cloacae |
7 (23.3%) |
Enterobacte-riaceae |
|||
|
Citrobacter koseri |
2 (6.7%) |
||||
|
Pseudomonas fluorescens |
3 (10.0%) |
Pseudomo-nadaceae |
Pseudomonadales |
||
|
Pseudomonas chlororaphis |
1 (3.3%) |
||||
|
Bacillus mycoides |
7 (23.3%) |
Bacillaceae |
Bacillales |
Bacilli |
Bacillota |
|
Bacillus altitudinis |
1 (3.3%) |
||||
|
Staphylococcus lentus |
1 (3.3%) |
Staphylococ-caceae |
|||
|
Всего |
30 (100%) |
- |
- |
- |
- |
Эндофиты семян яровой твердой пшеницы
По данным Щербакова и соавторов, в семенах озимой мягкой и твердой пшеницы содержится не более 2–3-х морфотипов бактерий, а доминирующей группой являются грамположительные спорообразующие бактерии рода Bacillus [Щербаков, Заплаткин, Чеботарь, 2013]. Количество видов эндофитов, выделенных нами из одного сорта яровой твердой пшеницы, составило от 1 до 4. Микробиота семян яровой твердой пшеницы представлена видами P. agglomerans (R=100%), E. cloacae (R=67%), B. mycoides (R=67%), B. altitudinis (R=33%) (табл. 2).
Среди эндофитов обнаружены почвенные бактерии B. mycoides, ризобактерии B. altitudinis. Бактерии вида P. agglomerans наиболее часто выделяются с поверхности семян и листьев растений. Бактерии E. cloacae содержатся в фекалиях животных и человека.
Таблица 2
Распределение доминирующих видов эндофитных бактерий в семенах яровой твердой пшеницы
[Distribution of the dominant species of endophytic bacteria in spring durum wheat seeds]
Сорта яровой твердой пшеницы
‘Саратовская золотистая’ I ‘Луч 25’ I ‘Памяти Васильчука’
Виды бактерий и номер штамма авторской коллекции
|
E. cloacae 1а P. agglomerans 2а B. mycoides 5 |
E. cloacae 1 P. agglomerans 2 B. altitudinis 3 B. mycoides 4 |
P. agglomerans 6 |
Наибольшее сходство видового состава эндофитных бактерий семян (K J =40%) отмечено у сортов ‘Саратовская золотистая’ и ‘Луч 25’.
Эндофиты яровой твердой пшеницы в разные фазы вегетации растений
A.F. Bintarti и соавторы [2022] на модели фасоли обыкновенной показали, что из семян растений выделяется, как правило, ограниченное количество видов микроорганизмов. При прорастании семян активируется ряд ферментов и стимулируется рост эндофитных представителей микробиома семян, которые, вероятно, находятся в состоянии покоя до прорастания семени [Cope-Selby et al., 2017]. При этом видовой состав эндофитных бактерий существенно изменяется. В то же время обнаруживаются виды микроорганизмов, содержащиеся в семенах.
По нашим данным, через 11 дней после прорастания семян, наряду с ранее обнаруженными видами P. agglomerans (R=100%), B. mycoides (R=33%), выделены виды бактерий P. fluorescens (R=67%) , C. koseri (R=67%) (табл. 3).
Таблица 3 Распределение доминирующих видов эндофитных бактерий в растениях яровой твердой пшеницы на разных фазах вегетации
[Distribution of the dominant species of endophytic bacteria in spring durum wheat plants at different phases of vegetation]
|
Продолжительность вегетации с момента посева (дней) / Фенофаза [Куперман, 1984] |
Органы растений |
Сорта яровой твердой пшеницы |
||
|
‘Саратовская золотистая’ |
‘Луч 25’ |
‘Памяти Васильчука’ |
||
|
Виды бактерий и номер штамма авторской коллекции |
||||
|
11 / Прорастание -первый лист |
Лист |
P. agglomerans 7а P. fluorescens 7б |
P. agglomerans 8 C. koseri 9 B. mycoides 10 |
P. fluorescens 11 C. koseri 12 P. fluorescens 13 P. agglomerans 14 |
|
35 / Выход в трубку -стеблевание |
Корень |
P. chlororaphis 22 |
B. mycoides 16 |
E. cloacae 23 |
|
Стебель |
E. cloacae 15 |
E. cloacae 24 |
||
|
Лист |
E. cloacae 20 B. mycoides 21 |
B. mycoides 19 |
E. cloacae 18 |
|
|
60 / Колошение, начало цветения |
Стебель |
S. lentus 28 |
НВ |
НВ |
|
Лист |
НВ |
НВ |
B. mycoides 29 |
|
|
Колос |
НВ |
P. agglomerans 26 |
P. agglomerans 34 |
|
Примечание. НВ – эндофиты не выделены.
Представители вида P. fluorescens наиболее часто встречаются в сельскохозяйственных почвах, обнаруживаются на листьях и корнях растений. Обращает на себя внимание присутствие среди бактериальных эндофитов растений нормальной микрофлоры человека и животных, таких как C. koseri и E. cloacae.
В процессе онтогенеза растения из ризосферы, филосферы в различные ткани растений попадают новые виды бактерий, и видовой состав эндосферной микробиоты изменяется. В то же время видовое разнообразие бактерий в тканях растений может уменьшиться за счет селективного преимущества одних видов микроорганизмов перед другими. По нашим данным, через 35 дней после прорастания семян в видовом составе бактерий превалировали E. cloacae (R=100%), B. mycoides (R=67%). У сорта ‘Саратовская золотистая’ в корнях обнаружен эндофит P. chlororaphis (R=33%) – бактерия, используемая в качестве инокулянта почвы в сельском хозяйстве и садоводстве.
Представляет интерес выявленный переход бактерий P. agglomerans у сортов ‘Луч 25’ и ‘Памяти Ва-сильчука’ из проростков в колос в фазу цветения на 60-й день после прорастания семян (табл. 3), что предполагает возможную вертикальную передачу клеток P. agglomerans от взрослого растения к семенам. В подтверждение этого представители P. agglomerans изначально были обнаружены в семенах яровой твердой пшеницы всех трех использованных сортов пшеницы. Наиболее изученным и, вероятно, наиболее важным путем передачи является колонизация корней растения бактериями из почвы. В меньшей степени изучена горизонтальная передача эндофитов через надземные части растения (устьица эпидермиса листьев и стебля) и вертикальный перенос эндофитов [Frank, Saldierna Guzmán, Shay, 2017; Rana et al., 2020]. Лучшее понимание путей и способов передачи бактериальных эндофитов принесет пользу фундаментальным и прикладным исследованиям взаимодействий растений и эндофитов как в сельскохозяйственных, так и в естественных экосистемах.
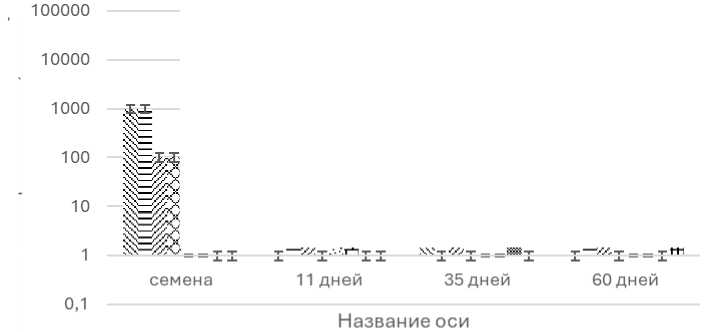
По нашим данным, на разных стадиях роста и развития растений менялся качественный и количественный состав микроорганизмов. Концентрация различных видов бактерий колебалась от 100 КОЕ/г до 1×104 КОЕ/г (рис. 4). При прорастании семян и дальнейшем развитии растения происходит постепенная элиминация грамположительных почвенных бактерий рода Bacillus (с 700 КОЕ/г до 100 КОЕ/г) и увеличение микробиоты грамотрицательных бактерий: E. cloacae ( с 1 000 КОЕ/г до 10000 КОЕ/г), P. agglomerans ( с 1 000 КОЕ/г до 3 000 КОЕ/г), P. chlororaphis (с 0 до 10 000 КОЕ/г). Факт превалирования среди эндофитов грамотрицательных над спорообразующими бактериями ранее было описано для тефа Eragrostis tef (Zuccagni) Trotter семейства Злаки [Tsegaye Z. et al., 2018].
」/ шоу CXBUexl g 江nd ①.oieg 0gl。① һииоү

7 E.cloacae
二 P.agglomerans 女 В. mycoides v B.altitudinis
^ P.fluorescens ^ P.chlororaphis M- S.lentus
Рис. 4. Количество выделенных эндофитов в КОЕ на 1 г растительной ткани на разных фазах роста и развития растений
[The number of isolated endophytes in CFU per 1 g of plant tissue at different phases of plant growth and development]
Ряд выделенных бактериальных эндофитов имеет прикладное значение, в частности, в повышении устойчивости растений к абиотическим и биотическим факторам. Бактерии P. agglomerans могут служить биоконтролирующим организмом для борьбы с болезнями растений. Они используются для борьбы с фитофторозом, заболеванием растений, вызываемым бактерией Erwinia amylovora , являются симбионтами медоносных пчел. Бактерии P. fluorescens стимулируют рост растений, способствуют разложению различных загрязняющих веществ и могут быть использованы для борьбы с патогенами растений. Спорообразующие бактерии B. altitudinis являются стимулирующими рост растений ризобактериями [Малева и др., 2023] и ранее были выделены из корней мягкой пшеницы [Yue et al., 2019]. По данным Yue Z. и соавторов [2019], присутствие эндофита B. altitudinis повышает стрессоустойчивость мягкой пшеницы к абиотическим факторам и увеличивает всхожесть семян. Использование стимулирующих рост растений бактериальных эндофитов перспективно для повышения продуктивности сельскохозяйственных культур.
Заключение
В результате проведенных исследований из семян и растений яровой твердой пшеницы выделены 30 штаммов эндофитных бактерий видов P. agglomerans , E. cloacae , C. koseri , P. fluorescens , P. chlororaphis ,
-
B. mycoides , B. altitudinis , S. lentus. Показало изменение парадигмы эндофитного бактериального разнообразия на разных стадиях роста. Установлено, что сорта пшеницы отличаются по видовому составу эндофитных бактерий. Приуроченность видового состава бактериальных эндофитов к тому или иному сорту пшеницы определяется, очевидно, генотипом сорта, т.е. совокупностью всех наследственных свойств особи, обусловливающих морфофизиологические особенности сорта. На видовой состав эндофитов влияют генотип растения-хозяина, тип ткани, стадия роста и состояние здоровья растения. Разнообразие в количественном и качественном составе эндофитной микрофлоры у разных сортов, в разных органах, на разных стадиях развития согласуется с предположением о том, что различные физиологические структуры, метаболиты и особенности роста растений влияют на их способность привлекать и давать селективные преимущества различным эндофитным бактериям, в том числе вступающим в симбиотическую связь с растением-хозяином. Эндофитные бактерии могут корректировать видовой состав и разнообразие в зависимости от различных генотипов растений, органов, состояния здоровья и стадий роста, чтобы получать постоянный запас питательных веществ. Заселение различными эндофитами тканей растений обеспечивает многочисленные возможности для улучшения роста растения-хозяина. Таким образом, выделенные бактериальные эндофиты могут образовывать оптимальную ассоциацию с тканями растений и использоваться в качестве источника биоудобрений для устойчивого сельского хозяйства. Будущие исследования предполагают изучение роли эндофитных сообществ в производстве основных первичных и вторичных метаболитов, а также выявление механизмов положительного влияния эндофитов на растения и повышения урожайности сельскохозяйственных культур.
Список литературы Сравнительный анализ биоразнообразия эндофитных микроорганизмов яровой твердой пшеницы на разных фазах роста и развития растений
- Васильева Е.Н. и др. Эндофитные микроорганизмы в фундаментальных исследованиях и сельском хозяйстве // Экологическая генетика. 2019. № 1. URL: https:IIcyberlenlnka.ruIartlcleInIendofltnye-mikroorganizmy-v-fundamentalnyh-issledovaniyah-i-selskom-hozyaystve.
- Васильчук Н.С. Селекция яровой твердой пшеницы. Саратов, 2001. 123 с.
- Куперман ФМ. Mорфофизиология растений. M., 1984. 240 с.
- Mалева M.r. и др. Влияние биоудобрения на биомассу и содержание низкомолекулярных антиоксидантов у Brassica oleracea при биофортификации медью // Субтропическое и декоративное садоводство. 2023. № 84. С. 130-142.
- Mедведев И.Ф. Агроэкологические основы повышения плодородия склоновых черноземных почв Поволжья: автореф. дис.... докт. с/х наук. Саратов, 2001. 43 с.
- Сарварова Е.Р. Поиск новых свойств эндофитных бактерий Bacillus subtilis Cohn.: дис.... канд. биол. наук. Уфа, 2021. 124 с.
- Сарварова Е.Р. и др. Выделение эндофитов из диких и культурных видов пшеницы. Текст: электронный // Современные подходы и методы в защите растений: материалы Всерос. науч.-практ. конф. с междунар. участием. Екатеринбург: Изд-во Урал. ун-та, 2018. С. 204-206.
- Успанова ДМ. и др. Биоремедиационный потенциал аборигенных микроорганизмов чернозема южного // Поволжский экологический журнал. 2022. № 2. С. 21б-231.
- Чеботарь В.К. и др. Эндофитные бактерии в микробных препаратах, улучшающих развитие растений (обзор) // Прикладная биохимия и микробиология. 2015. Т. 51, № 3. С. 283-289.
- Широких А. А. и др. Выделение и оценка биорегуляторных свойств эндофитных бактерий // Теоретическая и прикладная экология. 2008. № 3. С. 73-80.
- Щербаков А. В. Эндофитные сообщества сфагновых мхов как источник бактерий - эффективных ассоциантов сельскохозяйственных культур: дис.... канд. биол. наук. СПб., 2013. 179 с.
- Щербаков А.В., Заплаткин А.Н., Чеботарь В.К. Эндофитные бактерии, населяющие семена пшеницы, перспективные продуценты микробных препаратов для сельского хозяйства // Достижения науки и техники АПК. 2013. № 7. URL: https:IIcyberlenlnka.ruIartlcleInIendofltnye-bakterll-naselyayuschle-semena-pshenitsy-perspektivnye-produtsenty-mikrobnyh-preparatov-dlya-selskogo-hozyaystva.
- Advanced Bacterial Identification Software. URL: https:Htgw1916.net/bacterla_logare_desktop.html. (дата обращения: 20.02.2024).
- Bashlr S., Iqbal A., Hasnaln S. Comparative analysis of endophytic bacterial diversity between two varieties of sunflower Helianthus annuus with their PGP evaluation // Saudi J. Biological Scl. 2020. Vol. 27(2). P. 720-726.
- Bintarti A.F. et al. Endophytic microbiome variation among single plant seeds // Phytoblom. J. 2022. Vol. 6(1). P. 45-55.
- Comby M. et al. Screening of wheat endophytes as biological control agents against Fusarium head blight using two different in vitro tests // Microbiological Research. 2017. Vol. 202. P. 11-20.
- Cope-Selby N. et al. Endophytic bacteria in Miscanthus seed: Implications for germination, vertical inheritance of endophytes, plant evolution and breeding // GCB Bioenergy. 2017. Vol. 9. P. 57-77.
- Frank A.C., Saldierna Guzman J.P., Shay J.E. Transmission of bacterial endophytes // Microorganisms. 2017. Vol. 5(4). P. 70.
- Rana K.L. et al. Biodiversity, phylogenetic profiling, and mechanisms of colonization of seed microbi-omes // New and Future Developments in Microbial Biotechnology and Bioengineering / eds.: Ali Asghar Raste-gari, Ajar Nath Yadav, Neelam Yadav, Elsevier. 2020. Chapter 7. P. 99-125.
- Robinson R.J. et al. Endophytic bacterial community composition in wheat (Triticum aestivum) is determined by plant tissue type, developmental stage and soil nutrient availability // Plant and Soil. 2015. Vol. 405(1-2). P. 381-396.
- Tsegaye Z. et al. Characterization and identification of tef (Eragrostis tef) seed endophytic bacterial species and evaluate their effect on plant growth promotion // J. Plant Pathol. Microbiol. 2018. Vol. 9(4): 1000438.
- Whitman W.B., ed. Bergey's Manual of Systematics of Archaea and Bacteria. Hoboken, JohnWiley & Sons, Inc., 2015.
- Yue Z. et al. Microbiological Insights into the Stress-Alleviating Property of an Endophytic Bacillus alti-tudinis WR10 in Wheat under Low-Phosphorus and High-Salinity Stresses // Microorganisms. 2019. Vol. 7. URL: https://api.semanticscholar.org/CorpusID:207815604.


