Сравнительный анализ геномных характеристик у референтных штаммов Sinorhizobium meliloti - симбионтов люцерны
Автор: Румянцева М.Л., Мунтян В.С., Черкасова М.Е., Андронов Е.Е., Саксаганская А.С., Дзюбенко Е.А., Дзюбенко Н.И., Симаров Б.В.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Генетические ресурсы, интрогрессия, иммунитет (к 130-летию со дня рождения Н.И. Вавилова)
Статья в выпуске: 5 т.52, 2017 года.
Бесплатный доступ
Растительно-микробное симбиотическое взаимодействие - это уникальная высокоспецифичная биологическая система фиксации атмосферного азота и его трансформации в соединения, доступные для живых организмов. Принципиально новым подходом может стать создание системы генетического мониторинга стабильности хозяйственно ценных штаммов симбионтов в микробиомах агроэкосистем. Сопоставление геномных характеристик симбиотически активных штаммов может позволить выявить функционально значимые маркерные последовательности и стать основой для создания такой системы. Симбиотически активные штаммы Sinorhizobium meliloti СХМ1-105 (СХМ1) и Rm1021 (Rm2011) применяются в качестве референтных в отечественных и зарубежных лабораториях, поскольку активно используются для разработки и/или адаптации широкого круга методов симбиогенетики. СХМ1-105 (СХМ1) и Rm1021 (Rm2011) получены на основе производственных штаммов 425а и SU47. Штамм 425а выделен из клубеньков люцерны в середине 1970-х годов в Алматинской области Казахстана, входящей в состав Среднеазиатского первичного центра происхождения культурных растений, описанного Н.И. Вавиловым. Штамм SU47 выделен из клубеньков люцерны в конце 1930-х годов в Австралии - вторичном центре разнообразия культурных растений. Геномы исходных штаммов, а также их производных состоят из хромосомы (SMc) и двух мегаплазмид (SMa, SMb) и не содержат криптических плазмид. У CXM1-105 в отличие от Rm1021 в геноме отсутствуют 508 белок-кодирующих открытых рамок считывания (open reading frame - ORF), из которых, как следует из данных, полученных с использованием ДНК-биочипов SM6kOligo, 242 локализованы на SMa, 121 - на SMb и 145 - на SMc. Это указывает на существенные структурные различия во всех трех репликонах референтных штаммов CXM1-105 и Rm1021. Хромосома СХМ1-105 (СХМ1) и 425а не содержит последовательностей фагового происхождения - так называемых геномных островов, описанных у Rm1021. Установлено, что 62 ORF геномных островов Rm1021 сходны или гомологичны таковым у представителей того же вида или рода, а также у филогенетически удаленных классов бактерий. Однако в структуре хромосомы СХМ1-105 имеются сайты для интеграции геномных островов (EU196757, EU196758 и EU196759), которые на 99-100 % гомологичны таковым у Rm1021 (Rm2011). Оценка распространенности штаммов S. meliloti, имевших типы хромосомы SMcRm1021 (наличие островов) или SMcСХМ1-105 (отсутствие островов) в природных популяциях показала превалирование первых в районе, относящемся к Среднеазиатскому генцентру, вторых - в зоне экстремально засоленных почв Приаралья (Р
Симбиоз, люцерна, референтные штаммы, молекулярно-генетический анализ, геномные острова, сайты для специфической интеграции, дополнительный геном
Короткий адрес: https://sciup.org/142213853
IDR: 142213853 | УДК: 633.31:631.461.52:577.21 | DOI: 10.15389/agrobiology.2017.5.928rus
Текст обзорной статьи Сравнительный анализ геномных характеристик у референтных штаммов Sinorhizobium meliloti - симбионтов люцерны
Растительно-микробный симбиоз — это уникальная высокоспецифичная биологическая система фиксации атмосферного азота и его трансформации в соединения, доступные для живых организмов. Важную роль в повышении продуктивности растений играет микробный компонент (1),
∗ Работа поддержана Российским научным фондом (грант ¹ 17-06-01095).
значимость которого часто все еще остается недооцененной (1-3). Известно, что микроорганизмы, составляющие основу биопрепаратов, должны обладать определенными свойствами, в числе которых — вирулентность, специфичность, конкурентоспособность, симбиотическая активность и эффективность (продуктивность), а также должны соответствовать ряду технологических требований (4). Для соответствия этим требованиям и сохранения свойств штаммы следует подвергать поддерживающей селекции, поскольку со временем их хозяйственно ценные свойства ухудшаются или утрачиваются (5, 6). Одной из причин может быть то, что гены, детерминирующие симбиотические свойства клубеньковых бактерий, локализованы, как правило, на плазмидах, наличие и структура которых могут оказаться нестабильными (например, под воздействием абиотического стресс-фактора), что, в свою очередь может приводить к снижению или утрате эффективности (продуктивности) инокулированных растений (7, 8).
Принципиально иной подход заключается в создании системы для генетического мониторинга стабильности хозяйственно ценных штаммов и состоит в изучении пангенома клубеньковых бактерий люцерны и микробиома агроэкосистем (9-11). Сопоставление геномных характеристик симбиотически активных штаммов позволит выявить функционально значимые маркерные последовательности и стать основой для создания такой системы (12). Один из этапов этой работы — сравнение свойств производственных штаммов, которые могут быть рекомендованы в качестве модельных при разработке системы мониторинга стабильности агроэкосистем.
В настоящем обзоре впервые проведен анализ штаммов Sinorhizobium meliloti , полученных на основе производственных штаммов 425а и SU47, которые длительное время изучали в отечественных и зарубежных лабораториях, занимающихся вопросами симбиогенетики.
Происхождение штаммов 425а, SU47 и их производных . Современное таксономическое название штамма Rhizobium meliloti 425a — Sino-rhizobium ( Ensifer ) meliloti . Штамм был выделен как высокоактивный из клубеньков люцерны в Алматинской области (Казахстан, АС ¹ 549454 от 25.05.1977). В 1986 году на его основе был получен высокоэффективный, устойчивый к стрептомицину (StrR) штамм 425a-str-6, или СХМ1 (13), из которого впоследствии в результате УФ-мутагенеза получили штамм СХМ1-105 (14). Штамм R. meliloti SU47 выделен из клубеньков Medicago varia в Новом Южном Уэльсе (Австралия) в 1937 году (15). На основе SU47 был создан штамм Rm2011. Штамм Rm1021 — его StrR дериват. Также к производным от Rm2011 относят штамм RCR2011. Все штаммы, полученные из SU47, поддерживались в разных лабораториях мира, что обусловило различия в их названиях.
Люцерна относится к древнейшим культурам, используемым человечеством. Она упоминается в Вавилонских текстах, относящихся к 700 г. до н.э. (16). Главные очаги формообразования и распространения более древних диплоидных видов синей и желтой люцерны — Передняя Азия и Средняя Азия, входящие, согласно теории Н.И. Вавилова (17-19), в разные первичные очаги происхождения культурных растений (генцентры). Эти центры, в которых интенсивно и совместно действуют естественный и искусственный отборы, служат источниками разнообразия природных генотипов растений (20, 21). Алматинская область в Казахстане, где из клубеньков был выделен штамм 425а, прилегает к Среднеазиатскому генцен-тру, тогда как Австралия (место выделения штамма SU47) не относится к первичному центру разнообразия многолетних видов люцерны, однако на этом континенте сформировался вторичный генцентр рода Medicago L. На территорию Австралии многолетняя люцерна попала впервые из Франции (в конце XVIII века), а затем из США (19).
Учитывая исторические пути распространения люцерны как растения-хозяина, можно предположить, что штаммы-микросимбионты также претерпели аналогичное распространение. Можно выдвинуть предположение, что штамм SU47 мог быть привнесен с семенами или с почвой с территории Среднеазиатского центра. Это не противоречит выводам исследователей о том, что хромосомный генотип штамма RCR2011 (производный от SU47) имеет широкую географическую распространенность (22). Таким образом, допустимо предположить, что рассматриваемые штаммы 425а и SU47 могли иметь общие исторические корни происхождения.
Симбиотическая эффективность штаммов 425а, SU47 и их производных. Штамм SU47 был доступен в качестве симбиотически эффективного инокулянта для ди- и тетраплоидных форм люцерны в Австралии для фермерских хозяйств с 1955 года, в промышленных масштабах использовался там с 1960-х годов, в Новой Зеландии — с 1973-1975 годов (23). На основе щтамма Rm2011 создан биопрепарат Nitrogin (24). Симбиотические свойства Rm1021 и Rm2011 изучены в многолетних модельных микровегетационных и деляночных опытах, что и послужило обоснованием для отнесения этих штаммов к референтным (25, 26). Штамм 425а применяют для приготовления биопрепарата ризоторфин. Средняя прибавка урожайности люцерны при инокуляции этим штаммом, как было заявлено (АС ¹ 549454 от 25.05.1977), составляла 14,5 %. Полевые и деля-ночные опыты, проведенные с разными сортами люцерны (Якутская, Агния, Пастбищная 88, Вега) в континентальных и переходных условиях умеренного климатического пояса (Тюмень, Владикавказ, Ленинградская обл.), а также на Крайнем Севере в Республике Саха (Якутия) в период с 1999 по 2016 год, показали прибавку урожая зеленой массы люцерны на 9,8-48,4 % при инокуляции штаммом 425а (P < 0,0015) (27). Его производные — штаммы СХМ1 и СХМ1-105 также изучены по хозяйственно ценным свойствам, таким как продуктивность (эффективность симбиоза), азотфиксирующая (ацетиленредуктазная) активность, хозяйская специфичность, конкурентоспособность в модельных и деляночных опытах (13, 14, 28). По результатам независимых микровегетационных и вегетационных экспериментов, выполненных в разные годы, следует заключить, что штаммы СХМ1 и СХМ1-105 стабильно сохраняют высокую симбиотическую активность. Средняя прибавка сухой массы у инокулированных растений составляла 90,8-100,2 % (P < 0,0015) по отношению к контролю без инокуляции и 28,6-32 % (P < 0,0015) в сравнении со штамма Rm1021. Выявлены различия между рассматриваемыми штаммами по способности формировать симбиоз с модельным диплоидным видом люцерны — M. trun-catula сорта Jemalong в модельных микровегетационных опытах. Штамм СХМ1-105 формировал эффективные розовые клубеньки, а прибавка сухой массы растений относительно контроля без инокуляции была на 31,5 % выше по сравнению с аналогичными растениями, инокулированными штаммом Rm1021. Факт того, что Rm1021 не формирует эффективный симбиоз с M. truncatula А17, показан австралийскими исследователями (29). Вместе с тем в условиях слабого засоления (0,3 % NaCl) достоверных различий (P < 0,05) между рассматриваемыми штаммами по симбиотической эффективности не выявлено как с M. truncatula , так и с M. varia (В.С. Мунтян, персональное сообщение). Поэтому штаммы, полученные на основе 425а (СХМ1, СХМ1-105), используют как референтные: они имеют более высокие показатели симбиотической активности относительно штамма
Rm1021 и стабильно проявляют их в стандартных (типовых) условиях.
Методы молекулярно-генетического анализа, разработанные на основе референтных штаммов S. meliloti. С использованием перечисленных выше референтных штаммов были разработаны или адаптированы различные модели для изучения формирования и функционирования симбиотических систем и их молекулярно-генетического анализа. На основе производных штамма 425а были разработаны методы УФ- и химического мутагенеза, слияния протопластов, трансдукции, конъюгации, трансформации (30, 31). С использованием видоспецифичного участка ISRm2011-2 хромосомы штамма Rm2011 создана система типирования геномов (фингерпринтинг) природных штаммов клубеньковых бактерий люцерны (32). В геноме Rm2011 (Rm1021) имеется 12 копий ISRm2011-2, в геноме штамма СХМ1 — 11 копий (33). Значимым этапом в изучении симбиотически важных генов стала разработка систем общего en masse и направленного Tn5-Mob и mini-Tn5 мутагенеза. На основе референтного штамма Rm2011 получена коллекция из 12 тыс. mini-Tn5 мутантов, анализ более 9 тыс. которых показал, что инсерции mini-Tn5 в гены, кодирующие пептиды, происходили с частотой 0,6 (34, 35).
Более 20 генов, вовлеченных в контроль синтеза поли- и липополисахаридов, симбиотической эффективности, конкурентоспособности, соле-устойчивости, кислотоустойчивости секвенированы, и изучено их фенотипическое проявление у производных штамма СХМ1 (36-41). Геномы штаммов Rm1021 и Rm2011 просеквенированы соответственно в 2001 и 2013 году и представлены в базах данных , . В дальнейшем это позволило предложить методы современного геномного анализа с помощью фенотипических, ДНК- и экспрессионных биочипов (42, 43) для одновременного изучения работы более 14000 генов и межгенных областей, а также сравнения их экспрессии и фенотипического проявления (35, 44).
Сравнительный геномный анализ референтных штаммов. Геномы рассматриваемых референтных штаммов сходны, имеют по три репликона (хромосома и две мегаплазмиды) и не содержат дополнительных криптических плазмид. Согласно данным полногеномного секвенирования, у Rm1021 размер хромосомы (SMc) составляет 3,5 млн п.н., мегаплазмид SMa и SMb — соответственно 1,35 и 1,68 млн п.н., что и принято за типовую характеристику генома клубеньковых бактерий вида Sinorhizo-bium meliloti .
Репликон SMb рассматривают как малую хромосому Rm1021, поскольку он имеет средний состав ГЦ-пар 62,4 %, что на 0,3 % ниже такового в хромосоме. На этом репликоне локализовано 1570 генов (open reading frame, ORF — открытые рамки считывания), которые по функциональной значимости отнесены к 20 различным COG-группам (clusters of orthologous groups — кластеры ортологичных групп) (45). Однако преимущественно это гены, ответственные за углеводный метаболизм и синтез полисахаридов, необходимых для успешного микробно-растительного взаимодействия и для сапрофитного существования бактерий в почве или в прикорневой зоне — ризосфере. Второй мегарепликон Rm1021 — SMa содержит 1293 гена (ORF), а в его нуклеотидном составе в среднем 60,4 % ГЦ-пар, что существенно ниже, чем в SMc и SMb. В этом репликоне имеется участок размером 90 т.п.н., включающий кластеры nod , nif , fix генов, детерминирующих процесс формирования и функционирования азотфик-сирующего симбиоза с растением-хозяином.
Сравнительный анализ геномов референтных штаммов CXM1-105 и
Rm1021 с использованием ДНК биочипов SM6kOligo показал, что у CXM1-105 изменены или отсутствуют 242 ORF, локализованных на SMa, и 121 ORF на SMb (46). Это указывает на существенные различия в структурной организации мегарепликонов у референтных штаммов CXM1-105 и Rm1021.
Мы выделили 69 генов, относящихся к пяти различным группам, которые вовлечены в контроль таких признаков симбиозообразования как вирулентность ( nod ), клубенькообразование и его специфичность ( nol , noe ), процесс азотфиксации ( fix и nif ), и проанализировали их с использованием техники ДНК-биочипов (46). В результате было установлено, что у обоих модельных штаммов сходны 65 ORF, в том числе nodD1 , nodABC , nodEFGH , которые также имели похожие ПЦР-ПДРФ-типы (анализ полиморфизма длин рестрикционных фрагментов ДНК) (46). Остальные четыре ORF не были выявлены у CXM1-105 (46), что означало отсутствие или значительное изменение этих последовательностей (дивергентные последовательности). Три из них локализованы на SMa и относятся к группе fix -генов, а четвертая находится на SMb и предположительно кодирует аци-лтрансферазу (EC 2.3.1.-) из семейства генов белков cysElacA / lpxA / nodL .
Хромосома Rm1021 содержит 3341 открытую рамку считывания, продукты которых вовлечены в функционирование информационных систем — репликацию, транскрипцию, трансляцию, а также отвечают за ключевые пути метаболизма и формирования клеточных структур (45). Поэтому гены, расположенные на хромосоме, нередко называют коровыми.
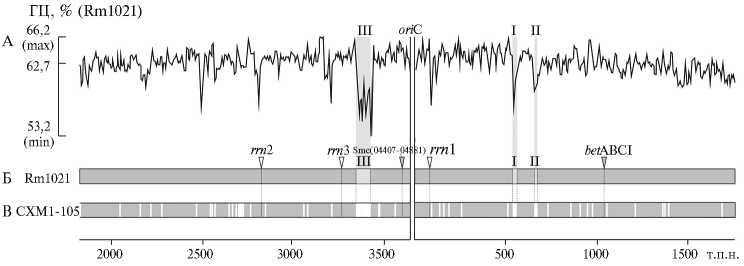
Сравнительный анализ структуры хромосомы у штаммов Sinorhizobium meliloti Rm1021 (А, Б) и СХМ1-105 (В) : А — содержание (%) ГЦ-пар в хромосоме Rm1021, определенное методом скользящей средней (окно 10000 п.н., шаг 5000 п.н., программа Unipro UGENE); Б и В — графические изображения структуры хромосомы у Rm1021 и СХМ1-105; oriC — точка начала автономной репликации хромосомы; I, II, III — соответственно геномные острова Sme21T, Sme19T, Sme80S; — проекция областей локализации геномных островов на графическое изображение хромосом Rm1021 и СХМ1-105; □ — последовательности, гомологичные у Rm1021 и СХМ1-105, □ — последовательности, не детектируемые в геноме СХМ1-105; V — rrn -опероны; V — локусы betABCI и SMc04407-SMc04881 (подробно описание см. в тексте статьи).
Мы проанализировали 5 локусов в хромосомах Rm1021 и СХМ1-105, которые расположены в удаленных районах хромосомы и могут дать представление о структуре жизненно важного репликона. Это межгенная последовательность SMc04407-04881 протяженностью 1280 п.н. между генами SMc04407 и SMc04881, которая расположена слева от точки начала репликации oriC (рис.). Вторая последовательность — локус, включающий часть bet -оперона, расположенного на расстоянии 1039 млн. п.н. справа от oriC (см. рис.). Эта последовательность из 1544 п.н. включала 1400 п.н. гена betC , межгенную область из 1 п.н. и 143 п.н. гена betB , которые участвуют в синтезе осмопротектора глицина-бетаина. ПЦР-ПДРФ-анализ не выявил различий по локусам SMc04407-04881 и betCB у рассматривае-932
мых референтных штаммов (47). Три других района соответствуют таксономически значимым межгенным последовательностям рибосомальных оперонов ( rrn ; см. рис.). По данным ПЦР-ПДРФ-анализа, все три межгенные последовательности rrn оперонов у штамма Rm1021 протяженностью 1307 п.н. каждая относятся к а-типу (48), а аналогичные районы СХМ1-105 — к б-типу, что может свидетельствовать о том, что геномы рассматриваемых штаммов принадлежат к филогенетически удаленным дивергировавшим клональным линиям (48, 49).
Особый интерес в структуре хромосомы Rm1021 представляют районы, в которых содержание ГЦ-пар на 6-8 % ниже среднего содержания (62,73 %). Такие участки имеют меньшую структурную жесткость (50) и эволюционно моложе в сравнении с коровой частью хромосомы. В хромосоме Rm1021 (Rm2011) присутствуют три таких последовательности (Sme80S, Sme21T и Sme19T), которые рассматривают как так называемые геномные острова (см. рис.). Эти структуры — нетипичные протяженные мобильные элементы, которые содержат последовательности фагового происхождения, IS-элементов и функционально значащих генов, а также более семи десятков последовательностей, с которых транскрибируются некодирующие РНК. Острова могут активно участвовать в горизонтальном переносе генов (51). Детально следует рассмотреть структурное расположение островов у Rm1021 относительно точки начала репликации хромосомы oriC (см. рис.). Два острова (Sme21T и Sme19T) смежно расположены справа от oriC и имеют сходную длину (20,7 и 18,6 т.п.н.). Sme21T находится на расстоянии 541 т.п.н. от oriC , Sme19T — на расстоянии 98,6 т.п.н. справа от него (см. рис.). Третий остров (Sme80S, протяженность 80,2 т.п.н.) расположен влево от oriC и удален на 216,4 т.п.н. Такое расположение островов в районах, приближенных к oriC , а также к рибосомальным оперонам, указывает на то, что эти последовательности могут иметь важное функциональное значение, поскольку реплицируются одними из первых. Структуры, аналогичные геномным островам, не выявлены нами в хромосомах штаммов 425а, СХМ1 и СХМ1-105. Кроме того, согласно данным, полученным c применением ДНК-биочипов, в структуре хромосомы СХМ1-105 отсутствуют 145 белок-кодирующих ORF (46). Представленный выше рисунок иллюстрирует различия между структурой хромосом у референтных штаммов Rm1021 и СХМ1-105.
Все три геномных острова, подобно так называемым островам патогенности, которые наиболее хорошо изучены, имеют сайтспецифическое встраивание. Местами интеграции островов Sme21T и Sme19T служат прямые нуклеотидные повторы, расположенные в 3 ′ -концах двух изоакцеп-торных тРНК треонина (тРНК-Тре), а в случае Sme80S — в 3 ′ -конце тРНК серина (тРНК-Сер) (52). На основе комплексного in silico анализа сайтспецифической интеграции геномных островов у S. meliloti Rm1021 была разработана система их детекции in vivo с помощью ПЦР и оригинальных пар праймеров (52). Согласно техническим параметрам метода ПЦР, с праймерами для амплификации внешних пограничных областей островов (области интеграции) ПЦР-продукты могут синезироваться только в случае отсутствия островов, как, например, у штамма СХМ1-105 (52). Последовательности, полученные в результате ПЦР и соответствующие пограничным областям в хромосоме СХМ1-105, секвенированы и депонированы в GenBank (EU196757, EU196758 и EU196759). Сравнительный анализ этих последовательностей у СХМ1-105 и областей интеграции геномных островов у Rm1021 позволил изучить их структуру и оценить степень гомологии. Установлено, что последовательность EU196757 (1230 п.н.) содержит 933
сайт для специфической интеграции острова Sme21T длиной 16 п.н. (прямой повтор), влево и вправо от которого имеются последовательности соответственно 880 и 334 п.н., на 99 % гомологичные у Rm1021 и СХМ1-105. Последовательность EU196758 (561 п.н.) имеет один прямой повтор длиной 31 п.н. — сайт для специфической интеграции острова Sme19T, а влево и вправо от него находятся последовательности размером 53 и 530 п.н. со 100 % гомологией у рассматриваемых референтных штаммов. Сайт для специфической интеграции третьего острова Sme80S — прямой повтор длиной 15 п.н. выявлен в последовательности EU196759 протяженностью 826 п.н. Влево и вправо от нее расположены последовательности (соответственно 397 и 417 п.н.), на 100 % гомологичные у Rm1021 и СХМ1-105. Слева на участке между геном SMc03748 и прямым повтором у Rm1021 также присутствует IS-элемент TRm11, которого нет у СХМ1-105. Анализ пограничных областей островов показывает, что в геноме СХМ1-105 сохраняются сайты для специфической интеграции/инсерции имевшихся, возможно, когда-то геномных островов. Кроме того, допустимо предположить, что отсутствие островов может способствовать большей структурной стабильности хромосомы у СХМ1-105, а также у СХМ1 и 425а, однако для подтверждения этого требуются соответствующие исследования.
Система детекции островов была использована для выявления структурных типов хромосом, подобных таковым у Rm1021 (SMcRm1021, имеют острова) или СХМ1-105 (SMcСХМ1-105, не имеют островов) в четырех географически удаленных районах. Установлено, что природные штаммы S. meliloti , выделенные в южном районе Узбекистана, входящего в состав Среднеазиатского генцентра, имели тип хромосомы SMcRm1021, встречавшийся с частотой 0,72. Штаммы из северного района Кавказа, примыкающего к Переднеазиатскому центру, который сыграл ведущую роль в формировании культурной диплоидной люцерны, а также из современного центра интра-грессивной гибридизации люцерны (21), расположенного в предгорье Му-годжары на севере Казахстана, тоже преимущественно имели тип хромосомы SMcRm1021. Частота этих типов была сходной, но оказалась ниже (0,54), чем в Среднеазиатском генцентре (52). Только на территории, находящейся на расстоянии 500 км от современного берега Аральского моря, которая подверглась экстремальному засолению, штаммы, выделенные из ризосферы солодки или из засоленных песков, имели преимущественно тип хромосомы SMcСХМ1-105 с частотой 0,62, то есть у них отсутствовали геномные острова. Различия между выборками штаммов из Среднеазиатского генцентра, в котором доминировали штаммы с типом хромосомы SMcRm1021, и Приаральского района, где превалировали штаммы с типом хромосомы SMcСХМ1-105, были достоверны ( χ 2 = 4,388; Р < 0,05). Следовательно, штаммы, имевшие острова, достоверно чаще встречались в районе первичного генцентра люцерны, тогда как под влиянием стресс-фактора (засоление) происходила утрата островов.
Представляло интерес оценить функциональную значимость геномных островов у Rm1021. В составе островов выявлены копии функционально важных генов, которые, например, могут участвовать в защите клетки от чужеродной ДНК (локус hsdRSM ), также могут влиять на устойчивость клеток к определенным почвенным условиям (участвуют в синтезе пигмента меланина, осмопротектора пролина). Кроме того, в составе одного из островов присутствует ген fixT3 — копия гена fixT (52), который, как ранее было показано (53), вовлечен в контроль азотного метаболизма, находится под влиянием двухкомпонентной системы глобальной регуляции FixJL и индуцируются при низком содержании кислорода, а также в 934
клубеньках. Однако функциональная роль существенной доли ORF не известна. Мы провели поиск последовательностей, сходных (гомологичных) таковым у штамма Rm1021, в геномах близкородственных, а также таксономически удаленных видов. Оказалось, что в островах Rm1021 присутствует 62 ORF, последовательности которых сходны или гомологичны таковым у бактерий — представителей 22 родов из 4 фил, а также у некуль-тивируемых бактерий. Чаще всего (33 %) в островах встречались OFR, гомологи которых выявлены у α -протеобактерий. Функционально они были связаны с хранением информации (K, L; 21 %), метаболизмом (E, P, G, M; 33 %) либо относились к группе слабо охарактеризованных (R, S; 17 %). ORF, гомологичные или сходные с таковыми у таксономически удаленных представителей β -, γ - и δ -протеобактерий, преимущественно были отнесены к группе вовлеченных в клеточные процессы и группе сигналинга (O, T, V; 17 %). Различия в распределении ORF между указанными таксонами бактерий были достоверны ( χ 2 = 11,02; P = 0,01). Таким образом, геном Rm1021 имеет так «дополнительный геном», включающий функционально значимые ORF, сходные или гомологичные таковым у представителей преимущественно того же вида или рода, а также у филогенетически удаленных классов бактерий. Подобное разнообразие ORF — результатом высокой активности горизонтального переноса генов, который мог иметь место как в почвенном микробиоме, так и in planta в клубеньке. В последнем, согласно недавней публикации (54), могут одновременно присутствовать разные представители филогенетически удаленных групп бактерий. Косвенным доказательством возможности горизонтального переноса генетических детерминант в клубеньке может сслужить выявленный нами факт наличия высокого филогенетического разнообразия OTF в геномных островах штамма Rm1021 — типичного представителя сапрофитных бактерий, формирующих необлигатный мутуалистический симбиоз с бобовыми растениями-хозяевами. В настоящее время нет возможности сделать заключение о том, что геномы референтных штаммов Rm1021 (Rm2011) и СХМ1-105 (СХМ1) различаются по наличию «дополнительного чужеродного генома», поскольку «чужеродные» гены могут быть закреплены в коровой части хромосомы СХМ1-105, однако подобное утверждение может подтвердиться при полногеномном секвенировании.
Таким образом, подводя итоги сравнительного анализа структур хромосом у референтных штаммов, полученных на основе производственных штаммов 425а и SU47, следует сделать вывод, что эти штаммы могут относиться к эволюционно дивергировавшим линиям клубеньковых бактерий, которые были распространены в Среднеазиатском центре происхождения культурных растений. Исходя из совокупности представленных данных, производные штамма 425а – СХМ1 и СХМ1-105 следует рассматривать как модельные высокоэффективные штаммы вида Sinorhizobium meli-loti , генетически отличающиеся от Rm1021/Rm2011, которые могут быть использованы для разработки приемов получения новых генетически стабильных штаммов клубеньковых бактерий, способствующих формированию высокопродуктивных и стрессоустойчивых растительно-микробных симбиозов, и создания «зонтичной» системы генетического мониторинга стабильности хозяйственно ценных штаммов в микробиомах агроэкоценозов.
Список литературы Сравнительный анализ геномных характеристик у референтных штаммов Sinorhizobium meliloti - симбионтов люцерны
- Мишустин Е.Н., Шильникова В.К. Клубеньковые бактерии и инокуляционный процесс. М., 1973.
- Bianco C., Defez R. Soil bacteria support and protect plants against abiotic stresses. In: Abiotic stress in plants -mechanisms and adaptations/A. Shanker, B. Venkateswarlu (eds.), InTech, Croatia, 2011 ( ) DOI: 10.5772/23310
- Тихонович И.А., Андронов Е.Е., Борисов А.Ю. Долгих Е.А., Жернаков А.И., Жуков В.А., Проворов Н.А., Румянцева М.Л., Симаров Б.В. Принцип дополнительности геномов в расширении адаптационного потенциала растений. Генетика, 2015, 51(9): 973-990 ( ) DOI: 10.7868/S001667581509012X
- Хотянович А.В. Методы культивирования азотфиксирующих бактерий, способы получения и применения препаратов на их основе. Л., 1991.
- Микробиология/Под ред. Е.Н. Мишустина, В.Т. Емцева. М., 1987.
- Саданов А.К., Гаврилова Н.Н., Дадонова Т.Н., Ратникова И.А. Критерии отбора штаммов клубеньковых бактерий в состав биопрепаратов для обогащения почвы биологическим азотом и повышения урожайности бобовых культур. Известия Национальной академии наук Республики Казахстан. Серия биологическая и медицинская, 2015, 1: 115-124.
- Lopez-Guerrero M.G., Ormeno-Orrillo E., Acosta J.L., Mendoza-Vargas А., Rogel M.A., Ramirez M.A., Rosenblueth M., Martinez-Romero J., Martinez-Romero E. Rhizobial extrachromosomal replicon variability, stability and expression in natural niches. Plasmid, 2012, 68(3): 149-158 ( ) DOI: 10.1016/j.plasmid.2012.07.002
- Kajic S., Hulak N., Sikora S. Environmental stress response and adaptation mechanisms in Rhizobia. Agriculturae Conspectus Scientificus, 2016, 81(1): 15-19.
- Galardini M., Mengoni A., Brilli M., Pini F., Fioravanti A., Lucas S., Lapidus A., Cheng J.F., Goodwin L., Pitluck S., Land M., Hauser L., Woyke T., Mikhailova N., Ivanova N., Daligault H., Bruce D., Detter C., Tapia R., Han C., Teshima H., Mocali S., Bazzicalupo M., Biondi E.G. Exploring the symbiotic pangenome of the nitrogen-fixing bacterium Sinorhizobium meliloti. BMC Genomics, 2011, 12: 235 ( ) DOI: 10.1186/1471-2164-12-235
- Schneiker-Bekel S., Wibberg D., Bekel T., Blom J., Linke B., Neuweger H., Stiens M., Vorhölter F.J., Weidner S., Goesmann A., Pühler A., Schlueter A. The complete genome sequence of the dominant Sinorhizobium meliloti field isolate SM11 extends the S. meliloti pan-genome. Journal of Biotechnology, 2011, 155(1): 20-33 ( ) DOI: 10.1016/j.jbiotec.2010.12.018
- Иванов Л.А. Научное Земледелие России: итоги и перспективы. Земледелие, 2014, 3: 25-29.
- Penttinen P., Terefework Z., Lindstroem K., Greco D., Auvinen P., Muntyan V., Roumiantseva M., De Lajudie P., Becker A. Divergent genes in potential inoculant Sinorhizobium strains are related to DNA replication, recombination, and repair. Journal of Basic Microbiology, 2016, 56(6): 680-685 ( ) DOI: 10.1002/jobm.201500592
- Зарецкая А.Н. Метод трансформации как способ повышения активности клубеньковых бактерий люцерны. Микробиология, 1976, 45(5): 873-877.
- Федоров С.Н. Получение мутантов клубеньковых бактерий люцерны с измененными симбиотическими свойствами под действием УФ-излучения. Автореф. канд. дис. Л., 1987.
- Geddes B.A., Oresnik I.J. The mechanism of symbiotic nitrogen fixation. In: The mechanistic benefits of microbial symbionts/C.J. Hurst (ed.). Springer International Publishing, Switzerland, 2016 ( ) DOI: 10.1007/978-3-319-28068-4_4
- Bolton J.L. Alfalfa: botany, cultivation and utilization. Interscience Publishers, NY, 1962.
- Вавилов Н.И. Центры происхождения культурных растений. Труды по прикладной ботанике, генетике и селекции, 1926, 16(2): 3-248.
- Синская Е.Н. Историческая география культурной флоры. Л., 1969.
- Дзюбенко Н.И., Дзюбенко Е.А. Гипотеза распространения люцерны желтой на северо-запад России вследствие антропогенных и исторических факторов. В сб.: Проблемы эволюции и систематики культурных растений. СПб, 2014: 19-20.
- Захаров-Гезехус И.А. Николай Иванович Вавилов: в контексте эпохи. М., 2012.
- Иванов А.И. Люцерна. М., 1980.
- Eardly B.D., Materon L.A., Smith N.H., Johnson D.A., Rumbaugh M.D., Selander R.K. Genetic structure of natural populations of the nitrogen-fixing bacterium Rhizobium meliloti. Appl. Environ. Microbiol., 1990, 56(1): 187-194.
- MacKinnon P.A., Robertson J.G., Scott D.J., Hale C.N. Legume inoculant usage in New Zealand. Journal of Experimental Agriculture, 1977, 5(1): 35-39 ( ) DOI: 10.1080/03015521.1977.10425930
- Smith R.S., Thorne S., Randall R. Rhizobia inoculants for various leguminous species. Nitragin Brand Inoculants Technical Bulletin, 1988, Iss. 102: 8.
- Keller M., Roxlau A., Weng W.M., Schmidt M., Quandt J., Niehaus K., Jording D., Arnold W., Puehler A. Molecular analysis of the Rhizobium meliloti mucR gene regulating the biosynthesis of the exopolysaccharides succinoglycan and galactoglucan. Mol. Plant-Microbe Interact., 1995, 8(2): 267-77 ( ) DOI: 10.1094/MPMI-8-0267
- Bradic M., Sikora S., Redzepovic S., Stafa Z. Genetic identification and symbiotic efficiency of an indigenous Sinorhizobium meliloti field population. Food Technology and Biotechnology, 2003, 41(1): 69-75.
- Троян Т.Н. Формирование эффективного бобово-ризобиального симбиоза и его роль. Автореф. канд. дис. Калининград, 2010.
- Проворов Н.А. Специфичность взаимодействия клубеньковых бактерий с бобовыми растениями и эволюция бобово-ризобиального симбиоза. Сельскохозяйственная биология, 1985, 20(3): 34-46.
- Terpolilli J.J., O'Hara G.W., Tiwari R.P., Dilworth M.J., Howieson J.G. The model legume Medicago truncatula A17 is poorly matched for N2 fixation with the sequenced microsymbiont Sinorhizobium meliloti 1021. New Phytologist, 2008, 179(1): 62-66 ( ) DOI: 10.1111/j.1469-8137.2008.02464.x
- Sharypova L.A., Pretorius-Guth I.-M., Simarov B.V., Puehler A. Genetic improvement of Rhizobium strains. In: The nitrogen fixation and its research in China/G.F. Hong (ed.). Springer-Verlag, Berlin, 1992: 266-285 ( ) DOI: 10.1007/978-3-662-10385-2_13
- Симаров Б.В., Аронштам А.А., Новикова Н.И., Баженова О.В., Проворов Н.А., Шарыпова Л.А. Генетические основы селекции клубеньковых бактерий/Под ред. Б.В. Симарова, А.А. Аронштама, Н.И. Новиковой. Л., 1990.
- Selbitschka W., Arnold W., Jording D., Kosier B., Toro N, Puehler A. The insertion sequence element ISRm2011-2 belongs to the IS630-Tc1 family of transposable elements and is abundant in Rhizobium meliloti. Gene, 1995, 163(1): 59-64 ( ) DOI: 10.1016/0378-1119(95)00371-C
- Roumiantseva M.L., Andronov E.E., Sharypova L.A., Dammann-Kalinowski T., Keller M., Young J.P., Simarov B.V. Diversity of Sinorhizobium meliloti from the Central Asian alfalfa gene center. Appl. Environ. Microbiol., 2002, 68(9): 4694-4697. ( ) DOI: 10.1128/AEM.68.9.4694-4697.2002
- Pobigaylo N., Wetter D., Szymczak S., Schiller U., Kurtz S., Meyer F., Nattkemper T.W., Becker A. Construction of a large signature-tagged mini-Tn5 transposon library and its application to mutagenesis of Sinorhizobium meliloti. Appl. Environ. Microbiol., 2006, 72(6): 4329-4337 ( ) DOI: 10.1128/aem.03072-05
- Serrania J., Johner T., Rupp O., Goesmann A., Becker A. Massive parallel insertion site sequencing of an arrayed Sinorhizobium meliloti signature-tagged mini-Tn5 transposon mutant library. J. Biotechnol., 2017, 257: 9-12 ( ) DOI: 10.1016/j.jbiotec.2017.02.019
- Румянцева М.Л., Симаров Б.В., Онищук О.П., Андронов Е.Е., Чижев-ская Е.П., Белова В.С., Курчак О.Н., Мунтян А.Н., Румянцева Т.Б., Затовская Т.В. Биологическое разнообразие клубеньковых бактерий в экосистемах и агроценозах. Теоретические основы и методы/Под ред. М.Л. Румянцевой, Б.В. Симарова. СПб, 2011.
- Онищук О.П., Шарыпова Л.А., Курчак О.Н., Беккер А., Симаров Б.В. Выявление генов Sinorhizobium meliloti, влияющих на синтез поверхностных полисахаридов и конкурентоспособность. Генетика, 2005, 41(12): 1617-1623.
- Симаров Б.В., Шарыпова Л.А., Чеснокова О.Н., Онищук О.П., Кучко В.В. Анализ Tn5-мутантов Rhizobium meliloti с увеличенной симбиотической эффективностью. Генетика, 1990, 26(4): 630-635.
- Sharypova L.A., Yurgel S.N., Simarov B.V., Keller M., Puehler A., Becker A. The eff-482 locus of Sinorhizobium meliloti CXM1-105 that influences symbiotic effectiveness consists of three genes encoding an endoglycanase, a transcriptional regulator and an adenylate cyclase. Mol. Gen. Genet., 1999, 261(6): 1032-1044 DOI: 10.1007/s004380051052
- Чижевская Е.П., Кроль Е.А., Онищук О.П., Сагуленко Е.А., Фомина-Ещенко Ю.Г., Симаров Б.В., Шарыпова Л.А. Физическое и генетическое картирование мутаций симбиотической эффективности на мегаплазмиде-2 штаммам CXM1 Rhizobium meliloti. Генетика, 1998, 34(9): 1220-1227.
- Румянцева М.Л., Мунтян В.С. Клубеньковые бактерии Sinorhizobium meliloti: солеустойчивость и ее генетическая детерминированность (обзор). Микробиология, 2015, 84(3): 263-280 ( ) DOI: 10.7868/S0026365615030179
- Krol E., Becker A. Global transcriptional analysis of the phosphate starvation response in Sinorhizobium meliloti strains 1021 and 2011. Mol. Gen. Genet., 2004, 272(1): 1-17 ( ) DOI: 10.1007/s00438-004-1030-8
- Sharypova L., Andronov E., Krol E., Becker A., Saal B., Wegener C. Untersuchungen der bakteriellen Diversität mittels Oligonukleotid-Microarrays. BioSpektrum, 2006, 12(1): 106-108.
- Biondi E.G., Tatti E., Comparini D., Giuntini E., Mocali S., Giovannetti L., Bazzicalupo M., Mengoni A., Viti C. Metabolic capacity of Sinorhizobium (Ensifer) meliloti strains as determined by phenotype MicroArray analysis. Appl. Environ. Microbiol., 2009, 75(16): 5396-404 ( ) DOI: 10.1128/aem.00196-09
- Румянцева М.Л. Генетические ресурсы клубеньковых бактерий (обзор). Генетика, 2009, 45(9): 1157-1172.
- Белова-Мунтян В.С., Симаров Б.В., Румянцева М.Л. Мозаичность генома альфа-протеобактерий. Мат. VII Московского межд. конгр. «Биотехнология: состояние и перспективы развития». М., 2013, т. 2: 363-364.
- Саксаганская А.С., Субботина А.Р., Черкасова М.Е., Мунтян В.С., Румянцева М.Л. Полиморфизм nod и bet групп генов у штаммов Sinorhizobium meliloti. Тез. докл. IX Межд. науч. конф. «Микробные биотехнологии: фундаментальные и прикладные аспекты». Минск, 2015: 48-49.
- Румянцева М.Л., Мунтян В.С., Менгони А., Симаров Б.В. ITS-полиморфизм солеустойчивых и солечувствительных природных штаммов Sinorhizobium meliloti -симбионтов люцерны, донника и пажитника. Генетика, 2014, 50(4): 400-412 ( ) DOI: 10.7868/S0016675814040109
- Langille M.G., Hsiao W.W., Brinkman F.S. Detecting genomic islands using bioinformatics approaches. Nature Rev. Microbiol., 2010, 8(5): 373-382 ( ) DOI: 10.1038/nrmicro2350
- Hudson C.M., Lau B.Y., Williams K.P. Islander: a database of precisely mapped genomic islands in tRNA and tmRNA genes. Nucl. Acids Res., 2015, 43: 48-53 ( ) DOI: 10.1093/nar/gku1072
- Румянцева М.Л. Популяционная геномика мутуалистического симбионта семейства Fabaceae на примере клубеньковых бактерий Sinorhizobium meliloti. Тез. докл. Всерос. конф. «50 лет ВОГиС: успехи и перспективы». М., 2016: 52.
- Мунтян В.С., Черкасова М.Е., Андронов Е.Е., Симаров Б.В., Румянцева М.Л. Встречаемость островов в геномах природных штаммов Sinorhizobium meliloti. Генетика, 2016, 52(8): 1126-1133 ( ) DOI: 10.7868/S0016675816080105
- Ferrieres L., Francez-Charlot A., Gouzy J. Rouille S., Kahn D. FixJ-regulated genes evolved through promoter duplication in Sinorhizobium meliloti. Microbiology, 2004, 150(7): 2335-2345 ( ) DOI: 10.1099/mic.0.27081-0
- Martinez-Hidalgo P., Hirsch A.M. The nodule microbiome: N2-fixing rhizobia do not live alone. Phytobiomes, 2017, 1(2): 70-82.


