Сравнительный анализ интегральной гидрофобности легуминов гороха различной сортовой принадлежности
Автор: Даниленко А.Н., Поляков А.В., Павловская Н.Е., Плащина И.Г.
Журнал: Вестник аграрной науки @vestnikogau
Рубрика: Современные агротехнологии
Статья в выпуске: 1 (40), 2013 года.
Бесплатный доступ
Использован термодинамический подход к оценке интегральной гидрофобности нативных и денатурированных форм легуминов, основных компонентов глобулиновой фракции запасных белков гороха десяти сортов отечественной селекции. В качестве меры интегральной гидрофобности белков использованы их теплоемкости гидратации, вычисленные на основании измеренных методом ДСК (дифференциальная сканирующая калориметрия) величин парциальных теплоемкостей белков в растворе и рассчитанных значений их теплоемкостей в газовой фазе по аддитивной схеме. Показано, что как нативные, так и денатурированные формы легуминов гороха различной сортовой принадлежности существенно отличаются по величинам теплоемкостей гидратации, что свидетельствует об их различной интегральной гидрофобности. Разработанный подход позволяет на примере растительных глобулинов прогнозировать различия в функциональных свойствах пищевых белков.
Интегральная гидрофобность, легумин гороха, дифференциальная сканирующая микрокалориметрия, теплоемкость гидратации
Короткий адрес: https://sciup.org/147124056
IDR: 147124056
Текст научной статьи Сравнительный анализ интегральной гидрофобности легуминов гороха различной сортовой принадлежности
Гидрофобность или гидрофобно - гидрофильный баланс нативных и денатурированных форм пищевых белков определяет их функциональные свойства [1]. Установлено , что белки , обладающие большей гидрофобностью , характеризуются большей межфазной активностью и , как следствие , более высокой эмульгирующей и пенообразующей способностью , а также способностью формировать более прочные термотропные гели [2].
Для оценки гидрофобности белков используют различные методы [3,4], которые не позволяют , однако , определить их интегральную гидрофобность .
В настоящей работе в качестве показателя интегральной гидрофобности белка использована теплоемкость его гидратации . Теплоемкость гидратации служит интегральной характеристикой гидрофобности белка , поскольку она определяется суммой вкладов гидрофобных и гидрофильных групп , принципиально различающихся по природе гидратации . В первом случае , в случае гидрофобной гидратации , образуются водородные связи между молекулами воды , входящими в клатратоподобную структуру , окружающую гидрофобные группы , во втором случае водородные связи образуются непосредственно между молекулами воды и гидрофильными группами самой молекулы белка . Соответственно , теплоемкости гидратации гидрофобных групп имеют положительные значения , а теплоемкости гидратации гидрофильных групп – отрицательные [5,6].
Важно отметить , что теплоемкости гидратации гидрофобных групп строго пропорциональны площади поверхности , доступной растворителю [4].
Теплоемкость гидратации нативного белка может быть рассчитана , если известны аминокислотные остатки , расположенные на доступной растворителю поверхности белка [5], то есть предполагается знание третичной структуры белка . Однако , как будет показано ниже , при определенных допущениях можно проводить сравнительную оценку теплоемкостей гидратации нативных белков , для которых третичная структура неизвестна . Впервые детально этот подход изложен в работе [7] для сравнительного анализа интегральной гидрофобности легумина кормовых бобов Vicia faba и продукта его ограниченного гидролиза трипсином .
Метод ДСК позволяет измерить теплоемкость белка в температурном интервале 5°-120° С , что дает возможность описания температурной зависимости теплоемкости гидратации белка [6], а значит и изменение его гидрофобности с температурой . В данной работе , однако , приведены результаты измерений теплоемкости гидратации при стандартной температуре 25° С .
Материалы и методика исследований
Материалы
Легумины (11S запасные глобулины ) гороха (Pisum sativum) сортов Норд , Орпела , Батрак , Зарянка , Спрут , Орлус , Орловчанин -1, Орловчанин -2, Шустрик и УГ -92-90 выделены по методике [8]. По данным скоростной седиментации содержание легумина в выделенных препаратах было не менее 95%. Образцы для исследований готовили путем растворения лиофилизованных препаратов в 0,1 М Na- фосфатном буфере с рН 7,6 и диализом против указанного буфера . Концентрацию белка в растворе определяли микробиуретовым методом [9]. Молекулярная масса для исследованных легуминов принята 360 кДа на основании данных малоуглового рассеяния рентгеновских лучей для легумина гороха [13].
Методы
Микрокалориметрия . Измерения проводили на дифференциальном адиабатном сканирующем микрокалориметре ДАСМ -4 А ( Институт биологического приборостроения РАН , г . Пущино , Россия ) в области температур 20-120° С при скорости сканирования температуры 2° С / мин и избыточном давлении в ячейках калориметра 0,2 МПа . В каждом эксперименте шкалу теплоемкости калибровали по эффекту Джоуля - Ленца . Концентрация белка в растворе составляла 0,1-0,5%.
Расчет теплоемкости белков при температуре 298,2 К проводили по уравнению (1):
C
уд , б ел
с уд,H2O
V
H2O
Д C
набл уд ,буф/H2O
V
Ч
Ч V
набл
Д C уд , р - р / буф
бел
m бел
С V где Cуд ,H2O и V H2O -
удельная теплоемкость и удельный парциальный объем воды ;
набл
C уд , буф /H2O и
Cнабл уд ,р-р/буф - разности теплоемкостей между водой и растворителем (буфером) и между буфером и раствором белка; V – объем калориметрической ячейки; Vбел и mбел – объем и масса белка в ячейке калориметра.
Предварительно установлено , что удельные значения C уд , бел не зависят от концентрации белка в растворе в изученном диапазоне , поэтому они являются парциальными величинами .
Пикнометрия . Для определения удельных парциальных объемов белка и растворителя определяли плотности их растворов при температуре 298,2 К . Расчет кажущегося удельного парциального объема белка проводили по формуле :
V ф =
с
( с - с 0 ) сс 0 m
где m – масса белка в пикнометре ; ρ и ρ 0 – плотность раствора белка и растворителя .
Парциальные удельные объемы для белков находили линейной экстраполяцией Vф к бесконечному разбавлению . Вычисленные парциальные удельные объемы для легуминов гороха различной сортовой принадлежности не различались между собой в пределах ошибки измерения. Их среднее значение равно 0,73 мл/г. Парциальные объемы денатурированных форм легуминов приняты равными парциальным объемам нативных, так как известно, что различия в парциальных удельных объемах для белков в нативном и денатурированном состояниях не превышают 4% [12], что сопоставимо с ошибкой определения парциального объема белка.
Аминокислотный анализ . Аминокислотный состав легуминов определяли на аминокислотном анализаторе LC – 5000 (“ Биотроник ”, ФРГ ). Перед проведением анализа препараты белков гидролизовали в 6 Н HCl при 110° в течение 24 часов , затем образцы лиофильно высушивали и растворяли в Na- цитратном буфере с рН 2,2, после чего наносили на колонку .
Результаты и их обсуждение
В таблице 1 приведены термодинамические параметры денатурации легуминов гороха различной сортовой принадлежности , а именно , величины парциальных теплоемкостей легумина в нативном и денатурированном состоянии , температуры T Д и энтальпии Δ Д H денатурации , а также разности теплоемкостей между денатурированной и нативной формами белков ( инкремент теплоемкости ) Δ д C уд .
Таблица 1 – Термодинамические параметры денатурации и теплоемкости легуминов гороха различной сортовой принадлежности
|
Экспериментальные величины |
Расчетные величины (298,2 К ) |
||||||||
|
Сорт гороха |
T Д , K |
Δ Д h, Дж / г |
Δ Д С уд Д ж / г · К |
C уд ( Н ) Дж / г · К |
C уд эксп ( Д ) Дж / г · К |
C уд г Дж / г · К |
C уд расч ( Д ) Дж / г · К |
C уд гид ( Д ) Дж / г · К |
C уд гид ( Н ) + C уд внут Дж / г · К |
|
Зарянка |
356,1 ±0,2 |
16,2 ±0,8 |
0,21 ±0,01 |
2,19±0,20 |
2,41 |
1,21 |
1,94 |
1,27 |
1,05 |
|
Орловчанин -1 |
356,5 ±0,2 |
17,0 ±0,7 |
0,21 ±0,01 |
1,90±0,20 |
2,12 |
1,20 |
1,97 |
0,97 |
0,77 |
|
Спрут |
357,0 ±0,3 |
17,2 ±0,9 |
0,22 ±0,02 |
2,08±0,20 |
2,30 |
1,21 |
1,97 |
1,16 |
0,94 |
|
Орпела |
357,7 ±0,2 |
19,1 ±0,9 |
0,22 ±0,02 |
1,64 ±0,12 |
1,86 |
1,20 |
1,95 |
0,73 |
0,51 |
|
Батрак |
357,9 ±0,2 |
16,5 ±1,0 |
0,23 ±0,01 |
1,99 ±0,15 |
2,21 |
1,22 |
1,96 |
1,06 |
0,84 |
|
Норд |
357,9 ±0,3 |
17,5 ±0,8 |
0,23 ±0,01 |
1,75 ±0,11 |
1,97 |
1,18 |
1,96 |
0,86 |
0,64 |
|
Орлус |
359,1 ±0,3 |
17,9 ±0,8 |
0,24 ±0,01 |
1,91 ±0,13 |
2,13 |
1,21 |
2,11 |
0,99 |
0,77 |
|
Орловчанин -2 |
359,9 ±0,3 |
16,9 ±1,0 |
0,22 ±0,02 |
1,70 ±0,12 |
1,92 |
1,20 |
1,95 |
0,79 |
0,57 |
|
Шустрик |
360,2 ±0,2 |
18,4 ±1,1 |
0,22 ±0,01 |
1,76 ±0,11 |
1,98 |
1,19 |
1,99 |
0,86 |
0,64 |
|
УГ -92-90 |
361,2 ±0,2 |
17,7 ±0,8 |
0,21 ±0,02 |
1,54 ±0,14 |
1,76 |
1,21 |
1,89 |
0,62 |
0,40 |
C уд г – теплоемкость в газовой фазе ;
C уд ( Н ) – теплоемкость нативного легумина в растворе ;
C уд эксп ( Д ) – экспериментальные значения теплоемкости денатурированного легумина в растворе ;
C уд гид ( Д ) – теплоемкость гидратации денатурированной формы легумина ;
C уд гид ( Н ) + C уд внут - сумма теплоемкостей гидратации нативной формы легумина и теплоемкости взаимодействия внутри молекулы .
C уд эксп ( Д ) была определена по уравнению :
C уд эксп ( Д ) = C уд эксп ( Н ) + Δ Д C уд , где Δ Д C уд – разность теплоемкостей между денатурированной и нативной формами белков .
C г уд , ост - теплоемкость аминокислотного остатка в газовой фазе , C уд , ост - теплоемкость аминокислотного остатка в растворе .
Видно , что температуры и энтальпии денатурации легуминов несколько различаются в зависимости от сортовой принадлежности гороха , в то же время разность теплоемкостей между денатурированной и нативной формами белка практически не изменяется .
На основании экспериментальных данных по аминокислотному составу легуминов ( табл .2) и литературных данных по теплоемкостям аминокислотных остатков в газовой фазе [4] рассчитаны теплоемкости легуминов в газовой фазе по уравнению :
Cгуд = 12Cуд,NH2 + (n-12)Cуд,CHCONH + nг i=1C уд,ост
+ 12С
+ уд ,CH2COOH
где C гуд , ост - теплоемкость аминокислотного остатка данного типа в газовой фазе .
Таблица 2 – Аминокислотный состав легумина гороха различной сортовой принадлежности
|
Амино кислотные остатки в белке |
Количество аминокислотных остатков данного типа в белке |
|||||||||
|
Норд |
Орпела |
Батрак |
Зарянка |
Спрут |
Орлус |
Орловчанин - 1 |
Орловчанин -2 |
Шустрик |
УГ -92- 90 |
|
|
Лизин |
135,0 |
139,3 |
131,8 |
126,2 |
125,4 |
137,4 |
126,5 |
109,8 |
126,7 |
116,2 |
|
Гистидин |
73,5 |
83,3 |
81,4 |
94,7 |
95,5 |
42,7 |
74,3 |
97,9 |
73,4 |
76,5 |
|
Аргинин |
229,0 |
248,9 |
239,5 |
228,9 |
231,3 |
98,5 |
211,8 |
189,6 |
221,0 |
187,6 |
|
Аспараг . к - та |
387,2 |
348,1 |
406,8 |
407,1 |
366,4 |
233,8 |
411,5 |
443,5 |
320,3 |
400,5 |
|
Треонин |
122,3 |
112,2 |
146,3 |
127,8 |
142,4 |
121,4 |
115,4 |
135,7 |
129,2 |
120,7 |
|
Серин |
193,1 |
189,1 |
207,9 |
213,3 |
149,2 |
118,6 |
199,3 |
212,5 |
202,2 |
184,0 |
|
Глутам . к - та |
779,7 |
722,6 |
745,7 |
767,0 |
788,7 |
903,3 |
748,8 |
773,8 |
761,0 |
796,0 |
|
Пролин |
245,0 |
259,1 |
209,1 |
196,1 |
205,7 |
237,2 |
200,9 |
236,1 |
259,6 |
229,1 |
|
Глицин |
201,9 |
189,3 |
246,1 |
244,2 |
256,8 |
282,1 |
261,2 |
245,5 |
228,4 |
217,1 |
|
Аланин |
182,8 |
152,0 |
190,5 |
200,0 |
204,6 |
330,2 |
205,7 |
249,2 |
196,0 |
186,4 |
|
Валин |
137,3 |
128,6 |
132,6 |
128,9 |
137,6 |
189,6 |
148,2 |
130,7 |
146,4 |
136,5 |
|
Изолейцин |
99,3 |
103,7 |
93,2 |
99,9 |
103,1 |
164,1 |
103,4 |
94,5 |
103,4 |
101,5 |
|
Лейцин |
230,0 |
242,1 |
235,1 |
230,6 |
234,8 |
276,1 |
249,4 |
218,6 |
231,3 |
247,5 |
|
Тирозин |
58,2 |
62,2 |
60,4 |
54,1 |
55,6 |
51,2 |
56,7 |
51,6 |
54,5 |
42,4 |
|
Фенилаланин |
108,8 |
118,9 |
102,0 |
100,8 |
108,1 |
132,0 |
114,5 |
99,3 |
109,6 |
118,1 |
Количество аминокислотных остатков на моль белка было определено исходя из мол . массы легуминов 360 кДа [13]. Детали и обоснование расчетов приведены в [6].
Парциальная теплоемкость денатурированной формы легумина была рассчитана по уравнению :
расч уд = уд,NH2 +(n ) уд,CHCONH +
n i=1
С уд,ост
+ уд ,CH2COOH
где C уд , ост - теплоемкость аминокислотного остатка данного типа в растворе . Парциальные теплоемкости для аминокислотных остатков , пептидной и NH2+CH2COOH групп взяты из [4]. Аспарагин и глутамин были определены в виде их кислот , однако , значения C уд , ост для аспарагина / аспарагиновой кислоты и глутамина / глутаминовой кислоты близки между собой [4].
Исходя из экспериментально полученных значений парциальной теплоемкости денатурированной формы легуминов в растворе – C уд ( Д ) и расчетных значений их теплоемкостей в газовой фазе – C удг , вычислены теплоемкости гидратации для денатурированной формы белков – C удгид ( Д ) ( табл .1) по уравнению [6]:
C гид ( Д ) = C ( Д ) - C г + R (5) уд уд уд
Из таблицы 1 видно , что теплоемкости гидратации для денатурированных форм легуминов различной сортовой принадлежности различаются между собой .
Для вычисления теплоемкости гидратации белков в нативной форме , помимо экспериментально измеренных значений – C уд ( Н ) ( табл . 1) требуются данные о доступной растворителю поверхности белка [5,6]. Для легуминов такие данные не обнаружены . Однако , если в 80
правую часть уравнения [5] ввести член C уд внут – соответствующую теплоемкость белка в растворе в нативном состоянии , характеризующую невалентные взаимодействия в белковой глобуле , то получим :
C гид(Н) = C (Н) - C г - C внут + R (6) у у уу
Как будет показано далее ( см . « Обсуждение »), значение C удвнут для легуминов можно считать одинаковым . Это обстоятельство делает содержательным сопоставление значений (C удгид ( Н ) + C удвнут ) для легуминов . Указанное значение для исследованных белков представлено в таблице 1. Видно , что для легуминов различной сортовой принадлежности значения этого параметра не одинаково .
Сопоставим экспериментальные и расчетные значения парциальных теплоемкостей легуминов в денатурированной форме в растворе – C удэксп ( Д ) и Cp расч ( Д ) ( табл . 1). Видно , что для большинства легуминов из различных сортов гороха экспериментальные значения C удэксп ( Д ) практически равны расчетным значениям Cp расч ( Д ), это свидетельствует о том , что в денатурированной форме все аминокислотные остатки белка доступны растворителю . Или другими словами , денатурированные белки близки к состоянию клубка [14]. Однако для легуминов сортов гороха Батрак , Зарянка , Спрут значения Cp расч ( Д ) меньше значений C удэксп ( Д ). Такая ситуация возможна лишь в том случае , если предположить , что легумины из указанных сортов находятся в комплексе с небелковым компонентом гидрофобной природы . Это , по - видимому , фосфолипиды , так как элементарный анализ показал наличие фосфора в указанных белковых препаратах .
Вычисленные значения теплоемкостей гидратации для денатурированной формы легуминов C уд гид ( Д ) также приведены в таблице 1. Видно , что они существенно различаются для легуминов гороха различной сортовой принадлежности , что свидетельствует об их различной интегральной гидрофобности , причем , чем выше значение C удгид ( Д ), тем более гидрофобным является белок .
Теплоемкость гидратации легумина в нативной форме , как было показано выше , может быть оценена лишь с помощью величины C удгид ( Н ) + C удвнут , рассчитанной по уравнению (6). Однако , для легуминов гороха различной сортовой принадлежности величину C удвнут можно принять постоянной , основываясь на следующих фактах . Температура и энтальпия денатурации легуминов не сильно различаются ( табл .1). Разности теплоемкостей между денатурированной и нативными формами белка - Δ д C уд в пределах ошибки эксперимента для исследованных легуминов также близки между собой . Равенство значений Δ д C уд свидетельствует о том , что в процессе денатурации легуминов происходит экспанирование гидрофобных ( неполярных ) аминокислотных остатков в растворитель , площадь поверхности которых (ASA нп ) для исследованных белков одинакова , так как известно , что Δ д C уд линейно связана с Δ ASA нп белков [16,17]. Это свидетельствует о приблизительно равном количестве вандерваальсовских контактов в нативных формах белков [17].
Изменение площади доступной растворителю поверхности при денатурации легуминов можно оценить количественно , используя численные данные о взаимосвязи значений Δ д C уд и Δ ASA нп , взятых для ряда белков из работы [16]. График зависимости Δ д C уд от Δ ASA нп для исследованных белков имеет линейный характер ( рис . 1). Зная значение Δд C уд для исследованных легуминов ( табл .1) и используя приведенную зависимость Δ д C уд от Δ ASA нп , можно графически вычислить значение Δ ASA нп для легуминов . Оно равно 12,4×103 А 2 в расчете на субъеденицу легумина ( молекулярная масса 60 кДа ).
Из вышесказанного следует , что теплоемкость гидратации нативных форм легуминов может быть оценена величиной (C уд ( Н ) + C удвнут ), рассчитанной по уравнению (6). Данные о теплоемкостях гидратации нативных легуминов приведены в таблице 1. Видно , что они существенно различаются для легуминов гороха различной сортовой принадлежности , что свидетельствует об их различной степени интегральной гидрофобности . Причем , как нативные , так и денатурированные формы легуминов по интегральной гидрофобности можно расположить в один ряд . Это становится возможным по той причине , что при денатурации легуминов происходит одно и то же изменение величины Δ ASA нп . Легумины располагаются по интегральной гидрофобности в следующий ряд : Зарянка > Спрут > Батрак > Орлус = Орловчанин -1 > Норд = Шустрик > Орловчанин -2 > Орпела > УГ -92-90.
Значения Δ ASAnp и Δ dCp были взяты из [16].
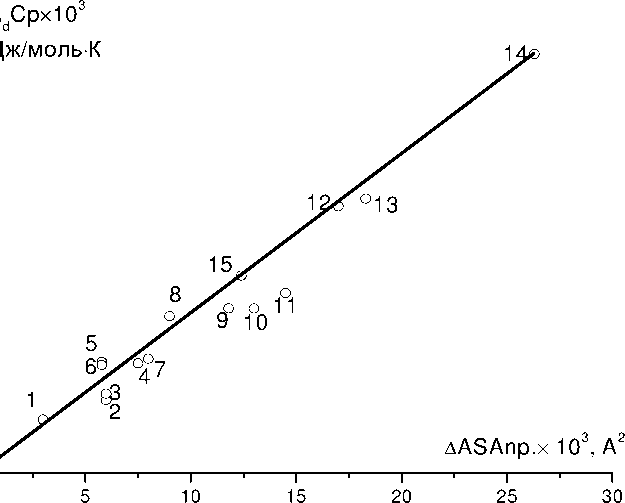
Рисунок 1 – Зависимость изменения доступной растворителю гидрофобной поверхности белков Δ ASAnp в процессе денатурации от разности теплоемкостей между денатурированной и нативной формами белка – Δ dCp:
-
1 – ингибитор трипсина
-
2 – парвоальбумин В
-
3 – рибонуклеаза А
-
4 – лизоцим
-
5 – рибонуклеаза - Т
-
6 – ферицитохром
-
7 – стафилококковая нуклеаза
-
8 – метмиоглобин
-
9 – В - трипсин
-
10 – папаин
-
11 – химотрипсин
-
12 – химотрипсиноген
-
13 – карбоникангидраза
-
14 – пепсиноген
-
15 – легумин
Итак , легумины семян гороха различной сортовой принадлежности как в нативном , так и в денатурированном состояниях различаются по величинам теплоемкостей их гидратации , что свидетельствует о различной степени их интегральной гидрофобности . Показано , что при денатурации легуминов происходит одно и то же изменение Δд C уд , или одно и то же изменение доступной растворителю гидрофобной поверхности белков .
Принимая во внимание это обстоятельство , можно заключить , что различия в интегральной гидрофобности денатурированных форм легуминов определяются только различиями в интегральной гидрофобности нативных форм легуминов .
Выводы
Таким образом , предложен новый метод оценки доступной гидрофобной поверхности на основе экспериментально установленного аминокислотного состава и парциальной теплоемкости интактной формы белка . В данной работе метод применен к исследованию интегральной гидрофобности легуминов гороха различной сортовой принадлежности , что позволяет прогнозировать такие их функциональные свойства , как поверхностная активность и обусловленные ею эмульгирующая и пенообразующая способность легуминов .
Список литературы Сравнительный анализ интегральной гидрофобности легуминов гороха различной сортовой принадлежности
- Nakai, S. Li-Chan Hydrophobic interactions in Food systems//CRC press Inc., Boca Raton, Florida, 1988
- Cherl-Ho Lee, Sung-Koo Kim Effects of protein hydrophobicity on the surfactant properties of food proteins//Food Hydrocolloids http://docviewer.yandex.ru/r.xml?sk=ye4c243b1ed8d83ee0310766e1816a2c7&url=http%3A%2F%2Fwww.sciencedirect.com%2Fscience%2Fjournal%2F0268005X>. 1987. № 1 (4). Р. 283-289
- Kato A., Nakai S. Hydrophobicity determined by a fluorescence probe method and its correlation with surface properties of proteins//Biochim.Biophis. Acta. 1980. 624. Р. 13-20
- Shimizu M., Saito M., Yamauchi. K. Hydrophobicity and Emulsifying Activity of Milk Proteins//Agric.Biol.Chem. 1986. № 50. Р. 791-792
- Ninad V. Prabhu and Kim A. Sharp Heat capacity in proteins//Annu. Rev. Phys. Chem. 2005. № 56. Р. 521-548
- Privalov P. L., Makhatadze G. I. Partial molar heat capacity of individual amino acid residues in aqueous solution: hydration effect//J.Mol.Biol. 1990. 213. Р. 385-391
- Privalov P. L., Makhatadze. G. I. Contribution of hydration and non-covalent interactions to the heat capacity effect on protein unfolding//J.Mol.Biol. 1992. 224. Р. 715-723
- Danilenko, A.N., V.T. Dianova., E.E. Braudo., T. Henning., K.D. Schwenke. Thermodynamic approach to the comparative analysis of integral hydrophobicity of legumin and legumin-T in native and denaturated forms. 1. Broad bean legumin.//Nahrung 41(1) (1997), http://docviewer.yandex.ru/r.xml?sk=ye4c243b1ed8d83ee0310766e1816a2c7&url=http%3A%2F%2Fonlinelibrary.wiley.com%2Fdoi%2F10.1002%2Ffood.v41%3A1%2Fissuetoc> 13-17,199
- Выделение и очистка IIS глобулинов из семян кормовых бобов и гороха/И. А. Попелло и [др.].//Прикладная биохимия и микробиология. 24 (1) (1988), 50-55
- Itzhaki R., Gall D. A microbiuret method for estimation of protein//Analyt. Biochem. 9 (1964), 401-410
- Privalov P. L., Khechinashvili N. N. A thermodynamic approach to the problem of stabilization of globular protein structure: a calorimetric study//J.Mol.Biol. 86 (1974), 665-684
- Privalov P. L. Microcalorimetry of proteins and their complexes.//Methods Mol. Biol. 490 (2009), 1-3
- Durchschlog H. In: Thermodynamic data for Biochem. And Biotechn., Ed: hinz H.J., Springer-Verlag, Berlin, 1986, pp.45-128
- Miles, M.J., V.J.Morris, V.Carrol, D.J.Wright, V.Newby. Small-angle X-ray scattering studies of 7S and 11S globulins from pea (Pisum sativum).//Int.J.Biol.Macromol. (1985), 125-126
- Privalov, P.L., E.I. Tiktopulo, S.Yu. Venyaminov., Yu.V. Griko, G.I.Makhatadze and Khechinashvili, N.N., J.Mol.Biol. 205 (1989), 735-750
- Naghibi, H., S.F.Dec, S.J.Gill. Heats of solution of ethane and propane in water from 0 to 50оC.//J.Phys. Chem. 91 (1987), 245-248
- Spolar, R.S., J.R. Livingstone and Record I.M. Use of Liquid Hydrocarbon and Amide Transfer Data to Estimate Contributions to Thermodynamic Functions of Protein Folding from the Removal of Nonpolar and Polar Surface from Water.//Biochemistry, 31 (1992), 3947-3955
- Privalov, P.L. Stability of proteins: small globular proteins.//Adv.Prot.Chem., 33 (1979), 167-241


