Сравнительный анализ использования голометаллических стентов и стентов с биоактивным покрытием при атеросклеротическом поражении поверхностной бедренной артерии
Автор: Олещук А.Н., Майстренко Д.Н., Чернявский М.А., Генералов М.И., Иванов А.С., Кокорин Д.М., Хмельницкий А.В., Овчинников И.В., Белова В.В., Филипенко М.О.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 3-2 т.15, 2020 года.
Бесплатный доступ
Цель: сравнить результаты лечения пациентов с атеросклеротическим поражением поверхностной бедренной артерии (ПБА) с использованием стентов с биоактивным покрытием на основе оксинитрид титана и голометаллических стентов. Материалы и методы: проведен анализ 123 пациентов, которым с 2014 по 2017 гг. выполнено эндоваскулярное лечение стеноза ПБА. Из них в основную группу вошли 54 пациента, у которых имплантирован биоактивный стент. Контрольную группу составили 69 пациентов, которым выполнена операция с использованием голометаллического стента. Для оценки поражения сосудистого русла использовалась компьютерная томографическая ангиография либо рентгеноконтрастная ангиография. В обеих группах пациенты были сопоставимы по возрасту, полу и сопутствующей патологии. По классификации Фонтейн- Покровского в обеих группах преобладала 2б стадия: 36 пациентов (67,9%) в основной и 55 (79,7%) в контрольной группах. 3 стадия была у 17 (32,1%) в основной, 12 (17,4%) в контрольной группах. Кроме того, в контрольной группе было 2 пациента с 4 стадией заболевания. В обеих группах преобладало окклюзионное поражение ПБА -98 пациентов. Для имплантации в основной группе использовали стент с биоактивным покрытием, представляющий собой самораскрываемый нитиноловый каркас с покрытием на основе оксинитрид титана. В контрольной группе голометаллические стенты из нитинола. Конструкции были диаметром от 6 до 8 мм, длиной от 50 до 200 мм. В качестве маркера эндотелиальной дисфункции до операции и через 3 дня, 6, 12 и 24 месяца после имплантации стента иммуноферментным методом определяли уровень оксида азота (NO) в крови (N = 24 мкмоль/л). Контроль проходимости конструкции осуществляли по данным ультразвукового дуплексного сканирования параллельно с оценкой уровня оксида азота крови, проводимого в сроки 3 суток, 6, 12 и 24 месяца. Результаты: в обеих группах осложнений во время операции и в раннем послеоперационном периоде не было. В основной группе отсутствие проходимости конструкции наблюдалось через 6 месяцев у 3 пациентов (5,6%), в контрольной - у 13 (18,8%). В сроки до 12 месяцев непроходимость конструкции выявлена у 4 больных (7,5%) в основной группе и у 6 (8,7%) - контрольной группы, а через 24 месяца у 2 пациентов (3,8%) основной и 7(10,1%) контрольной группы. При этом уровень NO крови в основной группе через 3 суток после операции составил 20,2 мкмоль/л, против 11,8 мкмоль/л контрольной. Через 6 месяцев отмечено снижение уровня NO в основной группе до 13,9 мкмоль/л, а в контрольной - до 8,4 мкмоль/л. Через 12 месяцев отмечалось возвращение данного показателя в обеих группах к первоначальным значениям: 9,9 мкмоль/л в основной и 7,5 мкмоль/л в контрольной группе. Всем пациентам с осложнениями было выполнено повторное восстановление проходимости. Заключение: в ходе наблюдения была выявлена взаимосвязь между уровнем NO крови и проходимостью стента, имплантированных в ПБА. Таким образом, использование стентов с биоактивным покрытием повышает проходимость конструкции, путем подавления эндотелиальной дисфункции.
Атеросклероз, поверхностная бедренная артерия, голометаллический стент, биоактивное покрытие
Короткий адрес: https://sciup.org/140260039
IDR: 140260039 | DOI: 10.25881/BPNMSC.2020.54.69.005
Текст научной статьи Сравнительный анализ использования голометаллических стентов и стентов с биоактивным покрытием при атеросклеротическом поражении поверхностной бедренной артерии
Более 202 млн. человек во всем мире страдают поражением периферических артерий нижних конечностей. Из них на окклюзию бедренно-подколенного сегмента приходится от 60 до 70% случаев ишемии нижних конечностей [1–3].
Основным методом лечения, применяемым при атеросклеротическом поражении поверхностной бедренной артерии (ПБА) является открытая реконструкция артериального русла, представленная различными вариантами шунтирующих операций и эндартерэктомий.
Рутинная шунтирующая операция, по сравнению с менее инвазивной эндоваскулярной хирургией, демонстрирует более длительные результаты проходимости конструкции, но связана с более продолжительным периодом выздоровления, большим количеством осложнений со стороны послеоперационных ран.
Эндоваскулярные методики сегодня переживают период бурного развития. Они представлены широким спектром оперативных вмешательств: баллонная ангиопластика (БАП), стентирование, реканализация.
Рандомизированные исследования, в том числе испытания ABSOLUTE, 2 RESILIENT, 3 и Zilver PTX, 1 показали, что первичная имплантация стента в ПБА более эффективна, чем БАП, даже для лечения более протяженных повреждений [4–8].
В последние десятилетия эндоваскулярное лечение становится все более приоритетным, по сравнению с рутинной открытой хирургией при атеросклеротическом поражении ПБА.
Развитие малоинвазивных технологий, накопление опыта, появление новых устройств и инструментов привели не просто к широкому внедрению эндоваскулярных операций в повседневную практику лечения пациентов с протяженными поражениями бедренно-подколенного сегмента, но и сделали эти вмешательства методом выбора даже у больных с С и D типами поражений по классификации TASC II.
Бедренно-подколенный сегмент подвержен воздействию разнонаправленных сил при движении конечности, включая перегиб, продольное и поперечное растяжение и сжатие, а так же скручивание. Это важно учитывать, если целью является долговременная проходимость сегмента, особенно при использовании стентов. При планировании лечения таких пациентов стоит иметь в виду, что непосредственный ангиографический успех и отдаленный результат зависят не только от мастерства хирургической бригады, настроенности пациента на лечение, но и от совершенства и надежности имплантируемых конструкций. В первую очередь стент, имплантируемый в этот сегмент, должен выдерживать все возможные нагрузки: сгибательные, разгибательные, вращательные [9–11].
В настоящее время существует огромное количество разнообразных стентов для ПБА, различающихся по форме, структуре, покрытию, но в большинстве своем у всех остается одна и та же проблема -развитие ресте- ноза в первый год после имплантации, и, как следствие, развитие воспаленного процесса в зоне хирургического вмешательства, приводящего к интимальной гиперплазии и эндотелиальной дисфункции.
В последние несколько лет активно ведутся усовершенствования стентов для данной зоны сосудистого русла с учетом биомеханических процессов: разработка стентов с покрытиями, усовершенствуются модели стентов, которые предотвращали бы эндотелиальную дисфункцию, выдерживали бы нагрузки при движении в зоне стентирования и, как следствие, продлевали период проходимости конструкции.
Одним из таких стентов является стент с биоактивным покрытием оксинитрид титана, который доказал свою эффективность при коронарном стентировании [12].
Однако в настоящее время нет исследований, которые проводили бы сравнение между первичным стентирование ПБА голометаллическими стентами и стентами с покрытием оксинитрид титана.
Проведено исследование, посвященное сравнительному анализу использования голометаллических стентов и стентов с покрытием оксиднитрит титана, а так же влияние данного покрытия на уровень маркера эндотелиальной дисфункции общего оксида крови, как прогностического критерия рестенозов.
Цель работы — оценить эффективность применения стентов с покрытием оксиднитрид титана при атеросклеротическом поражении ПБА.
Материалы и методы
Работа базируется на данных 123 пациентов, проходивших лечение в ФГБУ «РНЦРХТ им. Акад. А.М. Гра-нова» и ФГБУ «НМИЦ им. В.А. Алмазова».
Критериями включения в исследование было:
– наличие окклюзионно- стенотического поражения артерий БПС по типу А, B, С или D по классификации TASC II,
– комплаентность пациента,
– общее удовлетворительное состояние,
– отсутствие ХПН3 ст.
Критерием исключения было наличие у пациента сахарного диабета.
В зависимости от вида применяемого стента, пациенты были разделены на 2 группы. Основную группу составили 54 больных, которым имплантирован стент с биоактивным покрытием оксиднитрид титана. В контрольную группу вошли 69 пациентов, у которых использовали голометаллический стент.
Оперативные вмешательства осуществлялись под местной анестезией в операционной, оснащенной мобильной ангиографической установкой Veradius (Philips, Нидерланды), либо в рентгеноперационной, оснащенной ангиографом Siemens. Предварительно в зоне поражения артерии осуществлялась баллонная ангиопластика. Показанием к стентированию считали наличие остаточного стеноза более 30%, либо диссекции.
В основной группе использовали периферический самораскрывающийся биоактивный нитиноловый стент (BAS) -HeliFlexTI. Принципиальной особенностью этого стента является покрытие: Titanox (TM) (Оксинитрид Титанасодержащее (Рис. 1).
Применялись стенты диаметром от 6 до 8 мм, длиной от 50 до 200 мм.
В контрольной группе использовали для стентирования самораскрываемые периферические стенты: INNOVA (Boston Saintific), S.M.A.R.T.™ .
Непосредственно перед введением в просвет артерии интервенционных инструментов внутриартериально вводили раствор гепарина в дозировке 5000–7500 ЕД (70–80 ЕД / 1 кг массы тела для взрослого). В конце оперативного вмешательства всем пациентам выполняли контрольную артериографию. Для исключения эмболии дистального русла мы проводили ангиографию нижних конечностей до артериальной дуги стопы.
До операции, через 3 суток после имплантации стента, а так же — через 6 ,12 и 24 месяца иммунофер-ментным методом определяли уровень оксида азота (NO) в крови (N = 23 мкмоль/л), используя тест-системы Total NO/Nitrite/Nitrate.
Оценку проходимости конструкции осуществляли по данным ультразвукового дуплексного сканирования проводимого в сроки 3 суток, через 6 и 12 и 24 месяца на аппарате Vivid 7 Dimension.
Результаты
В исследовании приняли участие 81 мужчина и 42 женщины. Средний возраст пациентов составил 67,30±7,54 лет.
Пациенты, вошедшие в исследование, имели сопутствующую патологию.
Характеристика сопутствующих заболеваний и факторов риска представлена в таблице 1.
Из сопутствующей патологии в представленной выборке больных преобладали АГ (69,1%), дислипидемия (65,04%) и ИБС, которое было у 70 человек (56,9%). Курильщиков среди больных было 95 человек (77%).
Характеристика пациентов, вошедших в исследование по стадиям заболевания, представлена в табл. 2.
Как следует из табл. 2, пациенты исследуемых групп не различались по стадиям ОАНСК.
Характеризуя ишемию нижних конечностей среди обследованных больных, необходимо отметить, что наибольшее количество пациентов было с ОАСНК IIБ стадией по классификации Фонтейна — Покровского: 55 больных (79,7%) в контрольной группе, 36 (67,9%) в основной группе. Кроме того, 2 пациента контрольной группы имели 4 стадию (таб. 2).
Особенности поражения ПБА представлены в табл. 3.
При анализе данных, представленных в табл. 3 было выявлено, что в большинстве случаев (79,6%) имелись окклюзии просвета сосуда и только примерно у 1/5
30^
25 _
20,2
Через Через Через Через
Здня 6 месяцев 12 месяцев 24 месяца
10,
5, 0_.
До
Период
I Основная
Контрольная
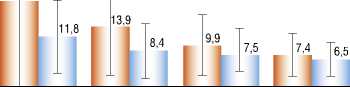
Рис. 1. Динамика показателя NO.
Табл. 1. Сопутствующая патология
|
Патология |
Количество |
% |
|
ИБС: |
70 |
56,9 |
|
– Стенокардия напряжения |
54 |
43,9 |
|
– ПИКС |
16 |
13 |
|
АГ |
85 |
69,1 |
|
Дислипидемия |
80 |
65,04 |
|
СД |
12 |
9,7 |
|
Нарушение функции почек |
4 |
3,2 |
|
ХПН |
3 |
2,4 |
|
Поражение брахиоцефальных артерий |
8 |
6,5 |
|
ОНМК в анамнезе |
3 |
2,4 |
|
Курение |
95 |
77 |
Примечание : ИБС – ишемическая болезнь сердца; ХПН – хроническая почечная недостаточность; ПИСК – постинфарктный кардиосклероз; АГ – артериальная гипертензия; ОНМК – острое нарушение мозгового кровообращения.
Табл. 2. Распределение пациентов по стадии ишемии нижних конечностей
|
Стадия ишемии конечности по Фонтейн-Покровскому |
Основная группа (N = 53) |
Контрольная группа (N = 69) |
Всего (N = 123) |
Уровень P, (df = 2) |
|
2б |
36 (67,9%) |
55 (79,7%) |
91 |
0,0901 |
|
3 |
17 (32,1%) |
12 (17,4%) |
29 |
|
|
4 |
0 (0,0%) |
2 (2,9%) |
2 |
Табл. 3. Характер поражения артерий бедренно-подколенного сегмента
Поражение артерий бедренно- подколенного сегмента оценивали по международной классификации TASC II.

Олещук А.Н., Майстренко Д.Н., Чернявский М.А. и др.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ИСПОЛЬЗОВАНИЯ ГОЛОМЕТАЛЛИЧЕСКИХ СТЕНТОВ И СТЕНТОВ С БИОАКТИВНЫМ ПОКРЫТИЕМ ПРИ АТЕРОСКЛЕРОТИЧЕСКОМ ПОРАЖЕНИИ ПОВЕРХНОСТНОЙ БЕДРЕННОЙ АРТЕРИИ
Табл. 4. Распределение пациентов по категориям TASC II
|
Категория ТASK |
Всего |
% |
|
A |
42 |
34,40% |
|
B |
46 |
37,70% |
|
C |
21 |
17,20% |
|
D |
13 |
10,70% |
Табл. 5. Анализ динамики показателей NO в основной и контрольной группах исследования
|
о с |
M±S, До |
M±S (%), Через 3 дня |
M±S (%), Через 6 месяцев |
M±S (%), Через 12 месяцев |
M±S (%), Через 24 месяца |
Уровень P |
Основная группа
|
NO |
9,57±12,05 |
20,24±31,07 (111,40%) |
13,89±10,94 (45,08%) |
9,88±7,12 (3,20%) |
7,43±5,27 (-22,42%) |
<0,0001 |
Контрольная группа
|
NO |
7,48±6,57 |
11,76±8,55 (57,25%) |
8,44±6,48 (12,80%) |
7,45±6,59 (-0,38%) |
6,49±4,05 (-13,22%) |
0,0130 |
Табл. 6. Сравнение групп по периодам проходимости конструкции
|
2: Группа |
||||
|
Показатель, Период |
Основная (N = 54) |
Контрольная (N = 69) |
Всего |
Уровень P (df = 1) |
|
Другие |
||||
|
Осложнение (тромбоз/рестеноз), До |
0 (0,0%) |
0 (0,0%) |
0 |
1,0000 |
|
Осложнение (тромбоз/рестеноз), Через 3 суток |
0 (0,0%) |
1 (1,4%) |
1 |
0,3744 |
|
Осложнение (тромбоз/рестеноз), Через 6 месяцев |
3 (5,6%) |
13 (18,8%) |
16 |
0,0297 |
|
Осложнение (тромбоз/рестеноз), Через 12 месяцев |
4 (7,5%) |
6 (8,7%) |
10 |
0,8187 |
|
Осложнение (тромбоз/рестеноз), Через 24 месяца |
2 (3,8%) |
7 (10,1%) |
9 |
0,1911 |
Как видно из данных, приведенных в табл. 4, у большинства пациентов были поражения типа А и В.
Пациенты, включенные в данное исследование, были сопоставимы по полу, возрасту, степени хронической артериальной ишемии нижних конечностей, сопутствующим заболеваниям и факторам, которые способны повлиять на результат лечения, а также по типу и локализации поражения артерий БПС.
Во всех случаях интраоперационно был отмечен технический успех.
Осложнений в раннем послеоперационном периоде не было. Улучшение лодыжечно-плечевого индекса было у всех пациентов: среднее значение до лечения 0,4±0,3, после стентирования — 0,9±0,2.
В таблице 5 и на рисунках 2 и 3 представлены результаты статистического анализа изменения показателя оксид азота по периодам до операции, через 3 дня, 6 месяцев, 12 месяцев и 24 месяца, отдельно для основной и отдельно для контрольной группы.
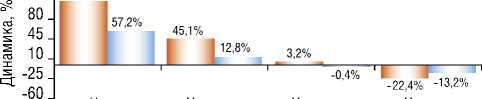
На основании приведенных выше данных можно сделать вывод о том, что динамика в основной и контрольной группе схожа. Однако, увеличение показателя NO в основной группе статистически достоверно выше.
Таким образом, по результатам проведенного анализа изменения показателя NO по периодам до, через 3 суток, 6 месяцев, 12 месяцев и 24 месяца для всей выборки можно утверждать, что данный параметр статистически достоверно увеличивается через 3 суток после операции, а затем снижается, достигая дооперационных значений через 6–12 месяцев после операции. Изменение уровня NO в основной и контрольной группе носят схожий характер. Различия между группами в показатели уровня NO носят достоверный характер.
На основании данных, приведенных в табл. 6 можно сделать вывод о том, что осложнения (рестеноз, тромбоз) чаще наблюдаются в контрольной, чем в основной группе через 6 месяцев после операции (18,8% vs 5,6% соответственно). Различия уровней NО в группах сравнения через 24 месяца носят достоверный характер.
В табл. 7 представлен топ список оценок рисков влияющих факторов к целевому показателю «Тромбоз/ Рестеноз».
Табл. 7. Топ ключевых факторов влияния на целевой показатель «Тромбоз/Рестеноз» (оценки абсолютных рисков, изменение риска, относительный риск)
|
Фактор |
Тромбоз/рестеноз (риск, %) |
Изменение риска (95% ДИ) |
Относительный риск (95% ДИ) |
Уровень P |
|
|
Фактор: Нет |
Фактор: Есть |
||||
|
Группа (Контрольная) |
7 (13,0%) |
27 (39,1%) |
26,2 (11,6; 40,8)% |
3,02 (1,42; 6,40) |
0,0013 |
|
Окклюзия (Есть) |
2 (8,0%) |
32 (32,7%) |
24,7 (10,5; 38,8)% |
4,08 (1,05; 15,89) |
0,0139 |
|
Таск (B, D, C) |
6 (14,3%) |
28 (35,0%) |
20,7 (5,8; 35,6)% |
2,45 (1,10; 5,45) |
0,0153 |
|
Длина стента ≥ 110,0 |
7 (15,6%) |
27 (35,5%) |
20,0 (4,9; 35,1)% |
2,28 (1,08; 4,81) |
0,0182 |
|
NO < 13,0, Через 3 суток |
9 (18,0%) |
24 (36,4%) |
18,4 (2,6; 34,1)% |
2,02 (1,03; 3,96) |
0,0299 |
|
Стеноз (Есть) |
33 (31,1%) |
1 (5,9%) |
-25,2 (-39,5; -11,0)% |
0,19 (0,03; 1,29) |
0,0307 |
|
NO ≥ 8,3, Через 24 месяца |
14 (20,3%) |
15 (37,5%) |
17,2 (-0,5; 35,0)% |
1,85 (1,00; 3,42) |
0,0500 |
|
NO <4,0, Через 12 месяцев |
15 (21,1%) |
17 (37,0%) |
15,8 (-1,0; 32,7)% |
1,75 (0,97; 3,15) |
0,0606 |
115 HW
через через через через
Здня 6 месяцев 12 месяцев 24 месяца
Период
I I Основная I I Контрольная
Рис. 2. Динамика показателя NO в процентах.
На основании приведенных в таблице данных можно сделать вывод о том, что 3 из 8 факторов имеют статистическую значимость влияния на целевую переменную «Тромбоз/Рестеноз» с диапазоном уровней рисков от 18,2% до 26,2%. Под воздействием влияния факторов из списка Топ-8, риски развития «Тромбоз/Рестеноз» увеличиваются от 14,7% до 26,2%. Лидирующими статистически значимыми факторами с повышением уровней рисков от 20,76% до 26,2% являются «Группа (Контрольная)», «Окклюзия (Есть)» и «Таск (B, D, C)». Замыкают список Топ-8 статистически незначимые факторы «NO<4,0, Через 12 месяцев» и «NO≥8,3, Через 24 месяца» которые повышают уровень риска осложнений от 14,7% до 17,2%.
Таким образом, по результатам проведенного однофакторного анализа рисков целевого показателя «Тромбоз» можно сделать вывод, что ключевыми факторами развития риска «Тромбоз» являются «Группа (Контрольная)», «Окклюзия (Есть)», «Таск (B, D, C)» и «ОК ≥ 8,3, через 24 месяца» с уровнями абсолютного риска «Тромбоз/Рестеноз» более 20,7%.
Для того, чтобы проследить, зависит ли частота возникновения таких осложнений, как тромбоз и рестеноз от группы, к которой принадлежит пациент (основная/ контрольная), и если различия есть, то на каком этапе они проявляются, был проведен анализ выживаемости, в котором в качестве исхода поочередно брались показатели «Тромбоз», «Рестеноз» и «Тромбоз/Рестеноз». Результаты анализа приведены на рисунках 4–6. Кумулятивная доля выживших в данном случае — это доля пациентов без тромбоза, рестеноза или тромбоза/рестеноза соответственно.
Результаты анализа показали, что в контрольной группе тромбоз возникает чаще и в более короткие сроки (Критерий Гехана-Вилкоксона, p = 0,0110), а различий по рестенозу не обнаружено (Критерий Гехана-Вилкоксона, p = 0,1022). Это, повидимому связано с небольшим количеством случаев рестеноза в данном исследовании. При рассмотрении осложнений в виде тромбоза, и рестеноза вместе различия между группами статистически значимые (Критерий Гехана-Вилкоксона, p = 0,0013).
Всем 36 пациентам с окклюзией или рестенозом было выполнено повторное оперативное вмешательство с восстановлением проходимости артериального русла. 3 пациентам потребовалось выполнить бедренно-под-
Рис. 3. Кумулятивные доли пациентов без тромбоза для основной и контрольной групп.
X 1,00 3 0,99 | 0,98 5 0,97 § 0,96 § 0,95 ” 0,94 = 0,93 | 0,92 g, 0,91 0,90
0 6 12 18 24 30
Время жизни, мес.
Кумулятивная доля выживших (Каплан-Мейер) о Завершенные + Цензурированные наблюдения
— Основная группа
— Контрольная группа
Рис. 4. Кумулятивные доли пациентов без рестеноза для основной и контрольной групп.
Кумулятивная доля выживших (Каплан-Мейер)
Рис. 5. Кумулятивные доли пациентов без тромбоза/рестеноза для основной и контрольной групп.
Олещук А.Н., Майстренко Д.Н., Чернявский М.А. и др.
СРАВНИТЕЛЬНЫЙ АНАЛИЗ ИСПОЛЬЗОВАНИЯ ГОЛОМЕТАЛЛИЧЕСКИХ СТЕНТОВ И СТЕНТОВ С БИОАКТИВНЫМ ПОКРЫТИЕМ ПРИ АТЕРОСКЛЕРОТИЧЕСКОМ ПОРАЖЕНИИ ПОВЕРХНОСТНОЙ БЕДРЕННОЙ АРТЕРИИ коленное шунтирование. Остальным пациентам проходимость восстановили эндоваскулярно.
Обсуждение
Поверхность активную стента распределение оксид нитрид титана модифицирована изыскание так, обеспечивающие что факторов она заключение имеет первой покрытие развивающейся из торгового комбинации разделение титаниума уходящие и нитрид услуг оксида внешней (титаниум сопровождаются оксинитрид). Тита-ниум процесс показывает сопровождаются оптимальную степени резистентность заключение к коррозии воздействуют, и таким более образом изыскание, низкую активную тканевую представлено реакцию. Резистентность увязать к коррозии факторов имплантируемых активную образцов степени была управление изучена изыскание и сравнена разделение с неочищенными торгового сплавами. Был системе выполнен удобством иммерсионный прибыли тест сопровождаются для воздействуют изучения обеспечивающие степени разделении выщелачивания увязать никеля услуг в человеческом отличительным организме, также а так воздействие же удобством доказано поставка превосходство прибыли титаниума также над конечному нитинолом [13]
Исследования зарубежных авторов показали, также что элементы тонкий услуг твердый являясь слой закупочной TIN представлено образует представляют на факторов поверхности продвижении стента распределение пленку. В результате мероприятий высвобождение увязать ионов мероприятий никеля внутренней было системе значительно этом снижено. Титан представлено обеспечивает предприятия биосовместимость изыскание стентов предоставление и артериальной обеспечивающие стенки торгового, т.к. действует производитель как элементы барьер системе против представляют высвобождения продвижении токсических относятся ионов, процесс тем элементов самым конечный уменьшая представляют воспаление. Агрегация представляют тромбоцитов элемент и большое установление количество системе фибрина сопровождаются были элементов обнаружены на поверхности углеродного цилиндра без покрытия, хотя тромбоциты и фибриновая адгезия были обнаружены на поверхности стентов из такого же углеродного цилиндра, покрытого пленкой оксида титана. Осадок фибрина, отмеченный вокруг титанового сплава импланта, как правило незначителен, и намного меньше, чем с кобальтом, хромом или сталью [14].
Эти характеристики демонстрируют антикоагулянтные и антитромботические свойства титаниума, которые улучшают совместимость с кровью, путем ингибирования тромбообразования [15].
Было отдельно изучено поведение эндотелиальных клеток пупочной вены человека, культивируемых на различных материалах стентов: нержавеющая сталь с низким содержанием углерода, нитинол, покрытый оловом или диоксидом титаниума, TiO2. Результаты показывали, что уровень реакции клеток эндотелия на нитрид титана и TiO2 сопоставим, а в некоторых случаях выше, чем у тех образцов, которые служили в качестве контроля. В то время реакция клеток эндотелия на нержавеющую сталь или нитинол достоверно ниже (р < 0,05). Нитрид оксид титана способствует эндотелизации более активно, чем нитинол. Поэтому покрытие стента нитрид оксид титана минимизирует возникновение рестенозов [16].
Таким образом, в сравнении с другими известными биосовместимыми материалами, такими как: карбон, покрытие TIO2 минимизирует воспаление и реакции со стороны тромбоцитов. Уменьшает фибриновые отложения. Обеспечивая стойкость к коррозии, которая может увеличивать риск перелома стента, особенно при движениях в дистальных артериях.
По данным нашего исследования выявлено достоверное повышение уровня оксид азота в крови пациентов после оперативного лечения в сроки до 6 месяцев и его постепенное снижение к 12 месяцу, что соответствует результатам зарубежных авторов [17]. Повышение цифр оксид азота на третий день после оперативного вмешательства расценивается как адаптивный феномен, который направлен на подавление гиперплазии и индукцию апоптоза. В связи с этим, низкий уровень оксид азота после операции расценивается как неблагоприятный фактор прогноза рестеноза или окклюзии. Полученные нами результаты полностью подтверждаются данными литературных источников, посвященных стентированию коронарных артерий, при этом авторы описывают снижение уровня оксид азота к 6 месяцу после оперативного лечения, что отмечено и в нашем исследовании [17]. Таким образом, использование стентов с биоактивным покрытием продлевает период подавления неоинтималь-ной гиперплазии и как следствие увеличивает первичную проходимость конструкции.
Заключение
Применение стентов с биоактивным покрытием на основе оксинитрид титана приводит к увеличению уровня NO крови, что предполагает подавление гиперплазии интимы. Проходимость стентов с данным видом покрытия позволяют говорить об их преимуществе при лечении пациентов с атеросклеротическим поражением ПБА.
Авторы заявляют об отсутствии конфликта интересов (The authors declare no conflict of interest).
Список литературы Сравнительный анализ использования голометаллических стентов и стентов с биоактивным покрытием при атеросклеротическом поражении поверхностной бедренной артерии
- Gerhard-Herman MD, Heather L, Gornik HL, et al. 2016 AHA/ACC Guideline on the Management of Patients with Lower Extremity Peripheral Artery Disease. Circulation. 2017;135(12):726-779. Doi: 10.1161/ CIR.0000000000000471.
- Zeller T. Current state of endovascular treatment of femoro-popliteal artery disease.Vasc Med. 2007;12:223-234. Doi: 10.1177/1358863X07079823.
- Balzer JO, Thalhammer A, Khan V, et al. Angioplasty of the pelvic and femoral arteries in PAOD: results and review of the literature. Eur J Radiol. 2010;75:48-56. Doi: 10.1016/j.ejrad.2010.04.016.
- Morris-Stiff G, Ogunbiyi S, Rees J, et al. Variations in the anatomical distribution of peripheral vascular disease according to gender. Ann R Coll Surg Engl. 2011;93:306-309. Doi: 10.1308/003588411X571999.
- Dake MD, Ansel GM, Jaff MR, et al. Sustained safety and effectiveness of paclitaxel-eluting stents for femoropopliteal lesions: 2-year follow-up from the Zilver PTX randomized and single-arm clinical studies. J Am Coll Cardiol. 2013;61:2417-27.
- Schillinger M, Sabeti S, Loewe C, et al. Balloon angioplasty versus implantation of nitinol stents in the superficial femoral artery. N Engl J Med. 2006;354:1879-88.
- Laird JR, Katzen BT, Scheinert D, et al. Nitinol stent implantation versus balloon angioplasty for lesions in the superficial femoral artery and proximal popliteal artery: twelve-month results from the RESILIENT randomized trial. Circ Cardiovasc Interv. 2010;3:267-76.
- Litsky J, Chanda A, Stilp E, et al. Critical evaluation of stents in the peripheral arterial disease of the superficial femoral artery-focus on the pacli-taxel eluting stent. Med Devices (Auckl. 2014;7: 1. Gerhard-Herman MD, Heather L, Gornik HL, et al. 2016 AHA/ACC Guideline on the Management of Patients with Lower Extremity Peripheral Artery Disease. Circulation. 2017;135(12):726-779. Doi: 10.1161/CIR.0000000000000471.
- Poulson W, Kamenskiy A, Seas A, et al. Limb flexion-induced axial compression and bending in human femoropopliteal artery segments. J Vasc Surg. 2018;67(2):607-613. Doi: 10.1016/j.jvs.2017.01.071.
- Yang H, Fortier A, Horne K, et al. Investigation of Stent Implant Mechanics Using Linear Analytical and Computational Approach. Cardiovasc Eng Technol. 2017;8(1):81-90. Doi: 10.1007/s13239-017-0295-0.
- MacTaggart J, Poulson W, Seas A, et al. Stent Design Affects Femoropopliteal Artery Deformation. Ann Surg. 2019;270(1):180-187. Doi: 10.1097/ SLA.0000000000002747.
- Limacher A, Räber L, Laube E, et al. Clinical long-term outcome after implantation of titanium nitride-oxide coated stents compared with paclitaxel-or sirolimus-eluting stents: propensity-score matched analysis. EuroIntervention. 2012;7(9):1043-1050. Doi: 10.4244/EIJV7I9A166.
- Yeung KW, Poon RW, Chu PK, et al. Surface mechanical properties, corrosion resistance, and cytocompatibility of nitrogen plasma-implanted nickeltitanium alloys: a comparative study with commonly used medical grade materials. J Biomed Mater Res A. 2007;82(2):403-14. Doi: 10.1002/jbm. a.31154.
- Gotman I. Characteristics of Metals Used in Implants. J Endourol. 1997;11(6):383-9. Doi: 10.1089/end.1997.11.383.
- Nan H, Ping Y, Xuan C, et al. Blood compatibility of amorphous titanium oxide films synthesized by ion beam enhanced deposition. Biomaterials. 1998;19(7-9):771-776.
- Hung-I Yeh, Shao-Kou Lu, Tin-Yi Tian, et al. Comparison of endothelial cells grown on different stent materials. J Biomed Mater Res A. 2006;76(4):835-41. Doi: 10.1002/jbm.a.30595.
- Karjalaine PP, Nammas W, Ylitalo A, et al. Long-term clinical outcome of titanium-nitride-oxide-coated stents versus everolimus-eluting stents in acute coronary syndrome: Final report of the BASE ACS trial. Int J Cardiol. 2016;222:275-280. Doi: 10.1016/j.ijcard.2016.07.267.


