Сравнительный анализ экспрессии генов ER и ароматазы в опухолевых тканях молочной железы и эндометрия
Автор: Хвостова Е.П., Пустыльняк В.О., Гольдинштейн О.З., Красильников С.Э., Сидоров С.В., Гуляева Л.Ф.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Экспериментальные исследования
Статья в выпуске: 4 (24), 2007 года.
Бесплатный доступ
В работе был определен уровень экспрессии генов эстрогенового рецептора (ERα) и ароматазы (CYP19) в опухолевых и прилежащих к ним нетрансформированных тканях 10 женщин, больных раком эндометрия, и 10 больных раком молочной железы. Сравнение профилей экспрессии генов показало совпадение усиления экспрессии генов CYP19 и ERα, у 6 больных с аденокарциномой тела матки и у 5 больных раком молочной железы, что может свидетельствовать о гормональной природе этих опухолей. У остальных больных в опухолях зарегистрировано увеличение экспрессии лишь одного из этих генов. В одной из десяти опухолей молочной железы наблюдалось уменьшение экспрессии генов CYP19 и ERα, свидетельствующее о гормононезависимой природе опухоли. Данные по экспрессии ERα, в 78 % случаев подтверждены результатами иммуногистохимического анализа. Таким образом, проведенное исследование подтверждает имеющиеся на сегодняшний день данные, что более чем в половине случаев злокачественные опухоли молочной железы и эндометрия являются гормонозависимыми.
Ароматаза, экспрессия гена, от-пцр, рак молочной железы, рак эндометрия
Короткий адрес: https://sciup.org/14054614
IDR: 14054614 | УДК: 576.385.5
Текст научной статьи Сравнительный анализ экспрессии генов ER и ароматазы в опухолевых тканях молочной железы и эндометрия
В последнее десятилетие во всем мире, в том числе и в России, отмечается увеличение частоты возникновения гормонозависимых опухолей у женщин. В первую очередь это относится к таким заболеваниям, как рак тела матки (РТМ) и молочной железы (РМЖ). В связи с этим важен поиск молекулярных маркеров для улучшения диагностики, что расширит возможности выявления опухолевых заболеваний на ранних стадиях, а также поможет внедрить новые методы лечения и профилактики. Одним из основных факторов риска развития РТМ и РМЖ является гиперэстрогения, к которой приводит ряд факторов, в частности малое число родов или бесплодие, ожирение, поздняя менопауза, ановуляторный цикл, синдром поликистозных яичников, эстрогенпродуцирующие опухоли яичников, повышенная продукция андрогенов
(адрено-индуцированный гиперкортицизм) [10]. В свою очередь, эстрогены стимулируют пролиферацию клеток, индуцируя факторы роста и их рецепторы, в том числе и эстрогеновый рецептор α (ERα) [13]. Увеличение концентрации эстрогенов в условиях дефицита прогестерона может приводить к гиперплазии тканей молочной железы и эндометрия, которая, несмотря на свою обратимость, способна прогрессировать в атипический вариант, предрасположенный к перерождению в рак. Одним из серьезных доказательств значения эстрогенов в патогенезе РТМ и РМЖ могут быть сведения о повышении частоты заболеваний у женщин после менопаузы, в течение длительного времени получавших заместительную терапию эстрогенсодержащими препаратами [12].
Одним из важных элементов патогенеза гормонозависимого рака является образование эстрогенов из андрогенов in situ. Эта реакция катализируется микросомальным, НАДФН-за-висимым ферментом – цитохромом Р450 19-го семейства (CYP19 или ароматаза) [1, 2]. Основным источником эстрогенов в организме женщины, находящейся в пременопаузе, являются яичники. Кроме того, эстрогены синтезируются и в других органах (клетки жировой ткани, кожи и др.), которые являются важнейшим источником этих стероидов после менопаузы. Несмотря на то, что общее количество экстрагенительных эстрогенов невелико, их высокая концентрация в отдельной ткани может обусловливать значительное влияние in situ [15]. Поэтому в настоящее время широкое распространение получила теория локального синтеза эстрогенов, согласно которой нарушение регуляции тканеспецифичного промотора гена ароматазы приводит к усилению активности фермента, что сопровождается увеличением концентрации эстрогенов, приводящей к злокачественной трансформации [5].
Биологический эффект эстрогенов реализуется через их взаимодействие с эстрогеновыми рецепторами, которые, в свою очередь, активируют гены-мишени во многих тканях. В настоящее время идентифицировано два вида ER: α и β, биологическое значение которых интенсивно изучается. Так, показано, что повышенная экспрессия ERα сопровождает процессы трансформации во многих тканях [6], тогда как ERβ играет ключевую роль в регуляции митотической активности, обеспечивая защиту от ERα-индуцированной гиперпролиферации [11]. Однако роль ERβ в гормональном канцерогенезе остается до конца не изученной. Показано, что содержание ERα может измениться в ответ на повышение концентрации эстрогенов, что, в свою очередь, приводит к усилению пролиферации в тканях-мишенях [13]. Одним из механизмов этого процесса может быть увеличение активности ароматазы. Однако вопрос о том, как связаны эти два процесса, остается открытым.
Таким образом, определение содержания эстрогеновых рецепторов и активности ароматазы поможет выявить гормональную природу опухоли, что является, прежде всего, важным показателем для проведения эффективного лечения. Следует заметить, что в настоящее время в клинике для определения эстрогеновых рецепторов используется иммуногистохимический анализ (ИГХА), тогда как клинический метод определения ароматазы еще не поставлен. Целью настоящей работы являлось определение уровня экспрессии генов эстрогенового рецептора α (ERα) и ароматазы (CYP19) в злокачественных опухолях женщин, больных раком эндометрия и молочной железы.
Материал и методы
Анализировали 20 пар (опухоль и условная норма) образцов тканей пациентов, полученных в ходе хирургического вмешательства; из них 10 пар – образцы тканей пациентов с аденокарциномой тела матки (средний возраст больных – 57 ± 15 лет) и 10 – с инфильтративным протоковым раком молочной железы (средний возраст больных – 64 ± 17 лет). За условную норму принимали гистологически нормальные ткани эндометрия и молочной железы, взятые из прилегающей к опухоли ткани. Верификация диагноза, забор образцов и их патоморфоло-гическая характеристика проводились врачами гинекологического отделения Новосибирского областного онкологического диспансера и 3-го онкологического отделения муниципальной городской больницы № 1. Стадия злокачественного процесса установлена по классификации TNM (табл. 1). Эксперименты соответствовали
Таблица 1
|
Номер пациентки |
Описание опухолевых образцов |
Иммуногисто -химия |
Относительный уровень мРНК |
||
|
TNM |
Стадия |
ER α |
ER α |
CYP19 |
|
|
Рак молочной железы |
|||||
|
133 |
T2N0M0 |
2 |
+ |
↑ |
↑ |
|
150 |
T2N2M0 |
2 |
- |
↓ |
↑ |
|
172 |
T 2 N 0 M 0 |
2 |
+ |
↑ |
↑ |
|
173 |
T1N2M0 |
1 |
- |
↓ |
↑ |
|
178 |
T 2 N 1 M 0 |
2 |
+ |
↑ |
↑ |
|
180 |
T2NXM0 |
2 |
+ |
↑ |
↑ |
|
194 |
T 2 N 1 M 0 |
2 |
+ |
↑ |
↓ |
|
202 |
T2NXM0 |
2 |
+ |
↑ |
↓ |
|
203 |
T 1 N X M 0 |
1 |
н.о. |
↓ |
↑ |
|
206 |
T 2 N X M 0 |
2 |
+ |
↓ |
↓ |
|
Рак тела матки |
|||||
|
1 |
T1N0M0 |
1 |
н.о. |
׀׀ |
↑ |
|
2 |
T2N0M0 |
2 |
н.о. |
↑ |
↑ |
|
3 |
T1N0M0 |
1 |
н.о. |
׀׀ |
↑ |
|
4 |
T2N0M0 |
2 |
н.о. |
↑ |
↑ |
|
5 |
T2N0M0 |
2 |
н.о. |
↓ |
↑ |
|
6 |
T 1 N X M 0 |
1 |
н.о. |
↓ |
↑ |
|
7 |
T1N0M0 |
1 |
н.о. |
↑ |
↑ |
|
8 |
T1N0M0 |
1 |
н.о. |
↑ |
↑ |
|
9 |
T2N0M0 |
2 |
н.о. |
↑ |
↑ |
|
10 |
T2N0M0 |
2 |
н.о. |
↑ |
↑ |
Примечание: н.о. – не определялось; ↑ – повышение уровня экспрессии гена; ↓ – понижение уровня экспрессии гена, ׀׀ – экспрессия гена не изменялась; + – ERα > 10%, - – ERα < 10%.
Характеристика клинических образцов и результаты изменения уровня экспрессии генов CYP19 и ERα
этическим стандартам биоэтического комитета ГУ «НИИ МББ СО РАМН», разработанным в соответствии с Хельсинской декларацией Всемирной ассоциации «Этические принципы проведения научных медицинских исследований с участием человека» с поправками 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными приказом Минздрава РФ № 266 от 19.06.03. Все лица, участвующие в исследовании, дали письменное информированное согласие на участие в исследовании.
Микроскопические тканевые срезы толщиной 5 мкм депарафинизировали, дегидратировали в спиртах. Кипятили в цитратном буфере (pH 7,6) 5 мин в микроволновой печи. Эндогенную пероксидазу блокировали в течение 30 мин раствором (0,01 % кислый натрий и 1 % перекись водорода). Неспецифичное связывание блокировали кроличьей сывороткой с TBS (150 мл/10мл) в течение 30 мин. Слайды инкубировали 1 ч при комнатной температуре с мышиными моноклональными антитела-
Таблица 2
|
Ген |
Последовательности нуклеотидных праймеров |
Размер продуктов ПЦР, п.н. |
|
|
GAPDH |
Прямой |
5’- CACCCATGGCAAATTCCATGGC -3’ |
297 |
|
Обратный |
5’- GCATTGCTGATGATCTTGAGGCT -3’ |
||
|
ERa |
Прямой |
5’- ATCCACCGAGTCCTGGACAAGATC -3’ |
181 |
|
Обратный |
5’- GGCACCACGTTCTTGCACTTCATG -3’ |
||
|
CYP19 |
Прямой |
5’-TGTGGACGTGTTGACCCTTCT -3’ |
99 |
|
Обратный |
5’- ACCACGATAGCACTTTCGTCCA -3’ |
||
|
18S rRNA |
Прямой |
5’- GTAACCCGTTGAACCCCATT -3’ |
131 |
|
Обратный |
5’- CCATCCAATCGGTAGTAGCG -3’ |
||
Праймеры для генов ERα, CYP19, GAPDH и 18S rRNA человека
ми против ER (DAKA, разведение 1:500), 30 мин со вторичными антителами (разведение 1:1000). Детекцию иммуноокрашивания проводили с помощью Peroxidase Detection Reagent Pack (Pierce) с диаминобензидином в качестве субстрата. Ядра дополнительно окрашивали гематоксилином.
Суммарную РНК из опухолевой и прилежащей ткани выделяли гуанидин-фенольным методом [9]. Количество РНК в пробе определяли спектрофотометрическим методом. Качественный анализ выделенной РНК проводили путем электрофоретического разделения в 1,5 % агарозном геле. Анализ экспрессии генов CYP19 и ERα проводили методом мультиплексной ОТ-ПЦР. Объем реакционной смеси для ПЦР составлял 20 мкл. В качестве эндогенного внутреннего контроля, относительно которого проводилось нормирование продуктов амплификации исследуемого гена, были выбраны гены «домашнего хозяйства» GAPDH для ERα и 18S rRNA для CYP19.
Для проведения мультиплексной ОТ-ПЦР использовали праймеры, синтезированные в компании «Лаборатория Медиген», г. Новосибирск (табл. 2). Продукты ПЦР генов CYP19 и 18S rRNA разделяли в 10 % полиакриламидном геле, окрашивали бромистым этидием (рис. 1А), ERα и GAPDH в 1,5 % агарозном геле (рис. 1Б), сканировали в УФ свете с помощью видеосистемы «DNA Analyzer» (г. Москва). Денситометрия проводилась с помощью компьютерной программы «Total Lab». Величину экспрессии каждого гена представляли в относительных единицах как отношение интенсивности окрашивания специфической полосы генов CYP19 или ERα к интенсивности полосы генов 18S rRNA или GAPDH соответственно.
Статистическая обработка результатов проводилась с помощью программы «Origin 6.1». В качестве отклонения от среднего значения использовалась средняя статистическая ошибка, в качестве критерия достоверности был использован t-критерий Стьюдента.
Результаты и обсуждение
Для установления гормональной природы опухоли в клинике стандартным подходом является ИГХА эстрогеновых рецепторов. В настоящей работе наряду с данным методом с помощью ОТ-ПЦР была измерена экспрессия ERα в образцах опухолевой и прилежащей, не трансформированной ткани у 10 больных с диагнозом рак молочной железы. Характеристика этих опухолей с установленным в клинике статусом ER приведена в табл. 1. Как видно из таблицы, семь женщин имели рецептор-по-ложительный эстрогеновый статус опухоли, а две – рецептор-отрицательный. Эти результаты позволяют сделать вывод, что в большинстве случаев (78 %) РМЖ является рецептор-по-ложительным.
При исследовании экспрессии гена ERα у семи больных наблюдалось повышение уровня экспрессии гена ERα в опухолевой ткани в 1,5 – 2,2 раза по сравнению с нормой, тогда как у трех
Рис. 1. Типичная картина разделения продуктов амплификации генов CYP19 и 18S rRNA (А) и ERα и GAPDH (Б); N – нетрансформированная ткань, Т – опухолевая ткань, М – ДНК маркер
больных наблюдалась обратная картина (рис. 2A). При сопоставлении этих данных с ИГХА (табл. 1) видно, что в 78 % случаев регистрируется совпадение результатов. Расхождение результатов в остальных случаях может быть связанно с недостаточной специфичностью ИГХА, где определяется суммарное содержание всех видов эстрогеновых рецепторов. Тем не менее в большинстве случаев использованный нами метод ОТ-ПЦР показал совпадения с ИГХА.
Для РТМ подходы к определению гормонального статуса опухоли пока находятся в стадии разработки, тем не менее проблема также важна как для лечения, так и для прогноза этого заболевания. Имеющиеся литературные данные по экспрессии ERα достаточно противоречивы, в одних источниках указывается на повышение экспрессии ERα в опухолевой ткани эндометрия по сравнению с нормой [14], тогда как в других сообщается о снижении экспрессии ERα [16], что свидетельствует о недостаточно ясной картине гормональной природы опухолей эндометрия. Поэтому следующим шагом было определение экспрессии эстрогенового рецептора в злокачественных опухолях эндометрия.
Оказалось, что у шести из 10 исследуемых больных в опухолевой ткани наблюдалось 1,5–2-кратное усиление экспрессии гена ERα по сравнению с нормой, у двух пациентов наблюдалась обратная картина, у двух уровень экспрессии гена ERα не изменялся (рис. 2Б). Таким образом, в тканях эндометрия, как и в случае РМЖ, более чем в половине случаев регистрировалось повышение экспрессии гена ERα. Этот факт также может говорить в пользу гормональной природы опухолей для таких больных. Следует заметить, что отсутствие изменений в экспрессии ERα в анализируемых образцах не исключает гормональной природы опухоли, так как ее рост может поддерживаться за счет постоянного синтеза эстрогенов, где существенную роль играет повышение активности ароматазы или стероидной сульфатазы [12].
На сегодняшний день считается доказанным тот факт, что локальное усиление экспрессии гена ароматазы в тканях-мишенях является одним из этиологических факторов возникновения и поддержания роста гормонозависимых опухолей у женщин [7]. Показано, что у женщин, страдающих эндометриозом или другими пред-
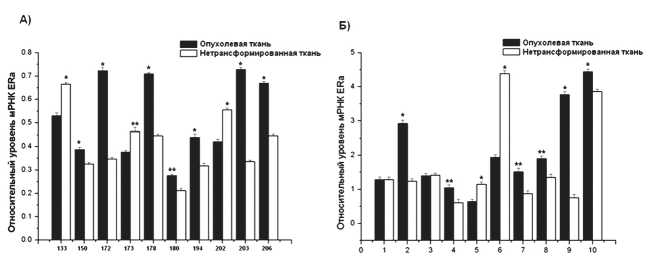
Рис. 2. Относительный уровень мРНК ERα в нетрансформированной и опухолевой ткани молочной железы (А) и эндометрия (Б). Представлено среднее значение ± SD. Каждый эксперимент проводился трижды.
Отличия значений с достоверностью: * – р<0,01, ** – р<0,05
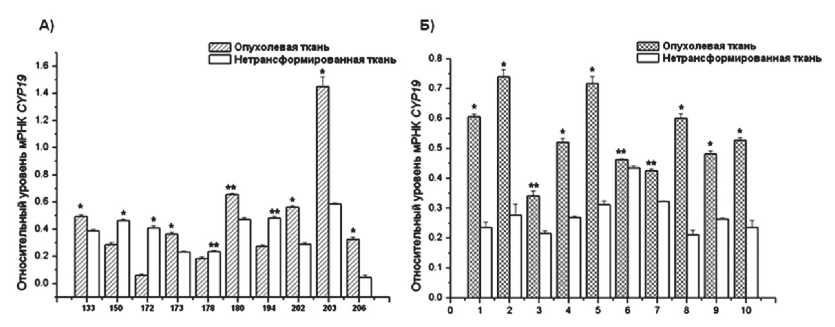
Рис. 3. Относительный уровень мРНК CYP19 в нетрансформированной и опухолевой ткани молочной железы (А) и эндометрия (Б). Представлено среднее значение ± SD. Каждый эксперимент проводился трижды.
Отличия значений с достоверностью: * – р<0,01, ** – р<0,05
раковыми заболеваниями эндометрия, определялся высокий уровень экспрессии гена ароматазы в репродуктивных органах, что позволяло судить о гормонозависимой природе данных заболеваний и проводить лечение ингибиторами ароматазы [8]. Аналогичные результаты были получены для РТМ и РМЖ [4, 17].
Для подтверждения гормональной природы опухолей, зависимой от активности ароматазы, нами было проведено измерение экспрессии ее гена в опухолях молочной железы и эндометрия. В опухолевых тканях молочной железы регистрировалось повышение уровня экспрессии гена CYP19 в 1,5–2,7 раза у шести из 10 исследуемых больных по сравнению с прилежащей нетрансформированной тканью, тогда как у четырех пациенток наблюдалась обратная картина (рис. 3А). Эти результаты могут свидетельствовать о различном вкладе ароматазы в опухолевый процесс в молочной железе.
У больных с аденокарциномой тела матки наблюдалась иная картина, во всех 10 исследуемых образцах было выявлено повышение уровня экспрессии гена CYP19 в опухолевой ткани (в 1,2–2,5 раза) относительно прилежащей нетрансформированной ткани (рис. 3Б). Эти данные могут свидетельствовать о существенном вкладе этого фермента в патогенез рака эндометрия, что подтверждают результаты, полученные N. Pathirage et al. [14]. Этот важный факт можно использовать для назначения лечения опухолей эндометрия ингибиторами ароматазы, что в настоящее время применяется в НИИ онкологии Томского научного центра СО РАМН [3].
При сравнении результатов экспрессии генов CYP19 и ERα в одной и той же опухолевой ткани установлено, что у шести больных с диагнозом аденокарцинома тела матки и у пяти больных с диагнозом рак молочной железы наблюдалось одновременное увеличение экспрессии генов CYP19 и ERα, что может говорить в пользу гормональной природы опухолей у данных больных (рис. 4). При этом увеличение экспрессии гена CYP19 и снижение экспрессии гена ERα отмечались у двух больных с диагнозом аденокарцинома тела матки и у двух с диагнозом рак молочной железы. Увеличение экспрессии CYP19 без изменения уровня экспрессии ERα наблюдалось у двух больных раком эндометрия. Такая комбинация также может говорить в пользу гормонозависимой опухоли, которая растет за счет постоянно поддерживаемой высокой концентрации эстрогенов без увеличения содер-
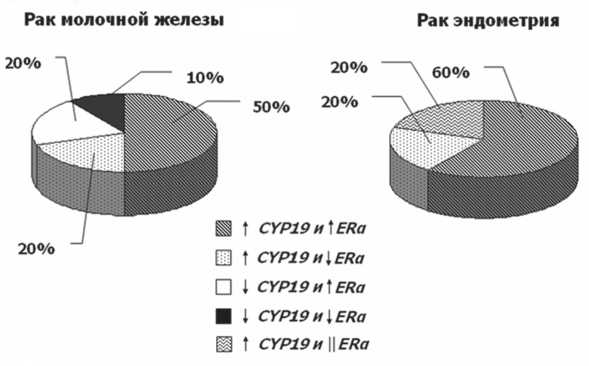
Рис 4. Сравнение профилей экспрессии генов CYP19 и ERα .
↑ – повышение уровня экспрессии гена; ↓ – понижение уровня экспрессии гена; ׀׀ – экспрессия гена не изменяется жания ERα. Снижение экспрессии гена CYP19 и увеличение экспрессии гена ERα отмечалось у двух больных РМЖ, что также говорит о гормональной природе опухоли, возникновение которой, возможно, обусловлено увеличением количества и активности эстрогеновых рецепторов. В данном случае эстрогены могут поступать из крови либо синтезироваться in situ за счет повышения активности стероидной сульфатазы. Снижение экспрессии генов CYP19 и ERα наблюдалось лишь у одной пациентки с диагнозом рак молочной железы, что может свидетельствовать о гормононезависимой природе опухоли. Такой комбинации не обнаружено для исследуемых опухолей эндометрия.
Анализ полученных результатов указывает на гетерогенность экспрессии генов CYP19 и ERα в исследуемых образцах. В половине случаев выявляется повышение экспрессии ER, сопровождающееся повышением экспрессии ароматазы. Аналогично можно выявить ситуацию, когда экспрессия данных генов существенно не меняется, хотя такие случаи довольно редки. Лишь в 1 из 20 анализируемых опухолей не выявляется повышение экспрессии ни ERα, ни ароматазы, что может говорить об истинной гормонозависимой природе опухоли. Интересным является также выявление опухолей с повышением экспрессии лишь одного из генов. Так, лишь в опухоли эндометрия выявлена комбинация, когда увеличение экспрессии ароматазы не сопровождалось увеличением эстрогенового рецептора. В этом случае можно предположить, что такие опухоли будут чувствительны к ингибиторам ароматазы. Напротив, лишь для РМЖ выявлено повышение экспрессии ERα и снижение ароматазы. В данном случае может быть рекомендована антиэстрогеновая терапия без применения ингибиторов ароматазы.
Таким образом, характеристика опухолей по экспрессии ERα и CYP19 может быть и одним из этапов разработки стратегии для дифферен- циального лечения опухолей молочной железы и эндометрия.


