Сравнительный анализ экспрессии генов и накопления БТШ70 у представителей двух разных популяций байкальского вида Eulimnogammarus verrucosus (Gerstf., 1858)
Автор: Мадьярова Е.В., Лубяга Ю.А., Гурков А.Н., Верещагина К.П., Кондратьева Е.М., Щапова Е.П., Тимофеев М.А., Люкенбах Т., Бедулина Д.С.
Журнал: Журнал стресс-физиологии и биохимии @jspb
Статья в выпуске: 4 т.9, 2013 года.
Бесплатный доступ
С помощью количественной ПЦР в реальном времени и денатурирующего электрофореза с последующим вестерн-блоттингом был определен базальный уровень и содержание БТШ70 у представителей двух удаленных популяций эндемичного вида амфипод озера Байкал Eulimnogammarus verrucosus (Gerstf., 1858). Произведена оценка динамики накопления БТШ70, а так же экспрессии гена бтш70 в условии градиентного повышения температуры. Обнаружены отличия в базальном содержании БТШ70 у исследуемых популяций: базальное содержание белка БТШ70 у представителей южной популяции вида достоверно превышает уровень белка представителей северной популяции. Характер динамики экспрессии бтш70 также отличался у обеих исследованных популяций. Показанные различия свидетельствуют о наличии внутривидовой фенотипической пластичности стресс-ответа у E. verrucosus.
Короткий адрес: https://sciup.org/14323816
IDR: 14323816
Текст научной статьи Сравнительный анализ экспрессии генов и накопления БТШ70 у представителей двух разных популяций байкальского вида Eulimnogammarus verrucosus (Gerstf., 1858)
Одним из актуальных научных направлений в биологии является изучение адаптаций живых организмов к условиям окружающей среды. Важную роль в процессе адаптации к различным факторам играют белки теплового шока (БТШ). Гены белков теплового шока (бтш) и синтез их продуктов индуцируются не только теплом, но и рядом других повреждающих факторов физического и химического происхождения (ультрафиолетом, тяжелыми металлами и др.) Наиболее консервативны гены бтш70. Аминокислотные последовательности БТШ70 у человека и E. сoli гомологичны на 50%, а ряд доменов – на 96% (Schlesinger, 1990). Такой консерватизм БТШ у всех изученных организмов свидетельствует об исключительно важной роли этих белков в защите клеток от повреждений во время и после стресса и указывает на важную роль этих белков в процессе адаптации.
Изучение роли БТШ70 в молекулярных механизмах адаптации на организменном уровне, а также на уровне популяций представляет интерес с точки зрения эволюции в целом и видообразования в частности.
Ранее, у нескольких видов ящериц, обитающих в разных температурных условиях, были найдены популяционные различия на уровне синтеза БТШ70 (Ulmasov ., 1992).
Одним из наиболее перспективных объектов исследования фенотипической пластичности стресс-ответа являются эндемичные обитатели озера Байкал. Самые многочисленные представители фауны озера Байкал амфиподы, представленные в озере 350 видами и подвидами. Амфиподы озера представляют собой универсальную модельную систему для изучения механизмов адаптации к меняющимся условиям среды.
Проведенные ранее исследования показали различия в механизмах экспрессии и синтеза БТШ70 в реакции на стрессовое воздействие у ряда байкальских амфипод (Тимофеев, 2010, Bedulina et al ., 2013). Однако исследований вариабельности стресс-ответа у разных популяций одного вида, до этого не проводили.
Целью данной работы явилась оценка влияния градиентного повышения температуры на экспрессию генов и накопление БТШ70 у представителей удаленных популяций эндемичного вида байкальских амфипод.
МАТЕРИАЛЫ И МЕТОДЫ
Объектом настоящего исследования были выбраны амфиподы вида Eulimnogammarus verrucosus (Gerstf., 1858). E. verrucosus - типичный обитатель литорали, встречается повсеместно под камнями, начиная с глубины в несколько сантиметров вплоть до 10 - 15 метров. Из ранее опубликованных материалов известно, что E. verrucosus холодолюбивый вид, предпочитающий температуру 5-6 °С, с диапазоном метаболической стабильности от 4 до 11 0С (Аксенов-Грибанов и др., 2013) Исследуемые популяции вида достаточно удалены друг от друга, находятся на разных широтах (Северобайкальск 109.313409,55.625964, Большие Коты 105.074681,51.904787), температура в литоральной зоне этих мест отличается. (Ладейщиков 1982).
В исследованиях использовали амфипод собранных в пос. Большие Коты (Южный Байкал - южная попуряция) и в прибрежной зоне г. Северобайкальск (Северный Байкал - северная популяция). Предварительно акклимированных амфипод экспонировали в аэрируемыхых аквариумах (объем 1,5-2 литра), помещенных в термостат при постепенном градиентном повышении температуры со скоростью 1 ˚С в час. Каждые 4 часа (при температурах 10 ˚С, 14 ˚С, 18 ˚С и 22 ˚С) фиксировали рачков для последующих молекулярно-биохимических анализов. Непосредственно перед началом и в ходе эксперимента часть особей, не подверженных температурному воздействию, была зафиксирована в качестве контроля. Работы проводили в ходе одного сезона (июль 2012 г).
Для выделения РНК использовали животных весом от 200 до 500 мг, которых гомогенизировали с использованием 0,5-1 мл Qiazol Reagent (Qiagen, USA) в гомогенизаторе
MM400 (Retsch, Germany). К смеси добавляли 200 мкл хлороформа, аккуратно перемешивали и центрифугировали. Верхнюю фазу переносилили на MaXtract гель (Qiagen, USA), для лучшего отделения РНК от геномной ДНК по прилагаемому к MaXtract гелю протоколу. Далее из водной фазы была изолирована РНК согласно протоколу для miRNeasy набору с добавочным шагом, который удаляет ДНКазы из смеси (Qiagen, USA). РНК элюировали с колонок 30 мкл воды.
Для обратной транскрипции использовали 5 мкг РНК, на которой синтезировали кДНК, с использованием Oligo(dT)18 праймера (Fermentas, USA, #SO131) и обратной транскриптазы H Minus Reverse Transcriptase (Fermentas, USA, #EP0452) по инструкции фирмы производителя.
Экспрессию гена бтш70 оценивали с помощью количественной ПЦР в реальном времени на приборе StepOnePlus (Applied Biosystems). Реакцию проводили в объеме 12.5 мкл с использованием набора SensiMix SYBR Low-ROX (Bioline) с финальной концентрацией 3 мМ MgCl 2 и 250 нМ каждого праймера. Для амплификации гена-мишени ( бтш70 ) и референтных генов ( β-actin, gapdh, Ef1a ) использовали специфичные праймеры: для гена β-actin прямой – GCTGCGGTGTTCATCTCATTCTC, обратный TTCGTCTGGACTTGGCTGGTC; для гена gapdh прямой – TTGCCGCCCTCAGCCTTG, обратный – CTCAGGTGGTCGCCGTCAAC; для гена Ef1a прямой – CTCGGTGCTGTCCATCTTGTTG, обратный – GGCTGATTGTGCTGTGCTGATC; для гена hsp70 прямой – CCAAGATGAAGGAGACTGCTGATG, обратный – CGCCGTGGGTTCGTTGATAATC. Количественная ПЦР проводилась при следующих условиях: 94 °C
4 мин; 35 циклов 95 °C 20 сек, 60 °C 20 сек и 72 °C
20 сек. Экспрессию гена бтш70 измеряли методом сравнения параметра относительной экспрессии ΔΔCt (Vandesompele et al ., 2002).
Для определения содержания БТШ70 проводили денатурирующий электрофорез с последующим вестерн-блоттингом. Вестерн-блоттинг осуществляли методом полусухого переноса на PVDF мембрану (GE Healthcare, UK) (Towbin., 1979). Мембраны по очереди выдерживали от 30 мин. до 1 часа в растворе моноклональных антител к БТШ70 (Sigma-Aldrich, # H5147, разведение 1:5000) и 4 часа в растворе вторичных антител коньюгированных с щелочной фосфотазой (antimouse IgG:AP Conj., Stressgen # SAB-101, разведение 1:1000). Для определения актина использовали антитела (Sigma-Aldrich, # A2668, разведение 1:1000) и вторичные антитела (Sigma, # A9919, разведение 1:1000) с последующей цветной реакцией с 5-бромо-4-хлоро-3-индолил фосфатом (BCIP) и нитроголубым тетразолием (NBT), осуществляемой щелочной фосфатазой, с образованием темно-синей окраски. Обработанные таким образом мембраны отмывали дистиллированной водой, высушивали, сканировали и подвергали денситометрическому анализу при помощи программы ImageJ (Ferreira, Rasband, 2012,. Уровень БТШ70 в каждом образце был нормализован по актину.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
На рисунке 1А представлены результаты оценки экспрессии гена бтш70 у особей не подвергшихся воздействию постепенного повышения температуры. Видно, что уровень экспрессии генов у представителей обеих популяций одинаков.
При градиентном повышении температуры среды достоверных отличий в уровне экспрессии генов у представителей северной популяции обнаружено не было, о чем свидетельствуют данные представленные на рисунке 1Б.
Иную картину можно наблюдать у представителей южной популяции. На рисунке 1Б можно увидеть, что при достижении температуры 14 0С уровень экспрессии бтш70 достоверно отличается от начальных значений
При оценке базальных уровней БТШ70 были обнаружены выраженые межпопуляционные различия. Как видно из рисунка 2А базальный уровень БТШ70 у особей южной популяции вида выше, чем у особей северной популяции.
При измерении уровня БТШ70 в ходе эксперимента на постепенное повышение температуры также были обнаружены различия между представителями обеих популяций.
Показано, что у представителей северной популяции вида при достижении температуры 10 0С уровень БТШ70 статистически достоверно отличается от начальных значений. У представителей южной популяции достоверных отличий от начальных значений не было.
Полученные нами данные о различие в базальном уровне содержании БТШ70 у представителей двух популяций E. verrucosus соотносятся с литературными данными.
Так ранее рядом работ показана связь между температурными условиями обитания животных и БТШ70 (Hofman, 2005). У южных видов пустынных ящериц при нормальных условиях наблюдалась повышенная экспрессия генов бтш70 , нежели у северных видов (Зацепина, 2009). Подобные работы также были произведены на моллюсках (Sagarin and Somero, 2006; Dutton, Hoffman, 2009; Dong et al ., 2008), дрозофилах (Garbuz et al ., 2002), лягушках (Ulmasov et al ., 1992) и других организмах.
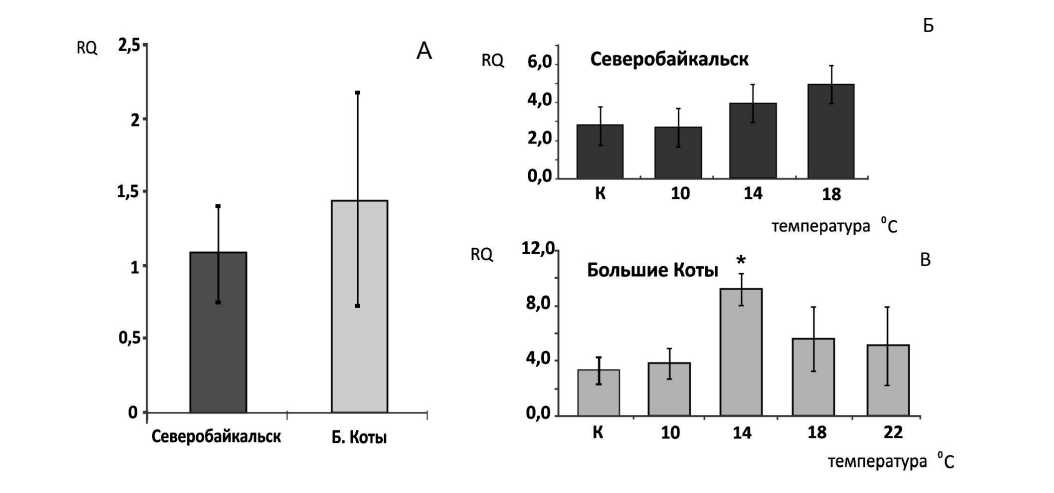
Рисунок 1. Экспрессия гена бтш70 E. verrucosus . А – контроль, Б – при градиентном повышении температуры среды на 1 °С в час у представителей южной популяции (Большие Коты), В - при градиентном повышении температуры среды на 1 °С у представителей северной популяции (Северобайкальск). RQ – относительный уровень экспрессии генов. * - статистически достоверное отклонение от контроля при P<0,05
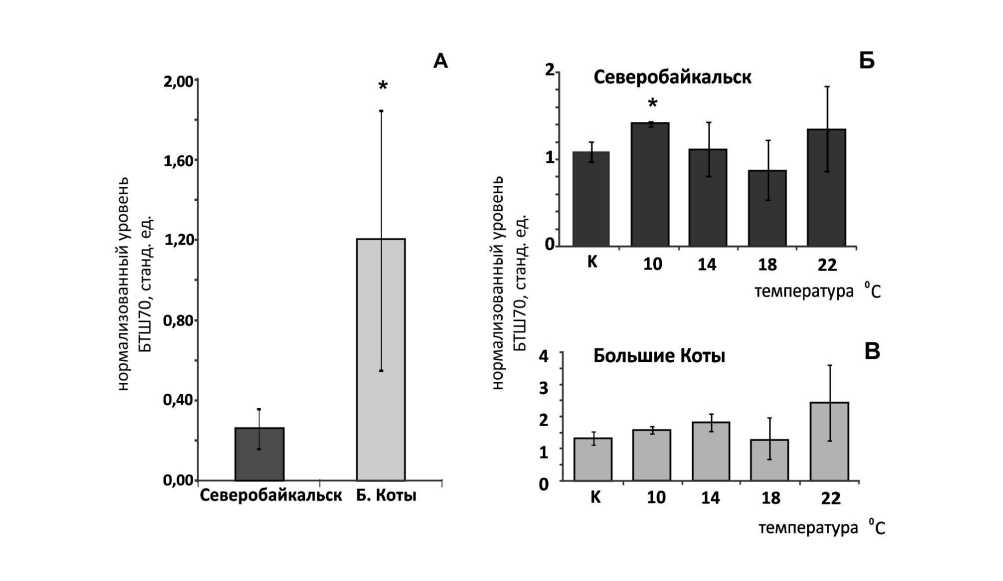
Рисунок 2. Уровень белка БТШ70 E. verrucosus А – в базальный уровень БТШ70, Б - при градиентном повышении температуры среды на 1 °С у представителей северной популяции (Северобайкальск), в - при градиентном повышении температуры среды на 1 °С у представителей южной популяции (Большие Коты). * - статистически достоверное отклонение от контроля при P<0,05
Можно заключить, что базальный уровень белка и характер динамики экспрессии генов бтш70 отличался у рачков обеих исследованных популяций. Показанные различия свидетельствуют о наличии внутривидовой фенотипической пластичности стресс-ответа у E. verrucosus.
Авторский коллектив выражает благодарность к.б.н. Протопоповой М.В. за дизайн праймеров и отработку метода. Работа выполнена при частичной финансовой поддержке грантов РФФИ (12-04-31767 мол_а, 12-04-90039 Бел_а, 12-04-98062-р_сибирь_а, 11-04-91321-СИГ_а), грантов Президента РФ МК-5466.2012.4, МД-2063.2012.4, ФЦП «Научные и научно-педагогические кадры инновационной
России», а также программы стратегического развития ИГУ.
Список литературы Сравнительный анализ экспрессии генов и накопления БТШ70 у представителей двух разных популяций байкальского вида Eulimnogammarus verrucosus (Gerstf., 1858)
- Bedulina D.S., Evgen’ev M.B., Timofeyev M.A., et al (2013) Expression patterns and organization of the hsp70 genes correlate with thermotolerance in two congener endemic amphipod species (Eulimnogammarus cyaneus and E. verrucosus) from Lake Baikal. Molecular ecology, 22, 1416-1430
- Dong Y., Ji T., Dong S., (2007) Stress Responses to Rapid Temperature Changes of the Juvenile Sea Cucumber (Apostichopus japonicas Selenka). Journal of Ocean University of China (Oceanic and Coastal Sea Research), 6:3, 275-280
- Garbuz D.G., Molodtsov V.B., Velikodvorskaia V.V., et al, 2002. Evolution of the Response to Heat Shock in Genus Drosophila. Russian Journal of Genetics, 38, 925-936. Ferreira T., Rasband W. (2012) ImageJ User Guide. 198 p
- Hofmann G.E., (2005) Patterns of Hsp gene expression in ectothermic marine organisms on small to large biogeographic scales. Integr. Comp. Biol., 45, 247-255
- Sagarin R. D., Somero G. N., 2006.Complex patterns of expression of heat-shock protein 70 across the southern biogeographical ranges of the intertidal mussel Mytilus californianus and snail Nucella ostrina. J. Biogeogr., 33, 622-630
- Schlesinger M. J. (1990) Heat shock proteins. J Biol Chem., 21, 12111-12114
- Towbin H, Staehelin T, Gordon T (1979) Electrophoretic transfer of proteins from polyacrylamide gels to nitrocellulose sheets: procedure and some applications. PNAS USA, 76, 4350-4354
- Ulmasov K.A, Shammakov S, Karavaev K, Evgen'ev M.B. (1992) Heat shock proteins and thermoresistance in lizards. PNAS USA, 89, 1666 1670
- Vandesompele J., De Preter K., Pattyn F., Poppe B., et al (2002) Accurate normalisation of real-time quantitative RT-PCR data by geometric averaging of multiple internal control genes. Genome Biology, 3(7): research 0034.1-0034.11
- Аксёнов-Грибанов Д.В., Лубяга Ю.А., Шахтанова Н.С. (2012) Определение температурного оптимума эндемичного байкальского вида амфипод Eulimnogammarus verrucosus (Gerstf., 1858) по изменениям показателей клеточного метаболизма. Журнал стресс-физиологии и биохимии, 8, 289-301
- Зацепина О.Е. (2009) Молекулярные механизмы регуляции экспрессии генов белков теплового шока при адаптации организмов к различным условиям обитания. Дис. … Д-р. биол. Наук Институт молекулярной биологии им. В. А. Энгельгардта РАН, 207 с
- Ладейщиков Н.П. (1982) Особенности климата крупных озер (На примере Байкала)/АН СССР.СО. Лимнол.ин-т; М: Наука, 137 с, Наука
- Тимофеев М.А. (2010) Экологические и физиологические аспекты адаптации к абиотическим факторам среды эндемичных байкальских и палеарктических амфипод: Дис. … Д-р. биол. Наук. ТГУ, Томск, 384с


