Сравнительный анализ механизмов действия пептидных токсинов -ингибиторов кальциевых и натриевых каналов при ишемии/ реперфузии
Автор: Юрова Е.В., Расторгуева Е.В., Белобородов Е.А., Погодина Е.С., Фомин А.Н., Саенко Ю.В.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Биологические науки
Статья в выпуске: 2, 2024 года.
Бесплатный доступ
Ишемия способствует развитию многих патологических состояний, с которыми сталкиваются в клинической практике. При этом последующая реперфузия может усиливать повреждение тканей, усугубляя состояние, вызванное ишемией. Значительную роль в развитии ишемически-реперфузионного повреждения играет изменение баланса ионов кальция и натрия. Резкого нарушения ионного баланса можно избежать посредством воздействия ингибиторов кальциевых и натриевых ионных каналов, находящихся на поверхности мембраны. Несмотря на то что подобные ингибиторы вызывают снижение клеточной гибели, механизмы их действия различаются. Цель исследования. Провести сравнительный анализ механизмов действия пептидных ингибиторов кальциевых и натриевых каналов на ишемически-реперфузионное повреждение эпителиальных клеток.
Ишемия, реперфузия, кальций, натрий, пептидные токсины, ионные каналы
Короткий адрес: https://sciup.org/14130552
IDR: 14130552 | УДК: 576.32/.36 | DOI: 10.34014/2227-1848-2024-2-155-165
Текст научной статьи Сравнительный анализ механизмов действия пептидных токсинов -ингибиторов кальциевых и натриевых каналов при ишемии/ реперфузии
Введение. Ишемия способствует развитию многих патологических состояний, с которыми сталкиваются в клинической практике, включая инфаркт миокарда, недостаточность периферических сосудов и инсульты [1, 2]. Хотя восстановление притока крови к ишемизированному органу необходимо для предотвращения необратимого повреждения клеток, реперфузия сама по себе может усилить это повреждение, усугубляя состояние, вызванное ишемией [3]. Длительная ишемия обусловливает множество клеточных метаболических и ультраструктурных изменений. Вы- званное ишемией снижение клеточного окислительного фосфорилирования приводит к невозможности повторного синтеза богатых энергией фосфатов, в т.ч. аденозин-5'-трифосфата (АТФ). Более низкий уровень АТФ снижает активность энергозависимой Na+/K+-АТФазы, что приводит к увеличению содержания внутриклеточного натрия и выведению калия из клеток. Повышенный уровень натрия в клетках снижает активность натрий-водородных обменных насосов (Na+/H+-насосов). Ионный обмен натрия на кальций компенсирует снижение концентрации внутриклеточного натрия.
Подобная компенсация ионного обмена приводит к повышению концентрации внутриклеточного кальция. Дисфункция Ca+2-АТФаз на поверхности эндоплазматического ретикулума усугубляет это состояние [4]. Помимо АТФаз, поступление ионов в клетку происходит через потенциал-зависимые ионные каналы на поверхности мембраны, что в любом случае ведет к накоплению ионов водорода, натрия и кальция и вызывает гиперосмолярность, приводящую к поступлению воды в цитоплазму и набуханию клеток. Перегрузка кальцием в свою очередь повреждает клетки по нескольким причинам: увеличивает концентрацию активных форм кислорода (АФК), вызывает апоптоз и некроз клеток, разрушает клеточные мембраны и нарушает функцию митохондрий [5]. Последующая реперфузия усугубляет состояние за счет дополнительного поступления АФК и ионов кальция. В итоге длительное ишемически-реперфузионное состояние может привести к апоптозу, аутофагии, некрозу и некроптозу [4, 6]. Резкого изменения внутриклеточного ионного баланса можно избежать за счет воздействия на ионные каналы на поверхности мембраны. К данным типам каналов относятся в т.ч. потенциал-зависимые кальциевые и натриевые каналы. Избирательное ингибирование таких каналов может оказать существенное влияние на течение процессов ише-мически-реперфузионного повреждения.
В природе существует группа пептидных токсинов, относящихся к семейству кнотти-нов, способных высоко избирательно блокировать кальциевые и натриевые потенциал-за-висимые каналы [7, 8]. В отличие от химических блокаторов, имеющих ряд недостатков, к которым относятся избирательность не только к целевым каналам, но и к близким семействам, а также высокие дозы для достижения эффекта [9], пептидные токсины характеризуются высокой избирательностью по отношению к определенному типу канала. Кроме того, кноттины обладают особой структурой – ингибиторным цистиновым узлом, за счет чего повышается их стабильность при циркуляции в крови, биодоступность и значительно снижается доза для достижения эффекта [10]. В наших предыдущих работах показан эффект пептидных ингибиторов натриевых [11] и кальциевых каналов [12] при моделировании условий ишемии/реперфузии, при этом механизм действия данных ингибиторов значительно различался.
Цель исследования. Провести сравнительный анализ механизмов действия пептидных ингибиторов кальциевых и натриевых каналов на ишемически-реперфузионное повреждение эпителиальных клеток.
Материалы и методы. В качестве пептидных ингибиторов использовались токсины omega-hexatoxin-Hv1a (Uniprot: TO1A_HADVE) как ингибитор кальциевых каналов и mu-agatoxin-Aa1a (Uniprot: T4G1E_AGEAP) как ингибитор натриевых каналов.
Синтез токсинов осуществлялся на пептидном синтезаторе ResPep SL (Intavis, Германия) в соответствии с Fmoc-химией по протоколу производителя. Анализ результата синтеза проводился с использованием метода ВЭЖХ на хроматографической системе Shimadzu LC-20AD XR (Shimadzu, Япония) на основе обращенно-фазовой хроматографии и метода масс-спектрометрии на масс-спектрометре MALDI-TOF MS FLEX series (Bruker Daltonics, Германия).
В работе использовалась клеточная культура CHO-K1 (Российская коллекция клеточных культур, Россия). Культура содержалась в стандартных условиях (среда DMEM/F12 («ПанЭко», Россия) c 10 % сыворотки (Biosera, Франция) и гентамицином при 37 °С, 5 % CO 2 ). Пассаж проводился каждые 3–4 дня с использованием раствора трипсина («ПанЭко», Россия). Для эксперимента культура высеивалась в концентрации 10 000 на ячейку 96-лу-ночного планшета и содержалась в стандартных условиях до достижения экспоненциальной стадии. После этого среда в ячейках менялась на DMEM («ПанЭко», Россия) с пониженным содержанием глюкозы (1 г/л) и сыворотки (1 %) и переносилась в инкубатор с 1 % кислорода на 3 ч (условия ишемии). По истечении времени среда менялась на стандартную без токсинов для контрольной группы и с 50 нМ токсинов для экспериментальных групп и оставлялась еще на 3 ч (условия реперфузии).
Через 3 ч от начала реперфузии в питательную среду добавлялись красители Yo-Pro 1 (1 мкМ) и PI (1 мкМ) [13] для фиксации уровня апоптоза и некроза соответственно. Для анализа концентраций ионов кальция и натрия среда для реперфузии убиралась через 3 ч от начала стадии и заменялась на фосфатно-солевой буфер. В буфер добавлялись красители Rhod-2 AM (500 нМ) для ионов кальция [14] и ION NATRIUM Green 2 AM (500 нМ) для ионов натрия [15]. Для анализа изменения уровня pH использовался краситель BCECF AM (500 нМ) [16]. Краситель добавлялся в различные промежутки времени: после окончания ишемии (0 мин), через 30 мин, 1,5 и 3 ч от начала реперфузии. Культура с красителями инкубировалась в течение 20 мин в темноте при 37 °С и 5 % СО 2 . После этого среда или буфер, содержащие красители, удалялись и промывались фосфатно-солевым буфером 2 раза. Анализ флуоресценции проводился на мультимодальном планшетном ридере CLARIO Star (BMG LabTech, Германия) в режиме матриксного сканирования.
Каждый эксперимент выполнялся в трех повторах. Для анализа достоверности отличия использовался критерий Манна – Уитни, для устранения эффекта множественного сравне- ния – критерий Бонферрони. Различия между группами считались статистически значимыми при p≤0,01.
Результаты. В ходе экспериментов по моделированию условий ишемии/реперфузии в культуре CHO-K1 было выявлено, что происходит значительное увеличение уровня как апоптоза, так и некроза относительно групп, не подвергшихся воздействию (нормальные условия) (рис. 1). При анализе влияния токсинов omega-hexatoxin-Hv1a, ингибитора кальциевых каналов, и mu-agatoxin-Aa1a, ингибитора натриевых каналов, в концентрации 50 нМ на уровень клеточной гибели в сменяющихся условиях ишемии и реперфузии было отмечено, что оба токсина способны снижать апоптоз и некроз. При этом токсин omega-hex-atoxin-Hv1a снижает уровень апоптоза почти на 40 % (рис. 1А), в то время как при совместной инкубации с токсином mu-agatoxin-Aa1a уровень апоптоза падает почти на 50 % и достигает нормальных значений (рис. 1Б). В отношении уровня некроза картина аналогична: оба токсина снижают уровень некроза почти на 60 %, однако токсин mu-agatoxin-Aa1a, ингибитор натриевых каналов, оказывает более выраженное влияние и снижает уровень некроза до нормы.
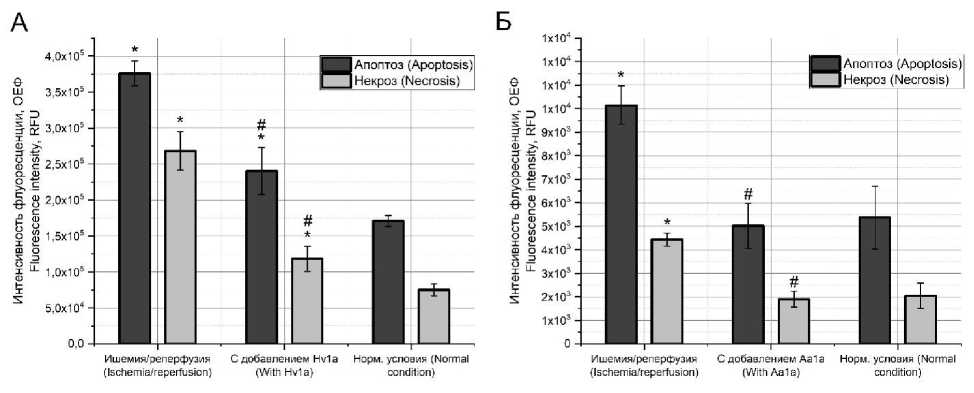
Рис. 1. Уровень апоптоза и некроза при моделировании условий ишемии/реперфузии в культуре CHO-K1 совместно с токсинами omega-hexatoxin-Hv1a (А) и mu-agatoxin-Aa1a (Б) в концентрации 50 нМ (* – отличие от группы «нормальные условия»; # – отличие от группы «ишемия/реперфузия»)
Fig. 1. Apoptosis and necrosis levels under simulated ischemia/reperfusion in CHO-K1 culture with omega-hexatoxin-Hv1a (A) and mu-agatoxin-Aa1a (B) at a concentration of 50 nM (* – difference from the norm; # – difference from the ischemia/reperfusion)
При анализе внутриклеточных концентраций ионов кальция и натрия в культуре клеток CHO-K1 в условиях трехчасовой ишемии зафиксировано значительное увеличение концентраций как кальция, так и натрия. При этом последующая трехчасовая реперфузия поддерживает повышенный уровень кальция, однако уровень натрия снижается до значений ниже нормальных (рис. 2А, Б). Добавление токсинов на стадии реперфузии приводит к различным результатам. Токсин omega-hexa-toxin-Hv1a, ингибитор кальциевых каналов, вызывает резкое, почти в 4 раза, снижение внутриклеточной концентрации ионов кальция и дополнительно почти в 1,5 раза ионов натрия, что в обоих случаях ниже концентраций в нормальных условиях. С другой стороны, токсин mu-agatoxin-Aa1a, ингибитор натриевых каналов, вызывает снижение концентрации кальция до нормального уровня, в то время как концентрация натрия повышается относительно группы «ишемия/реперфу-зия» до нормальных значений.
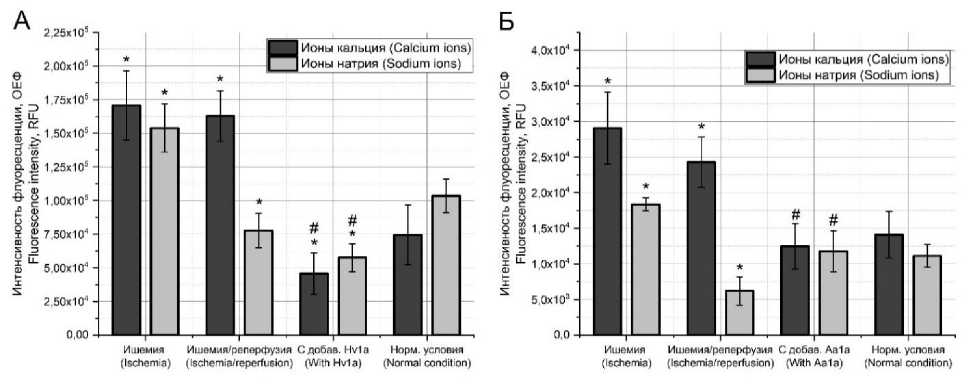
Рис. 2. Концентрация ионов кальция и натрия при моделировании условий ишемии/реперфузии в культуре CHO-K1 при совместной инкубации с токсинами omega-hexatoxin-Hv1a (А) и mu-agatoxin-Aa1a (Б) в концентрации 50 нМ
(* – отличие от группы «нормальные условия»; # – отличие от группы «ишемия/реперфузия»)
Fig. 2. Calcium and sodium ion concentrations under simulated ischemia/reperfusion in CHO-K1 culture during coincubation with omega-hexatoxin-Hv1a (A) and mu-agatoxin-Aa1a (B) at a concentration of 50 nM (* – difference from the norm; # – difference from ischemia/reperfusion)
Поскольку при моделировании условий ишемии/реперфузии в культуре CHO-K1 отмечено изменение внутриклеточных концентраций ионов кальция и натрия, происходит и изменение уровня pH. Так, сразу после трех часов ишемии отмечается пониженный уровень pH (рис. 3). Затем в первые 30 мин после начала реперфузии в контрольной группе наблюдается резкое увеличение pH выше нормального уровня с последующим снижением в течение 2,5 ч до уровня ниже нормальных условий. Эффект, оказанный токсинами, в данном случае носит различный характер.
Токсин omega-hexatoxin-Hv1a, ингибитор кальциевых каналов, поддерживает пониженный уровень pH практически 1,5 ч от начала реперфузии. После этого pH достигает нормального уровня и сохраняется на данных значениях до конца реперфузии (рис. 3А). Токсин mu-agatoxin-Aa1a, ингибитор натриевых каналов, действует по другому механизму. В первые 30 мин pH также повышается, однако в последующий 1 ч не отмечается резкого снижения, как в контрольной группе, а происходит поддержание на повышенном уровне в течение последующих 1,5 ч (рис. 3Б).
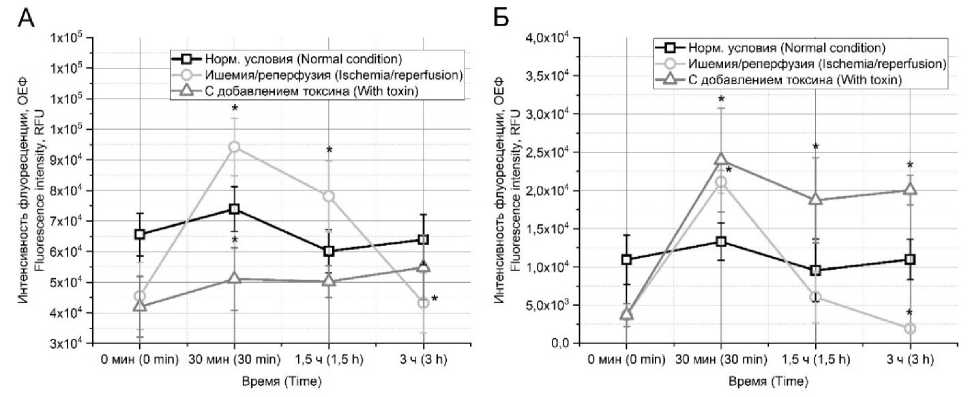
Рис. 3. Уровень pH при моделировании условий ишемии/реперфузии в культуре CHO-K1 при совместной инкубации с токсинами omega-hexatoxin-Hv1a (А) и mu-agatoxin-Aa1a (Б) в концентрации 50 нМ
(* – отличие от группы «нормальные условия» в той же временной точке)
Fig. 3. pH level under simulated ischemia/reperfusion in CHO-K1 culture during coincubation with omega-hexatoxin-Hv1a (A) and mu-agatoxin-Aa1a (B) at a concentration of 50 nM (* – difference from the norm at the same time point)
Обсуждение. В развитии ишемически-ре-перфузионного повреждения принимают участие различные типы ионов. Ключевую роль играют не только ионы кальция как вторичные мессенджеры в развитии клеточной гибели, но и ионы натрия, которые опосредованно вызывают повышение концентрации ионов кальция на стадии ишемии. Оказывать влияние на концентрацию ионов в клетке можно с использованием ингибиторов кальциевых и натриевых ионных каналов, которые находятся на поверхности мембраны. О действии кальциевых блокаторов как ингибиторов клеточной гибели при ишемически-репер-фузионном повреждении хорошо известно. Предварительное лечение верапамилом, блокатором потенциал-зависимых кальциевых каналов, перед ишемией-реперфузией у животных приводило к значительному ингибированию накопления кальция в кардиомиоцитах [17]. Аналогичное использование дилтиа-зема на кроличьей модели ишемии-реперфузии спинного мозга [18] и на крысиной модели ишемии инфаркта [19] также показало цито-протекторный эффект. Подобный эффект наблюдается при действии блокатора кальцие- вых каналов L-типа – бенидипина. Как показывают исследования, бенидипин снижает апоптоз и некроз при моделировании условий ишемии/реперфузии в экспериментах in vivo [20]. Было установлено, что ингибирование натриевых каналов тетродотоксином ослабляет активацию каспазы-3 и апоптоз [21]. Сакситоксин, блокатор натриевых каналов, предотвращает индуцированный анти-Fas-апоп-тоз в Т-клетках Jurkat, предотвращая приток натрия [22].
Несмотря на то что ингибиторы кальциевых и ингибиторы натриевых каналов в условиях реперфузии после ишемии вызывают снижение клеточной гибели, механизмы их действия различаются. Например, в случае с действием верапамила в культуре кардиомиоцитов при моделировании условий ишемии-реперфузии блокатор стимулировал передачу антиоксидантных сигналов SIRT1 (никотина-мид-аденозиндинуклеотид-зависимая деацетилаза, которая выполняет широкий спектр функций внутри клетки [23]) и подавлял окси-дативный стресс [17]. Бенидипин в крысиной модели ишемии миокарда значительно снижал высвобождение митохондриального ци- тохрома C, активацию каспазы-9 и ослаблял последующую каспазу-3 [20]. В случае с ингибированием натриевых каналов также наблюдаются различия в действии. Так, как упоминалось выше, тетродотоксин снижает активацию каспазы-3 [21].
В данном исследовании использовались пептидные ингибиторы кальциевых и натриевых ионных каналов – соответственно токсин omega-hexatoxin-Hv1a и токсин mu-agatoxin-Aa1a. Оба токсина в концентрации 50 нМ значительно снижали уровень апоптоза и некроза в клеточной культуре CHO-K1 после 3 ч ишемии с последующей трехчасовой реперфузией (рис. 1), однако механизм их действия был различен. Так, ингибитор кальциевых каналов omega-hexatoxin-Hv1a вызывал значительное снижение концентрации ионов кальция и натрия (рис. 2А). В данном случае резкое изменение концентраций до уровня ниже нормальных условий объясняет менее выраженное снижение уровня апоптоза и некроза в сравнении с ингибитором натриевых каналов и, скорее всего, связано с повышенной дозой токсина. Несмотря на это, уровень pH при действии omega-hexatoxin-Hv1a медленно поднимался до физиологического уровня на протяжении всей стадии реперфузии (рис. 3А), что также коррелирует с уровнем апоптоза и некроза. В отличие от ингибитора кальциевых каналов, ингибитор натриевых каналов вызывал снижение обоих типов ионов до нормального уровня (рис. 2Б), в то время как в контрольной группе концентрация ионов натрия снижалась резко. При этом уровень pH подни- мался в начале реперфузии, как и в контрольной необработанной группе, но затем медленно снижался до физиологического, в отличие от контрольной группы, где уровень pH резко падал до уровня ниже физиологического (рис. 3Б).
В итоге пептидные токсины – ингибиторы кальциевых и натриевых каналов снижают уровень апоптоза и некроза в культуре CHO-K1 при моделировании условий ишемии-реперфузии. Ингибитор кальциевых каналов снижает гибель клеток за счет снижения концентраций ионов кальция и натрия и поддержания физиологического уровня pH на протяжении всей стадии реперфузии. Ингибитор натриевых каналов снижает гибель за счет снижения концентрации кальция и повышения концентрации натрия, а также за счет поддержания повышенного уровня pH на стадии реперфузии.
Заключение. Таким образом, несмотря на то что в развитии ишемически-реперфузион-ного повреждения важную роль играют как концентрация ионов кальция, так и концентрация ионов натрия, а также их влияние друг на друга, ингибирование определенных типов каналов оказывает различный эффект на внутриклеточные процессы с одинаковым результатом в виде снижения клеточной гибели. Поскольку исследованные токсины могут быть использованы для разработки лекарственных препаратов, способствующих снижению ише-мически-реперфузионного повреждения, полученные данные можно учитывать при планировании результатов с определенным эффектом.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования Российской Федерации (проект № FEUF-2022-0008).
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
Вклад авторов
Концепция и дизайн исследования: Юрова Е.В., Саенко Ю.В., Фомин А.Н.
Литературный поиск, участие в исследовании, обработка материала:
Юрова Е.В., Белобородов Е.А., Расторгуева Е.В.
Статистическая обработка данных: Погодина Е.С.
Анализ и интерпретация данных: Юрова Е.В., Саенко Ю.В., Фомин А.Н.
Написание и редактирование текста: Юрова Е.В., Погодина Е.С.
Список литературы Сравнительный анализ механизмов действия пептидных токсинов -ингибиторов кальциевых и натриевых каналов при ишемии/ реперфузии
- Sánchez-Hernández C.D., Torres-Alarcón L.A., González-Cortés A., Peón A.N. Ischemia/Reperfusion Injury: Pathophysiology, Current Clinical Management, and Potential Preventive Approaches. Mediators Inflamm. 2020; 3: 1-13. DOI: 10.1155/2020/8405370.
- Kuriakose D., Xiao Z. Pathophysiology and Treatment of Stroke: Present Status and Future Perspectives. Int. J. Mol. Sci. 2020; 21: 7609. DOI: 10.3390/ijms21207609.
- Soares R.O.S., Losada D.M., Jordani M.C., Évora P., Castro-E-Silva O. Ischemia/Reperfusion Injury Revisited: An Overview of the Latest Pharmacological Strategies. Int J Mol Sci. 2019; 20 (20): 5034. DOI: 10.3390/ijms20205034.
- Wu M.Y., Yiang G.T., Liao W.T., Tsai A.P., Cheng Y.L., Cheng P.W., Li C.Y., Li C.J. Current Mechanistic Concepts in Ischemia and Reperfusion Injury. Cell Physiol Biochem. 2018; 46 (4): 1650-1667. DOI: 10.1159/000489241.
- Pittas K., Vrachatis D.A., Angelidis C., Tsoucala S., Giannopoulos G., Deftereos S. The Role of Calcium Handling Mechanisms in Reperfusion Injury. Curr Pharm Des. 2018; 24 (34): 4077-4089. DOI: 10.2174/ 1381612825666181120155953.
- Zhang Q., Jia M., Wang Y., Wang Q., Wu J. Cell Death Mechanisms in Cerebral Ischemia-Reperfusion Injury. Neurochem Res. 2022; 47 (12): 3525-3542. DOI: 10.1007/s11064-022-03697-8.
- Dongol Y.C., Cardoso F., Lewis R.J. Spider Knottin Pharmacology at Voltage-Gated Sodium Channels and Their Potential to Modulate Pain Pathways. Toxins. 2019; 11: 626. DOI: 10.3390/toxins11110626.
- Bourinet E., Zamponi G. W. Block of voltage-gated calcium channels by peptide toxins. Neuropharmacology. 2017; 127: 109-115. DOI: 10.1016/j.neuropharm.2016.10.016.
- Godfraind T. Discovery and Development of Calcium Channel Blockers. Front Pharmacol. 2017; 8: 286. DOI: 10.3389/fphar.2017.00286.
- Guillaume P., Jérôme G., Charlotte P., Laurent C., Jean-Christophe G. KNOTTIN: the database of inhibitor cystine knot scaffold after 10 years, toward a systematic structure modeling. Nucleic Acids Research. 2018; 46: 454-458. DOI: 10.1093/nar/gkx1084.
- Iurova E., Beloborodov E., Rastorgueva E., Fomin A., Saenko Y. Peptide Sodium Channels Modulator Mu-Agatoxin-Aa1a Prevents Ischemia-Reperfusion Injury of Cells. Molecules. 2023; 28: 3174. DOI: 10.3390/molecules28073174.
- Iurova E., Rastorgueva E., Beloborodov E., Pogodina E., Fomin A., Sugak D., Viktorov D., Tumozov I., Saenko Y. Protective Effect of Peptide Calcium Channel Blocker Omega-Hexatoxin-Hv1a on Epithelial Cell during Ischemia - Reperfusion Injury. Pharmaceuticals. 2023; 16: 1314. DOI: 10.3390/ph16091314.
- Gallardo Bolaños J.M., Miró Morán Á., Balao da Silva C.M., Morillo Rodríguez A., Plaza Dávila M., Aparicio I.M., Tapia J.A., Ortega Ferrusola C., Peña F.J. Autophagy and apoptosis have a role in the survival or death of stallion spermatozoa during conservation in refrigeration. PLoS One. 2012; 7 (1): e30688. DOI: 10.1371/journal.pone.0030688.
- Fonteriz R.I., de la Fuente S., Moreno A., Lobatón C.D., Montero M., Alvarez J. Monitoring mitochondrial [Ca(2+)] dynamics with rhod-2, ratiometric pericam and aequorin. Cell Calcium. 2010; 48 (1): 61-69. DOI: 10.1016/j.ceca.2010.07.001.
- Tay B., Stewart T.A., Davis F.M., Deuis J.R., Vetter I. Development of a high-throughput fluorescent no-wash sodium influx assay. PLoS One. 2019; 14 (3): e0213751. DOI: 10.1371/journal.pone.0213751.
- Alvarez-Leefmans F.J., Herrera-Pérez J.J., Márquez M.S., Blanco V.M. Simultaneous measurement of water volume and pH in single cells using BCECF and fluorescence imaging microscopy. Biophys J. 2006; 90 (2): 608-618. DOI: 10.1529/biophysj.105.069450.
- Bao M., Huang W., Zhao Y., FangX., Zhang Y., Gao F., Huang D., Wang B., Shi G. Verapamil Alleviates Myocardial Ischemia/Reperfusion Injury by Attenuating Oxidative Stress via Activation of SIRT1. Front Pharmacol. 2022; 13: 822640. DOI: 10.3389/fphar.2022.822640.
- Fansa I., AltugM.E., MelekI., Ucar E., Kontas T., Akcora B., AtikE., Duman T. The neuroprotective and anti-inflammatory effects of diltiazem in spinal cord ischaemia-reperfusion injury. J Int Med Res. 2009; 37 (2): 520-533. DOI: 10.1177/147323000903700228.
- Wei Y., Meng T., Sun C. Protective effect of diltiazem on myocardial ischemic rats induced by isoproterenol. Mol Med Rep. 2018; 17 (1): 495-501. DOI: 10.3892/mmr.2017.7906.
- Liu H.R., Gao F., Tao L., Yan W.L., Gao E., Christopher T.A., Lopez B.L., Hu A., MaX.L. Antiapoptotic mechanisms of benidipine in the ischemic/reperfused heart. Br J Pharmacol. 2004; 142 (4): 627-634. DOI: 10.1038/sj.bjp.0705847.
- Banasiak K.J., Burenkova O., Haddad G.G. Activation of voltage-sensitive sodium channels during oxygen deprivation leads to apoptotic neuronal death. Neuroscience. 2004; 126 (1): 31-44. DOI: 10.1016/S0306-4522(03)00425-1.
- Bortner C.D., Cidlowski J.A. Uncoupling cell shrinkage from apoptosis reveals that Na+ influx is required for volume loss during programmed cell death. J Biol Chem. 2003; 278 (40): 39176-39184. DOI: 10.1074/jbc.M303516200.
- Rahman S., Islam R. Mammalian Sirt1: insights on its biological functions. Cell Commun Signal. 2011; 9: 11. DOI: 10.1186/1478-811X-9-11.


