Сравнительный анализ миграционной активности и инвазивного потенциала культивируемых клеток солидных опухолей человека
Автор: Данилова Анна Борисовна, Нехаева Татьяна Леонидовна, Мисюрин Всеволод Андреевич, Авдонкина Наталья Александровна, Емельянова Наталья Викторовна, Балдуева Ирина Александровна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 3 т.19, 2020 года.
Бесплатный доступ
Введение. Понимание последовательности событий, обеспечивающих инвазивность малигнизированных клеток, имеет важное прогностическое значение. Изучение клеточных и молекулярных основ метастатического процесса закладывает основу для дальнейшего прогресса в лечении онкологических больных. Цель исследования - провести сравнительный анализ in vitro процессов миграции и инвазии культивируемых клеток солидных опухолей человека, выделенных из первичных и метастатических очагов. Материал и методы. Исследование проведено на клеточных культурах меланомы кожи (МК, n=29), рака почки (РП, n=2), колоректального рака (КРР, n=1), сарком мягких тканей (СМТ) и остеогенных сарком (ОС, n=39), выделенных из операционного материала пациентов, получавших лечение в НМИЦ онкологии им. Н.Н. Петрова. Миграцию и инвазию оценивали в режиме реального времени на приборе xCelligence (ACEA Bioscience inc., США). Осуществляли корреляционный анализ экспрессии раковых тестикулярных антигенов и продукции опухолевыми клетками спектра иммуносупрессивных факторов с параметрами миграции и инвазии. Результаты. Все исследованные культуры клеток солидных опухолей (n=65) демонстрировали in vitro инвазивный потенциал (iP), который составил для клеток РП 73,79 %; МК - 53,16 %; СМТ и ОС - 43,96 %; КРР - 5,16 %. Скорость миграции (MS) и инвазии (Slopeinv) была выше у клеток СМТ и ОС по сравнению с МК - 39,33 и 25,3 мкм/ч (p-3 соответственно (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Солидные опухоли, клеточные культуры, миграция, инвазия
Короткий адрес: https://sciup.org/140254354
IDR: 140254354 | УДК: 616-006-018-036.4:576.3 | DOI: 10.21294/1814-4861-2020-19-3-64-77
Текст научной статьи Сравнительный анализ миграционной активности и инвазивного потенциала культивируемых клеток солидных опухолей человека
Миграция клеток – эволюционно консервативный, многогранный процесс, который позволяет отдельным клеткам и их группам менять положение в трехмерном пространстве. Клеточная миграция является неотъемлемой частью процессов формирования тканей и органов при эмбриональном развитии, поддержания гомеостаза и регенерации [1]. Фактически любая клетка, содержащая ядро, в состоянии мигрировать после получения определенных промиграционных стимулов, это справедливо, в том числе, для стволовых, эпителиальных, эндотелиальных, стромальных клеток, нейронов и лейкоцитов [2].
В процессе опухолевой прогрессии малигнизированные клетки могут приобрести способность к миграции, в результате чего сначала меняется их локализация в ткани опухоли, а затем они способны выйти за ее пределы. Миграция опухолевых клеток характеризуется пластичностью с большими адаптационными возможностями и объединяет динамические изменения клеточного цитоскелета, клеточного и внеклеточного матрикса, клеточную адгезию, периклеточный протеолиз и тканевое ремоделирование [3]. Движущиеся малигнизиро- ванные клетки вынуждены приспосабливаться к внешним стимулам микроокружения, таким как архитектоника окружающей ткани, структура и тип субстрата, в котором они осуществляют движение, молекулярные триггеры, в частности компоненты экстрацеллюлярного матрикса, цитокины и хемо-кины [4].
В ответ на химические и физические сигналы, поступающие из опухолевого микроокружения в ходе метастатической диссеминации, злокачественные клетки реализуют универсальный репертуар механизмов инвазии, включающий функциональные программы как минимум двух уровней: на уровне одной клетки и популяционные. Генетическая гетерогенность опухолевых клеток приводит к формированию разнообразия механизмов миграции, что лежит в основе их адаптации к терапевтическим воздействиям.
Миграция и инвазия опухолевых клеток, безусловно, являются критическими процессами в метастатическом каскаде. Механизмы этих явлений многообразны, пластичны, имеют сходство с механизмами перемещения клеток в ходе эмбриогенеза, которые реализуются злокачественными клетками и микроокружением опухоли [5]. Прогресс в по- нимании молекулярных механизмов, лежащих в основе миграции и инвазии малигнизированных клеток в экспериментальных системах, должен быть дополнен пониманием реальных процессов, происходящих в организме онкологических больных. В настоящее время этот разрыв между клинико-патологическими и экспериментальными наблюдениями в основном связан с отсутствием соответствующих маркеров и комплексной модели in vivo, которая надлежащим образом повторяла бы стохастический канцерогенез у человека. В этой ситуации решением проблемы могут быть текущие клеточные биологические исследования in vitro по миграции опухолевых клеток, которые будут способствовать разработке методов улучшенной диагностики, прогноза и, в конечном итоге, инновационных методов лечения.
В статье представлены результаты сравнительного изучения процессов миграции и инвазии клеток солидных опухолей пациентов, выделенных из первичных, рецидивных и метастатических очагов, в клеточных экспериментальных системах in vitro .
Материал и методы
Исследование было проведено на клеточных культурах меланомы кожи (n=29), рака почки (n=2), колоректального рака (n=1), сарком мягких тканей и остеогенных сарком (n=39), выделенных из операционного материала 65 больных, получавших лечение в ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России. Большая часть образцов (n=53) была представлена метастатическими образованиями, 11 образцов – первичной опухолью и 7 – местным рецидивом заболевания (табл. 1).
Культивирование опухолевых клеток осуществляли, руководствуясь методами R.I . Freshney [6] c собственными модификациями [7]. В качестве селективного агента, предотвращающего рост фибробластов в первичной культуре опухолевых клеток, использовали препарат Human FibrOuttm 9 (Chi Scientific Inc., США). Непрерывно культивировали малигнизированные клетки не менее 10 пассажей, после чего использовали полученные клеточные культуры для исследования.
Для количественного анализа опухолевых клеток, способных к миграции и инвазии, клетки высаживали в специальные вставки с диаметром пор 8 мкм с/без матригеля (BD Bioscience, США) по технологии, предложенной K.A. Moutasim et al. (2011) [8]. Анализ скорости миграции опухолевых клеток проводили по методу, описанному в руководстве А.Ю. Александровой (2008) [9]. Для оценки процессов миграции использовали автоматическую систему наблюдения за живыми клетками Cell-IQ (Chip Man Technologies, Финляндия).
Для наблюдения за процессом миграции и инвазии опухолевых клеток в режиме реального времени был использован автоматический клеточный анализатор xCelligence (ACEA Bioscience Inc., США). Для осуществления экспериментов использовали планшеты CIM-16 (ACEA Bioscience Inc., США). Вносили в каждую лунку нижней камеры по 160 мкл питательной среды DMEM/F12 с 20 % CЭКРС в качестве хемоаттрактанта, затем присоединяли верхнюю камеру и добавляли 30 мкл бессывороточной среды или матригеля, чтобы покрыть дно лунок с мембранами. Оставляли планшеты на 1 ч в СО2-инкубаторе при 37 °С. Далее проводили фоновые измерения. Опухолевые клетки в количестве 4×104 вносили в верхние камеры, расположенные над мембраной, оставляли на 30 мин, чтобы исключить турбулентные возмущения жидкости в лунках, и начинали регистрацию электрических сигналов. Качество процессов миграции и инвазии с течением времени оценивали по изменению клеточного индекса CI и тангенса угла касательной к кривой динамики CI Slope в цифровом и графическом выражении.
Методом проточной цитофлуорометрии на приборе FACS Canto II (BD, США) определяли поверхностные молекулы на опухолевых клетках CD304 (Neuropilin-1), хемокиновые рецепторы CCR4, CCR7, CCR10, рецептор к VEGF CD309 (VEGFR-2); маркеры стволовых клеток опухоли CD133, CD338 (ABCG2); маркер пролиферации Ki67. Были использованы реагенты BD Bioscience, США.
Молекулярно-генетический анализ экспрессии раково-тестикулярных генов проводили методом ПЦР в реальном времени. В качестве референс-
Таблица 1/Table 1
Гистотип и локализация образцов солидных опухолей, из которых были получены клеточные культуры
Histological verification and localization of samples of solid tumors from which cell cultures were obtained
|
Опухоль/ Tumor |
Первичная/ Primary |
Рецидив/ Recurrence |
Метастатическая/ Metastatic |
Всего/ Total |
||
|
Меланома кожи/Skin melanoma |
||||||
|
Веретенокле- |
Мягкие ткани (1)/ soft tissues (1) |
|||||
|
точная/ |
1 |
0 |
3 |
Лимфатические узлы (1)/lymph nodes (1) |
4 |
|
|
Пигментная/ |
Spindle cell |
Головной мозг (1)/brain (1) |
||||
|
Pigmented |
Эпителиоидно- |
Мягкие ткани (2)/soft tissue (2) |
||||
|
клеточная/ |
1 |
0 |
13 |
Лифатические узлы (10)/lymph nodes (10) |
14 |
|
|
Epithelioid cell |
Щитовидная железа (1)/thyroid (1) |
|||||
|
Беспигментная/ |
Веретеноклеточная/ Spindle cell |
0 |
0 |
2 |
Мягкие ткани (1)/soft tissues (1) Легкое (1)/lung (1) |
2 |
|
Pigmentless |
Эпителиоидно- |
Мягкие ткани (1)/soft tissues (1) |
||||
|
клеточная/ |
1 |
2 |
6 |
Лимфатические узлы (4)/lymph nodes (4) |
9 |
|
|
Epithelioid cell |
Легкое (1)/lung (1) |
|||||
|
Саркомы мягких тканей и остеогенные саркомы/Soft tissue and bone sarcomas |
||||||
|
Остеосаркома/ Osteosarcoma |
0 |
0 |
6 |
Легкое (5)/lung (5) Мягкие ткани (1)/soft tissues (1) |
6 |
|
Липосаркома/Liposarcoma |
2 |
1 |
1 |
Легкое (1)/lung (1) |
4 |
|
Синовиальная саркома/ Synovial sarcoma |
0 |
2 |
5 |
Легкое (1)/lung (1) Мягкие ткани (1)/soft tissues (1) Молочная железа (1)/breast (1) |
7 |
|
Миксофибросаркома/ Myxofibrosarcoma |
1 |
1 |
6 |
Легкое (3)/lung (3) Мягкие ткани (3)/soft tissues (3) |
8 |
|
Лейомиосаркома/Leiomyosarcoma |
0 |
0 |
2 |
Легкое (2)/lung (2) |
2 |
|
Рабдомиосаркома/Rhabdomyosarcoma |
0 |
0 |
2 |
Легкое (2)/lung (2) |
2 |
|
Светлоклеточная саркома/Clear cell sarcoma |
0 |
0 |
1 |
Мягкие ткани (1)/soft tissues (1) |
1 |
|
Хондросаркома/ Chondrosarcoma |
2 |
1 |
3 |
Легкое (1)/lung (1) Мягкие ткани (2)/soft tissues (2) |
6 |
|
Дерматофибросаркома/ Dermatofibrosarcoma |
1 |
0 |
0 |
1 |
|
|
Веретеноклеточная саркома/ Spindle cell sarcoma |
1 |
0 |
0 |
1 |
|
|
Шваннома/Schwannoma |
0 |
0 |
1 |
Легкое (1)/lung (1) |
1 |
|
Колоректальный рак/Colorectal cancer |
|||||
|
Аденокарцинома/Adenocarcinoma |
0 |
0 |
1 |
Брюшная стенка (1)/abdominal wall (1) |
1 |
|
Рак почки/Renal cell cancer |
|||||
Светлоклеточный
|
почечноклеточный рак/ 1 0 Clear cell renal cell carcinoma Всего/Total 11 7 ного использовали контрольный ген ABL . Изучали экспрессию следующих генов: GAGE, HAGE, NY-ESO1, MAGEA1, PASD1, SCP1, SEMG1, SLLP1, SPANXA1, SSX1 и PRAME , как описано ранее [10]. Использовали специфические праймеры и флуоресцентные зонды, разработанные с использовани- |
1 Легкое (1)/lung (1) 2 53 71 ем последовательностей ресурса NCBI GenBank, и программы для сравнения последовательностей нуклеотидов и аминокислот BLAST (Basic Local Alignment Search Tool) [11]. Анализ полученных данных проводили с помощью систем статистической обработки IBMSPSS |
Таблица 2/Table 2
Характеристики миграционных и инвазивных свойств культивируемых клеток солидных опухолей Characteristics of the migratory and invasive properties of solid tumors cells
|
Тип клеточной культуры/ Type of cell culture |
Скорость миграции (мкм/ч)/ Rate of migration M (min-max) |
Инвазивный потенциал (%)/ Invasive potential M (min-max) |
Slope в процессе миграции e-3 (48 ч)/ Slope in the migration process M (min-max) |
Slope в процессе инвазии e-3 (48 ч)/ Slope in the invasion process M (min-max) |
|
МК/SM |
25,30* |
53,16 |
128,38 |
59,82* |
|
3,00–64,50 |
8,92–88,90 |
10,80 – 335,00 |
3,20–197,70 |
|
|
СМТ и ОС/STBS |
39,33* |
43,96 |
125,84 |
95,32* |
|
9,60–68,90 |
1,96–99,50 |
17,40 – 369,20 |
5,80–314,60 |
|
|
РП/RCC |
39,00 |
73,79 |
249,75 |
107,65 |
|
28,80 ; 49,20 |
72,92 ; 74,67 |
159,50 ; 340,00 |
93,50 ; 120,00 |
|
|
КРР/CRC |
20,40 |
5,16 |
79,00 |
132,00 |
|
Примечание: * – различия по скорости миграции и инвазии (slope) культивируемых клеток МК и СМТК статистически значимы, p<0,05 (согласно критерию Манна–Уитни). |
||||
Notes: * – differences in the rate of migration and invasion (slope) of cultured SM and STBS cells are statistically significant, p<0.05 (according to the Mann–Whitney test).
Таблица 3/Table 3
Анализ состава клеточных популяций в культурах меланомы кожи, выявленных методом проточной цитофлуорометрии
Analysis of the composition of cell populations in cultures of skin melanoma identified by flow cytofluorometry
|
Кол-во образцов/ Number of samples |
Популяции/ Populations |
Число клеток (%)/ Number of cells |
Ki67 (%) |
CD133 (%) |
CD338 (%) |
CCR10 (%) |
CCR7 (%) |
CCR4 (%) |
CD304 (%) |
|
P1 |
70,85 ± |
12,97 ± |
3,78 ± |
3,69 ± |
6,93 ± |
4,83 ± |
0,81 ± |
3,22 ± |
|
|
11 (64,7 |
3,92* |
3,38* |
1,20* |
1,98 |
2,16* |
1,74* |
0,42 |
1,09 |
|
|
%) |
P2 |
20,81 ± |
49,5 ± |
1,05 ± |
15,0 ± |
70,65 ± |
24,3 ± |
2,8 ± |
21,84 ± |
|
3,52* |
5,64* |
0,30* |
5,38 |
3,78* |
4,45* |
0,89 |
11,7 |
||
|
P1 |
18,23 ± |
7,16 ± |
14,68 ± |
4,01 ± |
18,26 ± |
3,72 ± |
3,3 ± |
10,38 ± |
|
|
6 (35,3 %) |
2,51** |
3,42** |
4,22** |
1,70 |
5,04** |
1,66** |
0,64 |
3,44** |
|
|
P2 |
53,55 ± |
33,9 ± |
1,06 ± |
2,13 ± |
51,88 ± |
25,42 ± |
16,16 ± |
31,66 ± |
|
|
6,13** |
5,46** |
0,36** |
1,56 |
10,00** |
3,85** |
2,57 |
7,59** |
Примечание: * – различия статистически значимы (p<0,05); ** – различия статистически значимы (p<0,05) согласно критерию Манна–Уитни.
Notes: * – differences are statistically significant, p<0,05; ** – differences are statistically significant, p<0,05, according to the Mann–Whitney criterion.
19.0 и Microsoft Excel 2010. Использовали методы описательной статистики, непараметрической статистики для оценки различий между двумя независимыми выборками с использованием критериев Спирмена и Манна–Уитни, для многогруппового сравнения медиан – с использованием критерия Краскела–Уоллеса [12].
Результаты
Все исследованные клеточные культуры солидных опухолей, полученные от разных больных, проявляли инвазивные свойства и демонстрировали различный инвазивный потенциал (IP) (табл. 2, рис. 1). Сравнительный анализ миграционных свойств клеток МК, СМТ и ОС показал, что в целом клетки СМТ и ОС обладали большей ско- ростью миграции (MS), определяемой по времени зарастания «экспериментальной раны»: для клеток меланом MS составила 25,3 мкм/ч, для клеток СМТ и ОС – 39,33 мкм/ч (р<0,05). IP МК и СМТ и СО, отражающий количество клеток, проникающих через трехмерную среду матригель за определенный промежуток времени (48 ч), составил 53,16 и 43,96 % соответственно. Наибольшим IP характеризовались клетки РП – 72,92 и 74,67 %. Средняя скорость инвазии, определяемая по параметру slope, была значимо выше у клеточных культур СМТ и ОС, чем у клеточных культур МК – 95,32е-3 и59,82е-3 соответственно (p<0,05). Статистически значимых различий скорости миграции и инвазии от длительности культивирования клеток (числа пассажей) выявлено не было. Согласно методу
Краскела – Уоллиса обнаружены различия в величине IP опухолевых клеток в зависимости от источника происхождения культивируемых клеток СМТ и ОС (первичная опухоль, рецидив, метастаз): 18,11 ± 3,05 %, 25,75 ± 5,57 %, 52,97 ± 5,64 % соответственно, р<0,05 (рис. 2А). Для культур МК данный анализ провести не удалось, так как злокачественные клетки были получены в основном из метастатических образцов.
Выявление корреляционных связей между параметрами миграции и инвазии клеток солидных опухолей человека и продукцией ими иммуносупрессивных факторов, факторов, ассоциированных с метастазированием, а также экспрессией хемокиновых рецепторов, позволило установить прямую корреляцию высокой силы между MS и количеством клеток МК, несущих рецепторы CCR10 (rho=0,682, p=0,007), а также продукцией PLGF (rho=0,772, p=0,009). Скорость инвазии клеток МК, определяемая по slope (SlopeInv), коррелировала с MS (rho=0,541, p=0,002), продукцией IGFBP (rho=0,717, p=0,03). Обратная корреляция
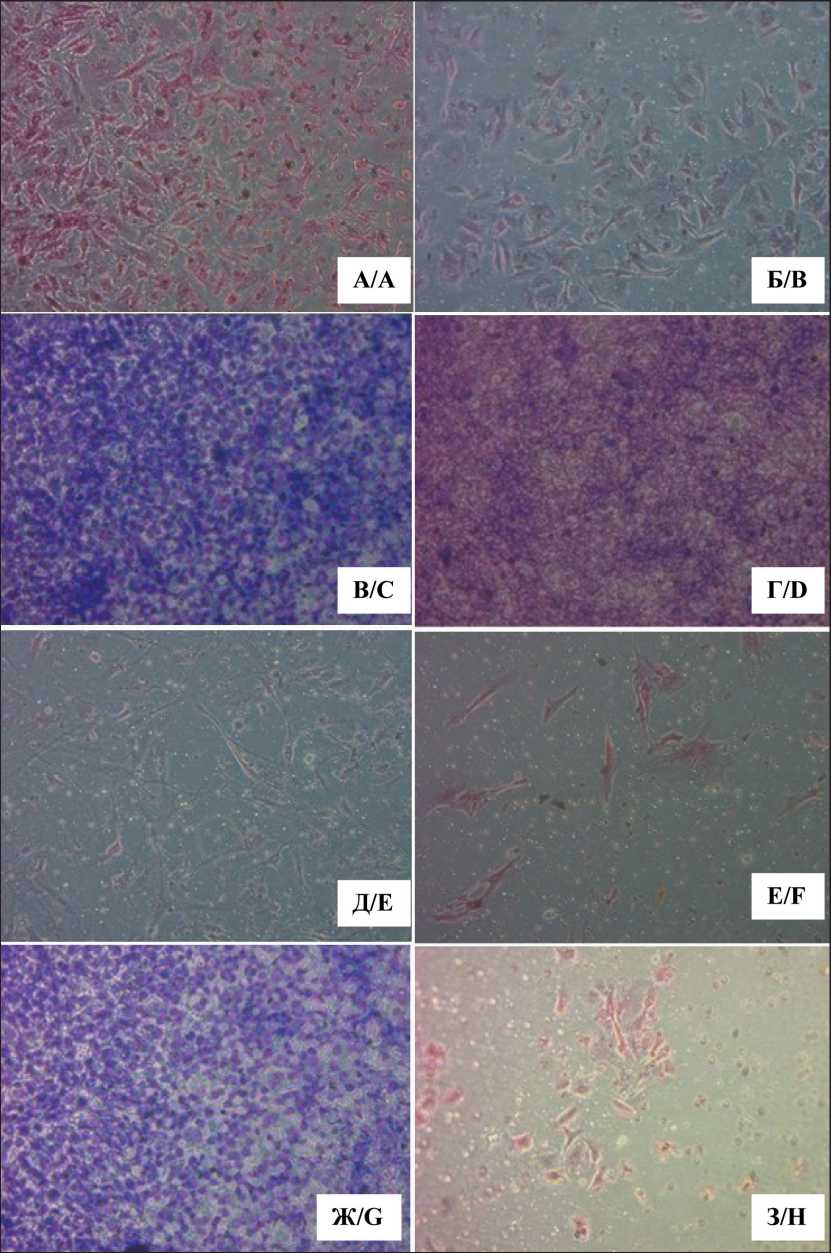
Рис. 1. Цитологические препараты опухолевых клеток, полученные в процессе миграции и инвазии с использованием технологии культивирования на пористой мембране в течение 48 ч: А, Б – культура МК #686, 31 пассаж, инвазивный потенциал 51,25 %;
В, Г – культура МК #520, 106 пассаж, инвазивный потенциал 72,92 %;
Д, Е – культура рабдомиосаркомы #862, 12 пассаж, инвазивный потенциал 17,34 %; Ж, З – клеточная культура КРР #485, 56 пассаж, инвазивный потенциал 5,16 %.
А, В, Д, Ж – миграция клеток, Б, Г, Е, З – инвазия клеток. Окраска по Гимза, инвертированный микроскоп, ×100 Fig. 1. Cytological preparations of tumor cells obtained during migration and invasion using technology of cultivation on a porous membrane for 48 hours. A, B – melanoma cell culture #686, passage
31, invasive potential 51,25 %; C, D – melanoma cell culture #520, passage 106, invasive potential 72,92 %;
E, F – rhabdomyosarcoma cell culture #862, passage 12, invasive potential 17,34 %;
G, H – Colorectal cancer cell culture #485, passage 56, invasive potential – 5,16 %.
A, C, E, G – cell migration, B, D, F, H – cell invasion.
Giemsa stain, inverted microscope, ×100
средней силы наблюдалась для SlopeInv и продукции хемокина CCL2 (rho=-0,550, p=0,018). Кроме того, процентное содержание CCR10+ клеток было ассоциировано с продукцией PECAM-1 (rho=0,782, p=0,004), а продукция PLGF оказалась связана с количеством CD133+ клеток (rho=0,705, p=0,023). Интересно, что количественное содержание CCL2, определяемое в супернатантах клеточных культур
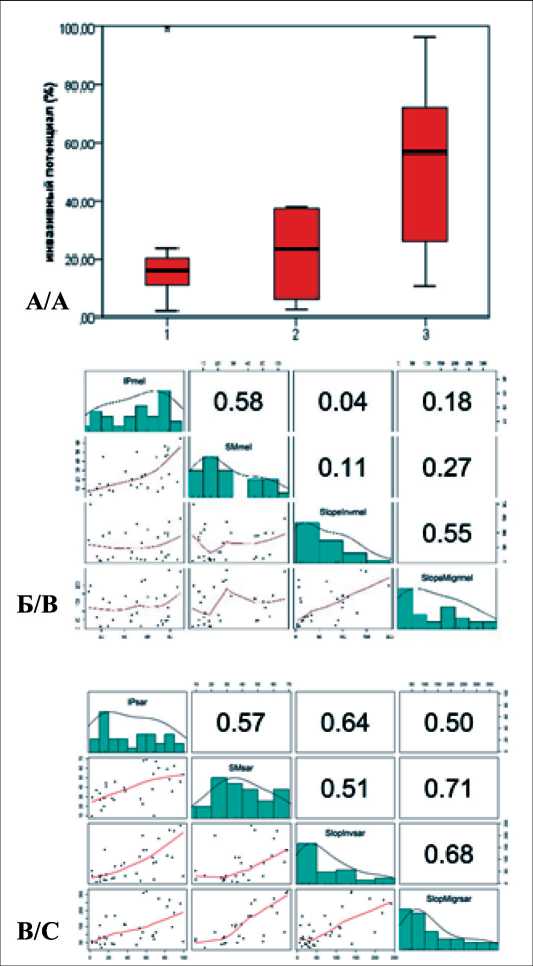
Рис. 2. Графическое изображение статистических закономерностей, связанных с процессами миграции и инвазии опухолевых клеток:
А – различия инвазивного потенциала в зависимости от источника происхождения культивируемых клеток СМТ и ОС (1 – первичная опухоль, 2 – рецидив, 3 – метастаз); Б – корреляция между инвазивным потенциалом и скоростью миграции клеток МК; В – корреляция между инвазивным потенциалом и скоростью миграции клеток СМТ и ОС
Fig. 2. Graphic representation of statistical patterns associated with the migration and invasion processes of tumor cells.
A – differences of STBS invasive potential depending on the cells origin (1 – primary tumor, 2 – tumor recurrence, 3 – metastasis); B the correlation between the invasive potential and the rate of migration of melanoma cells; C – correlation between the invasive potential and the rate migration of STBS cells
МК, коррелировало с продукцией клетками МК иммуносупрессивного фактора IL-10 (rho=0,665, p=0,029).
IP клеток СМТ и ОС коррелировал с MS, определяемой по скорости зарастания «экспериментальной раны» (rho=0,600, p=0,000), с Slope-Inv (rho=0,588, p=0,000) и скоростью миграции, определяемой с помощью прибора xCelligence (SlopeMigr) (rho=0,532, p=0,001) (рис. 2Б, В). Для клеток СМТ и ОС обнаружили также положительную корреляцию высокой силы между IP и продукцией факторов HB-EGF (rho=0,643, p=0,010), IGFBP-I (rho=0,857, p=0,014), PLGF (rho=0,786, p=0,036), PECAM-1 (rho=0,882, p=0,000), FST (rho=0,685, p=0,014), IL8 (rho=0,733, p=0,025) и SCF (rho=0,883, p=0,002). SlopeInv коррелировал с количественным содержанием FST в супернатантах культивируемых клеток СМТ и СО (rho=0,678, p=0,015) и SCF (rho=0,767, p=0,016). Выявленные статистические закономерности указывают на наличие сложных реципрокных коррелятивных взаимодействий, позволяющих опухолевым клеткам реализовывать свой инвазивный и метастатический потенциалы (рис. 3).
Согласно данным измерения электрического импеданса на приборе xCelligence, в большинстве случаев наблюдали «скачкообразный переход» малигнизированных клеток через поры мембраны (миграция) и через матригель (инвазия) (рис. 4А, Б, В, Г). В диапазоне времени 20–40 ч большая часть клеток перемещалась через пористую мембрану и распластывалась на ее обратной по-
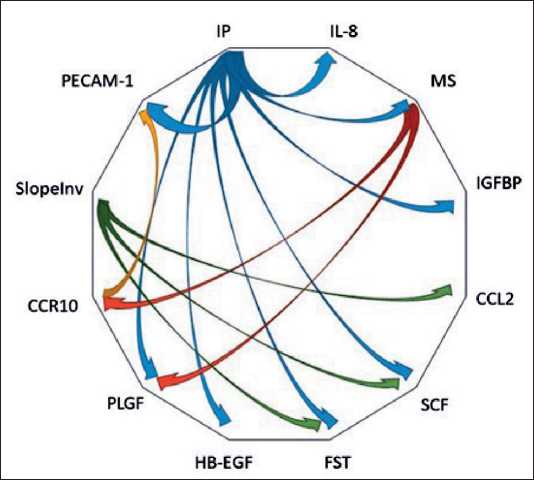
Рис. 3. Схематическое изображение выявленных корреляционных связей между параметрами миграционных, инвазивных свойств культивируемых клеток солидных опухолей человека и количественным содержанием активных молекул в супернатантах культур опухолевых клеток
Fig. 3. Schematic representation of correlation relations between the parameters of migratory, invasive properties of cultivated tumor cells and quantitative content of active molecules in tumor cell culture supernatants верхности, покрытой электродами, что нашло выражение в резком, скачкообразном изменении CI, который в дальнейшем практически не менялся. При измерении Slope в 3 временных периодах (5–20 ч, 20–40 ч, 40–48 ч) быстрое массовое перемещение клеток соответствовало значительному увеличению этого параметра (рис. 4А1, Б1, В1, Г1).
Среди культур клеток солидных опухолей, исследованных на предмет экспрессии РТА, только 4 культуры СМТ были негативны и исключены из поиска возможных корреляционных связей между экспрессией РТА и параметрами миграции и инвазии культивируемых малигнизированных клеток. В случае МК была обнаружена положительная корреляция средней силы между количественным выражением интенсивности экспрессии гена PRAME и величиной SlopeMigr (r=0,485, p=0,048), а также обратная корреляция средней силы между экспрессией гена PASD1 и SlopeInv (r=-0,486, p=0,048). Для клеток СМТ и ОС была обнаружена
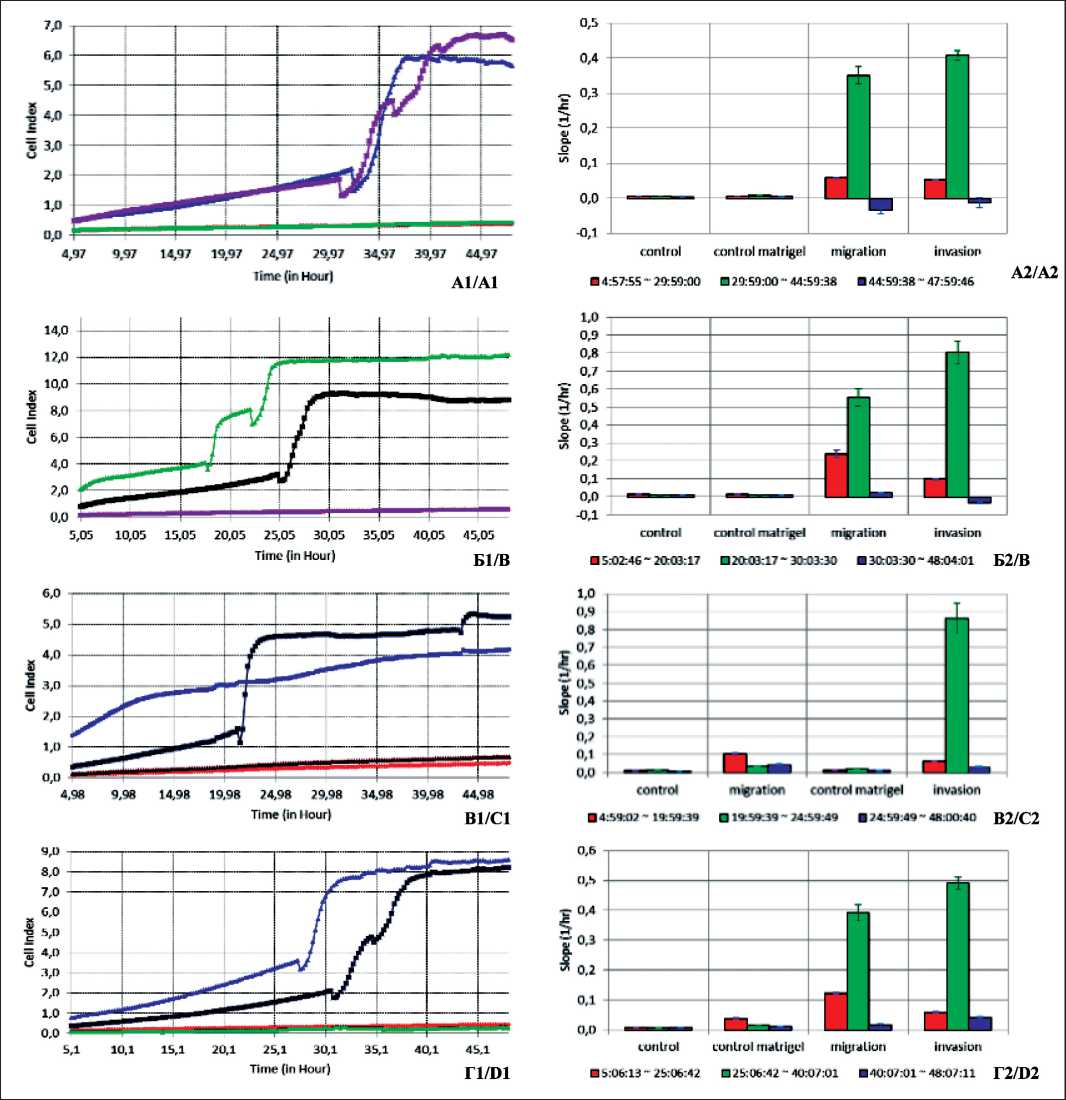
Рис. 4. Графическое изображение динамики CI и Slope в процессе миграции и инвазии культивируемых клеток солидных опухолей: А1, А2 – клеточная культура МК #283, 40 пассаж; Б1, Б2 – клеточная культура рабдомиосаркомы #919, 10 пассаж;
В1, В2 – клеточная культура КРР #485, 30 пассаж; Г1, Г2 – клеточная культура леймиосаркомы #699, 20 пассаж
Fig. 4. Graphical representation of the CI and Slope dynamics during the migration and invasion of solid tumors cells culture.
A1, A2 – Melanoma cell culture #283, 40 passage; B1, B2 – rhabdomyosarcoma cell culture #919, passage 10; C1, C2 – Colorectal cancer cell culture #485, 30 passage; D1, D2 – leiomyosarcoma cell culture #699, passage 20
взаимосвязь между интенсивностью экспрессии SSX1 и SlopeInv (r=0,469, p=0,043).
При изучении методом проточной цитометрии состава популяции культивируемых клеток солидных опухолей человека, для которых были определены параметры миграции и инвазии, было обнаружено, что 65,3 % (17 из 26) клеточных культур МК и 72,7 % (8 из 11) СМТ и СО распадались по размеру клеток и их гранулярности на две субпопуляции, которые различались по пролиферативной активности (Ki67), характеру экспрессии маркеров стволовых клеток CD133, CD338, хемокиновых рецепторов CCR7, CCR10 и нейропилина 1 (CD304) (рис. 5). При этом в целом наблюдали статистически значимые различия между выявленными субпопуляциями в количестве CD133+, CCR10+, CCR7+-клеток и в количестве клеток, позитивных по Ki67(p<0,05).
Количество опухолевых клеток, формирующих данные субпопуляции в случае СМТ и ОС, было одинаковым, но наблюдали статистически значимые различия между ними по относитель-
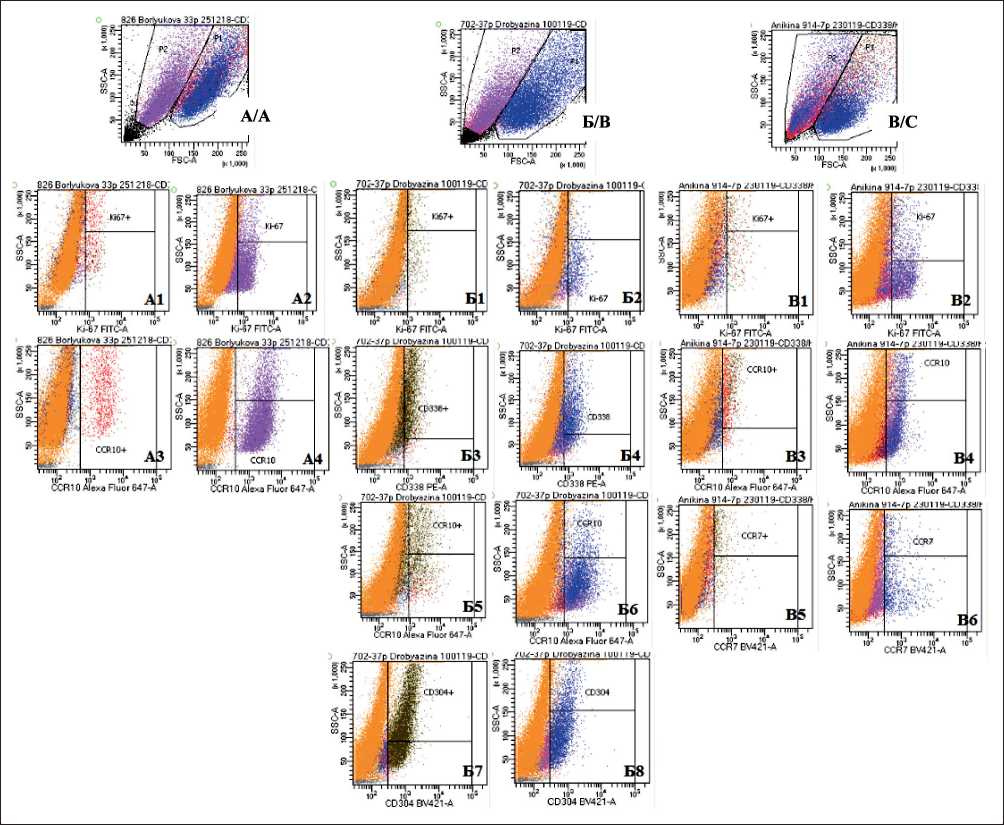
Рис. 5. Выявление особенностей популяции культивируемых клеток солидных опухолей методом проточной цитометрии: A –две субпопуляции Р1 и Р2 в клеточной культуре МК #826, 30 пассаж; А1, А2 – экспрессия Ki67 в популяциях Р1 и Р2 культуры #826; А3, А4 – экспрессия CCR10 в популяциях Р1 и Р2 культуры #826; Б – две субпопуляции Р1 и Р2 в клеточной культуре липосар-комы #702, 37 пассаж; Б1, Б2 – экспрессия Ki67 в популяциях Р1 и Р2 культуры #702; Б3, Б4 – экспрессия CD338 в популяциях Р1 и Р2 культуры #702; Б5, Б6 – экспрессия CCR10 в популяциях Р1 и Р2 культуры #702; Б7, Б8 – экспрессия CD304 в популяциях Р1 и Р2 культуры #702; В – две субпопуляции Р1 и Р2 в клеточной культуре синовиальной саркомы #914, 7 пассаж;
В1, В2 – экспрессия Ki67 в популяциях Р1 и Р2 культуры #914; В3, В4 экспрессия CCR10 в популяциях Р1 и Р2 культуры #914;
В5, В6 – экспрессия CCR7 в популяциях Р1 и Р2 культуры #914
Fig. 5. Identification of the population characteristics of solid tumors cells culture by flow cytometry. A – two subpopulations of P1 and P2 in melanoma cell culture # 826, passage 30; A1, A2 – Ki67 expression in populations P1 and P2 of culture #826; A3, A4 – CCR10 expression in populations P1 and P2 of culture #826; B – two subpopulations P1 and P2 in liposarcoma cell culture #702, passage 37; B1, B2 (Б1, Б2) – Ki67 expression in populations P1 and P2 of culture #702; B3, B4 (Б3, Б4) – CD338 expression in populations P1 and P2 of culture #702; B5, B6 (Б5, Б6) – CCR10 expression in populations P1 and P2 of culture #702; B7, B8 (Б7, Б8) – CD304 expression in populations of P1 and P2 culture #702; C – two subpopulations of P1 and P2 in synovial sarcoma cell culture #914, passage 7; C1, C2 (В1, В2) – Ki67 expression in populations P1 and P2 of culture #914; C3, C4 (В3, В4) – CCR10 expression in populations of P1 and P2 of culture #914; C5, C6 (В5, В6) – CCR7 expression in populations P1 and P2 of culture #914
ному количеству CD133+-клеток (13,63 ± 2,63 % и 4,66 ± 1,73 % соответственно) и CCR10+-клеток (11,95 ± 1,44 % и 48,52 ± 9,50 % соответственно, p<0,05 согласно методу Манна–Уитни).
В то же время среди клеточных культур МК можно было выделить две группы, где количественное соотношение этих субпопуляций было различным: в 64,7 % (11 из 17) клеточных культур МК та популяция, которая преобладала численно (Р1), имела большее количество CD133-позитивных клеток, в то время как численно меньшая популяция (Р2) характеризовалась повышенным пролиферативным потенциалом и имела большее количество клеток, несущих хемокиновые рецепторы CCR10, CCR7, CCR4, а также молекул нейропилина-1 (p<0,05 согласно критерию Манна–Уитни) (табл. 3).
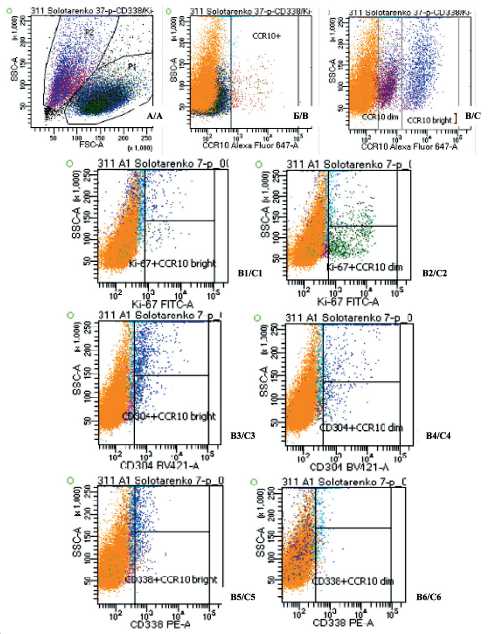
Рис. 6. Выявление особенностей популяции культивируемых клеток МК #311 методом проточной флуороцитометрии: А – выявление двух субпопуляций по размеру и гранулярности Р1 и Р2; Б – экспрессия CCR10 в субпопуляции Р1;
В – экспрессия CCR10 в субпопуляции Р2; В1, В2 – выявление Ki67 в субпопуляциях CCR10bright и CCR10dim;
В3, В4 – выявление CD304 в субпопуляциях CCR10bright и CCR10dim; B5, В6 – выявление CD338 в субпопуляциях CCR10bright и CCR10dim
Fig. 6. Identification of the population characteristics of melanoma cell culture #311 by flow cytometry. A – identification of two subpopulations P1and P2 in size and granularity; B – CCR10 expression in a P1 subpopulation; C – CCR10 expression in a P2 subpopulation; C1, C2 – Ki67 detection in the CCR10bright and CCR10dim subpopulations; C3, C4 – CD304 detection in the CCR10bright and CCR10dim subpopulations; C5, C6 – CD338 detection in the CCR10bright and CCR10dim subpopulations
В 35,3 % клеточных культур МК (6 из 17) соотношение между числом клеток в популяциях Р1 и Р2 было обратным, однако выявленные статистически значимые различия между популяциями сохранялись. Интересно, что в клеточной популяции двух культур МК были выявлены CCR10+-клетки, которые имели различную плотность данных рецепторов и разделялись на две субпопуляции по интенсивности флуоресценции: CCR10bright+ и CCR10dim+. Дальнейшее гейтирование по субпопуляции CCR10bright+ позволило обнаружить, что эта субпопуляция опухолевых клеток характеризуется более высоким содержанием СD338+ и CD304+- клеток, в то время как пролиферативный потенциал, определяемый по экспрессии Кi67, был выше в субпопуляции CCR10dim+ (рис. 6).
Обсуждение
Результаты многочисленных исследований указывают на высокую пластичность опухолевых клеток, которые способны синтезировать и экскретировать в микроокружение разнообразные факторы, формирующие среду, благоприятствующую их диссеминации. В нашем исследовании в условиях in vitro были изучены параметры миграции и инвазии культивируемых клеток солидных опухолей человека в связи с экспрессией и продукцией ими спектра молекул, ассоциированных с метастазированием. Изучали 4 основных параметра: IP, представляющий соотношение количества инвазивных клеток к мигрирующим, выраженное в процентах, MS опухолевых клеток, соответствующей скорости зарастания «экспериментальной раны», SlopeMigr и SlopeInv, параметров, характеризующих скорость инвазии и миграции малигнизированных клеток, вычисляемую с помощью клеточного анализатора в режиме реального времени.
Для клеток МК, СМТ и ОС наблюдали корреляцию изучаемых параметров миграции и инвазии опухолевых клеток. Как известно, миграция опухолевых клеток представляет собой адаптивный процесс, который связан с особенностями клеточной адгезии и перестройки цитоскелета, взаимодействием клеток с межклеточным матриксом и его ремоделированием, и является основой для инвазии и метастатической диссеминации [13]. В нашей работе клетки СМТ и ОС демонстрировали более высокую MS и более высокий SlopeInv по сравнению с культивируемыми клетками МК. Точечные измерения, которые удалось провести в отношении клеток МК, РП, КРР и СМТ и ОС, также показали, что СМТ и СО характеризуются более высокими инвазивными способностями. Это гетерогенная группа злокачественных опухолей, происходящих из трансформированных клеток мезенхимального происхождения, которые характеризуются агрессивным течением и метастатическими процессами. Недавно стало очевидно, что инвазия и метастазирование сарком ассоциированы с разнообразными стимулами опухолевого микроокружения, связанными с ремоделированием экстрацеллюлярного матрикса, модуляцией жесткости клеточного цитоскелета, взаимодействием клеток с матриксом, влиянием многих сигнальных факторов и пространственных молекулярных градиентов [14]. В то же время, вероятно, метастатический потенциал злокачественных клеток генетически детерминирован, на что указывают статистически достоверные результаты по различию IP, определяемого в экспериментальных условиях in vitro для образцов СМТ и ОС, полученных из первичного опухолевого очага, рецидива и метастатических образований, при этом наиболее высоким инвазивным потенциалом характеризовались именно метастатические клетки.
Известно, что хемокины и факторы роста являются ключевыми факторами опухолевой инвазии и облегчают интра- и экстравазацию малигнизированных клеток, инициируя образование метастазов. Опухолевые клетки продуцируют множество хемоаттрактантов для макрофагов, нейтрофилов, лимфоцитов, фибробластов и мезенхимальных стволовых клеток, которые, в свою очередь, продуцируют вещества, стимулирующие миграцию злокачественных клеток [15].
В нашем исследовании был выявлен целый спектр корреляционных связей между параметрами миграции и инвазии клеток солидных опухолей в системе in vitro и опухолеассоциированными факторами, способствующими иммуносупрессии, метастазированию, пролиферации малигнизированных клеток, при этом для клеток МК, СМТ и ОС этот спектр были несколько различным. MS, определенная в культурах МК, коррелировала с относительным количеством CCR10+ опухолевых клеток. В исследовании L. Kühnelt-Leddihn et al. были выявлены прогностические факторы, связанные с гиперэкспрессией хемокиновых рецепторов CCR7 и CCR10 при меланоме кожи [16]. Обнаружено, что избыточная экспрессия этих рецепторов связана с неблагоприятным течением заболевания независимо от толщины опухоли по Бреслоу и уровня инвазии по Кларку. Корреляция количества клеток МК, несущих рецепторы CCR10, с продукцией ими PECAM-1, а также корреляция IP клеток СМТ и количественного содержания в их клеточных супернатантах PECAM-1 подтверждают факт участия этого фактора в прогрессии солидных опухолей, который был выявлен ранее [17].
При исследовании механизмов иммуносупрессии у больных СМТ и ОС ранее нами было установлено, что клетки метастатических СМТ и ОС способны продуцировать высокие уровни хемокина CCL2, количество которого находится в прямой зависимости от содержания в периферической крови больных CCR4+-регуляторных Т-лимфоцитов [18]. В этой связи интересен факт обнаружения обратной корреляции между про- дукцией клетками МК CCL2 и SlopeInv. Можно предполагать, что опухоль представлена несколькими субпопуляциями злокачественных меланоцитов, обладающих разными потенциями, что подтверждается данными, полученными в процессе анализа культивируемых клеток МК, СМТ и ОС с помощью проточной цитофлуорометрии. Наличие среди культивируемых клеток МК и СМТК как минимум двух субпопуляций, статистически значимо различающихся по экспрессии маркера стволовых клеток CD133, маркера пролиферации Ki67, хемокиновых рецепторов CCR10, CCR7 и нейропилина-1, позволяет предполагать наличие группы опухолевых клеток с выраженным метастатическим потенциалом и группы покоящихся злокачественных клеток, несущих «зародышевый» потенциал и формирующих иммуносупрессивное микроокружение, тем более, что была обнаружена корреляция между продукцией клетками МК CCL2 и IL-10.
В нашем исследовании содержание PLGF в надосадочной жидкости культур МК и СМТ и СО было ассоциировано с MS клеток МК и IP клеток СМТ и ОС. Как известно, PLGF относится к семейству сосудистого эндотелиального фактора роста и играет важную роль в неоангиогенезе, находясь в сложном скоординированном взаимодействии с другими факторами этого семейства [19]. N. Song et al. показали, что избыточная экспрессия PLGF значительно увеличивала инвазивность культивируемых клеток рака яичника через активацию транскрипционного фактора ZEB2, ответственного, наряду с другими факторами, за индукцию эпителиально-мезенхимального перехода и поддержание адаптированного мезенхимального фенотипа злокачественных клеток [20].
Интересно, что для некоторых опухолей отмечена высокая экспрессия HB-EGF, лиганда рецептора эпидермального фактора роста, например для клеточных культур и ткани рака яичников [21]. Было доказано, что HB-EGF играет важную роль в онкогенезе рака яичников и может служить прогностическим маркером [22]. В нашем исследовании мы обнаружили, что клетки СМТ и ОС, демонстрировавшие высокий IP, продуцировали значительные количества HB-EGF.
Также нами были получены данные о том, что клетки СМТ и ОС с гиперпродукцией фоллиста-тина демонстрировали высокий IP и SlopeInv. Фоллистатин представляет собой белок, который связывает димеры активина с высокой аффинностью, реализуя эндогенный селективный механизм ингибирования передачи сигналов активина [23]. Его роль, как и активина, в онкогенезе и метастазировании остается неизученной [24, 25]. Однако среди противоречивых данных есть сведения, указывающие на прогностическую роль секреции фоллистатина при злокачественных новообразованиях. Так, повышенный уровень этого белка в сы- воротке крови пациентов с раком предстательной железы коррелировал с наличием костных метастазов и увеличенным уровнем PSA, что позволило исследователям предложить фоллистатин как терапевтическую мишень при этом заболевании [26]. Интересна обнаруженная нами корреляция между SlopeInv клеток СМТ и СО и продукцией ими фактора стволовых клеток SCF, который является мультифункциональным цитокином, участвующим в прогрессировании опухоли [27]. В последнее время было продемонстрировано, что система SCF/c-kit выполняет важные функции в неоангиогенезе, пролиферации и инвазии злокачественных клеток [28]. C. Gao et al. показали, что уровень SCF коррелировал со стадией метастазирования (pTNM) при раке поджелудочной железы [29]. Группа пациентов с высокой экспрессией SCF имела значительно более низкие показатели выживаемости по сравнению с больными, которые имели низкую экспрессию SCF.
Анализ экспрессии раково-тестикулярных генов, принадлежащих к основным наиболее изученным семействам, продемонстрировал, что для культивируемых клеток МК существует положительная корреляция между активностью гена PRAME и величиной SlopeMigr и обратная корреляция между экспрессией гена PASD1 и SlopeInv. Для клеток СМТ и ОС была обнаружена взаимосвязь между интенсивностью экспрессии SSX1 и SlopeInv. Эти данные согласуются с имеющим место представлением о способности малигнизированных клеток реализовать программы функционирования аномально экспрессируемых генов для формирования инвазивного фенотипа. В частности, показано, что такие раково-тестикулярные гены, как SPANX-A/C/D и CTAG2, регулируют различные аспекты инвазивного поведения клеток рака молочной железы [30]. D. Wang et al. обнару- жили, что активация гена MAGEA1 ассоциирована с пролиферацией, миграцией и метастазированием клеток МК [31]. Недавние исследования продемонстрировали, что в 90 % синовиальных сарком функционируют слитые гены SS18-SSX1/ SSX2, продукты которых участвуют в регуляции клеточного роста и пролиферации, ремоделировании хроматина, способствуя онкогенезу [32]. Z.S. Xu et al. показали, что сверхэкспрессия PASD1 активировала транскрипционный фактор STAT3, регуляция функционирования которого тесно связана с такими физиологическими процессами, как пролиферация клеток, выживание и дифференцировка, и потенцировала IL-6-индуцированную активацию STAT3, тогда как нокдаун по PASD1 давал противоположный эффект [33]. G. Al-Khadairi et al. обнаружили, что PRAME индуцирует миграцию и инвазию клеток трижды негативного рака молочной железы через изменение экспрессии основных маркеров эпителиально-мезенхимального перехода E-кадгерина, N-кадгерина, виментина и ZEB1 [34].
Список литературы Сравнительный анализ миграционной активности и инвазивного потенциала культивируемых клеток солидных опухолей человека
- Sonnemann K.J., Bement WM. Wound repair: toward understanding and integration of single-cell and multicellular wound responses. Annu Rev Cell Dev Biol. 2011; 27: 237-63. doi: 10.1146/annurev-cellbio-092910-154251.
- FriedlP. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 2004 Feb; 16(1): 14-23. doi: 10.1016/j. ceb.2003.11.001.
- Te Boekhorst V., Friedl P. Plasticity of Cancer Cell Invasion-Mechanisms and Implications for Therapy. Adv Cancer Res. 2016; 132: 209-64. doi: 10.1016/bs.acr.2016.07.005.
- Friedl P., Wolf K. Plasticity of cell migration: a multiscale tuning model. J Cell Biol. 2010 Jan 11; 188(1): 11-9. doi: 10.1083/ jcb.200909003.
- YilmazM., Christofori G. Mechanisms of motility in metastasizing cells. Mol Cancer Res. 2010 May; 8(5): 629-42. doi: 10.1158/1541-7786. MCR-10-0139.
- FreshneyR.I. Culture of animal cells: a manual of basic technique and specialized applications. 6th ed. John Wiley & Sons. 2010. 732p.
- DanilovA.O., Larin S.S., DanilovaA.B, Moiseenko V.M., BalduyevaIA., Kiselev S.L., Tourkevich YE.A., Bartchuk A.S., Anisimov V.V., Gaftov G.I., Kochnev V.A., Hanson K.P. An improved procedure for autologous gene-modified vaccine preparation for active specific immunotherapy of disseminated solid tumors. Problems in Oncology. 2004; 50(2): 219-227.
- Moutasim K.A., Nystrom M.L., Thomas G.J. Cell migration and invasion assays. Methods Mol Biol. 2011; 731: 333-343. doi: 10.1007/9781-61779-080-5 27.
- Александрова А.Ю. Механизмы миграции культивируемых клеток. Методы культивирования клеток. СПб., 2008. С. 40-55. [AlexandrovaA.Yu. The mechanisms of propagation of cultured cells. Cell cultivation methods. Saint-Peterburg, 2008. P. 40-55. (in Russian)].
- Danilova A., Misyurin V., Novik A., Girdyuk D., Avdonkina N., Nekhaeva T., Emelyanova N., Pipia N., Misyurin A., Baldueva I. Cancer/ testis antigens expression during cultivation of melanoma and sofft tissue sarcoma cells. Clin Sarcoma Res. 2020 Feb 4; 10: 3. doi: 10.1186/ s13569-020-0125-2.
- Basic Local Alignment Search Tool [Internet]. URL: https://blast. ncbi.nlm.nih.gov/Blast.cgi (cited 11.02.2020).
- Everitt B.S., Pickles A. Statistical Aspects of the Design and Analysis of Clinical Trials. London. Imperial College Press, 2004. 322.
- Odenthal J., Takes R., Friedl P. Plasticity of tumor cell invasion: governance by growth factors and cytokines. Carcinogenesis. 2016 Dec; 37(12): 1117-1128. doi: 10.1093/carcin/bgw098.
- 14.LewisD.M., ParkK.M., Tang V., Xu Y., PakK., Eisinger-Mathason T.S., Simon M.C., Gerecht S. Intratumoral oxygen gradients mediate sarcoma cell invasion. Proc Natl Acad Sci USA. 2016 Aug 16; 113(33): 9292-7. doi: 10.1073/pnas.1605317113.
- Roussos E.T., Condeelis J.S., Patsialou A. Chemotaxis in cancer. Nat Rev Cancer. 2011 Jul 22; 11(8): 573-87. doi: 10.1038/nrc3078.
- Kühnelt-LeddihnL., MüllerH., EisendleK., ZelgerB., Weinlich G. Overexpression of the chemokine receptors CXCR4, CCR7, CCR9, and CCR10 in human primary cutaneous melanoma: a potential prognostic value for CCR7 and CCR10? Arch Dermatol Res. 2012 Apr; 304(3): 185-93. doi: 10.1007/s00403-012-1222-8.
- Abraham V., Cao G., ParambathA., LawalF., Handumrongkul C., Debs R, DeLisser H.M. Involvement of TIMP-1 in PECAM-1-mediated tumor dissemination. Int J Oncol. 2018; 53(2): 488-502. doi: 10.3892/ ijo.2018.4422.
- Пита Н.П., Балдуева И.А., Данилова А.Б., Авдонкина Н.А., Новик А.В., Нехаева Т.Л., Гафтон Г.И., Емельянова Н.В. Иммуносу-прессивный потенциал периферических регуляторных Т-лимфоцитов в процессе опухолевой прогрессии у больных метастатическими саркомами мягких тканей. Вопросы онкологии. 2018; 64(3): 400-407. [Pipia N.P., Baldueva I.A., Danilova A.B., Avdonkina N.A., Novik A.V., Nekhaeva T.L., Gafton G.I., Emelyanova N.V. Immunosuppressive potential of peripheral regulatory T-lymphocytes in the process of tumor progression in patients with metastatic soft tissue sarcomas. Problems in Oncology. 2018; 64(3): 400-407. (in Russain)].
- Albonici L, Giganti M.G., Modesti A., Manzari V., Bei R. Mul-tifaceted Role of the Placental Growth Factor (PlGF) in the Antitumor Immune Response and Cancer Progression. Int J Mol Sci. 2019 Jun 18; 20(12): 2970. doi: 10.3390/ijms20122970.
- SongN., LiuH., MaX., Zhang S. Placental Growth Factor Promotes Ovarian Cancer Cell Invasion via ZEB2. Cell Physiol Biochem. 2016; 38(1): 351-8. doi: 10.1159/000438635.
- Shen Y., Ruan L., Lian C., Li R., Tu Z., Liu H. Discovery of HB-EGF binding peptides and their functional characterization in ovarian cancer cell lines. Cell Death Discov. 2019 Mar 25; 5: 82. doi: 10.1038/ s41420-019-0163-9.
- Yagi H., Yotsumoto F., Miyamoto S. Heparin-binding epidermal growth factor-like growth factor promotes transcoelomic metastasis in ovarian cancer through epithelial-mesenchymal transition. Mol Cancer Ther. 2008 Oct; 7(10): 3441-51. doi: 10.1158/1535-7163.MCT-08-0417.
- Seachrist D.D., Sizemore S.T., Johnson E., Abdul-Karim F.W., Weber Bonk K.L., Keri R.A. Follistatin is a metastasis suppressor in a mouse model of HER2-positive breast cancer. Breast Cancer Res. 2017 Jun 5; 19(1): 66. doi: 10.1186/s13058-017-0857-y.
- Kudo-Saito C. FSTL1 promotes bone metastasis by causing immune dysfunction. Oncoimmunology. 2013; 2(11): e26528. doi: 10.4161/ onci.26528.
- Kudo-Saito C., Fuwa T., Murakami K., Kawakami Y. Targeting FSTL1 prevents tumor bone metastasis and consequent immune dysfunction. Cancer Res. 2013 Oct 15; 73(20): 6185-93. doi: 10.1158/0008-5472. CAN-13-1364.
- Sepporta M.V., Tumminello F.M., Flandina C., Crescimanno M., GiammancoM., La GuardiaM., di MajoD., Leto G. Follistatin as potential therapeutic target in prostate cancer. Target Oncol. 2013 Dec; 8(4): 215-23. doi: 10.1007/s11523-013-0268-7.
- Vazquez-Mellado M.J., Monjaras-Embriz V., Rocha-Zavaleta L. Erythropoietin, Stem Cell Factor, and Cancer Cell Migration. Vitam Horm. 2017; 105: 273-296. doi: 10.1016/bs.vh.2017.02.008.
- Zhang M., Ma Q., Hu H., Zhang D., Li J., Ma G., Bhat K., Wu E. Stem cell factor/c-kit signaling enhances invasion of pancreatic cancer cells via HIF-1a under normoxic condition. Cancer Lett. 2011 Apr 28; 303(2): 108-17. doi: 10.1016/j.canlet.2011.01.017.
- Gao C., Li S., Zhao T., Chen J., Ren H., Zhang H., Wang X., Lang M., Liu J., Gao S., ZhaoX., Sheng J., Yuan Z., Hao J. SCF, regulated by HIF-1a, promotes pancreatic ductal adenocarcinoma cell progression. PLoS One. 2015 Mar 23; 10(3): e0121338. doi: 10.1371/journal. pone.0121338.
- Maine E.A., Westcott J.M., PrechtlAM., Dang T.T., Whitehurst A.W., Pearson G.W. The cancer-testis antigens SPANX-A/C/D and CTAG2 promote breast cancer invasion. Oncotarget. 2016 Mar 22; 7(12): 14708-26. doi: 10.18632/oncotarget.7408.
- Wang D., Wang J., Ding N., Li Y., Yang Y., Fang X., Zhao H. MAGE-A1 promotes melanoma proliferation and migration through C-JUN activation. Biochem Biophys Res Commun. 2016 May 13; 473(4): 959-965. doi: 10.1016/j.bbrc.2016.03.161.
- Przybyl J., Jurkowska M., Rutkowski P., Debiec-Rychter M., Siedlecki J.A. Downstream and intermediate interactions of synovial sarcoma-associated fusion oncoproteins and their implication for targeted therapy. Sarcoma. 2012; 2012: 249219. doi: 10.1155/2012/24921.
- Xu Z.S., Zhang H.X., Zhang Y.L., Liu T.T., Ran Y., Chen L.T., Wang Y.Y., Shu H.B. PASD1 promotes STAT3 activity and tumor growth by inhibiting TC45-mediated dephosphorylation of STAT3 in the nucleus. J Mol Cell Biol. 2016 Jun; 8(3): 221-31. doi: 10.1093/jmcb/mjw005.
- Al-Khadairi G., Naik A., Thomas R., Al-Sulaiti B., Rizly S., De-cock J. PRAME promotes epithelial-to-mesenchymal transition in triple negative breast cancer. J Transl Med. 2019 Jan 3; 17(1): 9. doi: 10.1186/ s12967-018-1757-3.


