Сравнительный анализ отдаленных результатов эндоваскулярной реваскуляризации при острой ишемии конечности у пациентов в острой стадии новой коронавирусной инфекции COVID-19 и без нее
Автор: Никольский А.В., Кравчук В.Н., Трофимов Н.А., Ермаков В.С., Федоровцев В.А., Волков Д.В., Шарабрин Е.Г., Васильченко Е.Е., Баженова К.И.
Журнал: Московский хирургический журнал @mossj
Рубрика: Сердечно-сосудистая хирургия
Статья в выпуске: 4 (90), 2024 года.
Бесплатный доступ
Введение. Эндоваскулярная реваскуляризация в сочетании с катетеруправляемым селективным тромболизисом является методом выбора при лечения острой ишемии конечности. Целью данного исследования было сравнение отдаленных результатов эндоваскулярных вмешательств с применением селективного катетеруправляемого тромболизиса при ОИК у пациентов в острой стадии новой коронавирусной инфекции COVID-19 и без нее.Материалы и методы. В исследование были включены 121 пациент с ОИК, которым выполнялась эндоваскулярная реваскуляризация с селективным катетруправляемым тромболизисом тканевым активатором плазминогена альтеплазой. Группа исследования (n=71) - пациенты, оперированные в острой стадии новой коронавирусной инфекции COVID-19, контрольная группа (n=50) - без инфекции. Проходимость реконструированных артерий оценивалась через 6 и 12 месяцев после операции с помощью УЗДГ и КТ-ангиографии.Результаты. Анализ проходимости реконструированных артериальных сегментов показал более высокие показатели в группе COVID-19 как через 6 месяцев (80,0 % против 73,7 %, p≤0,598), так и через 12 месяцев после вмешательства (70,6 % против 63,8 %, p≤0,621). Хотя различия не достигли статистической значимости, наблюдалась тенденция к лучшим результатам в группе COVID-19. Частота поздних ретромбозов составила 32,8 % в общей группе эндоваскулярного лечения, при этом распределение между группами было следующим: 10 пациентов в группе COVID-19 и 13 пациентов в контрольной группе (p≤0,156).Заключение. Настоящее исследование демонстрирует сопоставимую частоту неблагоприятных исходов эндоваскулярных вмешательств при ОИК в отдаленном периоде как у пациентов с инфекцией COVID-19, так и без нее. При этом частота поздних ретромбозов и рецидивов ОИК у пациентов группы контроля была несколько выше (13,9 % против 5,8 %), а прогноз течения рецидива ОИК в контрольной группе был хуже.
Covid-19, острая ишемия нижних конечностей, реваскуляризация, эндоваскулярные вмешательства, отдаленные результаты
Короткий адрес: https://sciup.org/142243831
IDR: 142243831 | УДК: 616.13-004.6-089-06:578.834.1 | DOI: 10.17238/2072-3180-2024-4-97-105
Текст научной статьи Сравнительный анализ отдаленных результатов эндоваскулярной реваскуляризации при острой ишемии конечности у пациентов в острой стадии новой коронавирусной инфекции COVID-19 и без нее
Острая ишемия конечностей (ОИК) остается одной из наиболее сложных проблем в сосудистой хирургии, характеризующейся высокими показателями инвалидизации и летальности [1]. Появление новой коронавирусной инфекции COVID-19 значительно усложнило данную клиническую ситуацию, поскольку вирус ассоциирован с повышенным риском артериального тромбоза через множество патофизиологических механизмов, включая эндотелиальную дисфункцию, гиперкоагуляцию и системный воспалительный ответ [2–5]. По данным литературы, частота артериальных тромботических осложнений у пациентов с COVID-19 составляет от 2 % до 5 %, при этом тромбоз артерий нижних конечностей является одним из наиболее частых проявлений [6–11].
Эндоваскулярные вмешательства в сочетании с катетеру-правляемым тромболизисом тканевым активатором плазминогена являются методом выбора в лечении ОИК, предлагая ряд преимуществ перед традиционными открытыми хирургическими подходами, включая меньшую травматичность, более низкую частоту периоперационных осложнений и более быстрое восстановление. Однако оптимальная стратегия лечения пациентов с ОИК на фоне COVID-19 остается предметом дискуссий, особенно учитывая сложное взаимодействие между вирусной инфекцией, системным воспалением и тромбозом. Существующие исследования демонстрируют противоречивые результаты эндоваскулярных вмешательств у пациентов с COVID-19 и ОИК, особенно в отношении долгосрочных исходов [12].
Несмотря на растущее количество публикаций, посвященных тромботическим осложнениям COVID-19 и их лечению, сохраняется значительный пробел в знаниях относительно отдаленных результатов эндоваскулярных вмешательств у данной группы пациентов [13]. Большинство существующих исследований ограничены небольшими размерами выборки, короткими периодами наблюдения и гетерогенными подходами к лечению.
Целью настоящего исследования было сравнение отдаленных результатов эндоваскулярных вмешательств с применением селективного катетеруправляемого тромболизиса при ОИК у пациентов в острой стадии новой коронавирусной инфекции COVID-19 и без нее. В задачи работы входила оценка проходимости реконструированных артериальных сегментов, частоты рецидивов острой ишемии и развития хронической артериальной недостаточности в период до 12 месяцев после реваскуляризации.
Материалы и методы
В исследование был включен 121 пациент с острой ишемией нижних конечностей IIA–IIB класса по Резерфорду, госпитализированный с 1 января 2018 г. по 20 июня 2023 г. в ГБУЗ НО «Городская клиническая больница № 5 Нижегородского района г. Нижнего Новгорода» перепрофилированной в специализированный хирургический Ковид-госпиталь с 14.04.2020 года по 20.06.2023, и на базе БУ «Республиканский кардиологический диспансер» г. Чебоксары, так же, перепрофилированного в Ко-вид-госпиталь со специализированной сердечно-сосудистой хирургической помощью с 1.01.2021 г по 1.03.2022 г. Все пациенты были разделены на две группы: I (n=50) — контрольная, без коронавирусной инфекции COVID-19 и II (n=71) группа — с подтвержденным диагнозом COVID-19 в острой стадии.
В качестве метода реваскуляризации в I и II группах выполнялись эндоваскулярные вмешательства: проводниковая реканализация и баллонная ангиопластика артерий в сочетании с селективным катетеруправляемым тромболизисом тканевым активатором плазминогена альтеплазой.
В послеоперационном периоде в течении 12 месяцев все пациенты получали рекомендованную антитромботическую терапию.
Оценка проходимости реконструированных артериальных сегментов проводилась через 6 и 12 месяцев после вмешательства с помощью ультразвукового дуплексного сканирования (УЗДГ) и мультиспиральной компьютерно-томографической ангиографии (МСКТ-АГ). Первичными конечными точками были частота ретромбозов оперированной артерии и рецидивов острой ишемии. В качестве вторичных исходов оценивались частота развития хронической артериальной недостаточности IIБ стадии и потребность в повторных реваскуляризациях.
Статистическую обработку данных проводили с использованием программной среды «R». Количественные показатели представлены в виде медианных и межквартильного интервала (Ме [25 %; 75 %]), качественные — в виде абсолютных и относительных частот. Для сравнения групп применяли U-критерий Манна-Уитни и точный тест Фишера. Различия считали статистически значимыми при p<0,05.
Результаты
В ходе анализа данных 121 пациент с ОИК были получены следующие результаты. Медианы возраста в группах контроля и исследования составили 72 [60; 80] лет и 66 [59;72] лет соответственно и достоверно не различались (р < 0.058). Распределение пациентов по полу: 66,0 % мужчин в группе контроля и 59,1 % – в группе исследования соответственно.
Больные обеих групп были сопоставимы по характеру основного заболевания: локализации острого тромбоза, характеру ОИК и классу ОИК (по Резерфорду).
Локализация острого артериального тромбоза у пациентов обеих групп достоверно не отличалась, чаще всего вмешательства выполнялись по поводу поражения артерий нижних конечностей (табл. 1).
Степень проявления клинического течения основного заболевания – ОИК в обеих группах была сопоставима. Пациенты группы исследования чаще поступали в стационар уже со II B классом ОИК по Резерфорду (рис. 1).
Таблица 1
Распределение больных по локализации ОИК в группах
Table 1
Distribution of patients by ALI localization in groups
|
Локализация тромбоза/ Localization of thrombosis |
I группа (контроль)/ Group I (control) n=50 |
II группа (исследование)/ Group II (study) n=71 |
|
Ишемия нижних конечностей/ Lower limb ischemia |
41 (82 %) |
45 (63,3 %) |
|
Подвздошно-бедренный сегмент/ Iliac-femoral segment |
5 (10 %) |
8 (11,2 %) |
|
Бедренно-подколенный/ Femoropopliteal |
16 (32 %) |
18 (25,3 %) |
|
Берцовые артерии/ Tibial arteries |
20 (40 %) |
19 (26,7 %) |
|
Ишемия верхних конечностей/ Upper limb ischemia |
9 (18 %) |
26 (36,6 %) |
|
Плечевая артерия/ Brachial artery |
5 (10 %) |
14 (19,7 %) |
|
Локтевая и лучевая артерии/ Ulnar and radial arteries |
4 (8 %) |
12 (16,9 %) |
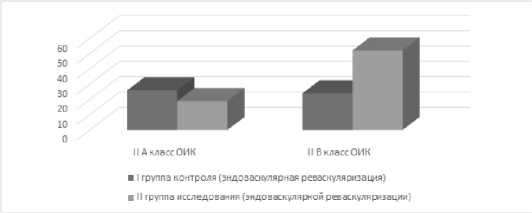
Рис. 1. Распределение больных в группах эндоваскулярной реваскуляризации по клиническому течению острой ишемии конечностей на момент оперативного лечения (класс ОИК по Резерфорду)
Fig. 1. Distribution of patients in endovascular revascularization groups according to the clinical course of acute limb ischemia at the time of surgical treatment (class of DEC according to Rutherford)
Причиной развития ОИК в группе исследования являлись в большей степени тромбозы артерий поливалентной этиологии, тромбоэмболии и атеросклеротическое поражение артерий встречалось в меньшей степени (рис. 2).
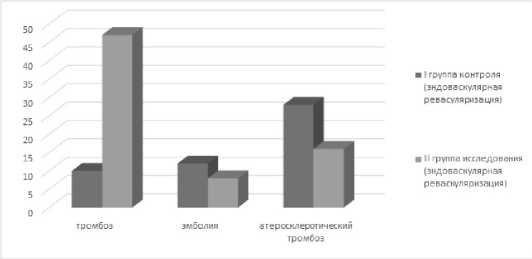
Рис. 2. Распределение больных в группах эндоваскулярной реваскуляризации по генезу развития ОИК
Fig. 2. Distribution of patients in endovascular revascularization groups according to the genesis of the development of DEC
При оценке коморбидного фона пациентов контрольной и исследуемой групп, были изучены: ИБС, наличие ДН, СД, ХБП, ФП (табл. 2).
Пациенты исследуемой группы имели ИБС в анамнезе в 52 %, в контрольной группе ИБС встречалась с частотой 68 % p < 0,326). Фибрилляция предсердий была в анамнезе у 29 % пациентов группы исследования и у 30% – пациентов контрольной группы p < 0,208). Встречаемость СД в группах была сопоставима: 35 % и 42 % соответственно. В сравниваемых группах пациентов равномерно встречались больные с ХБП (табл. 2).
Таблица 2
Характеристика коморбидного фона пациентов групп эндоваскулярной реваскуляризации
Table 2
Characteristics of comorbid background in patients undergoing endovascular revascularization
|
Показатель/ Parameter |
I группа (контроль)/ Group I (control) n=50 |
II группа (исследование)/ Group II (study) n=71 |
р |
|
ИБС/ CAD |
68 % |
52 % |
< 0,326 |
|
СД/ DM |
42 % |
35 % |
< 0,562 |
|
ДН по различным причинам/ RD from various causes |
8 % |
66 % |
< 0,002 |
|
ХБП/ CKD |
18 % |
21 % |
< 0,134 |
|
ФП/ AF |
30 % |
29 % |
< 0,208 |
Группы были сопоставимы по основным демографическим и клиническим характеристикам, за исключением более высокой частоты дыхательной недостаточности у пациентов с COVID-19 (66 % против 8 %, p < 0,002).
Медиана времени от начала симптомов ОИК до реваскуляризации составила 30 [8; 36] часов без значимых различий между группами (p<0,266).
Непосредственный технический успех вмешательства был достигнут у 95,0 % в группе эндоваскулярного лечения (p=0,021).
Отдаленные результаты прослежены у 77 % выписанных пациентов (70 больных), медиана наблюдения составила 12 [6; 12] месяцев. Общая проходимость реконструированных артериальных сегментов после эндоваскулярных операций через 6 и 12 месяцев была выше в группе исследования: 70,6 % против 63,8 % (p=0,621) соответственно (табл. 3).
Таблица 3
Проходимость реконструированных артерий в отдаленном периоде
Table 3
Patency of reconstructed arteries in the long-term period
|
Период/ Period |
Эндоваскулярные операции, группа I/ Endovascular operations, group I % (n/N) |
Эндоваскулярные операции, группа II/ Endovascular operations, group II % (n/N) |
p |
|
6 мес./ 6 months |
73,7 (28/38) |
80,0 (32/40) |
0,598 |
|
12 мес./ 12 months |
63,8 (23/36) |
70,6 (24/34) |
0,621 |
В ходе обследования было выявлено, что ретромбоз оперированной артерии развился у 21 больного: через 12 месяцев у 10 пациентов группы исследования (34–24=10) и у 13 пациентов контрольной группы (36–23=13), достоверно не различаясь между группами (p=0,156).
У пациентов, оперированных в острой стадии новой коронавирусной инфекции рецидив ОИК наблюдался реже в сравнении с пациентами, оперированными без COVID-19 в анамнезе: 5,8 % против 8,3 %, (p=0,716).
Трое пациентов контрольной группы были госпитализированы экстренно с рецидивом клиники ОИК на фоне ретромбоза артерий оперированного сосудистого бассейна. Нарушение режима антитромботической терапии в качестве причины ретромбоза было выявлено у двух из них, им было выполнено оперативное вмешательство: бедренно-подколенное шунтирование и тромбоэмболэктомия из поверхностной бедренной артерии с удовлетворительным результатом. У одного пациента после оперативного лечения прогрессировали явления ОИК, ему была выполнена ампутация конечности. У четырех паци- ентов ретромбоз артерий носил асимптомный характер и был выявлен при плановом контрольном УЗДГ ТС исследовании. Еще у пяти пациентов контрольной группы манифестировали явления ХАН 2Б стадии, после перенесенной ОИК, двое больных были пролечены консервативно, трем пациентам было выполнено плановое оперативное вмешательство: эндоваскулярная реваскуляризация у двух пациентов с окклюзией берцовых артерий и бедренно-подколенное шунтирование аутовеной у одного пациента. Все три оперированных пациента были выписаны с положительной клинической динамикой на фоне восстановления кровотока.
В группе исследования нарушение режима антитромбо-тической терапии имело место у трех пациентов, двое из них были госпитализированы с клиникой ОИК. Одному пациенту была выполнена открытая реваскуляризация — тромбэктомия из подколенной артерии с удовлетворительным результатом, еще одному пациенту – эндоваскулярная реваскуляризация КБА берцовых артерий. Двум пациентам с клиникой ХАН 2А стадии была назначена консервативная терапия. У шести пациентов группы эндоваскулярной реваскуляризации при контрольном УЗДГ ТС обследовании были выявлены асимптомные ретромбозы периферических артерий оперированного артериального бассейна, больным была предложено консервативное лечение. Частота возврата ОИК была выше в группе контроля 8,3 % (3 пациентов) и имела более тяжелое течение — одному пациенту потребовалось выполнение ампутации. В группе исследования рецидив ОИК случался реже, лишь у 5,8 % (2 пациента), однако, частота асимптомных ретромбозов в группе исследования была выше относительно контрольной: 17,6 % (6 пациентов) и 11,1 % (4 пациента) соответственно (рис. 3).
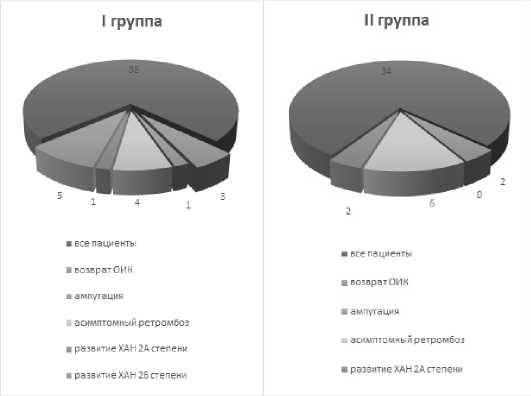
Рис. 3. Поздние осложнения в группах эндоваскулярной реваскуляризации
Fig. 3. Late complications in endovascular revascularization groups
Клиника хронической артериальной недостаточности 2 Б стадии (классификация А.В. Покровского) манифестировала в 13,9 % случаев после эндоваскулярной реваскуляризации в контрольной группе у пациентов без коронавирусной инфекции в анамнезе, в то время как у пациентов после эндоваскулярной реваскуляризации с управляемым селективным катетерным тромболизисом на фоне острой инфекции COVID-19 хроническая ишемия протекала клинически легче на уровне 2А стадии и встречалась значимо реже, лишь у 5,8 % больных (p=0,042).
Повторные реваскуляризации в отдаленном периоде потребовались 10 % пациентов, чаще оперативное лечение выполнялось у пациентов после эндоваскулярной реваскуляризации без коронавирусной инфекцию в анамнезе – 13,8 %.
Эндоваскулярный подход в сочетании с селективным кате-теруправляемым тромболизисом тканевым активатором плазминогена — альтеплазой, в нашей работе продемонстрировал сопоставимые результаты в аспекте отдаленной проходимости и частоты рецидивов ишемии конечности как у пациентов, перенесших коронавирусную инфекцию, так и без нее.
Изучение динамики функционального статуса конечности в сроки 6 и 12 месяцев после операции показало более быстрое его восстановление в группе пациентов оперированных на фоне острой стадии COVID-19. Так, через 6 месяцев после вмешательства большинство пациентов группы исследования не имели симптомов тяжелой ишемии конечности или отмечали минимальную перемежающуюся хромоту. В то же время, в контрольной группе, до 18% пациентов страдали от проявлений ХАН, у 10 % пациентов имела место ишемия конечности 2 степени. Различия между группами сохранялись через 12 месяцев наблюдения, однако отмечалась тенденция к росту числа бессимптомных тромбозов среди пациентов группы исследования (табл. 4).
Анализ актуальных литературных источников демонстрирует противоречивые результаты отдаленного периода после эндоваскулярных вмешательств по поводу ОИК, еще меньше данных опубликовано относительно послеоперационного периода ОИК в острой стадии коронавирусной инфекции [13–16]. В нашем исследовании эндоваскулярный подход в сочетании с селективным управляемым катетерным тромболизисом показал сопоставимые результаты в группах по таким показателям, как частота ретромбозов и функциональный статус конечности в отдаленно послеоперационном периоде.
Лимитирующими факторами настоящего исследования являются его ретроспективный характер и относительно небольшой объем выборки.
Заключение
Проведенное исследование, включавшее 121 пациента с острой ишемией конечностей (группа COVID-19, n=71; контрольная группа, n=50), продемонстрировало эффективность эндоваскулярной реваскуляризации с селективным катетеруправляемым тромболизисом в обеих группах пациентов. Отдаленные результаты прослежены у 77 % выписанных пациентов (70 больных)
с медианой наблюдения 12 [6; 12] месяцев. Анализ проходимости реконструированных артериальных сегментов показал более высокие показатели в группе COVID-19 как через 6 месяцев (80,0 % против 73,7 %, p≤0,598), так и через 12 месяцев после вмешательства (70,6 % против 63,8 %, p≤0,621). Хотя различия не достигли статистической значимости, наблюдалась тенденция к лучшим результатам в группе COVID-19. Частота поздних ретромбозов составила 32,8 % в общей группе эндоваскулярного лечения, при этом распределение между группами было следующим: 10 пациентов в группе COVID-19 и 13 пациентов в контрольной группе (p≤0,156). Рецидив ОИК наблюдался реже у пациентов с COVID-19 (5,8 % против 8,3 %, p<0,066).
Таблица 4
Динамика функционального статуса (включая классификацию А.В. Покровского) после эндоваскулярной реваскуляризации
Table 4
Dynamics of functional status (including A.V. Pokrovsky classification) after endovascular revascularization
|
Стадии ишемии/ Stages of ischemia |
Эндоваскулярные операции, группа I % (n/N)/ Endovascular operations, group I % (n/N) |
Эндоваскулярные операции, группа II % (n/N)/ Endovascular operations, group II % (n/N) |
p* |
||
|
6 месяцев/ 6 months |
12 месяцев/ 12 months |
6 месяцев/ 6 months |
12 месяцев/ 12 months |
||
|
Нет/ none |
73,6 (28/38) |
63,8 (23/36) |
80,0 (32/40) |
70,6 (24/34) |
<0,598 |
|
1 |
7,8 (3/38) |
11,1 (4/36) |
10,0 (4/40) |
17,6 (6/34) |
<0,412 |
|
2А |
0,0 (0/38) |
2,7 (1/36) |
5,0 (2/40) |
5,8 (2/34) |
<0,055 |
|
2Б/ 2B |
10,5 (4/38) |
13,9 (5/36) |
0,0 (0/40) |
0,0 (0/34) |
<0,012 |
|
3–4 |
0,0 (0/38) |
0,0 (0/36) |
0,0 (0/40) |
0,0 (0/34) |
=1,000 |
|
ОИК/ ALI |
7,8 (3/38) |
8,3 (3/36) |
5,0 (2/40) |
5,8 (2/34) |
<0,066 |
*p — для сравнения исходных значений между группами (критерий χ2)
Различия выявлены в отношении развития хронической артериальной недостаточности. В контрольной группе у 13,9 % пациентов развилась клинически значимая хроническая ише- мия 2Б стадии по классификации А.В. Покровского, тогда как в группе COVID-19 преобладали малосимптомные формы 1 и 2А стадии (p=0,042). Повторные реваскуляризации потребовались 10 % пациентов, чаще в контрольной группе — 13,8%, относительно 5,8 % в группе исследования (p=0,058). Динамическое наблюдение выявило более благоприятное течение послеоперационного периода в группе COVID-19: через 6 месяцев после вмешательства 80,0 % пациентов не имели симптомов ишемии или отмечали минимальную перемежающуюся хромоту, в то время как в контрольной группе до 18% пациентов страдали от проявлений ХАН, у 10 % имела место ХАН 2 стадии.
Полученные результаты свидетельствуют о том, что эндоваскулярная реваскуляризация с селективным катетеру-правляемым тромболизисом является эффективным методом лечения ОИК как у пациентов с COVID-19, так и без него. При этом отмечено ослабление негативного влияния COVID-19 на отдаленные результаты лечения. Данный факт может быть связан с особенностями патогенеза тромбообразования при COVID-19 и более активной антикоагулянтной терапией в послеоперационном периоде у этой группы пациентов.
Список литературы Сравнительный анализ отдаленных результатов эндоваскулярной реваскуляризации при острой ишемии конечности у пациентов в острой стадии новой коронавирусной инфекции COVID-19 и без нее
- Семьин И.С., Иваненко А.Н., Жарова А.С., Пятков В.А., Бахтин И.Л., Соболев Г.А., Киселев А.Д., Коротких А.В., Казанцев А.Н., Черных К.П. Эндоваскулярная стентовая тромбэктомия у пациентов с оcтрым тромбозом артерий нижних конечностей на фоне COVID-19. Журнал им. Н.В. Склифосовского «Неотложная медицинская помощь», 2023. № 12. С. 161-169.
- Никольский А.В., Кравчук В.Н., Мухин А.С., Трофимов Н.А., Ермаков В.С., Волков Д.В., Никольский В.О., Жидков И.М., Баранова Д.Г.. Эффективность открытой и эндоваскулярной реваскуляризации при лечении острой ишемии конечности у пациентов в острой стадии COVID-19. Грудная и сердечно-сосудистая хирургия, 2024. № 4. С. 539-547.
- Bozzani A., Arici V., Tavazzi G. Acute Thrombosis of Lower Limbs Arteries in the Acute Phase and After Recovery From COVID-19. Ann Surg, 2021, № 273, pp. 159-160. https://doi.org/10.1097/SLA.0000000000004700
- Никольский А.В., Волков Д.В., Федоровцев В.А., Косоногов А.Я., Трофимов Н.А., Косоногов К.А., Пенкнович А.А., Десятникова И.Б., Гаркавцев А.В., Рыбинский А.Д., Ярыгин В.В., Гусев С.В., Трухин К.В. Лечение острых артериальных тромбозов у пациентов с тяжелым течением новой коронавирусной инфекции. Кардиология и сердечно-сосудистая хирургия, 2022. № 15. С. 13-18.
- Indes J.E., Koleilat I., Hatch A.N., Choinski K., Jones D.B., Aldailami H., Billett H., Denesopolis J., Lipsitz E.C. Early experience with arterial thromboembolic complications in patients with COVID-19. J Vasc Surg, 2021, № 73, рр. 381-389.
- Björck M., Earnshaw J.J., Acosta S., Bastos Gonçalves F., Cochennec F., Debus E.S. et al. Editor’s Choice - European Society for Vascular Surgery (ESVS) 2020 Clinical Practice Guidelines on the Management of Acute Limb Ischaemia. Eur. J. Vasc. Endovasc. Sur, 2020, № 59, pp. 173-218. https://doi.org/10.1016/j.ejvs.2019.09.006
- Al-Zoubi N., Shatnawi N., Jarbo H., Khader Y., Alzoubi H. Acute Limb Ischemia in Patients Infected with SARS-CoV-2. Vasc Endovascular Surg, 2022, № 56, рр. 90-95.
- Davis F.M, Albright J., Gallagher K.A., Gurm H.S., Koenig G.C., Schreiber T. Early Outcomes following Endovascular, Open Surgical, and Hybrid Revascularization for Lower Extremity Acute Limb Ischemia. Ann. Vasc. Surg. 2018, № 51, pp. 106-112. https://doi.org/10.1016/j.avsg.2017.12.025
- Gąsecka A., Borovac J.A., Guerreiro R.A., Giustozzi M., Parker W., Caldeira D., Chiva-Blanch G. Thrombotic Complications in Patients with COVID-19: Pathophysiological Mechanisms, Diagnosis, and Treatment. Cardiovasc Drugs Ther, 2021, № 35, рр. 215-229.
- Goldman I.A., Ye K., Scheinfeld M.H. Lower-extremity Arterial Thrombosis Associated with COVID-19 Is Characterized by Greater Thrombus Burden and Increased Rate of Amputation and Death. Radiology, 2020, № 297, рр. E263-E269.
- Nishiga M., Wang D. W., Han Y. et al. COVID-19 and cardiovascular disease: from basic mechanisms to clinical perspectives. Nat. Rev. Cardiol, 2020, № 17, pp. 543-558.
- Ilonzo N., Judelson D., Al-Jundi W. et al. A review of acute limb ischemia in COVID-positive patients. Semin Vasc Surg, 2021, № 34, pp. 8-12. https://doi.org/10.1053/j.semvascsurg.2021.04.004
- Madani M.H., Leung A.N.C., Becker H.C., Aorto-iliac/right leg arterial thrombosis necessitating limb amputation, pulmonary arterial, intracardiac, and ilio-caval venous thrombosis in a 40-year-old with COVID-19. Clin Imaging, 2021, № 75, pp. 1-4. https://doi.org/101016/j.clinimag.2020.12.036
- Stoklasa K., Sieber S., Naher S. Patients with Acute Limb Ischemia Might Benefit from Endovascular Therapy-A 17-Year Retrospective Single-Center Series of 985 Patients. J Clin Med, 2023, № 12, pp. 54-62.
- Herzig M., Kennedy K., Hawkins B. et al. Contemporary Practice Patterns and Outcomes of Endovascular Revascularization of Acute Limb Ischemia. J Am Coll Cardiol Intv, 2024, № 17, pp. 2379-2390.
- Muhammad K., Tantawy T.G., Makar R.R., Olojugba O. Successful Catheter-directed thrombolysis for acute lower limb ischemia secondary to COVID-19 infection. Annals of Vascular Surgery, 2020, № 1, pp. 12-15. https://doi.org/10.1016/j.avsg.2020.09.044


