Сравнительный анализ респираторных реакций на микроинъекции L-глутамата в различные структурно-функциональные отделы вестибулярного ядерного комплекса мозга новорожденных крыс in vitro
Автор: Глазкова Елена Николаевна, Тюрин Николай Леонидович, Широлапов Игорь Викторович, Татарников Валерий Станиславович, Пятин Василий Фдорович
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Физиология
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
Исследовали роль различных структурно-функциональных отделов вестибулярного комплекса ядер в реализации респираторных реакций в изолированных понтобульбоспинальных препаратах новорожденных крыс in vitro. Установлено, что глутаматергическая система вестибулярного ядерного комплекса играет важную роль в центральных механизмах регуляции спонтанной биоэлектрической активности дыхательного центра. При этом основное модулирующее влияние принадлежит глутаматергической системе нейронов рострального и каудального отделов медиального вестибулярного ядра.
Вестибулярный комплекс ядер, дыхательный центр, глутамат, респираторные реакции
Короткий адрес: https://sciup.org/146279513
IDR: 146279513 | УДК: 612.2
Текст научной статьи Сравнительный анализ респираторных реакций на микроинъекции L-глутамата в различные структурно-функциональные отделы вестибулярного ядерного комплекса мозга новорожденных крыс in vitro
Морфо-функциональное развитие нейронных структур ВЯК, как и респираторной нейронной сети, происходит в период раннего постнатального онтогенеза путем формирования функции разных медиаторных систем. Как известно, именно при участии медиаторных систем осуществляются регулирующие и модулирующие синаптические влияния на дыхательный центр (Gittis, du Lac, 2007; Pasqualetti et al., 2007; Пятин и др., 2016a,б; Татарников и др., 2017).
У взрослых животных основная роль в механизмах синаптического взаимодействия ВЯК со структурами бульбарного дыхательного центра принадлежит глутаматергической системе (Уates, Bronstein, 2005). Однако роль глутаматергической системы ВЯК в механизмах реализации его регулирующих влияний на дыхательный центр новорожденных животных в настоящее время остаётся не раскрытой, что делает актуальным исследование функций этой области мозга в регуляции дыхания в раннем постнатальном онтогенезе.
Целью настоящего исследования являлось изучение роли различных структурно-функциональных отделов вестибулярного комплекса ядер в реализации респираторных реакций в изолированных понтобульбоспинальных препаратах новорожденных крыс in vitro.
Методика. Эксперименты выполнены на 48 изолированных понтобульбоспинальных препаратах (ПБСП), полученных из мозга белых и пигментированных беспородных крыс в возрасте от 0 до 4 суток, в условиях in vitro. Подготовка объекта для экспериментального исследования осуществлялась в два этапа. На первом этапе животных наркотизировали эфиром и помещали в специальную установку для проведения подготовительной операции. Путем дорсальной кранио- и ламинэктомии обнажали головной мозг и шейные сегменты спинного мозга. Ствол мозга пересекался на межколликулярном уровне. Во время препарирования мозг животных непрерывно орошался искусственной цереброспинальной жидкостью, охлажденной до +10°С и насыщаемой смесью кислорода (95%) и углекислого газа (5%). Препарат высвобождали от мозговых оболочек и последовательно пересекали дорсальные и вентральные корешки спинного мозга под контролем бинокулярного микроскопа. Кроме того, препарировали волокна с V по XII пары черепно-мозговых нервов. По окончании препарирования температуру перфузионного раствора, орошающего ПБСП, постепенно повышали с +10°С до +25±0,5°С и затем пересекали спинной мозг на уровне VI-VII пары вентральных корешков.
На втором этапе изолированный ПБСП переносили в проточную термостатированную камеру (+25±0,5°С) и помещали в специальное фиксирующее устройство камеры дорсальной поверхностью вверх для осуществления визуального контроля места микроинъекции. Скорость суперфузии ПБСП мозга составляла в среднем 2,5 мл/мин. В экспериментах на изолированном ПБСП мозга новорожденных животных использовался раствор искусственной цереброспинальной жидкости (ИЦСЖ) следующего состава (моль/л): NaCI - 124,0; КС1 -
5,0; СаСЕ - 2,4; MgSO4 - 1,3; NaHCO3 - 26; КН2РО4 - 1,2; d-глюкоза -30 (по Suzue, 1984). В течение всего эксперимента pH раствора ИЦСЖ в регистрационной камере поддерживали постоянным на уровне 7,3±0,05.
О спонтанной генерации ритма в дыхательном центре ПБСП мозга новорожденных крыс судили по суммарной биоэлектрической активности диафрагмальных мотонейронов. С этой целью отводилась биоэлектрическая активность от С4-С5 вентральных корешков спинного мозга с помощью хлорсеребряного всасывающего электрода (внутренний диаметр 100-150 мкм). Отводимые разряды диафрагмальных мотонейронов усиливали с помощью усилителя переменного тока (DL 314N-725; Neurobiolab Company), подавали на вход аналого-цифрового преобразователя (L-Card El4-440, FBM Engineering) и записывали на жесткий диск персонального компьютера в формате wav.
Раствор Е-глутамата (50 мМоль/л; Sigma Chemicals, USA) вводили в мозг с помощью микрошприца МШ-1 через стеклянную микропипетку с диаметром кончика 20-30 мкм под контролем бинокулярного микроскопа. Вещество растворяли ex tempore в ИЦСЖ и вводили в объеме 20-30 ил. Микропипетку в соответствии со стереотаксическими координатами вводили в исследуемые структуры и удерживали там в течение всего времени наблюдения во избежание распространения вещества вверх по треку (таблица).
Таблица 1
Координаты точек микроинъекций веществ в различные функциональноспецифические области вестибулярного комплекса ядер (в мм)
|
Структура вестибулярного комплекса |
Ростральнее obex |
Латеральнее средней линии мозга |
Вглубь от дорсальное поверхности мозга |
|
Медиальное ядро: Ростральная часть |
1,8 |
0,5 |
0,2 |
|
Каудальная часть |
1,0 |
0,5 |
0,2 |
|
Латеральное ядро |
1,8 |
1,0 |
0,5 |
|
Спинальное ядро |
1,5 |
1,0 |
1,0 |
|
Верхнее ядро |
2,2 |
1,5 |
0,5 |
В контрольных экспериментах по аналогичной методике инъецировали ИЦСЖ в том же объеме. Для гистологического контроля места микроинъекции по окончании эксперимента ПБСП фиксировали в 10% растворе формалина, после стандартной гистологической проводки заключали в парафиновый блок, из которого готовили коронарные срезы толщиной 10-20 мкм, с последующей окраской тионином по методу Ниссля (Буреш с соавт., 1991). Для сравнения использовали микрофотографии поперечных срезов мозга новорожденных крыс и атлас мозга взрослой крысы (Paxinos, Watson, 1997).
При обработке полученных нейрограмм оценивали следующие параметры: продолжительность респираторного цикла (с), время респираторного разряда (с), амплитуду респираторного разряда (относительные единицы). Для определения степени вариабельности параметров использовали коэффициент вариации - отношение среднего квадратичного отклонения к величине средней арифметической. Для описания пиков спектра респираторных разрядов использовали следующие параметры: частота пика (Гц) и мощность пика (относительные единицы). Средние показатели рассчитывали на основании данных, полученных от 10 последовательных респираторных залпов.
Полученные экспериментальные данные обрабатывали статистически с помощью программного пакета SigmaStat 2.0 с использованием непарного и парного t-теста Стьюдента. Все данные представлены как средние значения±стандартные ошибки. Для построения графиков пользовались программным пакетом Sigma Plot 10.0 (Jandel Scientific, USA). Статистически значимыми считались изменения со значениями р < 0,05.
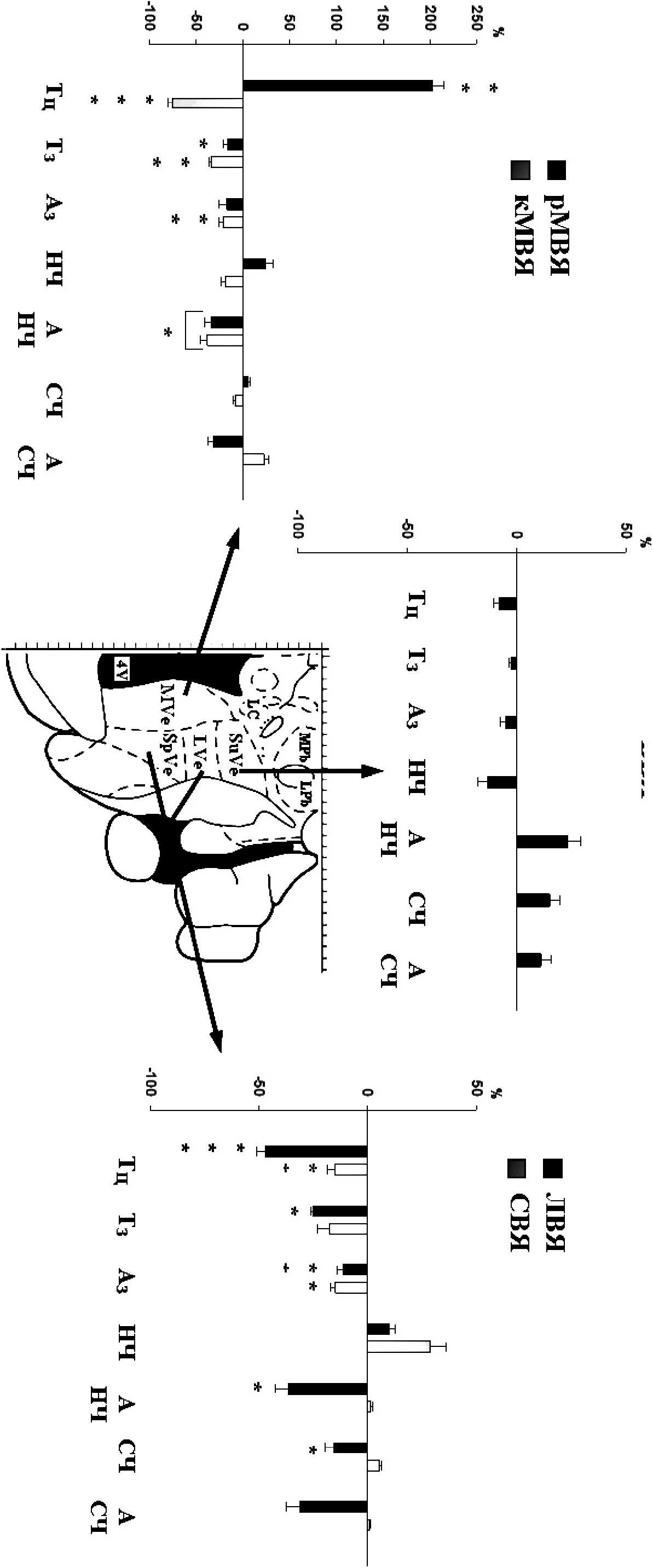
Результаты и обсуждение. В серии экспериментов исследованы реакции биоэлектрической активности, регистрируемой в С4-С5 вентральных корешках ПБСП мозга 0-3 суточных новорожденных крыс, на микроинъекции глутамата в область рострального и каудального отделов медиального вестибулярного ядра (МВЯ), латерального (ЛВЯ), спинального (СВЯ) и верхнего вестибулярных ядер (ВВЯ). Установлено, что стимуляция глутаматергической системы ВЯК вызывает два типа ответных реакций со стороны бульбарного дыхательного центра: инспираторно-активирующие и инспираторно-ингибирующие, при этом выявлена четкая зависимость типа эффекта от локализации воздействия (рисунок).
Так, инспираторно-ингибирующий эффект наблюдали только в случае микроинъекции глутамата в ростральную часть МВЯ, при этом нами были выявлены возрастные особенности наблюдаемых реакций у ПБСП мозга 0-1 суточных (п=10) и 2-3 суточных (п=6) новорожденных крысят. В возрастной группе ПБСП 0-1 суточных крысят в 95% случаев нами было зарегистрировано полное торможение спонтанной активности дыхательного центра. Средняя продолжительность респираторного цикла при этом почти в 5,5 раз превышала величину данного показателя в исходных условиях (р<0,001; парный t-тест). В отдельных экспериментах продолжительность депрессии респираторного ритма составляла более 20 мин. В возрастной группе ПБСП 2-3 суточных крысят микроинъекция глутамата в ростральный отдел МВЯ также вызывала уменьшение частоты генерации респираторных залпов в С4-С5 вентральных корешках за счет значительного увеличения общей продолжительности дыхательного цикла в среднем на 203,4±12,5 % (р<0,01; парный t-тест). При этом обнаружены статистически значимые различия в изменении данного параметра между исследуемыми возрастными группами ПБСП мозга (р<0,01; t-тест).
Характерной особенностью, сопровождающей снижение ритмической активности дыхательного центра в обеих возрастных группах ПБСП, являлось резкое повышение вариабельности длительности респираторного цикла, что указывает на нерегулярность процесса генерации дыхательного ритма. На спектрограммах респираторных разрядов ПБСП мозга 0-1 суточных крысят происходило значительное увеличение мощности низкочастотного пика в среднем на 132,5±24,1% (р<0,05; парный t - тест), тогда как на спектрограммах респираторных разрядов ПБСП мозга 2-3 суточных крысят на фоне введения глутамата в исследуемую область наблюдали снижение мощности осцилляций низко- и среднечастотного диапазонов на 34,2±6,4% (р<0,05; парный t-тест) и 31,3±5,7% (р>0,05; парный t-тест) соответственно.
В целом, оценка изменений спектральных характеристик респираторных разрядов на фоне микроинъекции L-глутамата в ростральную область МВЯ свидетельствует о том, что данная структура вестибулярного ядерного комплекса у новорожденных крыс не только тормозит процессы дыхательного ритмогенеза, но и модулирует активность генератора инспираторного паттерна. Что касается возрастных особенностей изменений биоэлектрической активности, зарегистрированной в С4-С5 вентральных корешках в условиях данных экспериментов, то согласно данным ряда авторов, на протяжении первых трех суток после рождения как в дыхательном центре, так и в вестибулярном ядерном комплексе новорожденных крыс и мышей происходит активное изменение экспрессии рецепторов к медиаторам, в том числе к глутамату и ГАМК, что может обусловливать обнаруженные нами различия (Onimaru, Homma, 2002; Eugene et al., 2007; Pasqualettie et al., 2007; Тюрин, 2009).
В сериях опытов с микроинъекциями глутамата в каудальную часть МВЯ (п=8), а также ЛВЯ (п=8) и СВЯ (п=8) были зарегистрированы инспираторно-активирующие ответные реакции дыхательного центра. В этих сериях исследований использовали ПБСП мозга как 0-1, так и 2-3 суточных новорожденных крыс, однако сравнительный анализ не выявил возрастных различий в эффектах действия глутамата на их респираторную активность.
Максимальное увеличение частоты генерации инспираторных залпов наблюдали на фоне введения глутамата в каудальную часть МВЯ почти в 2,5 раза (р<0,001; парный t - тест) по сравнению с исходным уровнем. Рост данного параметра был обусловлен как уменьшением общей продолжительности дыхательного цикла на 75,б±4,8% (р<0,001; парный t - тест), так и укорочением длительности инспираторного залпа на 32,4±2,4% (р<0,01; парный t-тест). На спектрограммах респираторных разрядов наблюдали значительное снижение амплитуды осцилляций низкочастотного диапазона на 38,2±7,3% (р<0,05; парный t-тест). Продолжительность наблюдаемых реакций составляла в среднем 1,5-2 мин, после чего показатели активности дыхательного центра возвращались к фоновым значениям, при этом латентный период не превышал 5-7 с.
В условиях микроинъекций глутамата в ЛВЯ и СВЯ сохранялась общая направленность реакции, однако выраженность инспираторно-активирующего эффекта существенно снижалась, при этом прирост частоты генерации респираторных разрядов составили, соответственно, 83,4±4,8% (р<0,05; парный t-тест) и 24,7±3,4% (р<0,05; signed rank-тест). Кроме того, в условиях воздействия L-глутамата на область ЛВЯ выявлено снижение мощности низкочастотных осцилляций (36,8±5,89 %; р<0,05; парный t-тест), тогда как спектральные характеристики респираторных разрядов на фоне микроинъекции исследуемого вещества в спинальное ядро вестибулярного комплекса не претерпевали статистически значимых изменений, что свидетельствует о преимущественном воздействии L-глутамата через структуры СВЯ на активность генератора дыхательного ритма, а не паттерна инспираторной активности. В условиях введения L-глутамата в СВЯ обнаружены также определенные отличия в динамике протекания дыхательных реакций, в частности, удлинение латентного периода реакции до 20-30 с, а также уменьшение ее длительности до 30-40 с. Все эти данные свидетельствуют о том, что СВЯ в естественных условиях играет менее значимую роль в реализации вестибуло-респираторных влияний, чем структуры латерального и каудальной части медиального вестибулярных ядер.
- is*
Hd h^ M
О
Я О я
о я (D я hrl 2
я to я о о d
о
о я о to к X
W я to л я я
S о м я
я я
ввя
"3 °N "81-03 „кпгоиояе п впгоиопд,. кпаеэ AJSi хпншээд
Применение раствора L-глутамата для локального воздействия на область верхнего субъядра вестибулярного комплекса (п=8) практически не вызывает изменений как частотно-временных показателей спонтанной активности дыхательного центра, так и спектральных характеристик инспираторных разрядов в ПБСП мозга О - 3 суточных новорожденных крыс. Отклонения отдельных параметров не превышали 5-10% (р>0,05) от исходных значений и были сравнимы с таковыми после микроинъекции в указанную структуру вестибулярного комплекса ИЦСЖ.
Заключение. В настоящей работе установлено, что глутаматергическая система вестибулярного ядерного комплекса играет важную роль в центральных механизмах регуляции спонтанной биоэлектрической активности дыхательного центра, оказывая существенное влияние на функциональное состояние генератора респираторного ритма и структуры, ответственные за формирование респираторного паттерна. При этом сравнительный анализ респираторных реакций на микроинъекции L-глутамата в различные функционально-специфические отделы вестибулярного ядерного комплекса показал, что основная роль в механизме регуляции ритмической активности дыхательного центра у новорожденных крыс принадлежит глутаматергической системе нейронов рострального и каудального отделов медиального вестибулярного ядра и, в меньшей степени, латерального и спинального ядер вестибулярного комплекса.
ТАТАРНИКОВ Валерий Станиславович - кандидат медицинских наук, старший преподаватель кафедры физиологии с курсом безопасности жизнедеятельности и медицины катастроф ФГБОУ ВО СамГМУ Минздрава России, 443099, Самара, ул. Чапаевская, д. 89.
ПЯТИН Василий Фёдорович - доктор медицинских наук, профессор, заведующий кафедрой физиологии с курсом безопасности жизнедеятельности и медицины катастроф ФГБОУ ВО СамГМУ Минздрава России, 443099, Самара, ул. Чапаевская, д. 89.
Глазкова Е.Н. Сравнительный анализ респираторных реакций на микроинъекции L-глутамата в различные структурно-функциональные отделы вестибулярного ядерного комплекса мозга новорожденных крыс in vitro / Е.Н. Глазкова, Н.Л. Тюрин, И.В, Широлапов, В.С. Татарников, В.Ф. Пятин // Вести. ТвГУ. Сер. Биология и экология. 2018. №2. С. 25-34.
Список литературы Сравнительный анализ респираторных реакций на микроинъекции L-глутамата в различные структурно-функциональные отделы вестибулярного ядерного комплекса мозга новорожденных крыс in vitro
- Пятин В.Ф., Татарников В.С., Глазкова Е.Н., Тюрин Н.Л. 2016а. Роль ГАМКергических рецепторов нейронов зоны А5 моста в регуляции реакции дыхательного центра при болевой стимуляции у крыс. Ульяновский медико-биологический журнал. Приложение. № 4. С. 67-68.
- Пятин В.Ф., Татарников В.С., Глазкова Е.Н., Широлапов И.В. 2016б. Роль норадренергических А5 нейронов моста в регуляции реакции дыхания и артериального давления на болевой стимул у крыс//Современные проблемы науки и образования. № 3. Режим доступа: http://www.science-education.ru/ru/article/view?id=24474 (дата обращения: 20.05.2016).
- Татарников В.С., Широлапов И.В., Глазкова Е.Н., Пятин В.Ф. 2017. Центральный хеморецепторный и барорецепторный контроль А5 норадренергических нейронов моста у крыс//Российский физиологический журнал им. И.М. Сеченова. Т. 103. № 10. С. 1148-1159.
- Тюрин Н.Л. 2009. Роль NMDA-и non-NMDA-подтипов глутаматных рецепторов нейронных структур медиального вестибулярного ядра в регуляции дыхательного ритмогенеза у новорожденных крыс in vitro//Бюл. экспериментальной биологии и медицины. Т. 147. № 8. С. 129-133.
- Barmack N.H. 2003. Central vestibular system: vestibular nuclei and posterior cerebellum//Brain Res. Bull. V. 60. P. 511-541.
- Day B. L., Fitzpatrick R.C. 2005. The vestibular system//Curr. Biol. 2005. V. 15. P. R583 -586.
- Elsen F.P., Ramirez J.-M. 2005. Postnatal development differentially affects voltage-activated calcium currents un respiratory rhythmic versus nonrythmic neurons if the pre-Botzinger complex//J. Neurophysiol. V. 94. P. 1423-1431.
- Eugene D., Deforges S., Guimont F., Idox P.P., Vidal P.P., Moore L.E., Vibert N. 2007. Developmental regulation of the membrane properties of central vestibular neurons by sensory vestibular information in the mouse//J. Phisiol. V. 583. P. 923-943.
- Gittis A.H., du Lac S. 2007. Firing properties of GABAergic versus non-GABAergic vestibular neurons conferred by a differential balance of potassium currents//J. Neurophysiol. V. 97. P. 3986-3996.
- Liu Q., Wong-Riley M.T.T. 2004. Developmental changes in the expression of GABAA receptor subunits in the rat pre-Botzinger complex//J. Appl. Physiol. V. 96. P. 1825-1831.
- Onimaru H., Homma I. 2002. Development of the rat respiratory neuron network during the late fetal period//Neurosci. Res. V. 42. № 3. P. 209-218.
- Pasqualetti M., Dıaz C., Jean-Sebastien R., Rijli F.M., Glover J.C. 2007. Fate-mapping the mammalian hindbrain: segmental origins of vestibular projection neurons assessed using rhombomere-specific Hoxa2 enhancer elements in the mouse embryo//J. Neurosci. V. 27(36). P. 9670-9681.
- Paxinos G., Watson C. 1997. The rat brain in stereotaxic coordinates. San Diego. Academic.
- Yates B.J., Bronstein A.M. 2005. The effects of vestibular system lesions on autonomic regulation: observation, mechanisms and clinical implications//J. Vestib. Res. V. 15. P. 119-129.


