Сравнительный анализ результатов бедренно‑большеберцового синостозирования при перипротезной инфекции
Автор: Бугаев Г.А., Виноградский А.Е., Прокопьев Д.С., Борзунов Д.Ю.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 5 т.31, 2025 года.
Бесплатный доступ
Введение. Перипротезная инфекция (ППИ) после тотальной артропластики коленного сустава остается серьезной проблемой ортопедии, требующей применения радикальных методов лечения. Бедренно-большеберцовое синостозирование (ББС) является одной из последних спасательных операций при неэффективности или невозможности ревизионного эндопротезирования. Однако в настоящее время нет единого мнения о рациональной технологии, обеспечивающей оптимальный анатомо-функциональный результат хирургической реабилитации. Цель работы — анализ клинических исходов хирургического лечения пациентов с ППИ при выполнении ББС коленного сустава с использованием интрамедуллярного стержня (ИС) и аппарата Илизарова (АИ). Материалы и методы. Проведен сравнительный анализ 46 пациентов с ППИ, которым выполнен артродез коленного сустава (АКС). Пациенты разделены на две группы в зависимости от технологии остеосинтеза для создания костного блока между бедренной и большеберцовой костью: 25 пациентов в группе 1 (ИС) и 21 — в группе 2 (АИ). Оценивали клинические характеристики больных, коморбидный фон, тип костных дефектов и микробиологический профиль. Статистический анализ сравнения функциональных результатов, сроков анкилоза, укорочения конечности, рецидивов инфекции и осложнений выполнен с помощью программы Jamovi (версия 2.6.17). Результаты. Средние сроки формирования костного блока были значимо меньше в группе 1 (ИС), — 4,5 месяца против семи месяцев в группе 2 (АИ), p = 0,027. Функциональные результаты между группами в целом были сопоставимы (p = 0,075). При значимых по утрате костной ткани дефектах (AORI тип III) пациенты группы 2 (АИ) демонстрировали лучшие показатели LEFS (p = 0,018). Частота рецидивов инфекции составила 13 % в группе 1 (ИС) и 4,8 % в группе 2 (АИ), p = 0,609. Системные осложнения (6,5 %) выявлены только в группе 1 (ИС). Нежелательные явления учитывали с применением унифицированной классификации осложнений. Обсуждение. Полученные результаты свидетельствуют, что ИС и АИ обеспечивают сопоставимую эффективность лечения пациентов с ППИ с различиями в сроках формирования костного блока и функциональных показателях при значительных по протяженности костных дефектах. Возрастающая распространенность полирезистентной микрофлоры и частота осложнений требуют внимательного и индивидуального подхода к выбору методики ББС. Заключение. Результаты исследования демонстрируют эффективность обеих методик: использование ИС способствует более быстрому формированию костного блока между бедренной и большеберцовой костью, тогда как АИ обеспечивает лучшие анатомо-функциональные результаты у пациентов со значительной утратой костной ткани.
Бедренно-большеберцовое синостозирование, артродез коленного сустава, перипротезная инфекция, интрамедуллярный стержень, аппарат Илизарова, клинические исходы, рецидив инфекции, осложнения артродеза
Короткий адрес: https://sciup.org/142246008
IDR: 142246008 | УДК: 616.728.3-089.844-06:616-022.1:[616.718.46+616.718.51] | DOI: 10.18019/1028-4427-2025-31-5-574-586
Текст научной статьи Сравнительный анализ результатов бедренно‑большеберцового синостозирования при перипротезной инфекции
Бедренно-большеберцовое синостозирование (ББС) при перипротезной инфекции (ППИ) на сегодняшний день остается одной из наиболее дискуссионных и востребованных спасательных операций. Несмотря на значительный прогресс в области эндопротезирования и совершенствование алгоритмов профилактики инфекционных осложнений, развитие ППИ после первичного тотального эндопротезирования коленного сустава остается значимой проблемой. По современным литературным данным, частота возникновения ППИ после первичного тотального эндопротезирования коленного сустава колеблется от 0,2 % до 2 %, а после ревизионных вмешательств достигает 28 % [1]. Более того, риск рецидива инфекции возрастает с каждой последующей санирующей операцией, существенно влияя на качество жизни пациентов и увеличивая медицинскую и социальную нагрузку на общество [2].
Актуальная в настоящее время тактика лечения пациентов с ППИ, предложенная A.F. Chen, включает продолжительное применение антибактериальной терапии, хирургическую обработку с сохранением имплантата, одно- и двухэтапное ревизионное эндопротезирование, а также спасательные операции, к которым относят артродезирование сустава, резекционную артропластику и ампутацию конечности [3]. «Золотым стандартом» признано двухэтапное ревизионное эндопротезирование с использованием цементного спейсера, импрегнированного антибиотиком. Такой подход, впервые описанный J.N. Insall et al. [4], позволяет добиться эрадикации инфекции в 88–96 % случаев [5, 6].
Нередко в клинической практике можно столкнуться с ситуацией, когда ревизионное эндопротезирование выполнить невозможно. Причинами этого являются тотальные и субтотальные дефекты костей, образующих коленный сустав, тяжелая недостаточность или отсутствие разгибательного аппарата коленного сустава, а также наличие полирезистентной микрофлоры, вызывающей хроническую костную инфекцию с постоянными рецидивами и свищеобразованием. Совокупность перечисленных осложнений в исходе эндопротезирования в литературе именуют «ужасной триадой» ( англ .: Terrible Triad) [7].
За последние 15 лет общая частота выполнения артродезирующих операций на коленном суставе по поводу ППИ составила 0,26 % [8], однако, как отмечают отечественные авторы, тенденция к увеличению числа таких вмешательств сохраняется [9].
Сравнительная оценка исходов спасательных операций показывает, что, несмотря на сохраняющиеся риски, артродез коленного сустава позволяет достигать более благоприятных функциональных результатов и ранней реабилитации, нежели ампутация, обеспечивая пациентам не только возможность самообслуживания, но и социализацию. Согласно систематическому обзору J. Low et al., 86,4 % пациентов после формирования ББС сохраняют способность к самостоятельному передвижению и уходу за собой, в то время как после ампутации конечности этот показатель составляет лишь 54,4 % [10].
Среди известных техник артродезирования, применяемых при ППИ коленного сустава, наибольшее распространение получили методы использования интрамедуллярного стержня (ИС) и аппарата Илизарова (АИ). Применение накостных пластин в современной практике ограничено из-за неоднозначных результатов, высокой частоты рецидива инфекции и необходимости длительной иммобилизации [11, 12]. Вместе с тем, несмотря на широкое распространение методов использования ИС и АИ, данные сравнительной эффективности этих подходов разрозненны и зачастую основаны на анализе ограниченных серий наблюдений. В отечественной литературе отсутствует комплексное сравнение клинических исходов, частоты рецидивов инфекции и осложнений после применения данных методик при ППИ, что определяет актуальность и научную новизну настоящего исследования.
Цель работы — анализ клинических исходов хирургического лечения пациентов с ППИ при выполнении ББС коленного сустава с использованием ИС и АИ.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включены пациенты, проходившие лечение на базе Госпиталя ветеранов войн (Екатеринбург) в период с 2016 по 2024 гг. Анализ результатов и хирургическое лечение выполнено одним коллективом хирургов-исследователей.
Критерии включения в исследование:
-
— пациенты с ППИ коленного сустава и невозможностью ревизионного эндопротезирования;
-
— пациенты, прошедшие двухэтапное ревизионное эндопротезирование коленного сустава по поводу ППИ с последующим рецидивом;
-
— пациенты, прошедшие не менее двух санирующих операций по поводу ППИ;
-
— наличие дефектов костей, образующих коленный сустав;
-
— наличие полирезистентной микрофлоры по данным микробиологических исследований (МБИ);
-
— недостаточность/отсутствие разгибательного аппарата коленного сустава (в том числе надколенника).
Критерии невключения :
-
— выполнение ББС по другим этиологическим причинам (посттравматические, остеомиелитические);
-
— неконтролируемое течение инфекционного процесса, приведшее к ампутации конечности;
-
— выполнение ББС по поводу ППИ с различными вариантами костной пластики;
-
— конверсия методов для проведения костного транспорта и уменьшения укорочения конечности в процессе синостозирования.
Критерий исключения — отказ пациента от участия в исследовании.
Всего в исследование включено 46 пациентов, которым выполнено ББС по поводу ППИ после тотальной артропластики коленного сустава: группа 1 (ИС) — 25 пациентов, группа 2 (АИ) — 21 пациент. В группу 1 (ИС) вошли 12 пациентов, наблюдавшихся проспективно, и 13 — ретроспективно. Группа 2 (АИ) сформирована на основании ретроспективных наблюдений.
Доля женщин в исследуемой выборке составила 67,4 % ( n = 31), мужчин — 32,6 % ( n = 15). Средний возраст женщин — (70,2 ± 9,37) года, мужчин — (63,7 ± 14,53) года. Средний индекс массы тела (ИМТ) пациентов обеих групп составил (28,7 ± 3,99) кг/м².
Исходные характеристики пациентов в сравниваемых группах
Распределение пациентов по критериям коморбидности ASA ( англ .: American Society of Anesthesiologists Physical Status Classification System) [13], типам инфекции по D.T Tsukayama [14] и костных дефектов по AORI ( англ .: Anderson Orthopaedic Research Institute) [15] в обеих группах представлено в табл. 1. Группы были сопоставимы по основным поло-возрастным и клиническим характеристикам ( p > 0,05).
Таблица 1
Распределение пациентов по классификационным признакам
|
Параметры сравнения |
Группа 1 (ИС), n = 25 |
Группа 2 (АИ), n = 21 |
p -value |
|
|
Шкала ASA |
||||
|
I |
абс. |
1 |
2 |
0,812 |
|
% |
2,2 |
4,3 |
||
|
II |
абс. |
12 |
9 |
|
|
% |
26,1 |
19,6 |
||
|
III |
абс. |
12 |
10 |
|
|
% |
26,1 |
21,7 |
||
|
Время от ТЭП до дебюта ППИ, лет (Ме [МКИ]) |
2 [1–5] |
2 [1–5] |
0,821 |
|
|
Продолжительность ППИ, лет (Ме [МКИ]) |
3 [2–4] |
4 [3–4] |
0,474 |
|
|
Кол–во санирующих операций (Ме [МКИ]) |
4 [3–6] |
4 [3–5] |
0,659 |
|
|
Тип ППИ по Tsukayama |
||||
|
I тип (острая послеоперационная) |
абс. |
2 |
3 |
0,921 |
|
% |
4,35 |
6,52 |
||
|
II тип (поздняя хроническая) |
абс. |
9 |
7 |
|
|
% |
19,57 |
15,22 |
||
|
III тип (острая гематогенная) |
абс. |
9 |
8 |
|
|
% |
19,57 |
17,39 |
||
|
IV тип (интраоперационная культура) |
абс. |
5 |
3 |
|
|
% |
10,87 |
6,52 |
||
|
Тип дефектов по AORI |
||||
|
I тип (F1/T1) |
абс. |
5 |
5 |
0,655 |
|
% |
10,87 |
10,87 |
||
|
II тип (F2A/T2A) |
абс. |
5 |
6 |
|
|
% |
10,87 |
13,04 |
||
|
II тип (F2B/T2B) |
абс. |
6 |
6 |
|
|
% |
13,04 |
13,04 |
||
|
III тип (F3/T3) |
абс. |
9 |
4 |
|
|
% |
19,57 |
8,70 |
||
Примечание : M — среднее значение; SD — стандартное отклонение; Me — медиана; МКИ — межквартильный интервал; ASA — шкала коморбидности и оценки операционного риска; ТЭП — тотальное эндопротезирование; Tsukayama — классификация перипротезной инфекции; AORI — классификация дефектов костей, образующих коленный сустав.
Интервал времени от первичной установки эндопротеза коленного сустава до манифестации пери-протезной инфекции в обеих группах составил два года (МКИ = 1–5; p = 0,821). Продолжительность инфекционного процесса (включая рецидивы и ремиссии) в группе 1 (ИС) в среднем составила три года (МКИ = 2–4), в группе 2 (АИ) — четыре года (МКИ = 3–4; p = 0,474). Медиана числа хирургических вмешательств на исследуемом сегменте до артродезирующей операции составила 4 (МКИ = 3–6) в группе 1 (ИС) и 4 (МКИ = 3–5) в группе 2 (АИ) ( p = 0,659).
Большинство пациентов обеих групп имели дефекты коленного сустава средних размеров II типа (F2A/T2A и F2B/F2B по классификации AORI), — 23,9 % и 26,0 % соответственно ( p = 0,655). Значительные по величине дефекты III типа (F3/T3) выявлены у 19,6 % ( n = 9) пациентов группы 1 (ИС) и у 8,7 % ( n = 4) пациентов группы 2 (АИ) ( p = 0,346). В обеих группах преобладали поздние хронические и острые гематогенные формы ППИ (по классификации Tsukayama), статистически значимых различий между группами не выявлено ( p = 0,921). В обеих группах превалировал соматически отягощённый контингент пациентов III класса по шкале ASA с несколькими тяжёлыми сопутствующими заболеваниями, в том числе в стадии декомпенсации — 26,1 % ( n = 12) в группе 1 (ИС) и 21,7 % ( n = 10) в группе 2 (АИ), различия не достигали статистически значимой разницы ( p = 0,812).
Больным выполняли стандартный комплекс обследования: клинические, лабораторные, рентгенологические и микробиологические исследования с целью подтверждения гнойно-воспалительного процесса и уточнения характера его течения. Пациентам группы 1 (ИС) за две недели до госпитализации выполняли КТ-исследование (Siemens SOMATOM, Германия) нижних конечностей для планирования и заказа индивидуального длинного бедренного стержня («ЦИТО», Россия). Стоит отметить, что все пациенты на момент выполнения артродезирующей операции прошли двухэтапное ревизионное эндопротезирование.
В положении пациента на спине производили обработку операционного поля. При наличии свища вводили в его канал красящий индикатор (раствор бриллиантовой зелени с 3 %-ной перекисью водорода) для определения пораженных костных участков, а также выявления скрытых затеков. Хирургический доступ выполняли по старому послеоперационному рубцу с его иссечением. По возможности малоинвазивно удаляли компоненты цементного спейсера. Производили забор тканевых биоптатов для микробиологического и гистологического исследований. Далее осуществляли радикальную хирургическую обработку очага инфекции в пределах здоровых тканей, вскрытие интрамедуллярных каналов.
При выполнении артродеза методом Илизарова следовал последовательный монтаж аппарата внешней фиксации на бедре и голени в спицевом или гибридном (спице-стержневом) вариантах. Количество опор зависело от размера костного дефекта и площади контакта бедренного и большеберцового концов. При малых размерах дефекта (AORI I тип) монтировали три кольцевых опоры, при более крупных, асимметричных или субтотальных дефектах (AORI II и III тип) — по четыре кольцевых опоры.
В случае выполнения АКС интрамедуллярным стержнем точку входа на уровне грушевидной ямки формировали ретроградно с помощью титановой развертки, интрамедуллярный стержень вводили антеградно [16]. После дистального блокирования производили обратное сколачивание стержня до полного контакта концов отломков бедренной и большеберцовой костей. Проксимальное блокирование выполняли по динамической схеме одним винтом при малых размерах дефекта (AORI I тип) и хорошем контакте поверхностей, либо по статической схеме с возможностью динамизации двумя винтами при крупных дефектах (AORI II и III тип). Устанавливали активный ПХВ-дренаж. Рану ушивали послойно.
В послеоперационном периоде все пациенты получали антибактериальную терапию: при наличии результатов бактериологических посевов и определении возбудителя на предыдущих этапах лечения — этиотропную, при их отсутствии — эмпирическую (Ванкомицин + Цефоперазон/сульбактам). По результатам МБИ интраоперационного материала антимикробную (противобактериальную или противогрибковую) терапию корректировали. Также пациенты получали противовоспалительную, обезболивающую, симптоматическую и сосудистую терапии. Перевязки выполняли один раз в два дня. Удаляли дренажи на вторые–четвертые сутки. Снятие швов выполняли на 14–16 сутки. Занятия с методистом ЛФК начинали со вторых суток после операции.
Осуществляли дозированную компрессию на стыке фрагментов в аппарате Илизарова, которую поддерживали на протяжении периода внешней фиксации. Всех пациентов наблюдали травматологи по месту жительства и приглашали на контрольный осмотр один раз в два–три месяца до появления рентгенологических признаков формирования костного блока между бедренной и большеберцовой костями. При замедленном формировании костной мозоли межфрагментарную компрессию в аппарате Илизарова увеличивали.
При статической схеме блокирования интрамедуллярного стержня пациента госпитализировали через два–три месяца для динамизации стержня. По достижении формирования костного блока в условиях стационара выполняли клинический тест на состоятельность костного сращения (отсутствие подвижности), после чего аппарат демонтировали. Ни в одном случае при достижении костного анкилоза стержень не удаляли. Укорочение оперируемой конечности компенсировали ортопедической обувью. В дальнейшем пациентов вызвали на контрольный осмотр для оценки результатов динамического наблюдения в отдаленные периоды.
Функциональный результат оценивали с применением опросника LEFS ( англ .: Lower Extremity Functional Scale) через четыре–шесть месяцев после операции (по достижении анкилоза). Сумму баллов менее 19 оценивали как минимальную функцию или отсутствие функции; 20–39 б. — значительное ограничение функции; 40–59 б. — умеренное ограничение, 60–79 б. — незначительное ограничение. Сумма в 80 баллов считалась максимальной и подразумевала наличие полной функции [17].
Укорочение конечности определяли с помощью сантиметровой ленты при финальном осмотре в сравнении с контралатеральной конечностью. Конечной точкой для определения срока ББС являлось формирование костного блока при визуализации рентгенограмм, состоятельности клинического теста для группы 2 (АИ) и ходьбе с полной нагрузкой на оперированную конечность для обеих групп пациентов.
В настоящий момент отсутствует классификация, стандартизирующая учет осложнений для обеих методик. В связи с этим, нами предложена унифицированная классификация для регистрации и анализа осложнений ББС:
-
— Категория 0 . Отсутствие осложнений:
+ отсутствие каких-либо осложнений.
-
— Категория 1 . Незначимые осложнения:
-
> 1.1 лёгкие контрактуры в смежных суставах;
-
+ 1.2 незначительное воспаление мягких тканей (купируемое консервативно);
-
+ 1.3 незначительные остаточные деформации, не нарушающие функцию;
-
+ 1.4 тракционная невропатия (купируемая консервативно).
-
— Категория 2 . Осложнения, потребовавшие дополнительных мероприятий, без ухудшения исхода:
-
+ 2.1 воспаление мягких тканей, требующее повторных вмешательств;
-
+ 2.2 переломы на уровне регенерата, устраняемые консервативно или малоинвазивно;
-
+ 2.3 подвывихи/контрактуры средней тяжести, требующие вмешательства;
-
+ 2.4 нестабильность фиксирующих элементов, требующая вмешательства.
-
— Категория 3 . Значимые осложнения с негативным влиянием на результат:
-
+ 3.1 несостоятельность анкилоза / перелом регенерата;
-
+ 3.2 рецидив перипротезной инфекции;
-
+ 3.3 тяжёлые контрактуры, ограничивающие функцию;
-
+ 3.4 стойкие неврологические нарушения в конечности;
-
+ 3.5 переломы металлоконструкции или фиксирующих элементов.
-
— Категория 4 . Системные осложнения:
-
+ 4.1 тромбоэмболия лёгочной артерии;
-
+ 4.2 жировая эмболия;
-
+ 4.3 острое нарушение мозгового кровообращения;
-
+ 4.4 другие системные осложнения.
-
— Категория 5 . Прочие осложнения:
+ 5.0 другие осложнения, не вошедшие в классификацию.
Важно отметить, что в ходе исследования данные клинических исходов двух пациентов группы 1 (ИС) не учитывали по причине летального исхода в раннем послеоперационном периоде и обозначали как NA (данные отсутствуют). Однако эти случаи включены в анализ послеоперационных осложнений, что позволило оценить общую частоту критических событий, связанных с методикой. Исключение функциональных показателей обусловлено невозможностью их оценки, однако учет летальных исходов в разделе осложнений обеспечивает полноту данных и прозрачность методологии.
Исследование одобрено локальным этическим комитетом Госпиталя ветеранов войн (Екатеринбург, протокол от 14.12.2023 № 12/2023) и проведено в соответствии с Хельсинкской декларацией 1975 г. (пересмотр 2008 г.). Все пациенты дали письменное информированное согласие на участие в исследовании и публикацию данных. Детализирующая информация, способствующая персонификации включённых в исследование пациентов, отсутствует.
Статистический анализ проводили с применением программного обеспечения Jamovi (версия 2.6.17, Австралия) и Microsoft Excel (версия 16.75.2, США). Для описания количественных данных с нормальным распределением использовали среднее значение и стандартное отклонение (М ± SD), для отличных от нормального — медиану и межквартильный интервал (МКИ), соответствующий нижнему (Q1) и верхнему (Q3) квартилям (Ме [МКИ]). Проверку нормальности распределения данных проводили с помощью критерия Шапиро – Уилка. Категориальные данные описывали с указанием абсолютных значений и процентных долей (n, %). Сравнение групп по количественному показателю с нормальным распределением данных выполняли с помощью t-теста Стьюдента или U-критерия Манна – Уитни при распределении, отличном от нормального. Анализ качественных (номинальных) признаков выполняли с помощью χ ²-критерия Пирсона (при ожидаемых значениях в каждой ячейке больше 5) или точного критерия Фишера (при ожидаемых значениях в каждой ячейке меньше 5). Статистическую значимость различий между группами принимали при p < 0,05.
РЕЗУЛЬТАТЫ
Функциональные показатели, укорочение конечности и сроки формирования костного блока
Функциональные показатели по шкале LEFS в группе 2 (АИ) составили (38,3 ± 5,9) %, а в группе 1 (ИС) — (34,4 ± 8,1) % ( p = 0,075), что указывает на сопоставимую функциональную эффективность методов.
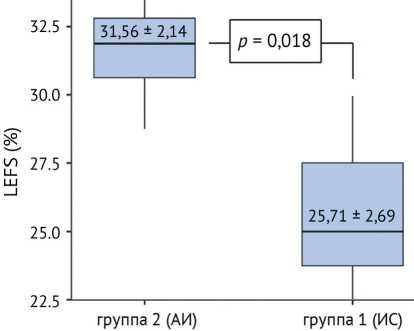
Рис. 1. Сравнение функциональных показателей (LEFS, %) между группами при костных дефектах III типа
При анализе пациентов с типом дефектов III по AORI выявлены значимые различия в функциональных показателях: в группе 2 (АИ) среднее значение LEFS составило (31,56 ± 2,14) %, тогда как в группе 1 (ИС) — (25,71 ± 2,69) % ( p = 0,018), что свидетельствует о лучших функциональных результатах при применении аппарата Илизарова в условиях значимых по протяженности костных дефектов (рис. 1).
Медиана укорочения конечности в группе 1 (ИС) составила 4,0 см (МКИ = 3,0–5,0), в группе 2 (АИ) — 3,0 см (МКИ = 3,0–4,0). Различия статистически не значимы ( p = 0,338), что свидетельствует о сопоставимом влиянии методов на длину конечности.
Статистически значимые различия выявлены в сроках анкилозирования коленного сустава: в группе 2 (АИ) — медиана 7 мес. (МКИ = 6,0–8,0), в группе 1 (ИС) — медиана 4,5 мес. (МКИ = 3,5–7,5; p = 0,027), что указывает на более быстрое формирование костного блока при использовании интрамедуллярных стержней.
Микробиологический профиль возбудителей и анализ рецидива инфекции
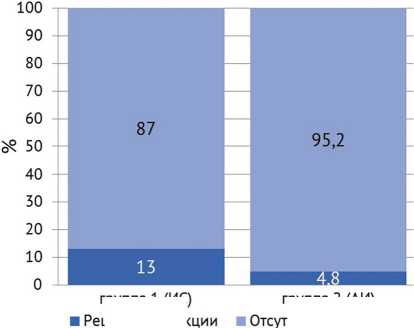
Рецидив инфекции был зафиксирован у трех (13 %) пациентов группы 1 (ИС) и у одного (4,8 %) пациента группы 2 (АИ). Статистического отличия между группами не выявлено ( p = 0,609), что указывает на отсутствие значимого влияния метода фиксации на вероятность повторного развития инфекции (рис. 2).
группа 2 (АИ) гствие рецидива группа 1 (ИС) цидив инфек
Рис. 2. Частота рецидива инфекции в группах сравнения
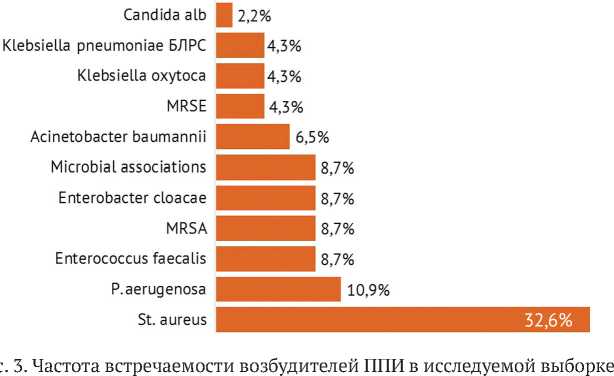
Микробиологический анализ выявил преимущественное распространение грамположительных микроорганизмов — 54,3 % ( n = 25), тогда как грамо-трицательные бактерии составляли 34,8 % ( n = 16). В 8,7 % ( n = 4) случаев были обнаружены микробные ассоциации, а грибковая флора встречалась в единичных наблюдениях — 2 % ( n = 1). Наиболее частым возбудителем оказался Staphylococcus aureus , выявленный в 32,6 % ( n = 15) случаев. Существенно реже определяли
Pseudomonas aeruginosa — 10,9 % ( n = 5), а также Enterococcus faecalis , MRSA, Enterobacter cloacae и другие микроорганизмы, суммарно встречавшиеся не более чем в 8,7 % случаев (рис. 3).
Анализ осложнений
Осложнения в сравниваемых группах согласно унифицированной классификации регистрации и анализа осложнений ББС представлены в табл. 2.
Таблица 2
Распределение осложнений в сравниваемых группах
|
Категория / Подкатегория |
Группа 1 (ИС) |
Группа 2 (АИ) |
||
|
абс. |
% |
абс. |
% |
|
|
Категория 0 . Отсутствие осложнений |
||||
|
0.0. Отсутствие каких-либо осложнений |
15 |
32,6 |
11 |
23,9 |
|
Категория 1 . Незначимые осложнения |
1 |
2,2 |
5 |
10,9 |
|
1.1. Лёгкие контрактуры в смежных суставах |
NA |
NA |
||
|
1.2. Незначительное воспаление мягких тканей (купировано консервативно) |
0 |
0 |
5 |
10,9 |
|
1.3. Незначительные остаточные деформации, не нарушающие функцию |
NA |
NA |
||
|
1.4. Тракционная невропатия (купировано консервативно) |
1 |
2,2 |
0 |
0 |
|
Категория 2 . Осложнения, потребовавшие дополнительных мероприятий, без ухудшения исхода |
1 |
2,2 |
2 |
4,3 |
|
2.1. Воспаление мягких тканей, потребовавшее повторных вмешательств |
0 |
0 |
1 |
2,2 |
|
2.2. Переломы на уровне регенерата, устранённые консервативно или малоинвазивно |
NA |
NA |
||
|
2.3. Подвывихи/контрактуры средней тяжести, потребовавшие вмешательства |
NA |
NA |
||
|
2.4. Нестабильность фиксирующих элементов, потребовавшая вмешательства |
1 |
2,2 |
1 |
2,2 |
|
Категория 3 . Значимые осложнения с негативным влиянием на результат |
5 |
10,9 |
3 |
6,5 |
|
3.1. Несостоятельность анкилоза / перелом регенерата |
0 |
0 |
2 |
4,3 |
|
3.2. Рецидив перипротезной инфекции |
3 |
6,5 |
1 |
2,2 |
|
3.3. Тяжёлые контрактуры, ограничивающие функцию |
NA |
NA |
||
|
3.4. Стойкие неврологические нарушения в конечности |
NA |
NA |
||
|
3.5. Переломы металлоконструкции или фиксирующих элементов |
2 |
4,3 |
0 |
0 |
|
Категория 4 . Системные осложнения |
3 |
6,5 |
0 |
0 |
|
4.1. Тромбоэмболия лёгочной артерии |
2 |
4,3 |
0 |
0 |
|
4.2. Жировая эмболия |
NA |
NA |
||
|
4.3. Острое нарушение мозгового кровообращения |
1 |
2,2 |
0 |
0 |
|
4.4. Другие системные осложнения |
NA |
NA |
||
|
Категория 5 . Прочие осложнения |
||||
|
5.0. Другие осложнения, не вошедшие в классификацию |
0 |
0 |
0 |
0 |
|
p -value |
0,022 |
|||
Примечание : NA — данные отсутствуют; различия считались статистически значимыми при p < 0,05 (точный тест Фишера).
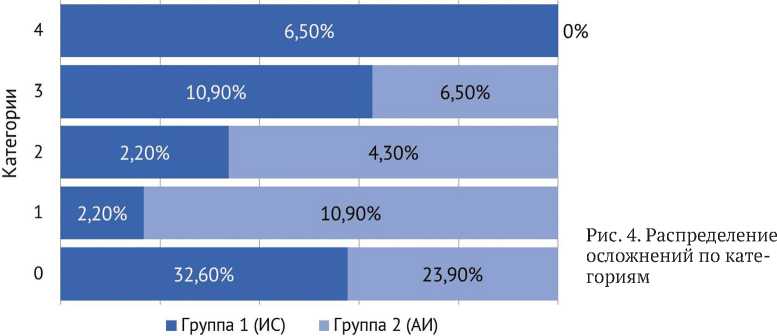
Осложнения первой категории, не оказывавшие влияния на исход лечения, наблюдали преимущественно в группе 2 (АИ), — 10,9 % ( n = 5) по сравнению с 2,2 % ( n = 1) в группе 1 (ИС).
Осложнения, потребовавшие дополнительных вмешательств (категория 2), зафиксированы у 4,3 % ( n = 2) пациентов группы 2 (АИ) и у 2,2 % ( n = 1) группы 1 (ИС).
Значимые осложнения (категория 3), оказавшие отрицательное влияние на исход лечения, отмечены у 10,9 % ( n = 5) пациентов группы 1 (ИС) и у 6,5 % ( n = 3) пациентов группы 2 (АИ).
Системные осложнения (категория 4) зарегистрированы только в группе 1 (ИС), — 6,5 % ( n = 3), включая два летальных исхода, обусловленных тромбоэмболией легочной артерии (категория 4.1), и один случай острого нарушения мозгового кровообращения (категория 4.3). В группе 2 (АИ) системные осложнения не отмечены.
Статистический анализ выявил достоверные различия между группами ( p = 0,022), что свидетельствует о влиянии выбранного метода на частоту и характер осложнений (рис. 4).
ОБСУЖДЕНИЕ
По мнению авторов данной работы, существуют определенная терминологическая неоднозначность в обозначении хирургического вмешательства, направленного на создание неподвижного коленного сустава путем сращения артикулирующих поверхностей. Традиционно такая операция именуется «артродезом сустава», а в англоязычных источниках можно встретить наименования «knee fusion» и «knee arthrodesis». С нашей точки зрения, используемый термин не в полной мере подходит для обозначения хирургической технологии и отражения анатомо-функциональной картины, наблюдаемой при неудачных исходах тотальной артропластики в условиях гнойной инфекции. Анатомо-функциональные изменения представлены дефектом тканей, сформированным после резекции суставных концов, секвестрированными участками эпиметафизарной зоны, нестабильным имплантатом и фактически отсутствием сустава [18]. Мы считаем, что более удачной формулировкой цели оперативного вмешательства является достижение сращения (синостоза) между двумя длинными трубчатыми костями, что более корректно характеризуется термином «бедренно-большеберцовое синостозирование» (ББС).
Оценивать функциональные результаты после артродеза коленного сустава следует, опираясь на функцию всей нижней конечности и ее опороспособность в целом. Не менее важно учитывать качество жизни пациента. Отдельная оценка функции коленного сустава нецелесообразна ввиду замыкания сустава в функционально-выгодном положении. Авторы других исследований используют различные варианты опросников, например: SF-12 [19], SF-36 [16], WOMAC [20], KSS [21, 22]. Некоторые авторы учитывают опороспособность конечности, хромоту и болевой синдром [23]. Однако такой подход не отражает качество жизни пациента после операции. Учет функциональных исходов должен также включать оценку уровня повседневной активности и качества жизни. По нашему мнению, опросник LEFS соответствует заявленным требованиям для оценки функциональных результатов после АКС. В литературе мы обнаружили лишь одно исследование, авторы которого использовали опросник LEFS для определения функциональных исходов АКС, — в работе D. Zajonz et al. при небольшой выборке из 25 пациентов, оперированных с использованием интрамедуллярного стержня, медиана LEFS составила 26 % (МКИ = 15–51) [24]. В нашем исследовании средний показатель LEFS в группе 1 (ИС) был (34,4 ± 8,1) %. Целевых исследований, оценивающих функцию конечности по LEFS (%) после АКС с применением аппарата Илизарова, мы не обнаружили. Анализ функциональных исходов по шкале LEFS показал сопоставимые результаты на уровне значительного ограничения функции при выполнении обеих методик (p = 0,075), однако при дефектах III типа по классификации AORI статистически значи- мые преимущества демонстрирует методика применения аппарата Илизарова. Полученные данные свидетельствуют, что именно при крупных костных дефектах использование АИ обеспечивает лучший функциональный исход, — (31,56 ± 2,14) балла в группе 2 (АИ) против (25,71 ± 2,69) баллов в группе 1 (ИС), p = 0,018. На основании этих результатов мы рекомендуем аппарат Илизарова для пациентов с крупными костными дефектами (AORI III). Вероятно, необходимо проведение дальнейших исследований с использованием стандартизированных инструментов оценки функциональных результатов АКС, основанных на единых опросниках и шкалах. Такой подход обеспечит получение более объективных и сопоставимых данных, углубит понимание влияния различных методик на функциональное состояние и качество жизни пациентов, а также будет способствовать выработке более чётких и обоснованных рекомендаций для клинической практики.
Немаловажным фактором, влияющим на функциональные результаты пациента и качество его жизни после артродеза коленного сустава, является остаточное укорочение конечности. Специалисты, занимающиеся эндопротезированием суставов и реконструкцией длинных трубчатых костей, считают укорочение до 2 см допустимым, не оказывающим существенного влияния на качество жизни и не требующим использования дополнительных средств опоры [25]. Тем не менее, на практике даже такое укорочение может сказываться на ходьбе и повседневной жизни пациента. Следует также учитывать, что равная длина ног при замыкании коленного сустава не всегда обеспечивает комфорт и может создавать неудобства для пациента. Остаточное укорочение зависит от размеров и характера дефектов костей, образующих коленный сустав. Каждая санирующая операция, направленная на ликвидацию очага инфекции, связана с остеонекрэктомией и, как следствие, потерей костной ткани. При выполнении артродеза коленного сустава необходимо добиться максимальной площади контакта резецированных концов отломков посредством моделирующей резекции, что также может привести к уменьшению длины нижней конечности. Сроки формирования костного блока напрямую влияют на функциональные результаты и возможность скорейшей реабилитации пациента. Однако методы, обеспечивающие более быстрое анкилозирование, могут сопровождаться увеличенным укорочением конечности [12], что требует взвешенного подхода при выборе тактики лечения, учитывающего как сроки формирования костного блока, так и возможные последствия остаточного укорочения.
Анализируя результаты работы, мы выявили, что время достижения костного блока имело существенные различия в зависимости от применяемой хирургической технологии. В группе с интрамедуллярным стержнем костное сращение формировалось быстрее за счет периостального гиперпластического костеобразования (медиана 4,5 мес.) по сравнению с использованием аппарата Илизарова (медиана 7 мес.), p = 0,027. Эти данные демонстрируют преимущество метода ИС с позиции продолжительности формирования костного блока при дефектах I и II типа по классификации AORI. Кроме того, использование метода ИС снижает нагрузку на амбулаторную медицинскую службу, минимизирует необходимость регулярных перевязок и существенно облегчает уход и самообслуживание пациента, повышая качество его жизни. Полученные в нашем исследовании результаты коррелируют с выводами G. Balato et al., представленными в крупном мета-анализе, включающем 26 статей и 422 пациента [26]. Авторы отмечают, что время формирования анкилоза коленного сустава было статистически значимо меньше ( p = 0,031) при использовании интрамедуллярного стержня, — 5,78 мес. (МКИ = 3,6–8,0) по сравнению с 7,19 мес. при применении аппарата Илизарова (МКИ = 6,3–10,3). Среднее укорочение конечности в группе ИС составило (2,4 ± 1,5) см, тогда как в группе АИ — (4,0 ± 0,7) см ( p = 0,005), что свидетельствует о значимом влиянии выбранного метода на степень остаточного укорочения. Следует подчеркнуть, что в упомянутом мета-анализе в группу ИС включали модульные конструкции, способные компенсировать укорочение конечности в пределах 2–4 см, однако не предусматривающие формирование костного анкилоза. Это обстоятельство объясняет статистически меньшие показатели укорочения в группе с ИС. Подобная тенденция отражена и в других зарубежных публикациях, рассматривающих применение модульных интрамедуллярных конструкций при АКС [27, 28].
Вместе с тем, мы считаем, что методика ББС сама по себе не является определяющим фактором остаточного укорочения конечности. Данное утверждение подтверждается результатами нашего исследования, где медиана укорочения конечности в группе 1 (ИС) составила 4,0 см (МКИ = 3,0–5,0), а в группе 2 (АИ) — 3,0 см (МКИ = 3,0–4,0), при этом статистических различий между группами не выявлено ( p = 0,338). Таким образом, влияние применяемых методик на длину конечности можно считать сопоставимым. По-прежнему остаётся актуальным вопрос устранения разницы в длине нижних конечностей для улучшения функциональных результатов и качества жизни пациентов. Безусловно, приоритетным при уравнивании длины конечностей является использование технологий чрескостно-го дистракционного остеосинтеза по Г.А. Илизарову.
Рецидив инфекции представляет одну из ключевых проблем в реконструкции нижних конечностей. Одним из важнейших взаимных ожиданий врача и пациента при принятии решения об артродезе коленного сустава является полное подавление очага инфекции и ликвидация рисков рецидива процесса.
Из факторов, влияющих на успешность эрадикации инфекции, известны следующие: радикальность хирургической обработки, восстановление целостности костного остова конечности на фоне таргет-ной антимикробной терапии. Радикальность хирургической обработки очага инфекции является ключевым фактором не только в лечении пациентов с ППИ, но и в профилактике рецидива инфекции [29]. В литературе отсутствует однозначное мнение, какая из методик артродеза наиболее эффективна с позиции профилактики рецидива инфекционного процесса. В этом контексте особенно важен тщательный анализ микробного пейзажа. Известный рост полирезистентной микрофлоры и её широкое распространение во всем мире существенно влияют на выбор антибактериальных препаратов, затрудняя подбор эффективной терапии и увеличивая риск рецидива инфекции. При этом некоторые гра-мотрицательные возбудители, в частности P. aeruginosa, K. pneumoniae и A. baumannii , ассоциированы с риском летального исхода до 10 % [30].
Данные отечественных авторов отражают высокий уровень сложности лечения пациентов с ППИ, требующих артродеза коленного сустава. Так, В.М. Прохоренко с соавт. сообщили, что применение аппарата Илизарова у 34 пациентов позволило добиться стойкого купирования инфекции в 85,29 % случаев, соответственно рецидив инфекции наблюдали на уровне 14–15 % [31]. В другом исследовании Н.М. Клюшин с соавт. на выборке из 63 пациентов отмечали 27 % ( n = 17) рецидивов инфекции при ар-тродезировании с помощью аппарата Илизарова. Авторы также констатировали преобладание грам-положительной микрофлоры (68 %, n = 43), где наиболее частым возбудителем был Staphylococcus aureus ( n = 32/64) [32]. В нашем исследовании рецидив инфекции наблюдали у трех (13 %) пациентов группы 1 (ИС) и у одного (4,8 %) пациента группы 2 (АИ), однако эти различия статистически не были значимы ( p = 0,609), что свидетельствовало о сопоставимой эффективности обоих методов в купировании инфекционного процесса. При этом в нашей выборке, как и в литературных данных, наиболее часто выявляемым возбудителем был золотистый стафилококк — в 32,6 % случаев ( n = 15). Эти выводы находят поддержку и в мета-анализе C.J. White et al., включающем 12 оригинальных исследований (суммарно 456 пациентов), в котором не выявлены статистически значимые различия в частоте рецидивов инфекции между интрамедуллярным стержнем и аппаратом Илизарова (OR = 0,91; 95 % ДИ: 0,38 – 2,15; p = 0,83) [33]. В случаях рецидива инфекции мы выполняли очередную санацию очага инфекции и реартродез. Для пациентов группы 1 (ИС) интрамедуллярный стержень извлекали и обрабатывали в ультразвуковой ванне, затем повторно устанавливали. В группе 2 (АИ) производили частичный перемонтаж аппарата с заменой чрескостных элементов. Необходимо отметить, что в клинических наблюдениях, принятых нами во внимание для анализа, мы не проводили конверсию методов остеосинтеза.
Наиболее популярной и практически применимой считается классификация осложнений, разработанная D. Paley, которая чётко разграничивает понятия «проблема», «препятствие» и «осложнение» и широко применяется в оценке исходов чрескостного остеосинтеза аппаратом Илизарова при реконструкции конечности [34]. Аналогичной стандартизированной системы для оценки осложнений после артродеза коленного сустава с использованием интрамедуллярной фиксации в настоящее время не существует. В имеющихся публикациях осложнения, возникающие при применении интрамедуллярного стержня и аппарата Илизарова, рассматривают раздельно [16], что затрудняет комплексный анализ различий в неблагоприятных событиях, связанных с формированием костного блока при ППИ. Опираясь на трактование вышесказанных понятий D. Paley, мы разработали унифицированную классификацию осложнений, которая охватывает все негативные исходы обеих методик. Для удобства анализа осложнения разделены на категории и детализированы в подкатегориях, что позволяет обеспечить более полное и структурированное рассмотрение возникающих проблем (табл. 2).
Наибольшее число осложнений, не влияющих на исход хирургической реабилитации (категории 1 и 2), зарегистрировано в группе 2 (АИ), — 15,2 %, n = 7, они связаны преимущественно с воспалением мягких тканей в области чрескостных элементов. Купирование воспалительного процесса обеспечивали местными инъекциями мягких тканей антибиотиками и перевязками с Левомеколем, а при стойкой параспицевой инфекции — перепроведением фиксирующих элементов. Также следует отметить случай послеоперационной нейропатии малоберцового нерва в группе 1 (ИС), который благополучно разрешился в течение 30 дней на фоне нейротропной терапии и снижения отёка мягких тканей. Аналогичные результаты приведены в работе B. Leroux et al., где два случая (13,3 %) завершились полным восстановлением чувствительности в течение шести месяцев после операции [35].
Более значимые осложнения, оказывающие влияние на исход лечения (категории 3 и 4), чаще встречались в группе 1 (ИС), — 10,9 % ( n = 5). Так, два случая (4,3 %) перелома интрамедуллярного стержня потребовали повторного хирургического вмешательства, — удаления штифта с последующим реартродезом по той же методике, но стержнем большего диаметра. Для группы 2 (АИ) характерны случаи перелома на уровне бедренно-большеберцового синостоза (4,3 %, n = 2), при этом тест на состоятельность костного блока был положительным, а рефрактура происходила в течение двух–трех недель после демонтажа аппарата Илизарова. В обоих случаях потребовалась повторная госпитализация и реостеосинтез.
С подобной проблемой столкнулись A.A. Bruno et al., у которых два из 15 пациентов после демонтажа аппарата внешней фиксации имели перелом зоны синостозирования, авторы ограничились внешней иммобилизацией конечности до полного формирования костного блока [15]. Системные осложнения отмечены в трех случаях (6,5 %) выполнения ББС интрамедуллярным стержнем, два из которых завершились летальным исходом. События могут указывать на потенциально более высокий риск развития критических исходов при использовании данной методики.
Ограничения исследования
Данное исследование имеет ряд ограничений. Во-первых, отсутствовала рандомизация и ослепление как пациентов, так и врачей, принимающих решение о выборе методики ББС. Во-вторых, выборка пациентов была относительно небольшой. Стоит уточнить, что АКС при ППИ является исключительным и редко применяемым, а не рутинным, вмешательством. Наконец, исключение из анализа клинических исходов двух пациентов группы 1 (ИС) в связи с летальным исходом в раннем послеоперационном периоде ограничивает полноту оценки результатов данной группы, однако их учёт в анализе осложнений снижает риск систематической ошибки и позволяет более объективно оценить безопасность метода.
ЗАКЛЮЧЕНИЕ
Бедренно-большеберцовое синостозирование у пациентов в условиях ППИ остается единственно возможной операцией, обеспечивающей приемлемые анатомо-функциональные результаты хирургической реабилитации и стойкое купирование гнойной инфекции. При анализе результатов лечения пациентов с ППИ сроки формирования костного блока при использовании интрамедуллярного стержня были менее продолжительными. Лучшие анатомо-функциональные результаты зарегистрированы у пациентов с субтотальными и тотальными костными дефектами при использовании внешней фиксации. Анализ частоты рецидивов инфекции не выявил статистически значимой разницы между группами. Частота и характер осложнений значимо отличались между группами, при этом системные осложнения наблюдали только в группе интрамедуллярной фиксации.


