Сравнительный анализ результатов применения различных хирургических методик у пациентов с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
Автор: Бажанов С.П., Толкачев В.С., Айтемиров Ш.М., Островский В.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 5 т.29, 2023 года.
Бесплатный доступ
Введение. Обилие хирургических методик, применяемых у пациентов с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава, требует тщательной оценки и сравнения ближайших и отдаленных результатов комплексного лечения, учитывая малое число публикаций по данной тематике, а также высокую социальную и экономическую значимость проблемы.Цель. Сравнить результаты применения различных методов хирургического лечения пациентов с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава.Материалы и методы. Объектом исследования стали 94 пациента с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава, которых разделили на три группы. В I группе осуществляли микрохирургический невролиз седалищного нерва; пациентам II группы выполняли микрохирургический невролиз ствола седалищного нерва с установкой стимулирующего электрода на его ствол; пациентам III группы - микрохирургический невролиз, а также установку стимулирующих многоканальных электродов на ствол седалищного нерва и сегментарный аппарат спинного мозга на уровне конуса и эпиконуса. Оценку клинико-функционального статуса проводили в динамике с использованием клинико-неврологического тестирования, а также динамического электрофизиологического мониторинга.Результаты. В послеоперационном периоде отмечали положительную динамику клинических и электрофизиологических показателей, которая заключалась в снижении болевого синдрома, степени выраженности функциональной недостаточности нижних конечностей, увеличении амплитуд М-ответа и снижении его латентного периода, при этом наиболее отчетливую положительную динамику отмечали в III исследуемой группе по сравнению с пациентами I и II групп (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Седалищный нерв, травма, тотальное эндопротезирование, электростимуляция, хирургическое лечение
Короткий адрес: https://sciup.org/142239030
IDR: 142239030 | УДК: 616.728.2-089.843-77-06:616.833.58-001.3]:616-079.8 | DOI: 10.18019/1028-4427-2023-29-5-507-511
Текст научной статьи Сравнительный анализ результатов применения различных хирургических методик у пациентов с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
Одним из наиболее грозных осложнений тотального эндопротезирования (ТЭП) тазобедренного сустава (ТБС) является закрытое повреждение седалищного нерва (ЗПСН), которое, по данным литературы, возникает у 0,17-8 % пациентов [1-3], а в 50-70 % случаев носит преходящий характер и может не сопровождать-
ся развитием выраженной клинической картины [4, 5]. Учитывая активный рост количества хирургических вмешательств на ТБС, увеличивается и распространенность ЗПСН, особенно среди пациентов трудоспособного возраста [6]. Ряд авторов в своих исследованиях отмечает, что удлинение конечности в ходе операции, женский пол, повторные хирургические вмешательства, цементная фиксация, а также задний доступ к ТБС коррелируют с ростом числа осложнений, что можно отнести к факторам риска [7-10]. При развитии нейропатии седалищного нерва (СН) после ТЭП ТБС у пациентов отмечается быстрое формирование болевого синдрома и выраженное нарушение сократительной функции мышц нижней конечности, что приводит в дальнейшем к атрофии и контрактурам суставов и отрицательно влияет на исходы лечения [11, 12].
Сложность хирургического лечения ЗПСН обусловлена высоким уровнем повреждения ствола нерва на уровне подгрушевидного и большого седалищного отверстий во время выполнения операции на ТБС, что может потребовать выполнения высокотравматичного доступа, связанного с массивной диссекцией мягкотканных структур, в ряде случаев приводящей к развитию выраженного рубцово-спаечного процесса в зоне операции, что повышает число неудовлетворительных результатов лечения [13, 14]. В качестве стандарта лечения подобных пациентов, как правило, выполняется
МАТЕРИАЛЫ
Исследование явилось продольным, открытым, проспективным с исторической группой контроля. Критерии включения пациентов в исследование: трудоспособный возраст, изолированный характер травмы СН после ТЭП ТБС (идиопатический коксартроз 3 стадии, индекс массы тела от 18,5 до 24,99, использование во время хирургического вмешательства только переднебокового доступа к ТБС и эндопротезов с бес-цементной фиксацией), степень повреждения нервных стволов, соответствующая II, III, IV по классификации Sunderland [26], КРБС в заинтересованной конечности, предшествующее неэффективное консервативное лечение в сроке не менее 3 месяцев с момента получения травмы, подписанное добровольное информированное согласие пациента на участие в исследовании.
В исследование вошли 94 пациента с ЗПСН, находившихся на стационарном лечении в НИИТОН СГМУ с 2005 по 2022 г., 41 (43,6 %) из которых мужского пола, 53 (56,4 %) – женского. Половых различий между исследуемыми группами выявлено не было (p = 0,785). Исследование проведено в трёх группах, однородных по тяжести повреждения нерва. При этом в I группе (n = 29) выполняли МН ствола СН на уровне его по- микрохирургический невролиз (МН), а в качестве рекомендаций и опций рассматриваются различные способы прямой электростимуляции (ЭС) СН [13, 15, 16]. Однако использование данных методик не всегда приводит к восстановлению полезной функции нижней конечности и сопровождается частым возникновением рецидивов комплексного регионарного болевого синдрома (КРБС) в нижней конечности [17-19]. Некоторые авторы применяют в своей работе комбинированную стимуляцию как периферического нерва, так и сегментарного аппарата спинного мозга, при этом демонстрируют улучшение ближайших и отдаленных результатов лечения [20]. Несмотря на обилие различных методик ЭС, в литературе нет единого мнения по поводу показаний, сроков и применяемых режимов, а большинство работ, исследующих ее влияние на регенераторные процессы, происходящие в мионевральном комплексе, выполнялись только на экспериментальных моделях [21-25].
Таким образом, высокая распространённость ЗПСН после ТЭП ТБС и частота неудовлетворительных результатов обусловливает актуальность данного исследования, направленного на поиск наиболее эффективной методики хирургического лечения.
Цель – сравнить результаты применения различных методов хирургического лечения пациентов с ЗПСН после ТЭП ТБС.
И МЕТОДЫ вреждения, во II группе (n = 32) – МН в сочетании с одноуровневой ЭС (непосредственно на ствол СН), в III группе (n = 33) выполняли МН в сочетании с двухуровневой ЭС (установку стимулирующих электродов как на ствол СН, так и на сегментарный аппарат СМ). Анализ результатов лечения производили по шкалам и опросникам: визуально-аналоговой шкале (ВАШ) [27], пятибалльной шкале оценки мышечной силы [28], пятибалльной шкале оценки чувствительности [29], шкале функциональной недостаточности Oswestry Disability Index (ODI) [30].
В качестве объективных методов исследования использовали электронейромиографию (ЭНМГ) нижних конечностей в динамике. Статистический анализ полученных результатов осуществляли с применением программ Statistica 13,0, Microsoft Office Excel 2019. В связи с тем, что распределение данных не соответствовало закону нормального распределения, использовали непараметрические методы статистики с вычислением медианы и межквартильного интервала (Me (Q1; Q3)), критерия Вилкоксона для связанных выборок, критерия Краскелла – Уоллиса. Различия между группами считали статистически значимыми при p < 0,05.
РЕЗУЛЬТАТЫ
До момента выполнения хирургического вмешательства интенсивность болевого синдрома у всех пациентов (n = 94) была высокой и составила 7,0 (6,0; 8,0) баллов, степень двигательных нарушений в заинтересованной конечности составила 1,0 (0; 2) балл, степень чувствительных расстройств составила 1,0 (0; 2) балл, при этом по данным показателям группы были однородны (критерий Краскелла – Уоллиса pваш = 0,949, pмыш = 0,452, pчувст = 0,950).
Функциональная недостаточность по шкале ODI до операции в группе I составила 31,0 (25,0; 40,0) балл, в группе II – 27,0 (21,0; 36,0) баллов, в группе III – 29,5 (21,5; 41,0), при этом оценка однородности трех групп показала отсутствие отличий (p = 0,579).
ЭНМГ-данные в дооперационном периоде свидетельствовали о высоком повреждении СН, при этом наиболее часто отмечали повреждение обеих его порций, что показано в таблице 1.
Таблица 1
Дооперационные показатели электронейромиографии нижней конечности у пациентов с закрытым повреждением седалищного нерва после тотального эндопротезирования тазобедренного сустава
|
Нерв |
Показатель |
Группа I Me (Q1; Q3) |
Группа II Me (Q1; Q3) |
Группа III Me (Q1; Q3) |
|
Малоберцовый |
М-ответ (мА) |
0,7 (0,1; 1,5) |
0,7 (0,0; 1,3) |
1,0 (0,4; 1,3) |
|
ЛП (мс) |
3,3 (3,1; 4,4) |
3,3 (0,0; 4,4) |
4,8 (4,2; 5,1) |
|
|
Большеберцовый |
М-ответ (мА) |
2,0 (1,0; 4,6) |
1,3 (1,0; 2,2) |
1,1 (0,6; 1,6) |
|
ЛП (мс) |
4,3 (3,5; 5,5) |
5,6 (4,6; 6,7) |
5,3 (4,6; 6,5) |
Примечание: Me – медиана (25 и 75 процентили), p > 0,05.
В соответствии с таблицей 1 во всех случаях (n = 94) показатели ЭНМГ характеризовались снижением амплитуды и увеличением латентного периода М-ответа, что соответствовало тяжелому аксонально-демиелинизирующему повреждению СН.
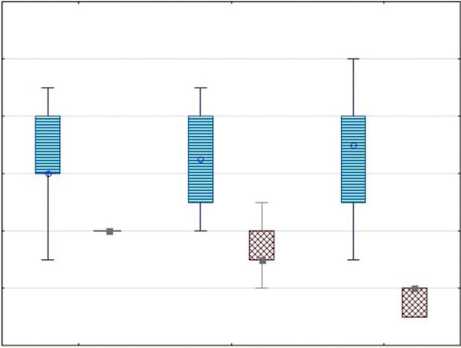
При контрольном обследовании через 6 месяцев после операции у всех пациентов было отмечено снижение выраженности болевого синдрома, при этом полный его регресс отмечали только у пациентов группы III (р < 0,05) (рис. 1).
1 2 3
Рис. 1. Динамика интенсивности болевого синдрома
Динамика показателей чувствительности и мышечной силы во всех исследуемых группах была выражена слабо, и статистически значимых различий вышеуказанных показателей за период наблюдения выявлено не было (p > 0,05).
Послеоперационная динамика функциональной недостаточности у пациентов в группах I и II была менее выражена по сравнению с пациентами группы III, что было обусловлено снижением степени выраженности болевого синдрома и, как следствие, приводило к улучшению показателей самообслуживания, при этом результаты тестирования по шкале ODI в группе I составили 28,0 (20,0; 34,0) баллов, в группе II – 16,5 (9,0; 21,5) баллов, в группе III – 5,9 (4,3; 8,5), p < 0,05.
При оценке показателей ЭНМГ было отмечено восстановление проводимости по волокнам малоберцового и большеберцового нервов, что коррелировало с положительной клинико-неврологической динамикой показателей и заключалось в увеличении амплитуды М-ответа и снижении его латентности. Это свидетельствовало об активизации регенераторных процессов в периферических сенсомоторных структурах нижней конечности. При этом медианные показатели амплитуд М-ответа в дистальной точке стимуляции малоберцо- вого нерва составили в группе I – 1,2 (0,3; 2,6), в группе II – 1,6 (1,2; 2,2), в группе III – 1,7 (0,7; 2,4) (p < 0,05)
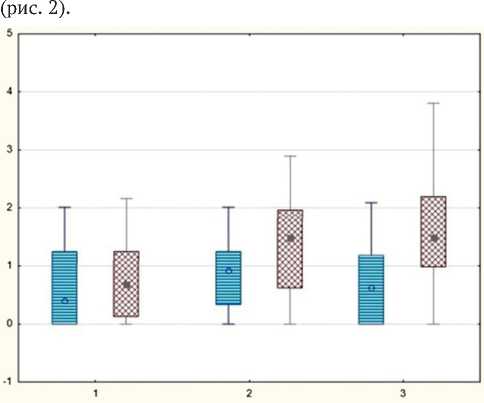
Рис. 2. Динамика показателей М-ответа малоберцового нерва
Показатели амплитуды М-ответа большеберцового нерва в послеоперационном периоде составили в группе I – 2,1 (1,1; 2,9), в группе II – 2,2 (1,4; 2,6), в группе III–3,2 (1,3; 5,60) (p < 0,01) (рис. 3).
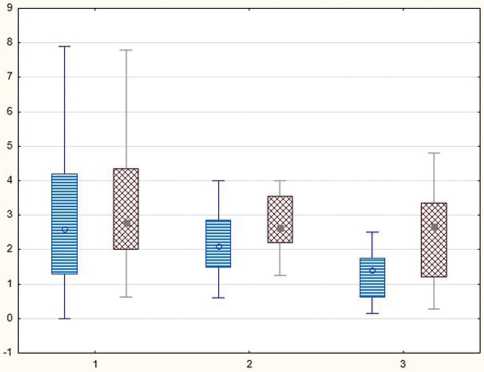
Рис. 3. Динамика показателей М-ответа большеберцового нерва
Таким образом, наиболее отчетливую положительную динамику клинико-неврологических и электрофизиологических параметров в виде регресса болевого синдрома, функциональной недостаточности нижней конечности, увеличения амплитуды и снижения латентности М-ответа выявили у пациентов в изучаемой группе III, что свидетельствовало о преимуществе сочетания методики МН и двухуровневой ЭС в лечении пациентов с ЗПСН после ТЭП ТБС.
ОБСУЖДЕНИЕ
Данное исследование явилось продолжением работы по изучению результатов лечения пациентов с ЗПСН после ТЭП ТБС [31], при этом отмечали, что восстановление функции СН происходило у всех пациентов, однако наиболее выраженный эффект регистрировали в III исследуемой группе. При анализе литературных данных отмечено незначительное количество печатных работ, посвященных лечению данной патологии [32, 33], что усложняет достоверное сравнение полученных данных в оригинальном исследовании с данными отечественной и зарубежной литературы.
Позитивный эффект от применения методики МН в сочетании с двухуровневой ЭС связан с одновременным электроимпульсным воздействием как на ствол периферического нерва, так и на сегментарный аппарат спинного мозга, что оказывает взаимоусиливающее влияние на образования периферической нервной системы.
В литературных источниках имеются указания на применение подобной методики в комплексном ле- чении пациентов с повреждениями периферических нервов, что продемонстрировано в работах Мещеряги-ной И.А. и соавт. [20, 33], при этом полученные данные схожи с настоящим исследованием, несмотря на некоторые отличия в технике установки стимулирующих электродов, заключающейся в использовании миниин-вазивных технологий [34].
На текущий момент до сих пор не определены четкие критерии, показания и оптимальный алгоритм выбора конкретной методики хирургического лечения у пациентов с ЗПСН после ТЭП ТБС. Также, несмотря на бурное развитие функциональной нейрохирургии и появление различных методик ЭС, до конца не установлены сроки, длительность, режимы электронейромодуляции [11, 35], что обусловливает необходимость проведения дальнейших исследований, которые позволят определить наиболее эффективный метод, а в перспективе – и установить персонализированный подход к лечению пациентов с ЗПСН после ТЭП ТБС.
ЗАКЛЮЧЕНИЕ
Сравнительный анализ различных методов хи- что позволило достоверно улучшить результаты ле-рургического лечения пациентов с ЗПСН после чения и проявилось более быстрым темпом сниже-ТЭП ТБС продемонстрировал достоверную эффек- ния болевого синдрома в заинтересованной нижней тивность методики применения МН в сочетании конечности и улучшением электрофизиологических с ЭС стволов ПС и сегментарного аппарата СМ, показателей.
Список литературы Сравнительный анализ результатов применения различных хирургических методик у пациентов с закрытыми повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава
- Schmalzried TP, Amstutz HC, Dorey FJ. Nerve palsy associated with total hip replacement. Risk factors and prognosis. J Bone Joint Surg Am. 1991;73(7):1074-80.
- Hasija R, Kelly JJ, Shah NV, Neet al. Nerve injuries associated with total hip arthroplasty. J Clin Orthop Trauma. 2018;9(1):81-86. doi: 10.1016/j. jcot.2017.10.011
- DeHart MM, Riley LH Jr. Nerve injuries in total hip arthroplasty. J Am Acad Orthop Surg. 1999;7(2):101-11. doi: 10.5435/00124635-19990300000003
- Толкачев В.С., Бажанов С.П., Коршунова Г.А. и др. Ближайшие клинические результаты хирургического лечения пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава. Гений ортопедии. 2022;28(6):774-777. doi: 10.18019/1028-4427-2022-28-6-774-777
- Mangual D, Valentin J, Acevedo J, et al. The Effect of Total Hip Arthroplasty on the Sciatic Nerve: an Electrodiagnostic Evidence Study. P R Health Sci J. 2020;39(3):254-259.
- Park JH, Hozack B, Kim P, et al. Common peroneal nerve palsy following total hip arthroplasty: prognostic factors for recovery. J Bone Joint Surg Am. 2013;95(9):e55. doi: 10.2106/JBJS.L.00160
- De Fine M, Romagnoli M, Zaffagnini S, Pignatti G. Sciatic Nerve Palsy following Total Hip Replacement: Are Patients Personal Characteristics More Important than Limb Lengthening? A Systematic Review. Biomed Res Int. 2017;2017:8361071. doi: 10.1155/2017/8361071
- Patel N, Golwala P. Approaches for Total Hip Arthroplasty: A Systematic Review. Cureus. 2023;15(2):e34829. doi: 10.7759/cureus.34829
- Devlieger BK, Drees P, Mattyasovszky S, et al. Impingement of the Sciatic Nerve due to a Protruding Acetabular Cage Rim. Arthroplast Today. 2020;6(4):825-829. doi: 10.1016/j.artd.2020.08.005
- Shemesh SS, Robinson J, Overley S, et al. Novel technique for intraoperative sciatic nerve assessment in complex primary total hip arthroplasty: a pilot study. Hip Int. 2018;28(2):210-217. doi: 10.5301/hipint.5000553
- Gordon T. Peripheral Nerve Regeneration and Muscle Reinnervation. Int J Mol Sci. 2020;21(22):8652. doi: 10.3390/ijms21228652
- Gronholdt-Klein M, Altun M, Becklen M, et al. Muscle atrophy and regeneration associated with behavioural loss and recovery of function after sciatic nerve crush. Acta Physiol (Oxf). 2019;227(3):e13335. doi: 10.1111/apha.13335
- Декопов А.В., Томский А.А., Исагулян Э.Д. и др. Лечение посттравматической невропатии седалищного нерва с использованием хронической нейростимуляции и эндоскопической техники. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2020;84(5):64-71. doi: 10.17116/neiro20208405164
- Беляк Е.А., Пасхин Д.Л., Лазко Ф.Л., и др. Эндоскопический невролиз седалищного нерва. Хирургия. Журнал им. Н.И. Пирогова. 2021;(11):66 75. DOI: 10.17116/hirurgia202111166
- Haastert-Talini K, Grothe C. Electrical stimulation for promoting peripheral nerve regeneration. Int Rev Neurobiol. 2013;109:111-124. doi: 10.1016/ B978-0-12-420045-6.00005-5
- Salmasi V, Olatoye OO, Terkawi AS, et al. Peripheral Nerve Stimulation for Occipital Neuralgia. Pain Med. 2020;21(Suppl 1):S13-S17. doi: 10.1093/ pm/pnaa083
- Davis G, Curtin CM. Management of Pain in Complex Nerve Injuries. Hand Clin. 2016;32(2):257-62. doi: 10.1016/j.hcl.2015.12.011
- Cobianchi S, Casals-Diaz L, Jaramillo J, Navarro X. Differential effects of activity dependent treatments on axonal regeneration and neuropathic pain after peripheral nerve injury. Exp Neurol. 2013;240:157-167. doi: 10.1016/j.expneurol.2012.11.023
- Buwembo J, Munson R, Rizvi SA, et al. Direct Sciatic Nerve Electrical Stimulation for Complex Regional Pain Syndrome Type 1. Neuromodulation. 2021;24(6):1075-1082. doi: 10.1111/ner.13294
- Мещерягина И.А., Скрипников А.А. Применение комбинированной электростимуляции при изолированных и сочетанных повреждениях периферических нервов верхних и нижних конечностей. Российский медицинский журнал. 2015;21(3):14-19.
- Bolívar S, Navarro X, Udina E. Schwann Cell Role in Selectivity of Nerve Regeneration. Cells. 2020;9(9):2131. doi: 10.3390/cells9092131
- Gordon T, Sulaiman O, Boyd JG. Experimental strategies to promote functional recovery after peripheral nerve injuries. J Peripher Nerv Syst. 2003;8(4):236-250. doi: 10.1111/j.1085-9489.2003.03029.x
- Gordon T. Electrical Stimulation to Enhance Axon Regeneration After Peripheral Nerve Injuries in Animal Models and Humans. Neurotherapeutics. 2016;13(2):295-310. doi: 10.1007/s13311-015-0415-1
- Alrashdan MS, Sung MA, Kwon YK, et al. Effects of combining electrical stimulation with BDNF gene transfer on the regeneration of crushed rat sciatic nerve. Acta Neurochir (Wien). 2011;153(10):2021-9. doi: 10.1007/s00701-011-1054-x
- Li X, Zhang T, Li C, et al. Electrical stimulation accelerates Wallerian degeneration and promotes nerve regeneration after sciatic nerve injury. Glia. 2023;71(3):758-774. doi: 10.1002/glia.24309
- Sunderland S. A classification of peripheral nerve injuries producing loss of function. Brain. 1951;74(4):491-516. doi: 10.1093/brain/74.4.491
- Huskisson EC. Measurement of pain. Lancet. 1974;2(7889):1127-31. doi: 10.1016/s0140-6736(74)90884-8
- Compston A. Aids to the investigation of peripheral nerve injuries. Medical Research Council: Nerve Injuries Research Committee. His Majesty's Stationery Office: 1942; pp. 48 (iii) and 74 figures and 7 diagrams; with aids to the examination of the peripheral nervous system. By Michael O'Brien for the Guarantors of Brain. Saunders Elsevier: 2010; pp. [8] 64 and 94 Figures. Brain. 2010;133(10):2838-44. doi: 10.1093/brain/awq270
- Хамзаев Р.И. Результаты хирургического лечения повреждений седалищного нерва и его ветвей: автореф. дис... канд. мед наук. Санкт-Петербург; 2009:22. Доступно по: https://www.dissercat.com/content/rezultaty-khirurgicheskogo-lecheniya-povrezhdenii-sedalishchnogo-nerva-i-ego-vetvei/read. Ссылка активна на 25.07.2023.
- Черепанов Е.А. Русская версия опросника Освестри: культурная адаптация и валидность. Хирургия позвоночника. 2009;(3):093-098. doi:10.14531/ss2009.3.93-98
- Толкачев В.С., Бажанов С.П., Коршунова Г.А. и др. Ближайшие клинические результаты хирургического лечения пациентов с повреждениями седалищного нерва после тотального эндопротезирования тазобедренного сустава. Гений ортопедии. 2022;28(6):774-777. doi:10.18019/1028-4427-2022-28-6-774-777
- Maeder B, Goetti P, Mahlouly J, et al. Entrapment of the Sciatic Nerve Over the Femoral Neck Stem After Closed Reduction of a Dislocated Total Hip Arthroplasty. J Am Acad Orthop Surg Glob Res Rev. 2019;3(2):e081. doi: 10.5435/JAAOSGlobal-D-18-00081
- Мещерягина И.А., Мухтяев С.В., Россик О.С. и др. Нейропатия седалищного нерва у пациентки после эндопротезирования по поводу врожденного вывиха головки бедра (клинический случай из практики). Гений ортопедии. 2014;(3):82-88.
- Худяев А.Т., Мартель И.И., Самылов В.В. и др. Малоинвазивные методы лечения повреждений периферических нервов. Гений ортопедии. 2012;(1):85-88.
- Zuo KJ, Gordon T, Chan KM, Borschel GH. Electrical stimulation to enhance peripheral nerve regeneration: Update in molecular investigations and clinical translation. Exp Neurol. 2020;332:113397. doi: 10.1016/j.expneurol.2020.113397


