Сравнительный анализ содержания антирадикальных компонентов в экстрактах некоторых лекарственных растений
Автор: Волков В.А., Пахомов П.М.
Журнал: Вестник Тверского государственного университета. Серия: Биология и экология @bio-tversu
Рубрика: Биохимия
Статья в выпуске: 5, 2007 года.
Бесплатный доступ
Выполнен количественный анализ общего содержания веществ с антирадикальной активностью в спиртовых экстрактах листьев 5 лекарственных растений, которое уменьшается в ряду Hypericum perforatum>Tanacetum vulgare=Plantago major=Achillea millefolium> Pinus sylvestris (хвоя второго года). Среднее количество антирадикальных компонентов в листьях Hypericum perforatum в 9 раз превышает таковое в хвое Pinus sylvestris. Установлено, что реакционная способность экстрактивных веществ в отношении радикала ДФПГ уменьшается в ряду Achillea millefolium>Tanacetum vulgare>Hypericum perforatum. Относительно высокая концентрация антирадикальных антиоксидантов в листьях зверобоя обусловлена высокой долей веществ с низкой реакционной способностью в отношении радикала ДФПГ.
Короткий адрес: https://sciup.org/146116086
IDR: 146116086 | УДК: 577.3
Текст научной статьи Сравнительный анализ содержания антирадикальных компонентов в экстрактах некоторых лекарственных растений
Тверской государственный университет
Выполнен количественный анализ общего содержания веществ с антирадикальной активностью в спиртовых экстрактах листьев 5 лекарственных растений, которое уменьшается в ряду Hypericum perforatum>Tanacetum vulgare=Plantago major=Achillea millefolium> Pinus sylvestris (хвоя второго года). Среднее количество антирадикальных компонентов в листьях Hypericum perforatum в 9 раз превышает таковое в хвое Pinus sylvestris. Установлено, что реакционная способность экстрактивных веществ в отношении радикала ДФПГ уменьшается в ряду Achillea millefolium>Tanacetum vulgare>Hypericum perforatum. Относительно высокая концентрация антирадикальных антиоксидантов в листьях зверобоя обусловлена высокой долей веществ с низкой реакционной способностью в отношении радикала ДФПГ.
Поиск и исследование перспективных природных источников веществ, обладающих антирадикальной (АРА) и антиоксидантной (АОА) активностью, является весьма актуальной задачей. Нарушение естественного баланса скорости свободнорадикального окисления и активности антиоксидантной защиты организма, возникающее под воздействием неблагоприятных факторов (загрязнение окружающей среды, хронический эмоциональный стресс, высокое содержание легкоусвояемых углеводов и жиров в рационе с одновременным снижением содержания биоантиокислителей), по данным многих исследований, играет важную роль в патогенезе многих заболеваний – сердечно-сосудистых, онкологических, нейродегенеративных, эндокринных [3; 9– 1].
В настоящей работе авторами была поставлена задача сопоставить антирадикальные свойства спиртовых экстрактов высушенных листьев пяти лекарственных растений: Hypericum perforatum, Tanacetum vulgare, Achillea millefolium, Plantago major и Pinus sylvestris (хвоя второго года). Препараты на основе этих растений используются в традиционной и народной медицине при лечении многих заболеваний [5–8; 14]. Антиоксидантные или антирадикальные свойства были ранее обнаружены у экстрактов листьев подорожника, тысячелистника, пижмы и зверобоя.
Материалы и методы исследования. Образцы для анализов были собраны в Максатихинском и Калининском районах Тверской области в период цветения в 2004– 2007 гг. и высушены при t=40°C и принудительной вентиляции [2] (электросушилка «Суховей»).
Для анализа количественного содержания в экстрактах веществ, обладающих антирадикальными свойствами, был применен широко распространенный в исследовательской практике метод, основанный на взаимодействии этих веществ со стабильным хромоген-радикалом 2,2-дифенил-1-пикрилгидразилом (ДФПГ) [4; 13; 15]. При взаимодействии с антирадикальными АО (фенольные соединения, тиолы, ароматические амины, аскорбиновая кислота) ДФПГ переходит в нерадикальную форму, что сопровождается исчезновением максимума поглощения при λ=517 нм в видимой области спектра.
Экстракция измельченного в течение 30 с в шаровой мельнице материала производилась 95% этанолом в течение 30 мин при непрерывном встряхивании с частотой 180 мин-1. Соотношение навески и растворителя 1:120 (масса/объем). 8,7⋅10-5 М раствор ДФПГ (Sigma-Aldrich, ω=97%) в этаноле, очищенном перегонкой, готовили непосредственно перед экспериментом. Из исходного экстракта готовили серию последовательных разбавлений; 0,8 мл каждого из полученных растворов серии приливали к 2,4 мл раствора ДФПГ, и через 30 мин регистрировали значения оптической плотности при λ=517 нм на спекторфотометре «Specord M40» (Carl Zeiss Jena, ГДР) [1]. В контрольном опыте вместо экстракта в реакционную систему вводили чистый этанол. По графику зависимости процента падения оптической плотности раствора ДФПГ в опыте по сравнению с контролем (PI) от коэффициента разбавления исходного экстракта методом линейной интерполяции определяли значение коэффициента разбавления, необходимое для достижения концентрации экстракта IC50, при которой падение оптической плотности за первые 30 мин реакции составляет 50%. Этот коэффициент разбавления служил мерой относительного содержания в образце веществ, обладающих антирадикальной активностью.
Средние значения и средние квадратические отклонения расчитывали, исходя из анализов не менее трех экстрактов, приготовленных из образцов, собранных в разных местах обитания.
Кинетические кривые падения оптической плотности ДФПГ при взаимодействии с экстрактивными веществами растений записывали при температуре 293±1К (использовали термостатируемые кюветодержатели). В кювету вводили 0,4 мл экстракта с концентрацией 2∙IC50 , 0.4 мл 0,4 М раствора уксусной кислоты в этаноле, 2,4 мл 8,7 ⋅ 10-5 М раствора ДФПГ в этаноле и быстро перемешивали содержимое кюветы. Кислота, подавляя ионизацию фенольных антиоксидантов, блокирует механизм SPLET (более быстрый) реакции ДФПГ с фенолами [12] и, таким образом, значительно снижает скорость реакции, облегчая проведение кинетических исследований. Кроме того, получаемые таким образом данные более адекватны с точки зрения сути изучаемой проблемы, поскольку алкоксильные, пероксильные, гидроксильные и другие нестабильные радикалы, способные к продолжению реакций цепного перекисного окисления липидов, отрывают атом водорода от молекулы липида по механизму HAT, которой не подавляется введением кислоты в наших опытах. Оптимум концентрации 50 мМ подобран авторами экспериментально.
Результаты исследования и их обсуждение. Данные по количественному анализу суммы антирадикальных АО, а также литературные сведения о содержащихся в исследуемых частях растений группах веществ, являющихся потенциальными антиоксидантами с точки зрения их химического строения, представлены в таблице. Приведенные результаты свидетельствуют о том, что различия в количественном содержании антирадикальных АО в листьях растений разных видов могут быть весьма значительными. Так, в листьях Plantago major этих веществ содержится в среднем в 9 раз больше, чем в хвое Pinus sylvestris . При этом среднее квадратическое отклонение в пределах образцов одного вида растения не превышает 60 %.
Однако кинетические кривые падения оптической плотности раствора ДФПГ при взаимодействии с антирадикальными АО экстрактов пижмы, зверобоя и тысячелистника, изображенные на рисунке, демонстрируют, что не следует количественное содержание антирадикальных компонентов в экстракте отождествлять с его антирадикальной активностью. Действительно, во всех проведенных нами опытах скорость взаимодействия антирадикальных экстрактивных веществ с ДФПГ убывало в ряду Achillea millefolium > Tanacetum vulgare > Hypericum perforatum (самая пологая кривая), несмотря на значительное превосходство зверобоя по количественному содержанию АО. По-видимому, высокая концентрация АО в листьях зверобоя достигается в основном за счет относительно малоактивных веществ.
Таблица
Относительные концентрации антирадикальных АО в листьях пяти лекарственных растений и данные литературы об их составе
|
Растение |
Относительна я концентрация антирадикальн ых АО |
Потенциальные антирадикальные АО (литературные данные) |
|
Hypericum perforatum |
75±15 |
Витамины С, Е. Дубильные вещества 3,88 – 7,94 %. Флавоноиды (рутин 2%, кверцетин и др.). Лейкоантоцианидины. Антрахиноны (гиперицин и др.) Фенолкарбоновые кислоты (кофейная). Кумарины [6]. |
|
Tanacetum vulgare |
20±10 |
Фенолкарбоновые кислоты (кофейная). Флавоноиды (эупателин, акацетин) [8]. |
|
Achillea millefolium |
18±10 |
Дубильные вещества. Кумарины 0,19%.Флавоноиды 0,3%.Фенолкарбоновые кислоты. Флобафены [8]. |
|
Plantago major |
18,4±0,8 |
Фенолкарбоновые кислоты (сиреневая, феруловая и др.). Флавоноиды (байкалеин, апигенин и др.). Тирозол [7;16]. |
|
Pinus sylvestris (хвоя второго года) |
8,3±2,1 |
Витамины C, E. Фенолы и их производные. Фенолкарбоновые кислоты (кофейная, хлорогеновая и др.). Лигнаны. Дубильные вещества (около 5%). Флавоноиды (кверцитин, рутин и др.). Процианидины [9]. |
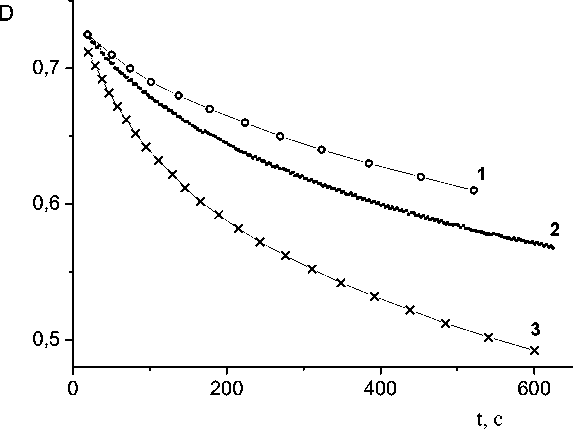
Кинетические кривые реакций ДФПГ с антирадикальными АО экстрактов Hypericum perforatum (1), Tanacetum vulgare (2), Achillea millefolium (3)
Из данных литературы (см. таблицу) видно, что активность экстрактов исследуемых растений в отношении радикала ДФПГ обусловлена наличием фенольных соединений различного строения и аскорбиновой кислоты. Это подтверждается рядом исследований [13], в соответствии с которыми концентрация в растительных экстрактах веществ, активных в отношении радикала ДФПГ, коррелирует с содержанием общих фенолов. Однако практически все литературные данные по составу фенольных соединений носят только качественный характер, в силу чего невозможно сделать предположение о том, какие конкретные соединения вносят наибольший вклад в антирадикальную активность каждого из изучаемых экстрактов.
Tver State University
A total amount of compounds with antiradical properties in alcoholic extracts of the leaves of five medicinal plants has been analysed. The order was Hypericum perforatum > Tanacetum vulgare = Plantago major = Achillea millefolium > Pinus sylvestris (second year needles). An average content of antiradical components in Hypericum perforatum leaves was 9 times higher than this value in the needles of Pinus sylvestris . It has been revealed that the reaction ability of compounds extracted from plant leaves toward DPPH radical decreases in following order: Achillea millefolium > Tanacetum vulgare > Hypericum perforatum . Relatively high antiradical antioxidant concentration in Hypericum perforatum leaves is due to high input of compounds with low reaction ability toward DPPH radical.


