Сравнительный морфологический анализ нефротоксичности доксорубицина и наноструктурированного доксорубицина в условиях перевиваемого канцерогенеза
Автор: Чаиркин Иван Николаевич, Чаиркина Наталья Викторовна, Дерябина Ольга Николаевна, Медвежонков Вячеслав Юрьевич, Калмин Олег Витальевич
Журнал: Морфологические ведомости @morpholetter
Рубрика: Краткие сообщения
Статья в выпуске: 2 т.26, 2018 года.
Бесплатный доступ
Исследование проведено на 120 беспородных белых лабораторных крысах, которым производили перевивку животным асцитной гепатомы Зайдела, которых разделили на три равные по численности группы. Из них первая группа животных была контрольной группой без лечения. Во второй группе животным вводился доксорубицин, в третьей группе животным вводился наноструктурированный доксорубицин в течение 21 суток. Целью исследования явилась оценка степени морфологических изменений в канальцах и клубочках почек под влиянием наноструктурированного доксорубицина и доксорубицина в условии перевиваемого канцерогенеза. Учитывая нефротоксичность изучаемых химиопрепаратов, изучали динамику структурных изменений в канальцах и клубочках почек. Проводили сравнительную морфологическую оценку возникающих в почках изменений. Полученные в ходе работы результаты морфологического исследования структурных компонентов почек доказывают, что доксорубицин и наноструктурированный доксорубицин оказывают различное воздействие, как на канальцевый аппарат, так и на клубочки почек в условии перевиваемого канцерогенеза...
Нанофармакология опухолей, наноструктурированный доксорубицин, перевиваемый канцерогенез, асцитная гепатома зайдела, нефротоксичность
Короткий адрес: https://sciup.org/143177250
IDR: 143177250
Текст краткого сообщения Сравнительный морфологический анализ нефротоксичности доксорубицина и наноструктурированного доксорубицина в условиях перевиваемого канцерогенеза
Чаиркин И.Н., Чаиркина Н.В., Дерябина О.Н., Медвеженков В.Ю., Калмин О.В. Сравнительный морфологический анализ нефротоксичности доксорубицина и наноструктурированного доксорубицина в условиях перевиваемого канцерогенеза// Морфологические ведомости.- 2018.- Том 26.- № 2.- С. 45-48. (26).02.45-48
Chairkin IN, Chairkina NV, Deryabina ОN, Medvezhonkov VY, Kalmin OV. The comparative morphological analysis of the nephrotoxicity of doxorubicin and nanostructured doxorubicin in conditions of transplantable carcinogenesis. Morfologicheskie vedomosti – Morphological Newsletter. 2018 June 30;26(2):45-48. (26).02.45-48
Введение. Рост онкологической заболеваемости в текущее десятилетие как в России, так и во всем мире объясняет повышенный интерес ученых к данной проблеме [1]. Химиотерапия является одним из ведущих и, нередко, единственным из возможных методов лечения злокачественных опухолей у человека. К наиболее эффективным и часто применяемым в последние годы противоопухолевым антибиотикам относятся препараты антрациклинового ряда, в частности, доксорубицин (адриамицин). Его цитостатический эффект обусловлен способностью связываться с ДНК опухолевых клеток, что вызывает угнетение их роста и пролиферации, а также с угнетением ДНК-зависимого синтеза РНК [2]. При этом антимитотическая активность препарата параллельно с опухолевыми клетками оказывает влияние и на нормальные клетки организма [3]. Низкая избирательность антимитотического действия на клетки, как опухолевые, так и здоровых тканей, большинства широко используемых в онкологической практике химиопрепаратов, в том числе и доксорубицина, на сегодняшний день является весьма актуальной проблемой. Ведется поиск способов защиты здоровой ткани от цитотоксического воздействия химиотерапии с привлечением экспериментальных моделей. Для преодоления токсичности химиопрепарата используются разнообразные системы доставки лекарственного вещества к опухолевым клеткам, позволяющие изменить его биораспределение и фармакокинетические характеристики [4-6]. Тем самым уменьшить цитотоксичность химиопрепарата по отношению к здоровой ткани. Наночастицы предлагаются в качестве одного из способов избирательной доставки фармацевтических агентов к тканям и органам, ограничивая при этом их воздействие на здоровую ткань [7-11].
Цель исследования - дать сравнительную морфологическую оценку степени нефротоксичности доксорубицина и наноструктурированного доксорубицина на модели экспериментальной гепатомы Зайдела.
Материалы и методы исследования . Эксперимент был поставлен на 120 беспородных белых крысах. Крысы были получены из питомника лабораторных животных (Филиал питомника «Столбовая» ФГБУН НЦБМТ ФМБА России) в возрасте 2 месяцев, массой 160-170 г. Животных содержали в стандартных условиях вивария, проведение эксперимента и все манипуляции на животных осуществлялись в строгом соответствии с требованиями Европейской конвенции по защите животных (Страсбург, 1986). Экспериментальная часть исследования включала 2 серии, в ходе которых изучали динамику структурных изменений в почках под влиянием доксорубицина и нанодоксорубицина в условии перевиваемой асцитной гепатомы Зайдела (культура опухоли получена в ФГБУ «РОНЦ им. Н.Н. Блохина» Минздрава России). В начале экспериментального исследования всем животным был перевит штамм гепатомы Зайдела внутрибрюшинно (0,5 мл нативной асцитической жидкости, которая была получена от животного-опухоленосителя на 5-е сутки после перевивки). Затем животные были ранжированы на 3 группы. Первая группа животных (n=40) была контрольная: животным данной группы не вводились изучаемые нами химиопрепараты, а на 3 сутки после двух перевивок опухоли им вводили в брюшную полость 0,5 мл 0,9% раствора натрия хлорида. Вторая и третья группы животных были опытными. Крысам второй группы (n=40) вводили доксорубицин (Фармахеми Б.В., Харлем, Нидерланды) в дозе 2 мг/кг веса, внутримышечно 1 раз в 7 дней. Животным третьей группы (n=40) вводили наноструктурированный доксорубицин (нанодокс) в дозе 1,5 мг/кг веса, внтримышечно 1 раз в 7 дней. Эксперимент длился 21 сутки. Крыс выводили из эксперимента на 7, 14, 21 сутки методом декапитации под уретановым наркозом. Материалом для исследования явились обе почки. Для морфологического исследования почки фиксировали в 4% параформальдегиде, приготовленном на 0,1 М фосфатном буфере (pH 7,4) при температуре 4°С, обезвоживали, заливали в парафин по стандартной методике. Из парафиновых блоков готовили серийные срезы толщиной 5-6 мкм во фронтальной плоскости на микротоме «Leica» и окрашивали гематоксилином и эозином. Морфометрическое исследование проводилось с помощью окулярной сетки, микрообъектива и программы «Видеотест Морфология 5.0». На серийных гистологических срезах толщиной 5-6 мкм, окрашенных гематоксилином и эозином с помощью окуляр-микрометра проводилась количественная оценка состояния канальцевого аппарата и клубочков почек. Морфометрическое исследование включало: определение площади почечного тельца (мкм²), площади сосудистого клубочка (мкм²), наружного диаметра проксимального канальца (мкм), внутреннего диаметра проксимального канальца (мкм), площади проксимального канальца (мкм2), наружного диаметра дистального канальца (мкм), внутреннего диаметра дистального канальца (мкм), площади дистального канальца (мкм2). Статистическая обработка данных включала вычисление среднеарифметического значения (М), его ошибки (m), оценки амплитуды вариационного ряда. О значимости различий судили по величине t-критерия Стьюдента и считали их значимыми при p<0,05.
Результаты исследования и обсуждение . При изучении на светооптическом уровне срезов почек экспериментальных животных, получавших доксорубицин, наиболее выраженные изменения проявлялись в проксимальных канальцах в виде дистрофических и некробиотических изменений в эпителиальных клетках, начиная с 7-х суток эксперимента и нарастания их по мере увеличения срока эксперимента. Эти изменения достигали максимума к 21-му дню эксперимента (рис. 1). Уже после однократного получения доксорубицина отмечалось нарушение полярности эпителиальных клеток канальцев с признаками набухания, вакуолизация цитоплазмы отдельных эпителиоцитов. Введение наноструктурированного доксорубицина не вызывало каких-либо видимых на светооптическом уровне структурных изменений в канальцевом аппарате почек.
После двукратного введения доксорубицина (14-е сутки эксперимента) наблюдаются значительные изменения в вышеназванных структурах почек экспериментальных животных. Просветы 1/3 канальцев заполнены аморфным эозинофильным содержимым. Дистрофические изменения в проксимальных канальцах почек выражаются вакуолизацией эпителиальных клеток, цитоплазма которых имела оптически пустой вид с набухшими уплощенными ядрами, часть из которых имела пикнотические изменения. Наблюдается частичное отторжение эпителиоцитов от базальной мембраны проксимальных канальцев и друг от друга, потеря значительным количеством ядер базофилии, кариолизис. Просветы канальцев умеренно расширены. В отдельных зонах канальцы истонченные, которые сливаясь, образуют кистоидные участки. В единичных клубочках выявляется фибриноидный некроз и сужение просвета отдельных капиллярных петель. Повреждение клубочков носит, вероятно, вторичный характер. Из-за выраженного повреждения проксимальных канальцев страдает структура всего нефрона, включая его клубочковый аппарат.
Исследование канальцевого аппарата и клубочков почек после двукратного введения нанодоксирубицина показывает иную картину в сравнении с введением обычного препарата доксорубицина. Клубочковый аппарат паренхимы почек оставался интактным (рис. 2). В канальцевом эпителии наблюдались умеренно выраженные дистрофические изменения в виде набухания эпителиоцитов и вакуолизации отдельных эпителиальных клеток. Просвет канальцев сужен за счет набухания эпителиоцитов.
На сроке 21 дня от начала введения доксорубицина в большей части проксимальных извитых канальцев наблюдался тотальный некроз эпителиальных клеток и его десквамация, были видны оголенные базальные мембраны диффузно расширенных проксимальных канальцев почек. При использовании наноструктурированного доксорубицина морфологические изменения на этом сроке эксперимента в проксимальных канальцах были менее выраженными: не наблюдался некроз эпителиоцитов, имело место набухание эпителиальных клеток, отдельные эпителиоциты были подвержены вакуолизации и десквамации. При морфометрическом исследовании наиболее значимыми были изменения высоты эпителиоцитов и показатели наружного и внутреннего диаметров проксимальных канальцев (таблица 1).
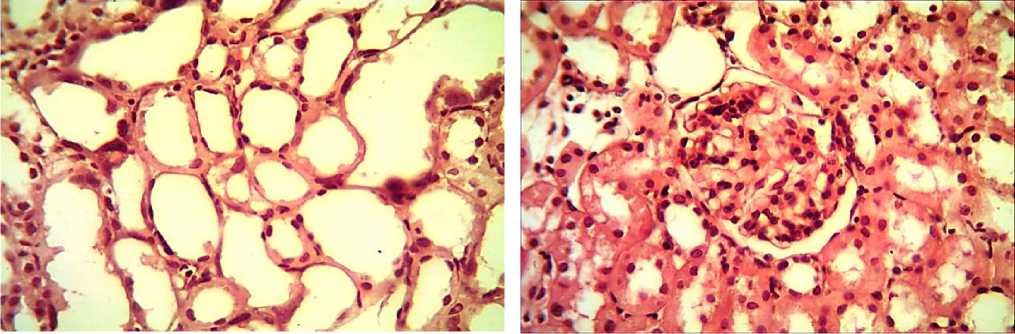
Рис. 1. Препарат почки крыс после трехкратного введения Рис. 2. Препарат почки крыс после трехкратного введения доксорубицина на 21-й день эксперимента. Окраска наноструктурированного доксорубицина на 21-й день гематоксилином и эозином. Ув.: х400. эксперимента. Окраска гематоксилином и эозином. Ув.:
х400.
Таблица 1
Морфометрические показатели проксимальных канальцев почек крыс при введении доксорубицина и наноструктурированного доксорубицина на разных сроках эксперимента
|
При введении доксорубицина |
||||
|
показатель |
значения (M±m) |
|||
|
контроль |
7 суток |
14 суток |
21 сутки |
|
|
высота эпителиоцитов проксимальных канальцев, мкм |
12,7±0,37 |
18,2±1,45* |
23,6±1,67* |
– |
|
наружный диаметр проксимального канальца, мкм |
35,5±2,43 |
38,4±3,32* |
42,8±5,22* |
48,8±6,15* |
|
внутренний диаметр проксимального канальца, мкм |
13,2±2,53 |
10,8±1,45* |
9,6±2,32* |
20,6±5,32* |
|
При введении наноструктурированный доксорубицин |
||||
|
показатель |
значения (M±m) |
|||
|
контроль |
7 суток |
14 суток |
21 сутки |
|
|
высота эпителиоцитов проксимальных канальцев, мкм |
12,7±0,37 |
13,4±0,53* |
14,9±0,64* |
18,2±1,44* |
|
наружный диаметр проксимального канальца, мкм |
35,5±2,43 |
35,9±2,73* |
36,4±3,48* |
38,2±4,72* |
|
внутренний диаметр проксимального канальца, мкм |
13,2±2,53 |
12,8±2,17* |
11,9±3,12* |
10,8±2,53* |
Примечание: * - p<0,05 при сравнении с контролем.
После однократного введения доксорубицина показатель наружного диаметра проксимальных канальцев увеличился на 10,8%, а показатель внутреннего диаметра уменьшился на 18,2%, за счет набухания эпителиоцитов, высота которых составила 18,2±1,45, что на 14,3% больше по сравнению с контролем (p<0,05). После трехкратного введения доксорубицина наблюдалось увеличение наружного и внутреннего диаметров проксимальных канальцев на 23,9% и 15,6% соответственно по сравнению с контрольной группой животных (p<0,05). На фоне трехкратного введения доксорубицина мы наблюдали увеличение наружного диаметра проксимальных канальцев лишь на 10,7% и уменьшение внутреннего диаметра проксимальных канальцев на 19%, в то время как уменьшение внутреннего диаметра проксимальных канальцев на 28% наблюдалось уже после двукратного введения доксорубицина (p<0,05) (таблица 1).
Заключение . Таким образом, проведенное исследование показало, что наноструктурированный доксорубицин в сравнении с обычным фармацевтическим препаратом доксорубицином оказывает сравнительно меньшее повреждающее действие как на канальцевый аппарат, так и на клубочки почек в условии перевиваемого канцерогенеза. Применение обычного доксорубицина сопровождается сравнительно выраженным нефротоксичным эффектом, показателем чего являются дистрофические и некробиотические изменения со стороны эпителия извитых канальцев и клубочкового аппарата почек. Использование наноструктурированного доксорубицина ограничивается умеренно выраженными дистрофическими изменениями эпителия канальцевого аппарата почек. Клубочковый аппарат при этом остается относительно интактным. Учитывая менее выраженное нефротоксичное действие наноструктурированного доксорубицина, наноструктурированные формы лекарственных препаратов, в частности, доксорубицина можно рекомендовать как перспективные для разработки новых лекарственных форм для лечения ряда онкологической патологии.
Список литературы Сравнительный морфологический анализ нефротоксичности доксорубицина и наноструктурированного доксорубицина в условиях перевиваемого канцерогенеза
- Reshetarova DA. Analiz onkologicheskoj zabolevaemosti naseleniya PFO Sovremennye problemy territorial'nogo razvitiya: elektron. zhurn. 2018;2 ID 39 ISSN:2542-2103.
- Terasaki T, Iga T, Sugiyama Y, Sawada Y, Hanano M. Nuclear binding as a determinant of tissue distribution of adriamycin, daunomycin, adriamycinol, daunorubicinol and actinomycin D. J Pharmacobiodyn. 1984;7(5):269-277.
- Matyash MG, Kravchuk TL, Vysockaya VV, Chernov VI, Gol'dberg VE. Inducirovannaya antraciklinami kardiotoksichnost': mekhanizm razvitiya i klinicheskie proyavleniya. Sibirskij onkologicheskij zhurnal. 2008;6(30):66-75.
- Ipatova OM, Zykova MG, Torhovskaya TI, Medvedeva NV, Prozorovskij VN. Vozmozhnosti ispol'zovaniya fosfolipidnoj nanosistemy s glicirrizinovoj kislotoj (Fosfogliv) dlya optimizacii lekarstvennyh preparatov, na primere doksorubicina i budesonida. Biomedicinskaya himiya. 2009;55(2):185-194.
- Pyataev NA, Shchukin SA, Korovina EYu, Zyrnyaeva NN. Osobennosti tkanevogo raspredeleniya i protivoopuholevoj aktivnosti doksorubicina pri vvedenii v forme kon"yugata s DNK u krys s transplantirovannoj karcinomoj RS-1. Rossijskij bioterapevticheskij zhurnal. 2011;10(2):55-61.
- Ying XY, Du YZ, Chen WW, Yuan H, Hu FQ. Preparation and characterization of modified lipid nanoparticles for doxorubicin controlled release. Pharmazie. 2008;63(12):878-882.
- Allen TM, Cullis PR. Liposomal drag delivery system: From concept to clinical applications. Adv Drag Deliv Rev. 2013;65:36-48.
- Alekseev KV, Alyautdin RN, Blynskaya EV, Kvinh BT. Nanorazmernye sistemy dostavki lekarstvennyh veshchestv. Vestnik novyh medicinskih tekhnologij. 2009;16(2):17-20.
- Baryshnikov AYu. Nanostrukturirovannye liposomal'nye sistemy kak sredstvo dostavki protivoopuholevyh preparatov. Vestnik RAMN. 2012;3:23-30.
- Tsyganova NA, Khayrullin RM, Terentyuk GS, et al. Pronitsaemost' pegilirovannykh zolotykh nanochastits cherez gematoplatsentarnyy bar'er krys//Byulleten' eksperimental'noy biologii i meditsiny. 2014;15 (3): 366-369.
- Sharafutdinova LA, Khismatullina ZR, Daminov MR, Valiullin VV. The study of embryotoxic effect of titanium dioxide nanoparticles on rats. Morfologicheskie Vedomosti -Morphological Newsletter. 2017;25(3):37-42.


