Средне-отдаленные результаты каротидного стентирования при асимптомных стенозах сонных артерий
Автор: Багин С.А., Крайнюков П.Е., Шугушев З.Х., Максимкин Д.А., Саидов С.С., Волков С.В., Коробков А.О.
Журнал: Вестник медицинского института "РЕАВИЗ": реабилитация, врач и здоровье @vestnik-reaviz
Рубрика: Клиническая медицина
Статья в выпуске: 2 (50), 2021 года.
Бесплатный доступ
В статье описан опыт применения каротидного стентирования при асимптомном церебральном атеросклерозе. В исследование вошло 147 пациентов с односторонним асимптомным поражением сонной артерии. Проведена оценка средне-отдаленных результатов каротидного стентирования у пациентов с асимптомными стенозами в сравнении с применением у данной категории пациентов консервативного лечения («оптимального медикаментозного лечения»). В ходе работы не было выявлено достоверного межгруппового различия частот возникновения неблагоприятных исходов (ТИА/инсульт, смерть от инсульта) в течение года с момента оперативного лечения или начала комплексной коррекции факторов риска.
Атеросклероз, стент, стеноз сонной артерии
Короткий адрес: https://sciup.org/143175597
IDR: 143175597 | УДК: 616.133.33-004.6 | DOI: 10.20340/vmi-rvz.2021.2.CLIN.3
Текст научной статьи Средне-отдаленные результаты каротидного стентирования при асимптомных стенозах сонных артерий
УДК 616.133.33-004.6
В настоящее время каротидная эндартерэктомия (КЭАЭ) является «стандартом» в реваскуляризации головного мозга, тогда как сравнимая с КЭАЭ эффективность и безопасность каротидной ангиопластики со стентированием (КАС) не может считаться абсолютно доказанной, так как имеет больший перипроцедуральный риск развития значимых осложнений [7, 8]. Конкурирующим по уровню доказательности с эндоваскулярными и открытыми хирургичис-кими методами профилактики острого нарушения мозгового кровообращения (ОНМК) при асимптомных поражениях экстракраниальных артерий является оптимальная медикаментозная терапия (ОМТ или Best Medical Treatment – ВМТ), напрв-ленная на коррекцию основных факторов риска прогрессирования и осложнений атеросклеротического процесса, таких как гиперлипидемия, артериальная гипертензия, гипергликемия, курение, дезагрегант-ная, а при необходимости – антикоагулянтная терапия.
Соотношение «Польза – Риск» является определяющим в предпочтении той или иной лечебной тактики. ВМТ сопоставима с хирургическим методами профилактики ОНМК за счет минимального риска своего применения, однако значительно уступает хирургическим методам лечения при благоприятных вариантах их применения. Наличие гемодинамически значимого асимптом-ного каротидного стеноза, даже при практически полном нивелировании риска развития ОНМК, прогрессивно приводит к развитию атрофических изменений вещества головного мозга, что клинически про-
является снижением когнитивной функции, которое также приводят не только к утрате трудоспособности, но и, в дальнейшем, к бытовой зависимости и, следовательно, к значительному снижению качества жизни.
Материалы и методы
В исследование включены пациенты, подвергшиеся хирургическому лечению по поводу асимптомного стеноза внутренней сонной артерии в период с 2012 по 2017 гг. Перед включением в выборку у всех пациентов было получено информированное письменное согласие на участие в исследовании.
Всего в исследование вошло 147 пациентов с односторонним асимптомным атеросклеротическим гемодинамически значимым поражением внутренних сонных артерий.
Критерии включения в исследование:
-
- наличие стеноза 70–99 % просвета ВСА по данным дуплексного сканирования брахиоцефальных артерий (БЦА) и/или ангиографии магистральных артерий головы;
-
- отсутствие в анамнезе хирургических вмешательств на экстракраниальных артериях.
Критерии исключения из исследования:
-
- КЭАЭ и/или КАС в анамнезе;
-
- наличие хронической окклюзии одной из ВСА;
-
- ОНМК/ТИА в анамнезе.
В зависимости от типа имплантированного стента, пациенты были разделены на четыре группы: группа 1 (N = 37, 25 мужчин и 12 женщин, средний возраст 66,29 ± 7,84 года), группа 2 (N = 32, 19 мужчин и 13 женщин, средний возраст 64,21 ± 6,75 года),
Таблица 1. Распределение количества наблюдений по группам
Table 1. Distribution of the number of observations by groups
|
Группа 1 |
Группа 2 |
Группа 3 |
Группа 4 |
Группа 5 |
|
N = 37 |
N = 32 |
N = 20 |
N = 19 |
N = 39 |
|
(21,4 %) |
(18,5 %) |
(11,6 %) |
(11,0 %) |
(22,5 %) |
Таблица 2. Сравнение протяженности стеноза ВСА в исследуемых группах
Table 2. Comparison of the length of ICA stenosis in the studied groups
|
Протяженность стеноза ВСА, мм |
Группа 1 |
Группа 2 |
Группа 3 |
Группа 4 |
Группа 5 |
|
16,38 ± 2,83 ΔΔ |
14,19 ± 2,07 ΔΔ |
16,42 ± 1,55 ΔΔ |
19,1 ± 3,21 ΔΔ |
19,4 ± 1,38 ΔΔ |
Примечание: ΔΔ – различия между группами недостоверны (р > 0,05).
Наружная сонная артерия
Внутренняя сонная артерия
В
А
С
Ожидаемое расположение артериальной стенки
Рис. 1. Расчет диаметра стеноза по критериям NASCET: A – диаметр ВСА дистальнее стеноза, включая постстенотическое расширение; B – наименьший диаметр в области стеноза; С – диаметр ВСА, включая атеросклеротическую бляшку
Fig. 1. Calculation of the diameter of stenosis according to NASCET criteria: A – ICA diameter distal to stenosis, including post-stenotic expansion; B – the smallest diameter in the area of stenosis; C – diameter of the ICA, including atherosclerotic plaque
Всем пациентам исследования проводили двойную антиагрегантную терапию, состоящую из аспирина (100 мг ежедневно) и клопидогреля (плавикс) 75 мг. Рекомендованную антитромботическую терапию пациенты получали регулярно, как минимум за трое суток до КАС. В отдельных случаях назначали нагрузочную дозу клопидогреля (плавикс) – 300 мг однократно накануне операции (в большинстве случаев за 6–12 часов до вмешательства). Двойную антиагрегантную терапию проводили у всех пациентов после имплантации стента: кло-пидогрел (плавикс) 75 мг в сутки в течение трех месяцев, аспирин – неограниченно долго.
Во всех случаях использовали системы защиты от дистальной эмболии. У 97 пациентов (89,81 %) применяли дистальную (фильтр-протекционная система RX Accunet Embolic Protection System, Abbott Vascular, USA), а в 11 случаях (10,19 %) – проксимальную (Mo.Ma Ultra Proximal Cerebral, Medtronic, USA) системы защиты церебрального кровотока).
Выбор инструментария для проведения операции каротидного стентирования осуществлялся с учетом анатомических особенностей сонных артерий, характера атеросклеротической бляшки и материальнотехнического оснащения отделения на момент выполнения вмешательства. В случае стеноза ВСА более 80 % выполняли предилатацию области стеноза.
Целевыми значениями уровня гликемии принимались суточные колебания глюкозы крови в пределах 3–10 ммоль/л. На протяжении всего периода наблюдения пациенты получали двойную дезагрегантную терапию (аспирин 100 мг + клопидогрель 75 мг в сутки). Достигнутым целевым максимумом артериального давления считался уровень 140/90 мм рт. ст. Целевым уровень общего холестерина крови считался показатель менее 4,5 ммоль/л, липопротеинов низкой плотности (ЛПНП) – менее 2,5 ммоль/л, три-ацилглицеридов (ТАГ) – менее 1,7 ммоль/л. С пациентами проводилась беседа, в ходе которой разъяснялся оптимальный образ жизни, диета, а также настоятельно рекомендовался отказ от вредных привычек.
Таблица 3. Сравнение степени стеноза ВСА до и после КАС и исходно в группе оптимального медикаментозного лечения
Table 3. Comparison of the degree of ICA stenosis before and after CAS and at baseline in the group of optimal drug treatment
|
Степень стеноза ВСА, % |
Группа 1 |
Группа 2 |
Группа 3 |
Группа 4 |
Группа 5 |
|
До КАС (ОМТ) |
76,38 ± 8,85 |
74,19 ± 7,02 |
74,45 ± 7,55 |
79,1 ± 10,27 |
72 ± 8,63 |
|
После КАС (ОМТ) |
28,11 ± 5,82 Δ |
29,18 ± 5,35 Δ |
28,6 ± 5,26 Δ |
28,05 ± 5,09 Δ |
– |
Примечание: Δ – внутригрупповые различия достоверны (р < 0,05).
Таблица 4. Сравнение степени стеноза ВСА до, непосредственно после КАС или КЭАЭ и через год Table 4. Comparison of the degree of ICA stenosis before, immediately after CAS or CEAE and after a year
|
Степень стеноза ВСА, % |
Группа 1 |
Группа 2 |
Группа 3 |
Группа 4 |
Группа 5 |
|
До КАС |
76,38 ± 8,85 |
74,19 ± 7,02 |
74,45 ± 7,55 |
79,1 ± 10,27 |
72 ± 8,63 |
|
После КАС |
28,11 ± 5,82 Δ |
29,18 ± 5,35 Δ |
28,6 ± 5,26 Δ |
28,05 ± 5,09 Δ |
– |
|
Через 1 год |
45,79 ± 8,64 Δ |
44,41 ± 9,25 Δ |
42,90 ± 5,80 Δ |
40,63 ± 5,42 Δ |
74,16 ± 5,72 ΔΔ |
|
p-value |
0,029 |
0,032 |
0,037 |
0,041 |
0,628 |
Примечание: Δ – внутригрупповые различия достоверны по сравнению с исходным значением стеноза ВСА после КАС (р < 0,05); ΔΔ – внутригрупповые различия недостоверны по сравнению с исходным значением стеноза ВСА после КАС (р > 0,05).
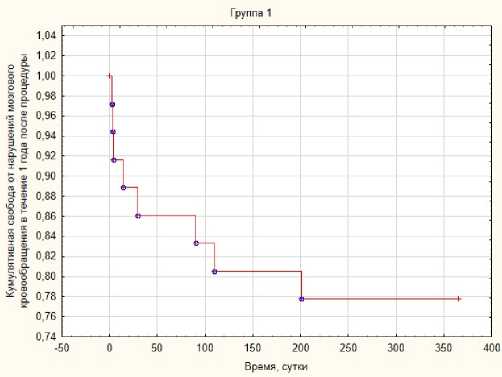
Рис. 2. Свобода от нарушений мозгового кровообращения в течение года после КАС в 1-й группе
Fig. 2. Liberation from cerebrovascular accidents within a year after CAS in the 1st group
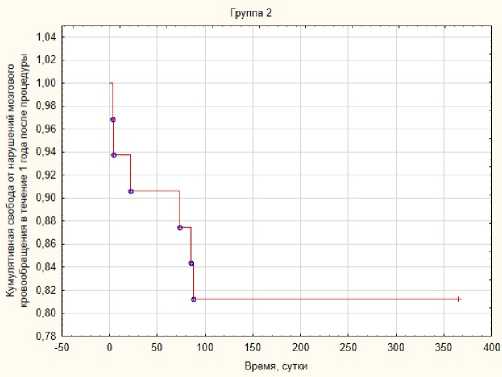
Рис. 3. Свобода от нарушений мозгового кровообращения в течение года после КАС во 2-й группе
Fig. 3. Liberation from cerebrovascular accidents within a year after CAS in group 2
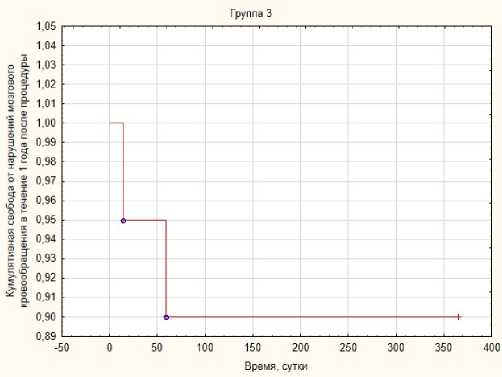
Рис. 4. Свобода от нарушений мозгового кровообращения в течение года после КАС в 3-й группе
Fig. 4. Liberation from cerebrovascular accidents within a year after CAS in the 3rd group группа 3 (N = 20, 15 мужчин и 5 женщин, средний возраст 66,42 ± 7,13 года), группа 4 (N = 19, 12 мужчин и 7 женщин, средний возраст 65,36 ± 6,10 года), группа 5 – контрольная (N = 39, 24 мужчины и 15 женщин, средний возраст 69,41 ± 5,13 года) (табл. 1).
Группа 1 – пациенты с имплантированными стальными саморасширяющимися стентами (Wallstent, Boston Scientific, США). В группу 2 вошли пациенты с имплантированными нитилоновыми конусными и цилиндрическими стентами (AccuLink, Abbott, США). Группа 3 включала пациентов, которым была выполнена имплантация каротидных стентов двухслойной структуры (Casper, Microvention, США). Группа 4 состояла из пациентов с имплантированными двухслойными стентами с внутренним слоем из полиэтилентерфталата (CGuard, InspireMD, США). Группа 5 (контрольная) включала пациентов с асимптомным стенозом ВСА, которым проводилась консервативная профилактическая терапия ОНМК, направленная на коррекцию основных факторов риска, хирургическая реваскуляризация головного мозга не проводилась по медицинским (наличие онкологических заболеваний, хронической сердечной недостаточности II–IV ФК, неконтролируемой артериальной гипертензии, хронической болезни почек III–V стадий, дыхательной недостаточности II–III стадии, хронической печеночной недостаточности, психических
заболеваний) или парамедицинским причинам (отказ пациента от операции).
Показания к эндоваскулярному вмешательству формулировались в соответствии с национальными рекомендациями по ведению пациентов с заболеваниями брахиоцефальных артерий [1].
Контрольной точкой исследования считалась частота возникновения ишемических событий в цереброваскулярном бассейне, смерть от инсульта, контрольный визит через один год после процедуры каротидного стентирования.
Критериями ангиографического успеха стентирования считали: восстановление просвета ВСА с возможным остаточным стенозом до 30 %, отсутствие диссекции и полное покрытие стентом зоны поражения.
Оценку степени стеноза сонных артерий по результатам ультразвукового исследования производили в соответствии с критериями NASCET [3, 9], основываясь на данных B-режима и цветового картирования кровотока. Оценивали локализацию, протяженность, степень стенотического поражения БЦА.
На основании данных предоперационного цветового дуплексного сканирования (ЦДС) брахиоцефальных артерий не было выявлено значимого межгуппового различия в протяженности стенотического поражения ВСА (табл. 2).
Результаты
При КАС в 100 % случаев применялся бедренный доступ. Всего выполнено 108 имплантаций каротидных самораскрывающихся стентов. Ангиографический успех, которым считался резидуальный стеноз не более 30 %, достигнут у 100 % пациентов.
При контрольном УЗДС экстракраниальных артерий с прицельной оценкой зоны эндоваскулярной реконструкции через один год с момента выполнения процедуры выявлено достоверное нарастание степени стеноза ВСА в области установленного стента. При межгрупповом сравнении степень рестеноза в области имплантированного стента оказалась сопоставима (табл. 4).
Летальность в исследуемых группах не отмечалась. Нарушения мозгового кровообращения со стойким неврологическим дефицитом выявлены в 1-й и 2-й группах и, вероятно, связаны с конструктивными особенностями данных моделей каротидных стентов. Таким образом, годовая свобода от нарушений мозгового кровообращения составила в 1-й группе 78,4 % (рис. 2). В 1-й группе зарегистрировано 8 случаев ОНМК: 7 по типу ТИА с полным регрессом
неврологической симптоматики в течение 24 часов, 1 инсульт. У одного из пациентов, перенесших ТИА интраоперационно, была зарегистрирована протрузия АСБ, потребовавшая дополнительной балонной экспозиции внутри стента.
Во 2-й группе зарегистрировано 5 случаев ОНМК по типу ТИА и 1 инсульт. В данной группе у трех пациентов интраоперационно была зарегистрирована протрузия АСБ, потребовавшая дополнительной ба-лонной экспозиции внутри стента, и в одном случае – имплантации «стент в стент». Свобода от нарушений мозгового кровообращения в течение года после процедуры во 2-й группе составила 81,25 % (рис. 3). Также отмечено, что в группе 1 клинически значимые нарушения мозгового кровообращения были более диссеминированы во времени, в то время как в группе 2 все они состоялись до 100-го дня с момента проведения КАС.
Свобода от нарушений мозгового кровообращения в течение года после процедуры в 3-й группе составила 90 % (рис. 4), в 4-й группе – 94,74 % (рис. 5), в контрольной группе – 92,3 % (рис. 6).
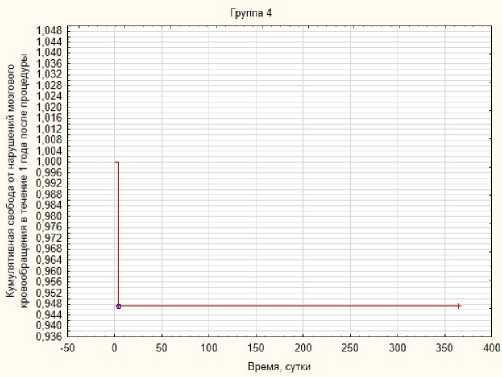
Рис. 5. Свобода от нарушений мозгового кровообращения в течение года после КАС в 4-й группе
Fig. 5. Liberation from cerebrovascular accidents within a year after CAS in the 4th group
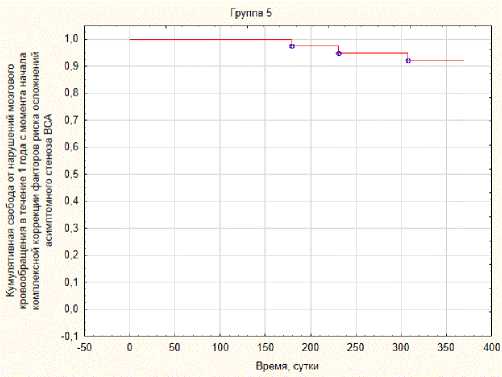
Рис. 6. Свобода от нарушений мозгового кровообращения в течение года с момента начала комплексной коррекции факторов риска асимптомного стеноза ВСА в контрольной группе
Fig. 6. Liberation from cerebrovascular accidents within a year from the start complex correction of risk factors for asymptomatic ICA stenosis in the control group
Наименьший показатель комплаентно-сти отмечен при отказе от курения и приёме гиполипидемической терапии (табл. 5). Целевые значения указанных лабораторных показателей были достигнуты у 28 пациентов (71,8 %).
В настоящем исследовании, при сопоставлении частот возникновения значимых церебральных событий в течение первого года при различных вариантах коррекции сосудистой недостаточности головного мозга, не было выявлено достоверно значимого межгруппового различия (р > 0,05), однако отмечалась различная временная диссеми- нация нарушений мозгового кровообращения за указанный временной интервал.
Обсуждение
Хирургические методы вторичной профилактики нарушений мозгового кровообращения при асимптомных стенозах сонных артерий остаются дискутабельной проблемой. До сих пор не проведены рандомизированные клинические исследования по сопоставлению эффективности КАС с оптимальной медикаментозной терапией (ОМТ) как для симптомных, так и для бессимптомных пациентов.
Таблица 5. Показатель приверженности лечению пациентов контрольной группы через год с момента назначения оптимальной медикаментозной терапии
Table 5. Indicator of adherence to treatment of patients in the control group one year after the appointment of optimal drug therapy
|
Оптимальная медикаментозная терапия |
Исходное количество пациентов, N (%) |
Количество пациентов, продолжавших придерживаться ОМТ через 1 год, N (%) |
Компла-ентность, % |
|
Двойная дезагрегантная терапия |
39 (100,0 %) |
39 (100,0 %) |
100,0 % |
|
Гипотензивная терапия |
26 (66,67 %) |
24 (61,54 %) |
92,31 % |
|
Гиполипидемическая терапия |
32 (82,05 %) |
21 (53,85 %) |
65,63 % |
|
Гипогликемическая терапия |
11 (28,21 %) |
10 (25,64 %) |
90,91 % |
|
Отказ от табакокурения |
17 (43,59 %) |
7 (17,95 %) |
41,18 % |
Список литературы Средне-отдаленные результаты каротидного стентирования при асимптомных стенозах сонных артерий
- Nacional'nye rekomendacii po vedeniyu pacientov s zabolevaniyami brahiocefal'nyh arterij. Angiologiya i sosudistaya hirurgiya. 2013;19(2):1-71. (In Russ).
- Lutz H.J. et al. Best medical therapy or wishful thinking in carotid disease? A single-center audit in Germany. Eur. J. Vasc. Endovasc. Surg. 2011;42(4)501-506.
- Moneta G.L. et al. Correlation of North American Symptomatic Carotid Endarterectomy Trial (NASCET) angi ographic definition of 70 % to 99 % internal carotid artery stenosis with duplex scanning. J. Vasc. Surg. 1993;17(1):152-157.
- Mas J.L. et al. Endarterectomy versus angioplasty in patients with symptomatic severe carotid stenosis (EVA-3s) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol. 2008;7(10):885-892.
- Stolker J.M. et al. Health-related quality of life following carotid stenting versus endarterectomy: results from the SAPPHIRE (Stenting and Angioplasty with Protection in Patients at HIgh Risk for Endarterectomy) trial. JACC: Cardiovasc. Interv. 2010;3(5):515-523.
- Brott T.G. et al. Long-term results of stenting versus endarterectomy for carotid-artery stenosis. New Engl. J. Med. 2016;374(11)1021-1031.
- Giacovelli J.K. et al. Outcomes of carotid stenting compared with endarterectomy are equivalent in asymp tomatic patients and inferior in symptomatic patients. J. Vasc. Surg. 2010;52(4):906-913.
- Silver F.L. et al. Safety of stenting and endarterectomy by symptomatic status in the carotid revascularization endarterectomy versus stenting trial (CREST). Stroke. 2011;42(3):675-680.
- Ferguson G.G. et al. The North American Symptomatic Carotid Endarterectomy Trial. Stroke. 1999;30(9):1751-1758.


