Среднеотдаленные результаты профилактической аблации предсердий у пациентов с пороками митрального клапана и атриомегалией: пилотное рандомизированное исследование
Автор: Богачев-прокофьев А.В., Сапегин Андрей Викторович, Пивкин А.Н., Шарифулин Р.М., Афанасьев А.В., Овчаров мА., Караськов А.М.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Нарушения ритма сердца
Статья в выпуске: 2 т.21, 2017 года.
Бесплатный доступ
Обоснование Сохранение или появление фибрилляции предсердий после операции на митральном клапане существенно снижает число положительных результатов операции в отдаленные сроки, обусловливая недостаточность кровообращения, сопутствующую пороку, и усиление легочной гипертензии, а также увеличивая риск тромбоэмболических осложнений и инсульта. В послеоперационном периоде разработаны и изучены стратегии медикаментозной профилактики развития ФП, при этом инвазивные методики находятся на стадиях разработки и клинических испытаний. Цель Провести оценку безопасности и эффективности процедуры хирургической профилактики фибрилляции предсердий у пациентов с атриомегалией и пороками митрального клапана в ближайшем послеоперационном периоде. Методы Проведен анализ 40 пациентов, оперированных в Сибирском федеральном биомедицинском исследова тельском центре имени академика Е.Н. Мешалкина в 2015-2017 гг. В исследование включены все пациенты с митральным пороком и дилатацией левого предсердия более 60 мм. Все пациенты имели синусовый ритм на момент операции и не имели документированной фибрилляции предсердий в анамнезе. Средний возраст пациентов составил 48,9±10,1 (23-69) года. Всем пациентам по показаниям выполнено вмешательство на митральном клапане. Случайным образом больные разделены на две группы: пациентов, подвергшихся конкомитантной превентивной аблации (п = 20), и пациентов с изолированным вмешательством на митральном клапане (п = 20). Проведена сравнительная оценка осложнений и сохранности синусового ритма через 3 мес. после операции. Результаты Пациенты, подвергшиеся превентивной аблации, через 3 мес. после операции значимо не отличались по количеству и характеру осложнений в сравнении с контрольной группой. В группе пациентов с превентивной аблацией отмечена более высокая свобода от фибрилляции предсердий в сравнении с группой пациентов, которым выполнена изолированная коррекция митрального порока: 95 против 40% пациентов соответственно. Заключение Превентивная аблация предсердий у пациентов с пороками митрального клапана и атриомегалией позволя ет уменьшить риск фибрилляции предсердий в 1,6 раза через 3 мес. после операции.
Фибрилляция предсердий, порок митрального клапана, атриомегалия, ревматическая болезнь сердца
Короткий адрес: https://sciup.org/142140801
IDR: 142140801 | DOI: 10.21688-1681-3472-2017-2-98-107
Текст научной статьи Среднеотдаленные результаты профилактической аблации предсердий у пациентов с пороками митрального клапана и атриомегалией: пилотное рандомизированное исследование
Фибрилляция предсердий (ФП) является самой распространенной наджелудочковой аритмией, которая значительно влияет на качество жизни пациентов, увеличивая число госпитализаций и риск смерти, обусловленной кардиальными причинами [1].
Поражение митрального клапана в естественном течении приводит к структурным изменениям левого предсердия как компенсирующей камеры: электрофизиологическому и структурному ремоделированию предсердного миокарда. Изменение электрофизиологических свойств влечет за собой нарушение сократительной функции предсердий. Структурное ремоделирование, гистологически проявляющееся фиброзом и потерей массы миокарда предсердий, необратимо и ведет к формированию блоков проведения, что является прямым фактором возникновения re-entry [2, 3].
Таким образом, возникновение ФП является закономерной стадией естественного течения митрального порока сердца [4] и встречается в 30–84% случаев у пациентов, требующих хирургического лечения клапанного порока [5–7].
Несколько мультицентровых проспективных рандомизированных исследований показали, что хирургическое лечение ФП при «открытых» операциях на сердце обусловливает более высокую свободу от фибрилляции предсердий, чем в группах пациентов, которым такое вмешательство не выполнялось [8].
Учитывая возрастающую долю реконструктивных операций при коррекции клапанных пороков, актуальность восстановления и поддержания синусового ритма неоспорима. Правильный ритм и отсутствие искусственного клапана сердца позволяют избежать пожизненного применения оральных антикоагулянтов [3].
Однако довольно большая группа пациентов не имеет пароксизмов ФП в анамнезе, и, несмотря на успешную гемодинамическую коррекцию порока, у многих пациентов ФП проявляется в отдаленном послеоперационном периоде. Выполнение катетерных методик лечения ФП после «открытых» кардиохирургических вмешательств затруднительно и связано с высоким риском [9].
Основной причиной возникновения ФП является патология митрального клапана [10], поэтому гемодинамическая коррекция порока является залогом успешного лечения ФП. Однако пациенты с поражением клапанного аппарата имеют множество факторов, предрасполагающих к возникновению и прогрессированию ФП: возраст, дилатацию левого предсердия (ЛП), снижение сократительной способности ЛЖ и морфологические изменения миокарда предсердий. По данным небольшого количества клинических наблюдений, самостоятельное восстановление синусового ритма у пациентов с ФП после гемодинамической коррекции порока наблюдается лишь в 2–5% случаев [11].
Достоверными предикторами возникновения ФП после коррекции порока являются исходный размер левого предсердия более 6,0 см, стенотическое поражение и ревматический генез митрального порока [12, 3].
H.J. Kim с соавторами показали, что впервые возникшая ФП после вмешательства на митральном
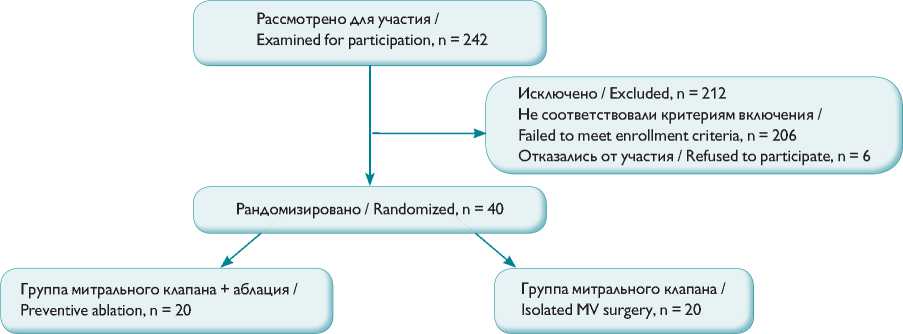
Рис. 1. Включение пациентов в исследование Fig. 1. Patient enrollment diagram
клапане по поводу ревматического поражения развивается в 20,5% случаев. Ежегодный прирост ФП у пациентов с данным заболеванием составляет 3,5%/ лет, зависит от размеров левого предсердия и тяжести митрального порока. Так, в группе пациентов с размером левого предсердия более 47 мм частота развития ФП была значительно выше [13].
При успешном нехирургическом восстановлении правильного ритма, несмотря на достаточную медикаментозную поддерживающую терапию, в отдаленном периоде возможен рецидив ФП ввиду непрекращающегося прогрессирования патологического процесса [14].
Ранняя диагностика и лечение, в том числе превентивное, являются важными факторами успешной и длительной конверсии ФП при митральных пороках сердца [15].
В связи с вышеизложенным возникает вопрос о целесообразности профилактической аблации предсердий у пациентов с пороками митрального клапана и атриомегалией.
Цель исследования: оценка безопасности и эффективности превентивной аблации у пациентов при коррекции митрального порока сердца, осложненного атриомега-лией.
Методы
Исследование является проспективным пилотным простым «слепым» рандомизированным.
В исследование включены 40 пациентов, оперированных в ФГБУ «СФБМИЦ им. ак. Е.Н. Мешалкина» в 2015–2017 гг.
Критерии включения: гемодинамически значимый порок митрального клапана, требующий хирургической коррекции; дилатация левого предсердия не менее 60 мм (по данным ЭхоКГ); синусовый ритм на момент операции и отсутствие документированных пароксизмов ФП в анамнезе.
Критерии исключения: гемодинамически значимое поражение аортального клапана; поражение коронарного русла, требующее вмешательства; отказ от участия в исследовании.
Первичная конечная точка исследования была комбинированной, включающей летальность и серьезные события послеоперационного периода: инфаркт миокарда, острое нарушение мозгового кровообращения, повторную госпитализацию, реоперацию. Вторичной конечной точкой была свобода от фибрилляции предсердий / трепетания предсердий / предсердной тахикардии (ФП/ТП/ПТ) через 3, 6, 9, 12 мес. после операции.
Исследование одобрено локальным этическим комитетом: № протокола 43, дата заседания 21.11.2014 г. Все пациенты подписали информированное согласие.
Основным показанием к оперативному лечению, согласно руководству Европейской ассоциации кардио-торакальных хирургов / Европейского общества кардиологов (англ. European Association for Cardio-Thoracic Surgery
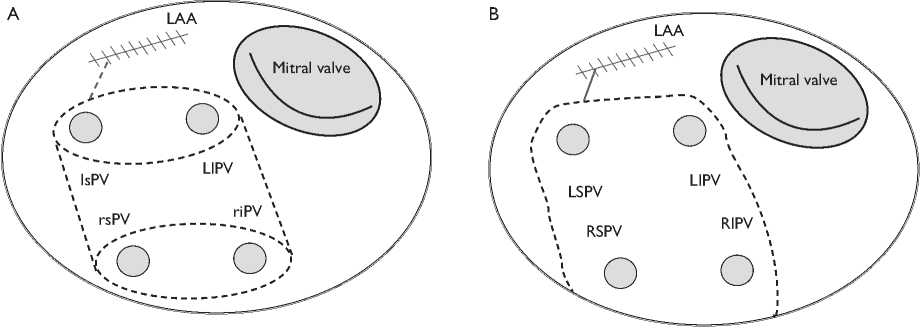
Рис. 2. Схема радиочастотной аблации ( А ) и криоаблации ( B ) левого предсердия
Fig. 2. Radiofrequency ablation and cryoablation diagram for left atrium
LAA (left atrial appendage) — ушко левого предсердия; Mitral valve — митральный клапан; LSPV (left superior pulmonary vein) — левая верхнедолевая легочная вена; LIPV (left inferior pulmonary vein) — левая нижнедолевая легочная вена; RSPV (right superior pulmonary vein) — правая верхнедолевая легочная вена; RIPV (right inferior pulmonary vein) — правая нижнедолевая легочная вена
/ European Society of Cardiology, EACTS/ESC) по ведению пациентов с клапанными пороками сердца 2014 г., являлось гемодинамически значимое поражение митрального клапана. Атриомегалию ЛП более 60 мм диагностировали на основании трансторакальной эхокардиографии (Эх-оКГ) из четырехкамерной позиции (рис. 1).
Методом генератора случайных чисел больные разделены на две группы: МК + аблация (n = 20) — пациенты, подвергшиеся хирургической профилактике фибрилляции предсердий, МК (n = 20) — пациенты контрольной группы, получившие изолированное вмешательство на митральном клапане.
Аблация выполнялась посредством неорошаемого биполярного радиочастотного электрода-зажима Isolator Synergy (AtriCure Inc., Cincinnati, OH, USA) либо криозонда CryoIce (AtriCure Inc., Cincinnati, OH, USA). Радиочастотная аблация производилась по схеме: изоляция правых и левых легочных вен отдельными коллекторами, изоляция задней стенки ЛП (box-lesion) с линией к ушку ЛП (рис. 2, А). В случае криоаблации проводилась изоляция задней стенки левого предсердия с линией к ушку ЛП (рис. 2, B). Ушко ЛП выключено из кровотока двурядным непрерывным швом.
Оценка сердечного ритма в раннем послеоперационном периоде проводилась на основании 24-часового холтеровского мониторинга электрокардиографии (ЭКГ), а через 3 мес. после операции использовался 72-часовой анализ электрокардиографии.
Статистический анализ
Данные пред- и интраоперационного исследования пациентов, а также результаты послеоперационного периода были подвергнуты статистической обработке с помощью пакета программ Stata10.0. Для описательной статистики количественных нормально распределенных признаков с равенством дисперсий использовались пара-
Таблица 1 Исходная характеристика пациентов
|
Показатель |
МК + аблация, n = 20 |
МК, n = 20 |
P |
|
Возраст, лет |
54,10±10,39 |
57,18±7,28 |
0,284 |
|
Пол (женский), n |
11 |
12 |
0,880 |
|
Размер ЛП, мм |
66±4,3 |
69±5,2 |
0,054 |
|
Протезирование МК, n (%) |
10 (50) |
9 (45) |
0,751 |
|
Пластика МК, n (%) |
10 (50) |
11 (55) |
0,751 |
|
Прочие вмешательства, n (%) |
|||
|
пластика трикуспидального клапана |
4 (20) |
6 (30) |
0,465 |
|
иссечение предаортальной мембраны |
1 (5) |
0 (0) |
0,311 |
|
пластика ДМПП |
2 (10) |
1 (5) |
0,548 |
|
РЧА легочной артерии |
1 (5) |
0 (0) |
0,311 |
|
ФВ ЛЖ, % |
67,1±6,47 |
70,8±5,63 |
0,061 |
|
Сахарный диабет, n (%) |
2 (10) |
3 (15) |
0,632 |
|
Заболевания щитовидной железы, n (%) |
2 (10) |
1 (5) |
0,548 |
|
ФК по NYHA, n (%) |
|||
|
II |
14 (70) |
16 (80) |
0,465 |
|
III |
6 (30) |
4 (20) |
0,465 |
|
Этиология, n (%) |
|||
|
ревматический порок |
11 (55) |
12 (60) |
0,749 |
|
дегенеративный порок |
8 (40) |
6 (30) |
0,507 |
|
инфекционный эндокардит |
1 (5) |
2 (10) |
0,548 |
|
Характер поражения митрального клапана, n (%) |
|||
|
стеноз |
7 (35) |
7 (35) |
0,999 |
|
недостаточность |
9 (45) |
8 (40) |
0,749 |
|
сочетанное поражение |
4 (20) |
5 (25) |
0,705 |
Примечание. МК — митральный клапан; ЛП — левое предсердие; ДМПП — дефект межпредсердной перегородки; РЧА — радиочастотная аблация; ФВ ЛЖ — фракция выброса левого желудочка; ФК по NYHA — функциональный класс по классификации Нью-Йоркской ассоциации сердца (англ. New York Heart Association)
Таблица 2 Данные операции и ближайшего послеоперационного периода
Результаты
Ни по одному из исходных дооперационных параметров не получено достоверных различий (табл. 1).
Все вмешательства выполнены в условиях искусственного кровообращения и умеренной гипотермии (33 °С). С целью кардиоплегии использовался раствор «Кусто-диол» (Dr. F.KOHLER CHEMIE, GmbH, Германия).
Значимо различались время окклюзии аорты и общее время искусственного кровообращения, что обусловлено временем, затраченным на выполнение левопредсердной аблации в группе профилактики ФП (табл. 2).
Госпитальной летальности в обеих группах не было. Несмотря на более продолжительное время искусственного кровообращения и пережатия аорты в группе МК + аблация, не отмечено достоверной межгрупповой разницы ни по характеру, ни по количеству осложнений в пе-риоперационном периоде (табл. 3).
В раннем послеоперационном периоде отмечено наиболее частое возникновение пароксизмов ФП в группе МК — 9 (45%) пациентов, в сравнении с 3 (15%) пациентами группы МК + аблация (p = 0,009).
Восстанавливали ритм медикаментозно (внутривенное введение амиодарона), при неэффективности медикаментозной кардиоверсии применяли электроимпульсную терапию.
На момент выписки у всех, за исключением одного пациента группы МК + аблация, восстановлен синусовый ритм. Одному (5%) пациенту группы МК в связи с развившейся брадиформой ФП имплантирован постоянный электрокардиостимулятор в режиме стимуляции VVI.
Пациентам обеих групп с пароксизмами ФП на госпитальном этапе в течение 3 мес. после операции назначена антиаритмическая терапия (табл. 4).
Таблица 3 Осложнения в ближайшем периоперационном периоде
|
Показатель |
МК + аблация, n = 20 |
МК, n = 20 |
p |
|
Острое нарушение мозгового кровообращения / транзиторная ишемическая атака, n (%) |
0 (0) |
1 (5) |
0,311 |
|
Реоперация ввиду кровотечения, n (%) |
1 (5) |
1 (5) |
0,999 |
|
Острая почечная недостаточность, n (%) |
0 |
1 (5) |
0,311 |
|
Хирургическая инфекция, n (%) |
1 (5) |
0 (0) |
0,311 |
|
Экссудативный перикардит, n (%) |
1 (5) |
2 (10) |
0,548 |
|
Экссудативный плеврит, n (%) |
4 (20) |
3 (15) |
0,677 |
|
Ранние пароксизмы фибрилляции предсердий, n (%) |
3 (15) |
9 (45 ) |
0,038 |
|
Имплантация электрокардиостимулятора, n (%) |
0 (0) |
1 (5) |
0,311 |
|
Срок госпитализации, дней |
16,2±4,9 |
17,1±4,5 |
0,548 |
Наблюдение проводилось через 1 и 3 мес. после операции. Обследование проводилось как при очной консультации, так и c помощью анализа данных, полученных при дистанционном обследовании (телефонный контакт с пациентом, эхокардиография, консультация кардиолога). На всех этапах наблюдения обследованы 40 (100%) пациентов из обеих групп.
Смертности не было в обеих группах. Повторные вмешательства на клапанах сердца не выполнялись в обеих группах. Свобода от ФП/ТП/ПТ оценивалась по данным ЭКГ в течение 30 сут. после операции и трехсуточного мониторирования ЭКГ на этапе наблюдения 3 мес. На момент анализа сердечного ритма 19 (95%) в группе МК + аблация и 12 (60%) пациентов в группе МК были свободны от ФП/ТП/ ПТ (p = 0,008) (рис. 3).
Анализ предикторов развития ФП производился по методике mixed-model c ограничением коэффициента правдоподобия. Оценены факторы: отсутствие превентивной аблации, пол, возраст пациентов, этиология порока, характер гемодинамических нарушений на МК (стеноз или недостаточность), размер левого предсердия, фракция выброса левого желудочка, наличие сопутствующей патологии трехстворчатого клапана, давление в легочной артерии.
Показано, что предикторами развития ФП на этапе 3-месячного периода являлись исходный размер левого
По поводу декомпенсации кровообращения на фоне пароксизма ФП были госпитализированы один пациент в группе МК + аблация в сроки 2 мес. после операции, два пациента в группе МК в сроки 1 и 2 мес. соответственно. В группе МК + аблация один пациент госпитализирован по поводу пневмонии на 12-е сут. с момента выписки (22е сут. после операции).
По результатам проведенной контрольной ЭхоКГ на этапах наблюдения отмечается динамика во времени, при внутригрупповом сравнении размер полости левого предсердия уменьшается (табл. 7). Однако не получено достоверно значимой межгрупповой разницы в динамике раз-
Свобода от ФП / Freedom from AF ■ ФП / AF
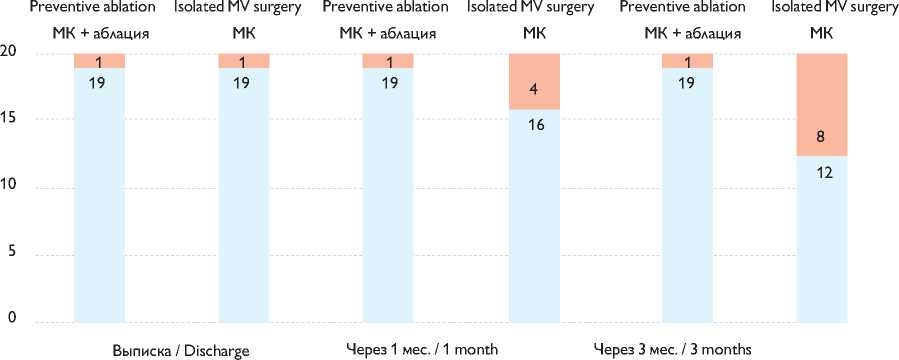
Рис. 3. Свобода от фибрилляции предсердий (ФП) / трепетания предсердий / предсердной тахикардии в сроки до 3 мес. после вмешательства
Fig. 3. Freedom from atrial fibrillation (AF) / atrial flutter / atrial tachycardia within three months after surgery. MV: mitral valve
|
Таблица 5 Предикторы развития фибрилляции предсердий в послеоперационном периоде |
|||
|
Показатель |
Отношение рисков |
Доверительный интервал |
р |
|
Размер ЛП |
0,982 |
0,972–0,995 |
0,005 |
|
Возраст |
0,998 |
0,994–1,001 |
0,306 |
|
Пол (мужской) |
1,247 |
1,096–1,419 |
0,001 |
|
Аблация |
0,786 |
0,689–0,897 |
0,000 |
|
Давление ЛА |
0,999 |
0,993–1,005 |
0,849 |
|
Ревматический порок |
0,938 |
0,767–1,148 |
0,538 |
|
Дегенеративный порок |
0,916 |
0,707–1,186 |
0,508 |
|
Инфекционный эндокардит |
1,017 |
0,792–1,307 |
0,890 |
|
Протезирование МК |
1,357 |
1,097–1,678 |
0,005 |
|
Вмешательство на ТрК |
1,294 |
1,135–1,474 |
0,000 |
|
Стеноз МК |
1,097 |
0,853–1,412 |
0,467 |
|
Недостаточность МК |
0,933 |
0,781–1,114 |
0,446 |
Примечание. ЛП — левое предсердие; ЛА — легочная артерия; ИЭ — инфекционный эндокардит; МК — митральный клапан; ТрК — трикуспидальный клапан; ОР — относительный риск; ДИ — доверительный интервал меров левого предсердия и сократительной способности левого желудочка, что обусловлено гемодинамической коррекцией порока митрального клапана (табл. 6).
Обсуждение
Порок митрального клапана в естественном течении осложняется развитием ФП, которая диагностируется более чем у 60% пациентов к моменту операции, и примерно у 80% из них она сохраняется после хирургической коррекции порока [6]. Фибрилляция предсердий, усугубляя легочную гипертензию, сопутствующую пороку, приводит к прогрессированию сердечной недостаточности и, как следствие, снижению качества жизни [11]. ФП является серьезным фактором тромбообразова-ния в левом предсердии и в 7 раз увеличивает риск эмбо- лических осложнений в сравнении со здоровой популяцией [16].
Гемодинамическая коррекция порока митрального клапана не исключает риск развития ФП в отдаленном послеоперационном периоде. До 90% пациентов после вмешательства на митральном клапане имеют ФП в отдаленные сроки вне зависимости от дооперационного анамнеза [4].
Многие авторы пытались стратифицировать пациентов, согласно риску возникновения аритмии. S.J. Kernis и коллеги в 2004 г. представили ретроспективный анализ 762 пациентов, оперированных по поводу недостаточности митрального клапана. Все пациенты имели синусовый ритм до операции, отсутствие пароксизмов ФП в анамнезе. У 72% пациентов удалось выполнить реконструктивное вмешательство на митральном клапане.
|
Таблица 6 Динамика эхокардиографических параметров фракции выброса левого желудочка и размеров левого предсердия |
|||
|
Показатель Дооперационные данные |
МК + аблация, n = 20 |
МК, n = 20 |
p |
|
ФВ ЛЖ, % |
67,1±6,47 |
70,8±5,63 |
0,061 |
|
размер ЛП, мм Через 1 мес. |
66±4,3 |
69±5,2 |
0,054 |
|
ФВ ЛЖ, % |
65,0±4,24 |
67,5±5,42 |
0,112 |
|
размер ЛП, мм Через 3 мес. |
57±4,7 |
56±5,4 |
0,535 |
|
ФВ ЛЖ, % |
65,3±6,34 |
66,8±5,73 |
0,437 |
|
размер ЛП, мм |
51±4,4 |
52±3,7 |
0,441 |
|
Примечание. МК — митральный клапан; ФВ — |
фракция выброса; ЛЖ |
— левый желудочек; ЛП |
— левое предсердие |
|
Таблица 7 Динамика размеров левого предсердия |
|||
|
Группа |
До операции, мм |
Через 3 мес., мм |
p |
|
МК + аблация, n |
= 20 66±4,3 |
51±4,4 |
<0,001 |
|
МК, n = 20 |
69±5,2 |
52±3,7 |
0,009 |
|
Примечание. МК |
— митральный клапан |
||
Основными предикторами развития ранней ФП (менее 12 сут. после операции), развившейся в 24% случаев, являлись: размер левого предсердия более 5,0 см, сопутствующее коронарное шунтирование, протезирование митрального клапана, сниженная фракция выброса левого желудочка. При анализе развития поздней ФП (более 12 сут. после вмешательства) пациенты разделены на две группы. В I группу вошли пациенты с размером ЛП более 5,0 см, во II — менее 5,0 см. В I группе ФП выявлена в 24±3% случаев, во II — 11±3%, p = 0,001. Таким образом основную роль в развитии поздней ФП играли размер ЛП более 5,0 см и предшествующие пароксизмы фибрилляции предсердий [17].
На современном этапе в хирургическом лечении ФП общепринятой считается концепция maze («лабиринт»). При данной операции достигается анатомическая изоляция триггерных зон ФП, расположенных главным образом в мышечных муфтах ЛВ и задней стенке левого предсердия [1].
Стратегии профилактики ФП после вмешательств на сердце менялись от медикаментозных к хирургическим. Так, по данным многих рандомизированных исследований, амиодарон у пациентов с исходно синусовым ритмом снижает количество периоперационных осложнений, в том числе ФП [18]. С целью профилактики ФП оправданы комбинации бета-блокаторов и ацетилцистеина [19], препаратов магния [20], статинов [21]. Колхицин, исследованный в 14 итальянских клиниках, не оправдал себя в профилактике фибрилляции предсердий [22].
Другое плацебо-контролируемое исследование не показало эффективности интраоперационного применения дексаметазона с целью профилактики впервые возникшей фибрилляции предсердий [23].
Возможности разработки инвазивной профилактики ФП стали обсуждать не так давно. В 2009 г. группой авторов во главе с E.J. Benjamin предложена идея организации исследовательской группы по этому вопросу [15]. Так, использование перикардотомии при операциях коронарного шунтирования снижает риск развития ФП, что обусловлено снижением частоты экссудативных перикардитов [24].
Следующим этапом в развитии технологий профилактики ФП стала эпикардиальная аппликация антиаритми-ческих препаратов. В 2014 г. группой авторов из сердечно-сосудистого центра в Китае опубликованы данные рандомизированного исследования эпикардиального применения амиодарона, осажденного на гидрогелевую основу, при операциях коронарного шунтирования. Показана его эффективность в отношении профилактики ФП в сравнении с плацебо [25].
Нашими коллегами в пилотном рандомизированном исследовании показана эффективность применения ботулотоксина, вводимого эпикардиально в проекции ганглионарных сплетений легочных вен при операциях коронарного шунтирования [26].
Методики инвазивной профилактики предсердных аритмий исследованы мало, преимущественно на группах больных, перенесших коронарное шунтирование. На сегодняшний день не существует ни одного исследования инвазивной профилактики в объеме изоляции легочных вен или задней стенки ЛП у пациентов с клапанными пороками сердца и выраженной атриомегалией.
Таким образом, наше исследование является первым, направленным на оценку безопасности и эффективности превентивной аблации у больных с клапанной патологией.
Заключение
На основании непосредственных и промежуточных результатов показано, что количество периоперационных осложнений значительно не различается в группах превентивной аблации и изолированного вмешательства на митральном клапане. На основании этого можно сделать вывод, что хирургическая профилактика ФП у пациентов с поражением митрального клапана и атрио-мегалией является безопасной процедурой.
На основе анализа динамики размеров левого предсердия не получено достоверной межгрупповой разницы. Отмечается внутригрупповая тенденция к уменьшению размеров ЛП, что обусловлено гемодинамической коррекцией митрального порока.
У пациентов, подвергшихся хирургической профилактике ФП, свобода от ФП/ТП/ПТ в 1,6 раза выше в сравнении с пациентами группы МК в течение 3 мес. с момента операции. Профилактическая аблация в среднеотдаленном периоде наблюдения объясняет меньшую долю ассоциированных с ФП госпитализаций.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Среднеотдаленные результаты профилактической аблации предсердий у пациентов с пороками митрального клапана и атриомегалией: пилотное рандомизированное исследование
- Badhwar V., Rankin J.S., Damiano R.J. Jr., Gillinov A.M., Bakaeen F.G., Edgerton J.R., Philpott J.M., McCarthy P.M., Bolling S.F., Roberts H.G., Thourani V.H., Suri R.M., Shemin R.J., Firestone S., Ad N. The Society of Thoracic Surgeons 2017 clinical practice guidelines for the surgical treatment of atrial fibrillation. Ann Thorac Surg. 2017;103(1):329-41. http://dx.doi.org/10.1016/j. athoracsur.2016.10.076
- Бокерия Л.А., Филатов А.Г., Ковалев С.А., Ковалев А.С. Электрофизиологический субстрат при фибрилляции предсердий. Вестник экспериментальной и клинической хирургии. 2012;5(3):528-30.
- January C.T., Wann L.S., Alpert J.S., Calkins H., Cigarroa J.E., Cleveland J.C. Jr., Conti J.B., Ellinor P.T., Ezekowitz M.D., Field M.E., Murray K.T., Sacco R.L., Stevenson W.G., Tchou P.J., Tracy C.M., Yancy C.W.; ACC/AHA Task Force Members. 2014 AHA/ACC/HRS guideline for the management of patients with atrial fibrillation. Circulation. 2014;130(23):2071-104. http://dx.doi. org/10.1161/CIR.0000000000000040
- Obadia J.F., el Farra M., Bastien O.H., Lièvre M., Martelloni Y., Chassignolle J.F. Outcome of atrial fibrillation after mitral valve repair. J Thorac Cardiovasc Surg. 1997;114(2):179-85. http://dx.doi. org/10.1016/S0022-5223(97)70142-9
- Braunwald's heart disease: a textbook of cardiovascular medicine. 8th edition. Libby P., Bonow R.O., Mann D.L., Zipes D.P., eds. Philadelphia: Elsevier Saunders; 2007. 616 p.
- Chen M.C., Chang J.P., Chen Y.L. Surgical treatment of atrial fibrillation with concomitant mitral valve disease: an Asian review. Chang Gung Medical Journal. 2008;31(6):538-45.
- Jahangiri M., Weir G., Mandal K., Savelieva I., Camm J. Current strategies in the management of atrial fibrillation. Ann Thorac Surg. 2006;82(1):357-64. http://dx.doi.org/10.1016/j. athoracsur.2005.11.035
- Cheng D., Ad N., Martin J., Berglin E.E., Chang B.C., Doukas G., Gammie J.S., Nitta T., Wolf R.K., Puskas J.D. Surgical ablation for atrial fibrillation in cardiac surgery (a meta-analysis and systematic review). Innovations (Phila). 2010;5(2):84-96. http://dx.doi. org/10.1097/IMI.0b013e3181d9199b
- Бокерия Л.А., Ревишвили А.Ш., Шмуль А.В., Джорджикия Т.Р., Кваша Б.И., Мацонашвили Г.Р., Проничева И.В., Сергуладзе C.Ю. Результаты хирургического лечения фибрилляции предсердий у пациентов с пороками сердца. Анналы аритмологии. 2012;9(4):14-22.
- Roy D., Talajic M., Dorian P., Connolly S., Eisenberg M.J., Green M., Kus T., Lambert J., Dubuc M., Gagné P., Nattel S., Thibault B. Amiodarone to prevent recurrence of atrial fibrillation. N Eng J Med. 2000;342(13):913-20. http://dx.doi.org/10.1056/NEJM200003303421302
- Целуйко В.Й., Жадан А.В., Зедгинидзе Э.Т. Фибрилляция предсердий после протезирования митрального клапана. Медицинские новости Грузии. 2015;(238):65-9.
- Sanfilippo A.J., Abascal V.M., Sheehan M., Oertel L.B., Harrigan P., Hughes R.A., Weyman A.E. Atrial enlargement as a consequence of atrial fibrillation. A prospective echocardiographic study. Circulation. 1990;82(3):792-7.
- Kim H.J., Cho G.Y., Kim Y.J., Kim H.K., Lee S.P., Kim H.L., Park J.J., Yoon Y.E., Zo J.H., Sohn D.W. Development of atrial fibrillation in patients with rheumatic mitral valve disease in sinus rhythm. Int J Cardiovasc Imag. 2015;31(4):735-42. http://dx.doi.org/10.1007/s10554-015-0613-2
- Van Gelder I.C., Hagens V.E., Bosker H.A., Kingma J.H., Kamp O., Kingma T., Said S.A., Darmanata J.I., Timmermans A.J., Tijssen J.G., Crijns H.J.; Rate Control versus Electrical Cardioversion for Persistent Atrial Fibrillation Study Group. A comparison of rate control and rhythm control in patients with recurrent persistent atrial fibrillation. N Eng J Med. 2002;347(23):1834-40. http://dx.doi. org/10.1056/NEJMoa021375
- Benjamin E.J., Chen P.-S., Bild D.E., Mascette A.M., Albert C.M., Alonso A., Calkins H., Connolly S.J., Curtis A.B., Darbar D., Ellinor P.T., Go A.S., Goldschlager N.F., Heckbert S.R., Jalife J., Kerr C.R., Levy D., Lloyd-Jones D.M., Massie B.M., Nattel S., Olgin J.E., Packer D.L., Po S.S., Tsang T.S.M., Van Wagoner D.R., Waldo A.L., Wyse D.G. Prevention of atrial fibrillation. Circulation. 2009;119(4):606-18. https://doi.org/10.1161/CirculationAHA.108.825380
- Medi C., Hankey G.J., Freedman S.B. Stroke risk and antithrombotic strategies in AF. Stroke. 2010;41(11):2705-13. https://doi. org/10.1161/StrokeAHA.110.589218
- Kernis S.J., Nkomo V.T., Messika-Zeitoun D., Gersh B.J., Sundt T.M. 3rd, Ballman K.V., Scott C.G., Schaff H.V., Enriquez-Sarano M. Atrial fibrillation after surgical correction of mitral regurgitation in sinus rhythm. Circulation. 2004;110(16):2320-5. https://doi. org/10.1161/01.CIR.0000145121.25259.54
- Aasbo J.D., Lawrence A.T., Krishnan K., Kim M.H., Trohman R.G. Amiodarone prophylaxis reduces major cardiovascular morbidity and length of stay after cardiac surgery: a meta-analysis. Ann Int Med. 2005;143(5):327-36.
- Ozaydin M., Icli A., Yucel H., Akcay S., Peker O., Erdogan D., Varol E., Dogan A., Okutan H. Metoprolol vs. carvedilol or carvedilol plus N-acetyl cysteine on post-operative atrial fibrillation: a randomized, double-blind, placebo-controlled study. Eur Heart J. 2012;34(8):597-604. https://doi.org/10.1093/eurheartj/ehs423.
- Gu W.J., Wu Z.J., Wang P.F., Aung L.H., Yin R.X. Intravenous magnesium prevents atrial fibrillation after coronary artery bypass grafting: a meta-analysis of 7 double-blind, placebo-controlled, randomized clinical Trials. Trials. 2012;13:41. https://doi. org/10.1186/1745-6215-13-41
- Chen W.T., Krishnan G.M., Sood N., Kluger J., Coleman C.I. Effect of statins on atrial fibrillation after cardiac surgery: a duration-and dose-response meta-analysis. J Thorac Cardiovasc Surg. 2010;140(2):364-72. https://doi.org/10.1016/j.jtcvs.2010.02.042
- Imazio M., Brucato A., Ferrazzi P., Pullara A., Adler Y., Barosi A., Caforio A.L., Cemin R., Chirillo F., Comoglio C., Cugola D., Cumetti D., Dyrda O., Ferrua S., Finkelstein Y., Flocco R., Gandino A., Hoit B., Innocente F., Maestroni S., Musumeci F., Oh J., Pergolini A., Polizzi V., Ristic A., Simon C., Spodick D.H., Tarzia V., Trimboli S., Valenti A., Belli R., Gaita F.; COPPS-2 Investigators. Colchicine for prevention of postpericardiotomy syndrome and postoperative atrial fibrillation: the COPPS-2 randomized clinical trial. J Am Med Assoc. 2014;312(10):1016 23. https://doi.org/10.1001/jama.2014.11026
- van Osch D, Dieleman J.M., van Dijk D., Jacob K.A., Kluin J., Doevendans P.A., Nathoe H.M.; DExamethasone for Cardiac Surgery (DECS) study group; DExamethasone for Cardiac Surgery DECS study group. Dexamethasone for the prevention of postoperative atrial fibrillation. Int J Card. 2015;182:431-7. https://doi.org/10.1016/j.ijcard.2014.12.094
- Biancari F., Mahar M.A. Meta-analysis of randomized trials on the efficacy of posterior pericardiotomy in preventing atrial fibrillation after coronary artery bypass surgery. J Thorac Cardiovasc Surg. 2010;139(5):1158-61. https://doi.org/10.1016Zj.jtcvs.2009.07.012
- Feng X.D., Wang X.N., Yuan X.H., Wang W. Effectiveness of biatrial epicardial application of amiodarone-releasing adhesive hydrogel to prevent postoperative atrial fibrillation. J Thorac Cardiovasc Surg. 2014;148(3):939-43. https://doi.org/10.1016/j. jtcvs.2014.05.049.
- Pokushalov E., Kozlov B., Romanov A., Strelnikov A., Bayramova S., Sergeevichev D., Bogachev-Prokophiev A., Zheleznev S., Shipulin V., Salakhutdinov N., Lomivorotov V.V., Karaskov A., Po S.S., Steinberg J.S. Botulinum toxin injection in epicardial fat pads can prevent recurrences of atrial fibrillation after cardiac surgery. J Am Coll Cardiol. 2014;64(6):628-9. https://doi.org/10.1016/j. jacc.2014.04.062


