Стабилин-1-позитивные макрофаги в миокарде пациентов с фатальным исходом инфаркта миокарда
Автор: Гомбожапова Александра Энхэевна, Роговская Юлия Викторовна, Ребенкова Мария Сергеевна, Шурупов Владимир Сергеевич, Кжышковская Юлия Георгиевна, Рябов Вячеслав Валерьевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 2 т.31, 2016 года.
Бесплатный доступ
Ремоделирование сердца и развивающаяся вследствие этого сердечная недостаточность по-прежнему является одной из основных причин смертности больных, перенесших инфаркт миокарда. Необходимость углубления знаний о том, какие же факторы приводят к различным исходам инфаркта миокарда, привело к смещению акцента исследований в сторону изучения процессов воспаления как клеточно-молекулярной основы постинфарктного ремоделирования. В последние годы предметом научного интереса стали клетки иммунной системы (макрофаги) как в здоровых тканях, так и при патологических состояниях. Выделяют две субпопуляции макрофагов: воспалительные М1 макрофаги и М2 макрофаги, выполняющие адаптивную, регенераторную, противовоспалительную функции. Одним из маркеров М2 макрофагов является скавенджер-рецептор стабилин-1. М2 макрофаги, экспрессируя стабилин-1, принимают участие в процессе деградации ацетилированных липопротеинов низкой плотности и гликопротеина SPARC (secreted protein acidic and rich in cysteine), являющегося универсальным регулятором процессов репарации, ангиогенеза и тканевого ремоделирования. Цель настоящей работы: показать наличие/отсутствие стабилин-1-позитивных макрофагов в миокарде пациентов с фатальным исходом инфаркта миокарда при помощи иммуногистохимического анализа. Полученные данные, подтверждающие наличие стабилин-1-позитивных М2 макрофагов, позволяют продолжить дальнейшие исследования по определению молекулярного профиля и функции этих клеток в процессах развития неблагоприятного ремоделирования сердца.
Инфаркт миокарда, макрофаг, иммуногистохимия, скавенджер-рецептор, стабилин-1
Короткий адрес: https://sciup.org/14920086
IDR: 14920086 | УДК: 616.127-005.8
Текст научной статьи Стабилин-1-позитивные макрофаги в миокарде пациентов с фатальным исходом инфаркта миокарда
Последние данные свидетельствуют о том, что современные методики инвазивного и медикаментозного лечения полностью реализовали свой потенциал по ограничению размера некроза, снижению смертности и улучшению функции миокарда у больных во время и после инфаркта миокарда [1–3]. Ремоделирование сердца и развивающаяся вследствие этого сердечная недостаточность по-прежнему является одной из основных причин смертности больных, перенесших инфаркт миокарда [4, 5]. Необходимость углубления знаний о том, какие же факторы приводят к различным исходам инфаркта миокарда, привело к смещению акцента исследований в сторону изучения процессов воспаления как клеточно-молекулярной основы постинфарктного ремоделирования [6].
Механизм развития неблагоприятного ремоделирования сердца до сих пор остается во многом не ясным. В последние годы предметом научного интереса стали клетки иммунной системы (макрофаги) как в здоровых тканях, так и при различных патологических состояниях [7]. Первыми были открыты макрофаги, участвующие в процессах воспаления – так называемые воспалительные М1 или классически активируемые макрофаги. Далее были установлены новые функции этих клеток: противовоспалительная, адаптивная, регенераторная. Макрофаги, которые выполняют эти функции, получили название М2 или альтернативно активируемых макрофагов. Продемонстрирован противовоспалительный фенотип М2 макрофагов, экспрессирующий на своей поверхности такие маркеры, как макрофагальный маннозный рецептор С тип 1 или CD206, скавенджер-рецепторы – CD163 и ста-билин-1 [7, 8].
Мультифункциональный скавенджер-рецептор стаби-лин-1 был впервые идентифицирован как MS-1 антиген, экспрессированный на поверхности синусоидальных эндотелиальных клеток селезенки человека [9]. Дальнейшие исследования показали наличие экспрессии стаби-лина-1 на поверхности тканевых макрофагов при хроническом течении воспаления и туморогенезе [9]. М2 макрофаги, экспрессируя стабилин-1, принимают участие в процессе деградации ацетилированных липопротеинов низкой плотности и гликопротеина SPARC (secreted protein acidic and rich in cysteine), являющегося универсальным регулятором процессов репарации, ангиогенеза и тканевого ремоделирования [9, 10].
В последние десять лет роль активно изучалась роль стабилина-1 в патогенезе злокачественных новообразований. В одном из недавних исследований, проведенных на мышах, получены данные о наличии этого маркера макрофагов на начальных стадиях развития глиомы и уменьшении его экспрессии по мере прогрессирования заболевания. Таким образом, было предположено, что изменение выраженности экспрессии стабилина-1 может помочь в оценке опухолевого роста [8]. В другом исследовании стабилин-1 рассматривался как новая иммуносупрессивная молекула, предполагалось, что моноциты кровяного русла с выраженной экспрессией стабилина-1 могут подавлять провоспалительные реакции in vivo [10].
Таким образом, моноциты/макрофаги являются клю- чевыми участниками воспалительной реакции, секретируют про- и противовоспалительные факторы, фагоцитируют погибшие клетки, способствуют формированию соединительной ткани, выделяют факторы ангиогенеза и фиброгенеза, во многом могут определять ремоделирование сердца, выделяя эластазу, коллагеназу и гиалуронидазу, а также воздействуя на процессы апоптоза и пролиферации кардиомиоцитов. К сожалению, фенотипические характеристики и функциональная роль этих клеток в процессе постинфарктного ремоделирования сердца остаются малоизвестными [11, 12]. Необходимо проведение исследований, направленных на изучение субпопуляций макрофагов в ткани сердца человека и определение их значения в процессах постинфарктного воспаления и заживления, результаты которых могли бы быть применены в клинической медицине, в том числе в поиске новых терапевтических мишеней для предотвращения неблагоприятного ремоделирования миокарда.
Цель работы: показать наличие/отсутствие стабилин-1-позитивных макрофагов в миокарде пациентов с фатальным исходом инфаркта миокарда при помощи иммуногистохимического анализа.
Задачи исследования:
-
1. Изучить методику иммуногистохимического анализа и оценки клеточного состава зоны инфаркта, пери-инфарктной зоны и отдаленных от инфаркта участков миокарда.
-
2. Выявить наличие/отсутствие стабилин-1-позитивных макрофагов в миокарде пациентов с летальным исходом инфаркта миокарда.
Материал и методы
В настоящей работе объектом исследования являлись фрагменты миокарда больных, умерших от острого инфаркта миокарда I типа.
Аутопсия проводилась на базе патологоанатомического отделения НИИ кардиологии. С парафиновых блоков были приготовлены микротомные срезы для последующего иммуногистохимического исследования. В каждом случае проводился забор от трех до пяти парафиновых блоков. С каждого блока выполнено двадцать срезов. Срезы фиксированы на стеклах с полилизиновым покрытием (по два среза на одно стекло); при этом один из срезов в каждом стекле использовался для отрицательного контроля. Кроме того, в каждой партии окрашиваемых срезов для положительного и отрицательного контроля использовались срезы плаценты.
Иммуногистохимическое исследование фрагментов сердечной мышцы проводилось с помощью набора мышиных моноклональных антител к стабилин-1. Во всех случаях мы использовали систему визуализации HRP-DAB (horseradish peroxidase – 3,3’- diamnobenzidine, пероксидаза хрена – 3,3’-диаминобензидин). Работа проводилась на современном универсальном прямом исследовательском микроскопе. Материал исследовался по количественным (количество стабилин-1-позитивных макрофагов в 1 мм2) и качественным признакам (локализация, характер распределения клеток – единичные клетки или инфильтраты).
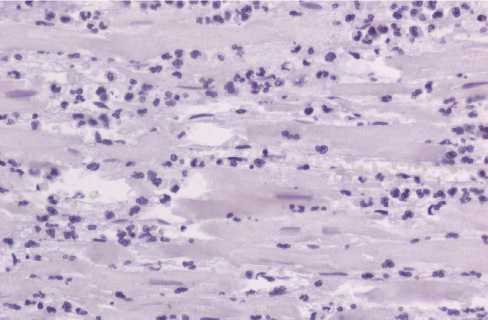
Рис. 1. Зона инфаркта. Инфильтрация миокарда нейтрофилами у пациента, умершего на 3-и сутки от развития инфаркта миокарда, стабилин-1-позитивные макрофаги отсутствуют. Аутопсия, иммуногистохимическое исследование, х400
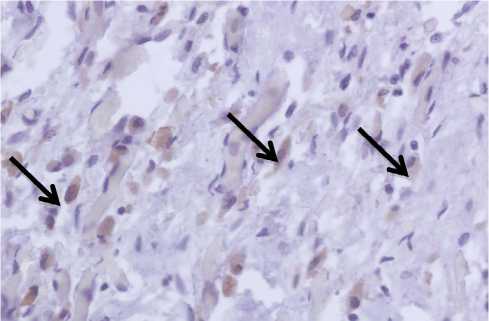
Рис. 2. Зона инфаркта. Инфильтрация миокарда стабилин-1-позитивными макрофагами у пациента, умершего на 16-е сутки от развития инфаркта миокарда. Аутопсия, иммуногистохимическое исследование, х400
Результаты и обсуждение
Проведено иммуногистохимическое исследование парафиновых срезов миокарда от девяти пациентов с различной давностью инфаркта миокарда. На светооптическом уровне были исследованы стабилин-1-позитивные макрофаги в зоне инфаркта, периинфарктной зоне и отдаленных от инфаркта участках миокарда.
Стабилин-1-позитивные макрофаги не определялись в участках некроза (рис. 1). Данная субпопуляция макрофагов появлялась в зоне инфаркта на стадии развития грануляционной ткани (рис. 2). В периинфарктной зоне стабилин-1-позитивные клетки выявлялись в виде одиночных клеток при давности инфаркта от 48 до 72 ч и более. В участках, отдаленных от зоны инфаркта, в срезе встречались единичные стабилин-1-позитивные макрофаги при площади среза 1 см2 и более.
Настоящий материал является первым этапом работы, выполняемой на базе отделения неотложной кардиологии, посвященной изучению функциональной пластичности моноцитов/макрофагов в процессах восстановительной регенерации и постинфарктного ремоделирования сердца.
Выводы
В результате проведенной работы мы подтвердили наличие стабилин-1-позитивных М2 макрофагов в миокарде пациентов с фатальным исходом инфаркта миокарда, что позволяет продолжить дальнейшие исследования по определению молекулярного профиля и функции этих клеток в процессах развития неблагоприятного ремоделирования сердца.
Работа выполнена при поддержке гранта РФФИ №1604-01268 и программы повышения конкурентоспособности Томского государственного университета. Работа ведется на базе Томского регионального центра коллективного пользования научным оборудованием при финан- совой поддержке государства в лице Минобрнауки России в рамках Соглашения 14.594.21.0001 (RFMEFI59414X0001).
Список литературы Стабилин-1-позитивные макрофаги в миокарде пациентов с фатальным исходом инфаркта миокарда
- Min X., Burchfield J., Hill J. Pathological ventricular remodeling: therapies//Circulation. -2013. -Vol. 128(4). -P. 388-400.
- Рябов В.В., Соколов А.А., Рябова Т.Р. Структурно-функциональная перестройка сердца в условиях реперфузионной терапии инфаркта миокарда. -Томск: STT, 2010. -252 с.
- Марков В.А., Рябов В.В., Вышлов Е.В. и соавт. Особенности ремоделирования сердца после инфаркта миокарда при фармакоинвазивных методах реперфузии и усиленной наружной контрпульсации. -Томск: STT, 2014. -244 с.
- Ishii H., Amano T., Matsubara T. et al. Pharmacological intervention for prevention of left ventricular remodeling and improving prognosis in myocardial infarction//Circulation. -2008. -Vol. 118. -P. 2710-2718.
- Федоров А.Ю., Усов В.Ю., Трубачева И.А. и соавт. Коронарная и сердечная недостаточность: Коллективная монография, посвященная 25-летию НИИ кардиологии Томского научного центра Сибирского отделения РАМН и 20-летию Филиала ГУ НИИ кардиологии ТНЦ СО РАМН Тюменский кардиологический центр. -Томск: STT, 2005. -716 с.
- Ismahil M., Hamid T., Bansal S. et al. Remodeling of the mononuclear phagocyte network underlies chronic inflammation and disease progression in heart failure: critical importance of the cardiosplenic axis//Circulation Research. -2014. -Vol. 114. -P. 266-282.
- Murray P., Wynn T. Protective and pathogenic functions of macrophage subsets//Nature Reviews Immunology. -2011. -Vol. 11. -P. 723-737.
- Clement D., Nance J. Philip, Hubbard J. et al. Stabilin-1 expression in tumor associated macrophages//Brain Research. -2012. -Vol. 1481. -P. 71-78.
- Kzhyshkowska J., Gratchev A., Goerdt S. Stabilin-1, a homeostatic scavenger receptor with multiple functions//J. Cell. Mol. Med. -2006. -Vol. 10. -P. 635-649.
- Palani S., Elima K., Ekhlom E. et al. Monocyte Stabilin-1 supresses the activation of Th1 lymphocytes//J. Immunol. -2015. -Vol. 196. -P. 115-123.
- Fujiu K., Wang J., Nagai R. Cardioprotective function of cardiac macrophages//Cardiovasc. Research. -2014. -Vol. 102. -P. 191-193.
- Frantz S., Bauersachs J., Ertl G. Post-infarct remodeling: contribution of wound healing and inflammation//Cardiovasc. Research. -2009. -Vol. 81. -P. 474-481.


