Стабилизаторы для функциональных медных наноматериалов триботехнического назначения
Автор: Герасина Юлия Станиславовна, Кочергин Евгений Сергеевич, Милов Алексей Александрович, Лукьянов Борис Сергеевич
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Машиностроение и машиноведение
Статья в выпуске: 1 (84) т.16, 2016 года.
Бесплатный доступ
При помощи расчетов методом теории функционала плотности систематически исследован процесс образования комплексов азотсодержащих молекул с малыми кластерами меди Cun(n=1-7, 13). Показано, что молекулы R1N=Y (Y=CR2R3, NR2, O) перспективны для поиска присадок для кластеров меди, так как являются синтетически доступными, имеют возможность проявлять восстановительные свойства, прочно связываются с атомами меди и не искажают исходную структуру кластера. Используя любой объемный заместитель R, можно блокировать доступ к большой площади поверхности кластера для агрессивных соединений. Комплексы кислорода на поверхности медного кластера существенно уступают в прочности структурам, образованным молекулами R1N=Y (Y=CR2R3, NR2, O). В зависимости от размера кластера сила взаимодействия изменяется синусоидально от минимума к максимуму.
Поверхность, нанокластер, медь, гибридизация азота, механизм роста, теория функционала плотности, комплексообразование
Короткий адрес: https://sciup.org/14250195
IDR: 14250195 | УДК: 544.18, | DOI: 10.12737/18268
Текст научной статьи Стабилизаторы для функциональных медных наноматериалов триботехнического назначения
Введение. В последнее время большой интерес вызывают исследования структуры и новые области применения кластеров металлов группы меди [1–3]. Нанокластеры этих металлов перспективны как для использования в медицине в качестве маркеров или части молекулярной структуры медицинских препаратов, так и в химической технологии (селективный катализ), оптике, электронике и ряде других областей техники и технологии [4–7]. Примером такого использования является применение наночастиц меди в триботехнике (раздел трибологии, науки о трении и изнашивании). В частности, большой интерес представляет собой использование кластеров меди в качестве присадки к маслам и смазкам для улучшения их триботехнических характеристик [8–10].
Свойства медных кластеров зависят от их размера и структуры, что в значительной мере определяется способами их получения и хранения. Кроме этого, важнейшей проблемой при синтезе является высокая способность нано-
Машиностроение и машиноведение
кластеров к агрегации и укрупнению, что приводит к необходимости поиска эффективных стабилизаторов. На данный момент существует ряд физических, химических и биологических методов получения металлических наносистем, но наиболее перспективными являются методы с минимальным числом стадий и компонентов [8]. Реакции химического восстановления наиболее перспективны ввиду их простоты, низкой стоимости и универсальности по сравнению с микробиологическими и физическими методами. При этом восстановителями нередко являются органические и неорганические молекулы с активными азотными и кислородными центрами, которые и выступают в качестве стабилизаторов получаемых кластерных структур [11]. Таким образом, использование азотсодержащих соединений в качестве стабилизатора для наночастиц меди является перспективным.
Ранее было доказано [12], что наиболее прочными контактами между поверностью кластера меди и элемен-торганическими веществами отличаются соединения с азотным центром — аммиак и амины, при этом сила такого взаимодействия изменяется с размером кластера и при вариации среды. В связи с этим интересно изучить энергетику Cu–N взаимодействия в зависимости от размера кластера меди и электронного строения азотного центра.
Целью исследования было изучение влияния типичных случаев локализации электронной плотности на азотном центре на контакт с поверхностью кластеров меди в различных апротонных средах (вакуум, углеводород н-гептан, двуатомный спирт-этиленгликоль) в рамках единого подхода.
При этом критериями поиска перспективных стабилизаторов для кластеров меди будем считать синтетическую доступность, возможность модификации заместителей для создания максимальных стерических препятствий к поверхности кластера металла, свойства восстановителя и формирование наиболее прочных связей с медью (максимальная энергия комплексообразования).
Экспериментальная часть. В рамках исследования были рассмотрены кластеры Cu n (n=1–7, 13). Для исследования влияния электронного строения азотного центра на процесс комплексообразования были использованы: производные аммиака — карбамовая кислота H 2 N–COOH и анилин H 2 N–Ph; молекулы с азотным центром в системе сопряжения — пиррол HNC 4 H 4 и пиридин NC 5 H 5 ; структуры азота с двойной связью — HN=CH 2 (метанимин), HN=NH (диазен) и HN=O (нитроксил); атомы азота с тройной связью — тиоцианат лития NCS ... Li, цианид лития N ≡ C ... Li и азот N 2 . Для сравнения рассчитаны некоторые комплексы с молекулярным кислородом и водой. Расчеты проводились с полной оптимизацией всех параметров методом теории функционала плотности PBEPBE/Lanl2DZ [13–15] с использованием пакета программ Gaussian–09 [16]. Идентификация стационарных точек осуществлялась путем расчета матрицы силовых постоянных. Все приведенные далее структуры являются минимумами на соответствующих поверхностях потенциальной энергии (ППЭ). Энергия стабилизации комплексов, образованных кластерами металла оценивалась как разность полной энергии комплекса и суммы полных энергий индивидуальных молекул. При наличии нескольких изомеров комплексов в таблицу вносился результат для наиболее стабильной формы. Влияние среды учитывалось в неявном виде — при помощи процедуры SCRF. Для исследования влияния среды выбраны апротонные среды различной полярности — н-гептан и этиленгликоль, а также вакуум.
Обсуждение и результаты. Расчеты методом PBEPBE/Lanl2DZ показывают, что для кластеров Cu n (n=3–6) наибольшей стабильностью отличаются плоские изомеры, для которых основным структурным мотивом являются треугольные формы. В тоже время кластеры где n>6 стабилизируются лишь в 3D формах. Так, на рис. 1 приведены три изомера Cu 7 , соответствующие минимуму на ППЭ и имеющие неплоское строение.
Как показывают расчеты, результаты которых приведены в табл. 1 и на рис. 2, в газовой фазе все производные аммиака (карбамовая кислота и анилин) проигрывают по устойчивости своих комплексов с поверхностью кластеров меди, как воде, так и молекуле кислорода (~21–22ккал/моль). При этом, с ростом размера кластера, энергия стабилизации таких структур изменяется нелинейно, подобно синусоиде.
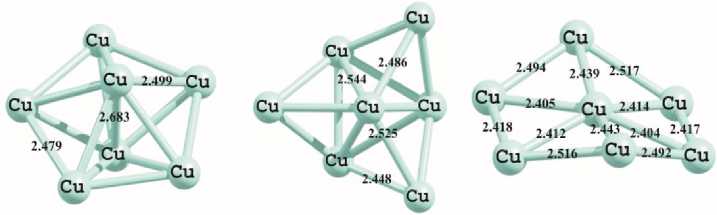
∆ E=0 ∆ E=5,21 ∆ E=22,33
Рис. 1. Геометрические характеристики минимумов, полученных при помощи расчетов методом PBEPBE/Lanl2DZ для структуры Cu7
На рис. 1 все длины приведены в ангстремах, ∆E — энергия относительной устойчивости в ккал/моль. Нулевое значение соответствует самому устойчивому изомеру.
Таблица 1
|
Молекула |
Cu 1 |
Cu 2 |
Cu 3 |
Cu 4 |
Cu 5 |
Cu 6 |
Cu 7 |
Cu 13 |
|
H 2 N–COOH |
7,29 |
13,54 |
17,78 |
17,15 |
||||
|
NH2 |
13,76 |
20,87 |
16,11 |
24,80 |
||||
|
N H |
12,65 |
11,96 |
16,26 |
15,11 |
||||
|
N |
21,37 |
30,00 |
36,71 |
33,74 |
26,84 |
|||
|
HN=CH 2 |
24,40 |
32,08 |
40,24 |
36,55 |
28,66 |
27,13 |
27,89 |
|
|
HN=NH |
31,02 |
33,16 |
46,05 |
40,18 |
31,75 |
27,28 |
30,57 |
36,71 |
|
HN=O |
46,92 |
38,04 |
58,89 |
48,90 |
43,37 |
33,07 |
39,47 |
52,28 |
|
NCS...Li |
16,82 |
32,81 |
42,65 |
39,27 |
31,58 |
|||
|
N ≡ N |
14,25 |
21,01 |
27,53 |
25,23 |
16,62 |
|||
|
N ≡ C...Li |
23,36 |
33,83 |
47,06 |
37,15 |
31,04 |
Энергии стабилизации комплексов, содержащих связь Cu–N, рассчитанные методом PBEPBE/Lanl2DZ (в ккал/моль) в условиях газовой фазы
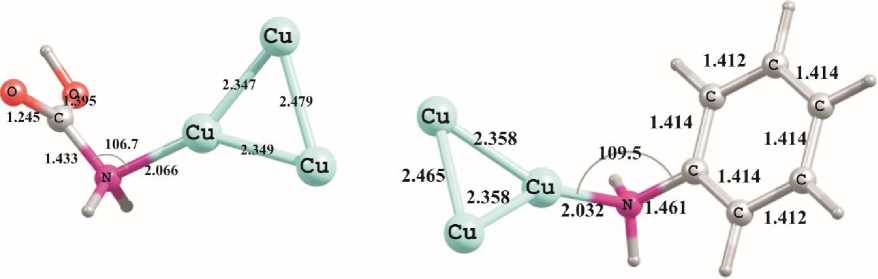
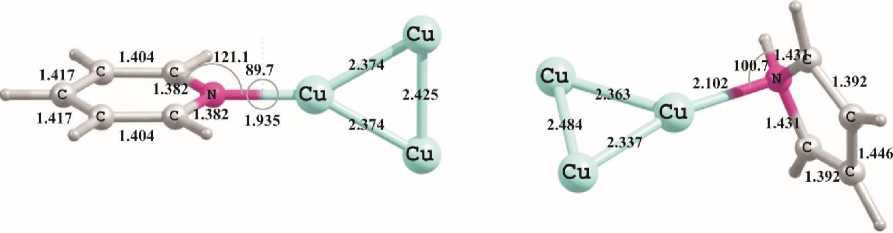
Рис. 2. Геометрические характеристики минимумов, полученных при помощи расчетов методом PBEPBE/Lanl2DZ для комплексов карбамовой кислоты, анилина, пиридина и пиррола с кластером Cu 3
Переход к молекулам пиррола и пиридина, в которых атом азота включен в цепь сопряжения, повышает устойчивость получающихся комплексов с Cu–N-взаимодействием. Так, молекула пиридина связывается с поверхностью медного кластера прочнее, чем молекулы воды или кислорода, и вполне может препятствовать их контакту с металлом, учитывая же существенный размер молекулы пиридина (радиус онзагеровской сферы для нее составляет 3,68Å), ее локализация на одном атоме меди защищает еще несколько ближайших атомов кластера.
Машиностроение и машиноведение
Наиболее стабильные комплексы на поверхности медного кластера дают молекулы, в которых азотный центр связан двойной связью с гетероатомом, при этом сила взаимодействия «кластер — молекула» растет с увеличением электроотрицательности заместителя в ряду HN=CH 2 < HN=NH < HN=O. Некоторые из этих комплексов изображены на рис. 3. Следует отметить, что стабильность образованных структур значительно превышает силу контакта с поверхностью меди молекул кислорода или воды (на ~10–20 ккал/моль). Как и в случае молекулы пиридина, энергия контакта Cu–N изменяется нелинейно, возрастая до максимума в случае кластера Cu 3 и далее уменьшаясь до минимума в случае комплексов с кластером Cu 6 . Следующая зона роста энергии Cu–N-взаимодействия начинается с семиатомного кластера меди (n=7). Для икосаэра Cu 13 энергия Cu–N взаимодействия сопоставима по величине с таковой для трехатомных кластеров меди, при этом координация с поверхностью медного кластера идет исключительно по азотному центру молекулы, без участия непроделенных электронных пар заместителей.
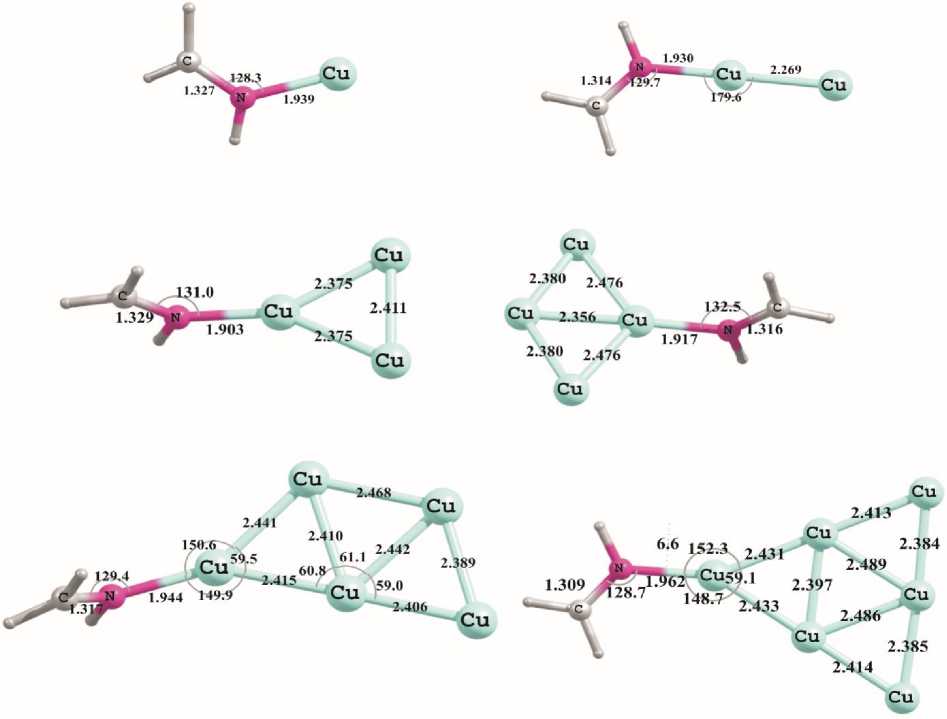
Рис. 3. Геометрические характеристики минимумов, полученных при помощи расчетов методом PBEPBE/Lanl2DZ для комплексов метанимина с кластерами Cun (n=1...6)
Органические молекулы, в которых азот связан тройной связью, занимают промежуточное положение по силе стабилизации их комплексов с кластерами меди, при этом структуры Cu n... N 2 с атмосферным азотом по всем пунктам проигрывает комплексам Cu n... O 2 , а токсичные соли цианида и тиоцианата лития показывают результаты близкие к ранее рассмотренным молекулам HN=Y (Y=CH 2 , NH, O), но более низкие по энергетике. Некоторые такого рода структуры приведены на рис. 4. Недостатком таких систем является их токсичность и возможность модификации только за счет противоиона, что дает немного вариантов, мало различающихся между собой.
Таким образом молекулы, в которых азот связан двойной связью с кислородом в условиях газовой фазы, являются перспективными структурными мотивами сложных молекулярных стабилизаторов кластеров меди, при этом токсичность молекул, полученных на их основе, будет достаточно низкой.
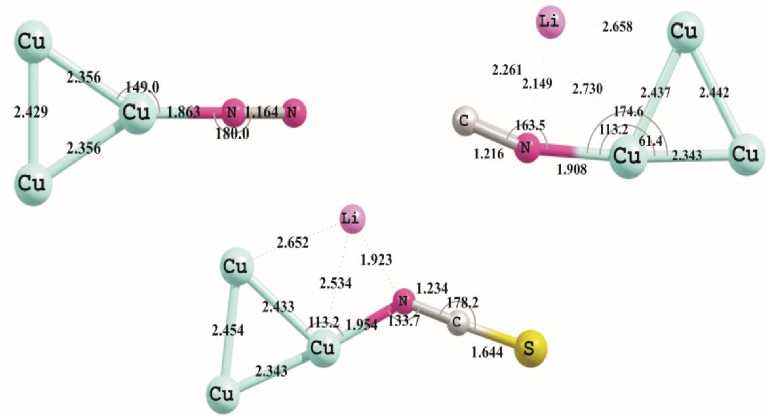
Рис. 4. Геометрические характеристики минимумов, полученных при помощи расчетов методом PBEPBE/Lanl2DZ для комплексов азота, цианида и тиоцианата лития с кластером Cu 3
Переход к неполярной среде n–гептана ослабляет все Cu–N-взаимодействия (табл. 2), но ослабление по-разному зависит как от размера кластера, так и от природы азотсодержащей молекулы. При этом все обнаруженные ранее тенденции сохраняются и наибольшей стабильностью отличаются структуры, где азотный центр связан двойной связью с гетероатомом, при этом максимальную эффективность по-прежнему показывает молекула нитроксила HN=O. Хотя молекулы диазена HN=NH и метанимина HN=СH 2 ощутимо проигрывают ей в качестве молекулы-стабилизатора в уловиях среды предельных углеводородов, они также являются перспективными моделями для поисков присадок за счет большего количества центров для замещения. В условиях неполярной среды соли цианида лития и тиоцианата лития заметно ухудшают свои свойства по сравнению с молекулами HN=Y (Y=CH 2 , NH, O).
Таблица 2
Энергии стабилизации комплексов, содержащих связь Cu–N, рассчитанные методом PBEPBE/Lanl2DZ (в ккал/моль) в неполярной системе (н-гептан)
Изменение среды на полярную апротонную среду двуатомного спирта (этиленгликоль) приводит к усилению всех Cu–N-взаимодействий на поверхности медных кластеров с сохранением всех обнаруженных ранее закономерностей и тенденций как по сравнению с газовой фазой, так и по сравнению со средой предельного углеводорода. Все соответствующие результаты приведены в табл. 3.
|
Молекула |
Cu 1 |
Cu 2 |
Cu 3 |
Cu 4 |
Cu 5 |
Cu 6 |
|
H 2 N-COOH |
7,33 |
13,70 |
17,63 |
16,13 |
||
|
NH2 |
13,97 |
21,33 |
25,92 |
23,93 |
||
|
N H |
12,43 |
11,75 |
15,55 |
13,61 |
||
|
N |
19,64 |
29,88 |
35,54 |
32,35 |
||
|
HN=CH 2 |
17,42 |
33,27 |
37,79 |
35,41 |
29,16 |
24,45 |
|
HN=NH |
28,82 |
30,39 |
43,31 |
36,48 |
32,04 |
24,57 |
|
HN=O |
46,85 |
35,52 |
58,35 |
46,30 |
45,05 |
|
|
NCS...Li |
10,92 |
25,23 |
33,81 |
30,39 |
||
|
N 2 |
14,43 |
20,71 |
27,03 |
24,06 |
||
|
N ≡ C...Li |
17,42 |
33,27 |
37,79 |
35,41 |
31,34 |
29,69 |
Машиностроение и машиноведение
Как показывают расчеты, в полярной среде многоатомных спиртов производные аммиака (карбамовая кислота и анилин) существенно проигрывают в силе образованных ими Cu–N-комплексов азотсодержащим молекулами с эффектами сопряжения (пиридин, пиррол) и молекулам с тройными связями (тиоцианаты и цианиды щелочных металлов). При этом наиболее прочные связи по-прежнему регистрируются для молекул с двойными связями, с безусловным лидером — молекулой нитроксила NH=O.
Таблица 3
Энергии стабилизации комплексов, содержащих связь Cu-N, рассчитанные методом PBEPBE/Lanl2DZ (в ккал/моль) в полярной апротонной системе (этиленгликоль)
|
Молекула |
Cu 1 |
Cu 2 |
Cu 3 |
Cu 4 |
Cu 5 |
Cu 6 |
|
NH2 |
14,61 |
21,79 |
25,66 |
24,44 |
||
|
N H |
12,47 |
11,37 |
14,49 |
13,38 |
||
|
N |
21,44 |
29,28 |
33,78 |
32,09 |
26,17 |
|
|
HN=CH 2 |
23,50 |
31,59 |
37,01 |
34,89 |
28,65 |
27,22 |
|
HN=NH |
32,75 |
31,92 |
46,13 |
38,82 |
31,03 |
26,58 |
|
HN=O |
54,07 |
36,70 |
65,00 |
50,25 |
47,62 |
33,11 |
|
NCS...Li |
12,82 |
26,76 |
25,67 |
|||
|
N 2 |
14,88 |
19,91 |
24,26 |
|||
|
N ≡ C...Li |
32,36 |
31,13 |
34,93 |
29,65 |
28,53 |
Выводы. Рассмотрев все основные случаи простейших азотсодержащих молекул, перспективных для использования как стабилизаторов нанопорошка меди, авторы выбрали для дальнейших экспериментов нитроксил H–N=O, диазен H–N=N–H и метанимин H–N=СH 2 , которые являются синтетически доступными, прочно связывающимися с поверхностью кластера меди молекулами, также проявляющими восстановительные свойства и не нарушающими структуры кластера меди при координации. При этом, заменяя водородный атом на любой объемный заместитель, возможно блокировать доступ к большой площади поверхности кластера различных агрессивных соединений. Следует также отметить, что комплексы кислорода на поверхности медного кластера существенно уступают в прочности структурам, образованным молекулами HN=Y (Y=CH 2 , NH, O). Полученные данные позволяют оптимизировать синтез стабилизированных медных наночастиц для их дальнейшего применения в качестве функциональных наноматериалов триботехнического назначения.
Список литературы Стабилизаторы для функциональных медных наноматериалов триботехнического назначения
- Jug, K. Structure and stability of small copper clusters/K. Jug, B. Zimmermann, P. Calaminici, A. M. Köster//J. Chem. Phys. -2002. -v.116. -p. 4497.
- Jug, K. Growth pattern and bonding of copper clusters/K. Jug, B. Zimmermann, A. M. Köster//International Journal of Quantum Chemistry. -2002. -V. 90, № 2. -p. 594-602.
- Grundner, S. Single-site trinuclear copper oxygen clusters in mordenite for selective conversion of methane to methanol/S. Grundner, M. A. C. Markovits, G. Li, M.Tromp, et al.//Nature Communications. -2014. -V. 6. -p. 7546.
- Гусев, А. И. Наноматериалы, наноструктуры, нанотехнологии/А. И. Гусев. -Москва: Физматлит, 2007. -414 с.
- Помогайло, А. Д. Наночастицы металлов в полимерах/А. Д. Помогайло, А. С. Розенберг, И. Е. Уфлянд. -Москва: Химия, 2000. -672 с.
- Губин, С. П. Наночастицы благородных металлов и материалы на их основе/С. П. Губин, Г. Ю. Юрков, Н. А. Катаева. -Москва: Азбука-2000, 2006. -154 с.
- Суздалев, И. П. Нанотехнология: физико-химия нанокластеров, наноструктур и наноматериалов/И. П. Суздалев. -Москва: КомКнига, 2006. -592 с.
- Мельников, А. Ф. Эффективность применения присадок на основе частиц твердых материалов при приработке деталей двигателей внутреннего сгорания/А. Ф. Мельников//Известия Самарского науч. центра Рос. академии наук. -2011. -Т. 13, № 4. -С. 1116-1118.
- Кужаров, А. С. Молекулярные механизмы самоорганизации при трении. Часть VIII. Физико-химические и функциональные свойства некоторых реметаллизантов современного рынка автохимии/А. С. Кужаров, А. А. Кужаров, Х. Нгуен, К. Г. Шучев, А. А. Рыжкин//Трение и износ. -2015. -Т. 36. -№ 1. -С. 62-69.
- Кужаров, А. С. Ещё раз и несколько иначе о металлоплакировании, фабо-и безызносности/А. С. Кужаров, А. А. Кужаров//Известия Самарского научного центра Российской академии наук. -2011. -Т. 13. -№ 4-3. -С. 772-775.
- Соловьев, М. Е. Квантово-химическое моделирование формирования наночастиц из карбоксилатов меди/М. Е. Соловьев, В. И. Иржак//Коллоидный журнал. -2015. -Т. 77. -№ 3. -С. 377-383.
- Герасина, Ю. С. Квантово-химическое исследование взаимодействия гидридов элементов V-VI групп и их алкилпроизводных с атомами, ионами и малыми кластерами металлов группы Ib/Ю. С. Герасина, А. А. Милов, А. А. Кужаров//Вестник ЮНЦ РАН. -2015. -Т. 11. -№ 2. -С. 23-29.
- Hay, P. J. Ab initio effective core potentials for molecular calculations -potentials for K to Au including the outermost core orbitals/P. J. Hay, W. R. Wadt//J. Chem. Phys. -1985. -V. 82. -p. 299-310.
- Perdew, J. P. Generalized gradient approximation made simple/J. P. Perdew, K. Burke, M. Ernzerhof//Phys. Rev. Lett. -1996. -V. 77. -p. 3865-3868.
- Perdew, J. P. Errata: Generalized gradient approximation made simple/J. P. Perdew, K. Burke, M. Ernzerhof//Phys. Rev. Lett. -1997. -V. 78. -p. 1396-1399.
- Frisch M. J., Trucks G. W., Schlegel H. B. et al. Gaussian 09. -Gaussian, Inc., Wallingford CT. -2013.


