Стандартная свободная энергия Гиббса образования кристаллических оксидов хрома переменного состава
Автор: Груба О.Н., Рябухин А.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (50), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156490
IDR: 147156490 | УДК: 536.75
Текст обзорной статьи Стандартная свободная энергия Гиббса образования кристаллических оксидов хрома переменного состава
В термодинамических расчетах большая роль отводится согласованию числовых значений величин. Одним из способов внутреннего (термические константы индивидуального вещества) и внешнего (термические константы различных веществ) согласований является использования свойств /’-потенциала. По определению - это разность между стандартной энтропией образования и абсолютной энтропией вещества [1-4],
P = b/S°-S°. (1)
Для простых веществ уравнение (1) переходит в P = -S°.
P-потенциал обладает рядом специфических свойств.
-
1. Аддитивность (P-потенциал сложного вещества равен сумме P-потенциалов элементов с учетом стехиометрических коэффициентов)
-
2. P-потенциал процесса равен нулю.
-
3. P-потенциал не является функцией структуры, то есть не зависит от агрегатного состояния вещества.
^)=^)+^)=-y^)-XS(4 (2)
Использование уравнения (2) для определения AyS позволяет согласовать величины \jH и \jG данного вещества. Так как наиболее точно известны энтропии простых веществ (особенно газов), а величина P-потенциала не зависит от агрегатного состояния, то это позволяет рассчитывать AyS с точностью экспериментальных данных абсолютной энтропии S. .
Таким образом, предложенная методика может использоваться для согласования термических постоянных простых и сложных веществ независимо от их агрегатного состояния.
Результаты расчетов Пи-потенциалов оксидов хрома и их Ау5 приведены в табл. 1.
Энергия Гиббса (свободная энергия) AG является одной из важнейших термодинамических характеристик. Особая роль ей отводится в химической термодинамике, так как величина и знак AG позволяют судить о состоянии системы - о ее положении относительно равновесия.
Созданные математические модели расчета 8, ЛуН позволяют определить A jG веществ, а Ср - температурные зависимости этих термодинамических характеристик. Изменение интенсивных параметров системы позволяет управлять химическими процессами.
В физической химии часто используется соотношение
^Gт=^H-T^S.
Применительно к стандартным условиям образования сложного вещества:
AyG° = АуЯ° - То AfS°. (3)
По этому уравнению с использованием полученных 5 [5] и A j-H [6] рассчитаны A yG оксидов хрома, представленные в табл. 2.
Расчетные точки ложатся на соответствующие пересекающиеся прямые зависимостей g(x). Определение вида зависимостей g(x) для каждой из трех выделенных ОТР, позволяет рассчитать А/7 для любых соединений, лежащих по составу в этой области. Кроме того, важным следствием является линейная зависимость удельной энергии Гиббса от состава.
Выводы
-
1. На основании ранее разработанных математических моделей расчета 8, A jH и в их развитие определены стандартные энергии Гиббса образования для бинарных кристаллических соединений металлов (оксидов).
-
2. Адекватность модели справочным данным подтверждена расчетами свободной энергии Гиббса оксидов хрома.
-
3. Математические уравнения моделей позволяют рассчитывать величины стандартных энергий Гиббса образования для соединений произвольного состава.
Груба О.Н., Рябухин А.Г.
Стандартная свободная энергия Гиббса образования кристаллических оксидов хрома переменного состава
Стандартные энтропии образования A j-S кристаллических оксидов хрома переменного состава
Зависимость стандартной энергии Гиббса образования кристаллических оксидов хрома СгОх от состава
Таблица 1
|
№ |
Вещество |
Структура |
8, Дж-моль '-КГ1 [5] |
-Р, УР-(2) |
AyS, УР- (1) |
|
1. |
Сг |
ОЦК (oFe) |
23,64 |
23,64 |
0 |
|
2. |
Сг2О СЮ0,5 |
29,337 |
149,798 74,899 |
91,124 45,562 |
|
|
3. |
Сг3О2 СгОо,б67 |
33,327 |
276,058 92,019 |
176,077 58,692 |
|
|
4. |
СГ304 СгОо,75 |
36,343 |
301,584 100,528 |
192,555 64,185 |
|
|
5. |
СЮ |
гцк NaCl |
59,611 |
126,158 |
66,545 66,547 |
|
6. |
СГ4О5 СЮ1,25 |
47,134 |
607,148 151,787 |
418,612 104,653 |
|
|
7. |
СГ3О4 СЮ1,ззз |
шпинель (MgAl2O4) |
44,471 |
480,887 160,296 |
347,474 115,824 |
|
8. |
Сг2О3 СЮ1,5 |
ГПУ |
40,480 |
354,833 177,416 |
273,873 136,936 |
|
9. |
СГ3О5 СЮ 1,667 |
42,319 |
583,61 194,537 |
456,653 152,218 |
|
|
10. |
СГ5О9 CrO^g |
тетрагон. |
43,977 |
1040,86 208,172 |
820,973 164,195 |
|
11. |
сю2 |
тетрагон. |
46,878 |
228,675 |
181,797 |
|
12. |
СГ4О9 СгО2,25 |
51,440 |
1017,22 254,304 |
811,456 202,864 |
|
|
13. |
СгзО12 СЮ2,4 |
ромбич. |
54,884 |
1348,41 269,682 |
1073,99 214,798 |
|
14. |
Сг2Оз СЮ2,5 |
монокл. |
57,580 |
559,868 279,934 |
444,708 222,354 |
|
15. |
СГ5О13 СЮ2>6 |
60,686 |
1450,93 290,186 |
1147,498 229,500 |
|
|
16. |
СЮз |
ромбич. |
80,008 |
331,193 |
251,185 |
Таблица 2
|
№ |
Вещество |
Lz |
-AyG, кДж-моль-1 [7-10] |
-АуЯ, кДж-моль 1 [6] |
-^S |
g, УР-(4) |
-AyG, кДж-моль-1 УР- (3) |
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
1. |
Сг |
24 |
0 |
0 |
0 |
0 |
|
|
2. |
Сг2О СЮо.5 |
28 |
361,564 180,782 |
91,124 45,562 |
5,97 |
334,41 167,20 |
|
|
3. |
Сг3О2 СЮо.667 |
29,336 |
757,563 252,521 |
176,077 58,692 |
8,01 |
705,09 235,03 |
|
|
4. |
СГ304 СЮо,75 |
30 |
1162,200 290,550 |
192,555 64,185 |
9,05 |
814,27 271,42 |
|
|
5. |
сю |
32 |
413,210 |
66,545 |
12,29 |
393,38 |
Окончание табл. 2
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
|
6. |
Сг4О5 СЮ1.25 |
34 |
1956,788 489,197 |
418,612 104,653 |
13,47 |
1832,04 458,01 |
|
|
7. |
Сг3о4 СгО].ззз |
34,664 |
1546,0±3,5 515,333±1,167 |
347,474 115,824 |
13,87 |
1442,41 480,80 |
|
|
8. |
СГ2О3 СЮ15 |
36 |
1058,96 [7] 1059,89 [8] 1046,84 [9] 1049,21 [10] |
1140,558±1,674 570,279 |
273,873 136,936 |
14,71 |
1058,94 529,47 |
|
9. |
Сг3о5 СЮ 1.667 |
37,336 |
1730,436 576,812 |
456,653 152,218 |
14,23 |
1594,35 531,45 |
|
|
10. |
СГ5О9 CrOL8 |
38,4 |
2906,480 581,296 |
820,973 164,195 |
13,86 |
2661,83 532,37 |
|
|
11. |
сю2 |
40 |
544,28 [8] 535,91 [10] |
586,772 |
181,797 |
13,31 |
532,60 |
|
12. |
СГ4О9 СгО2,25 |
42 |
2336,032 591,508 |
811,456 202,864 |
12,64 |
2124,22 531,05 |
|
|
13. |
СГ5О12 СЮ2.4 |
43,2 |
2966,125 593,225 |
1073,99 214,798 |
12,25 |
2646,08 529,22 |
|
|
14. |
СГ2О5 СЮ2.5 |
44 |
1187,802 593,901 |
444,708 222,354 |
11,99 |
1055,28 527,64 |
|
|
15. |
Сг5О1з СЮ2.6 |
44,8 |
2970,952 594,190 |
1147,498 229,500 |
11,74 |
2629,00 525,80 |
|
|
16. |
СЮ3 |
48 |
513,45 [7] 506,25 [8] 503,25 [10] |
590,362±3,347 |
251,185 |
10,77 |
516,81 |
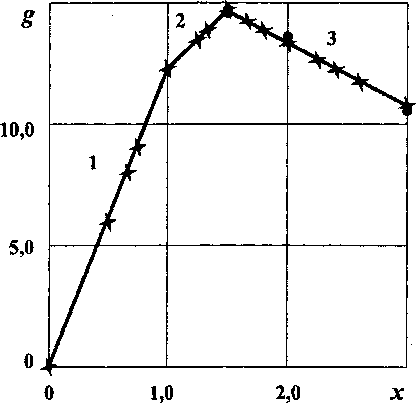
Зависимость удельной энергии Гиббса образования от состава оксидов хрома: 1 - ОТР-1; 2 - ОТР-2; 3 - ОТР-3 (х - расчет, • - эксперимент)
Список литературы Стандартная свободная энергия Гиббса образования кристаллических оксидов хрома переменного состава
- Рябухин А.Г. Стандартная энтропия электрона в водном растворе//Журнал физической химии. -1977. -Т. LI. -№4. -С. 968-969.
- Рябухин А.Г. Р-потенциал.//Изв. ЧНЦ УрО РАН. -1999. -Вып. 3. -С. 23-25.
- Рябухин А.Г. Способ согласования термических свойств веществ//Изв. ЧНЦ УрО РАН. -2000. -Вып. 2. -С. 29-31.
- Рябухин А.Г. Эффективные ионные радиусы. Энтальпия кристаллической решетки. Энтальпия гидратации ионов: Монография. -Челябинск: Изд. ЮУрГУ, 2000. -115 с.
- Рябухин А.Г., Груба О.Н. Энтропия кристаллических оксидов хрома//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 36-40.
- Рябухин А.Г., Груба О.Н. Расчет стандартной энтальпии кристаллических оксидов хрома.//Изв. ЧНЦ УрО РАН (в печати).
- Термические константы веществ: Справочник в 10 вып./Под ред. В.П. Глушко. М.: АН СССР. -ВИНИТИ. -1974. -Вып. VII (Т.2). -343 с.
- Уикс К.Е., Блок Ф.Е. Термодинамические свойства 65 элементов, их окислов, галогенидов, карбидов и нитридов/Пер. с англ. -М.: Металлургия, 1965. -240 с.
- Латимер В.М. Окислительные состояния элементов и их потенциалы в водных растворах. Пер. с англ./Под ред. проф. КВ. Астахова. -М.: Изд-во иностр. лит., 1954. -400 с.
- Термодинамические свойства неорганических веществ: Справочник/Под ред. А.П. Зефирова. -М.: Атомиздат, 1965. -460 с.


