Стандартные теплоемкости и энтропии карбидов хрома переменного состава
Автор: Груба О.Н., Рябухин А.Г.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Металлургия @vestnik-susu-metallurgy
Статья в выпуске: 10 (50), 2005 года.
Бесплатный доступ
Короткий адрес: https://sciup.org/147156494
IDR: 147156494 | УДК: 544
Текст обзорной статьи Стандартные теплоемкости и энтропии карбидов хрома переменного состава
Теплоемкость и энтропия веществ и их изменение в тепловых процессах являются важнейшими термическими характеристиками. Зависимости энтальпии и энергии Гиббса от температуры определяются температурными зависимостями теплоемкости и энтропии.
Несостоятельность прямой аддитивности или их инкрементов при расчете теплоемкости или энтропии сложных веществ количественно показана в [1,2].
Для бинарных систем АВХ, в которых компонент В при стандартных условиях является газом, разработаны корректные модели расчета С° и S0 в зависимости от состава [1,3-5].
Несомненный интерес и актуальность представляет создание моделей расчетов теплоемкости и энтропии бинарных кристаллических соединений МвуАх (MeAz/y или МеА^, в которых А является твердым веществом при стандартных условиях (С, Si, Р, В и т.п.).
Теоретическое и практическое значение в первую очередь имеет создание такой модели для веществ, содержащих углерод, в частности, карбидов. В качестве объектов изучения взяты карбиды хрома.
Соединения СгСх имеют большое практическое значение для производства металлического хрома, в металлургии хромистых сталей и ферросплавов с хромом. В справочной литературе приводятся данные для пяти кристаллических карбидов хрома: Сг4С, Сг23С6, Сг5С2, Сг7С3 и Сг3С2. Кроме того, имеются неподтвержденные сведения о существовании Сг6С и Сг3С.
Карбиды хрома благодаря ряду ценных свойств, а именно: высокая твердость при комнатных и высоких температурах, высокое сопротивление окислению, стойкость против абразивного износа и коррозии, нашли весьма широкое применение при производстве металлокерамических сплавов и для других целей. Промышленное производство карбидов хрома (в виде порошков) осуществляется путем карбонизации смеси оксида хрома Сг2О3 с углеродом при высоких температурах в атмосфере водорода [6].
Среди разнообразных направлений использования хрома наибольший удельный вес занимает производство ферросплавов. Сортамент феррохрома очень разнообразен. Существует 17 марок феррохрома и 5 марок металлического хрома. Сплавы отличаются в основном по содержанию углерода, которое изменяется от 0,01 до 8,0 % Серия «Металлургия», выпуск 6
(масс.). Высокоуглеродистый феррохром имеет в своем составе углерод в основном виде (Cr, Fe)7C3, а рафинированный содержит углерод в виде (Сг, Ге)23Сб [7]. Изучение термодинамических условий восстановления Сг2О3 углеродом осложняется отсутствием термических характеристик для карбидов хрома произвольного состава.
ТЕПЛОЕМКОСТЬ
Математическая модель
Математическая модель расчета теплоемкости кристаллических соединений обоснована и подтверждена многочисленными справочными данными на примерах оксидов s-, р- и ^-элементов произвольного состава, а также на трехкомпонентных оксидных ферри- и хромпшинелях, ильменитах [1, 3, 8]. Эта модель успешно использована при расчетах теплоемкости кристаллических нитридов марганца произвольного состава [5].
Кислород и азот при стандартных условиях представляют собой газы и, следовательно, не могут быть кристаллообразующими. Иначе обстоит дело, когда в соединении МеАх при стандартных условиях А находится в кристаллическом состоянии, то есть может само выступать в роли КО наряду с металлом или в противовес ему.
Основные положения математической модели для расчета теплоемкости бинарных оксидов и нитридов металлов, изложенные в [1, 3, 8] применимы и для карбидов.
-
1. Поле диаграммы «свойство-состав» делится на области твердых растворов (ОТР), в каждой из которых выделяется центральное кристаллообразующее (КО) вещество. Как правило, в роли КО выступает устойчивое соединение с известной структурой и термическими характеристиками. В первой OTP (ОТР-1) в качестве кристаллоообра-зующего выступает сам металл.
-
2. Аддитивностью обладают величины обратных теплоемкостей. Величина обратной теплоемкости твердого раствора имеет размерность моль-К-Дж-1. Она складывается из обратной величины теплоемкости кристаллообразующего компонента и обратной величины суммы теплоемкостей составляющих элементов с учетом объемной структурной постоянной К, включающей линейные структурные константы компонентов к. Физический смысл этой величины - изменение температуры моля вещества при сообщении ему одного джоуля энергии. Все расчеты проводятся на 1 моль металла, то есть для соединений состава МеАх.
Аналитическое выражение модели для любой ОТР имеет вид:
(о где х„ - координата границы рассматриваемой ОТР.
Уравнение (1) можно привести к более удобному линейному виду:
-
С”1 ^МеАх ^ = а±Ьх.
В табл. 1 (колонка 3) приведены имеющиеся справочные данные [9-12] для карбидов, расположенных в порядке увеличения содержания углерода в расчете на 1 моль металла.
Из анализа этих данных (колонки 1 и 2) следует, что в системе Сг-С должны существовать две области твердых растворов.
ОТР-1: Сг(ОЦК-2) - Сг4С(ГЦК-4, ОЦК-1) - Сг23С4(ГЦК-4) - Сг5С2(ГПУ-1);
ОТР-2: Сг5С2(ГПУ-1) - Сг7С3(ГПУ-8) -Сг3С2(ромб.-4).
Цифрами отмечены числа формульных единиц (координационные числа) структур.
В ОТР-1 объединяются карбиды с кубической структурой, в ОТР-2 - с более сложными структурами (ГПУ и ромбической). На границе областей расположен карбид Сг5С2 (ГПУ-1).
По мере увеличения содержания углерода изменяется характер атомно-молекулярного взаимодействия, что приводит к преобразованию пространственного расположения частиц, то есть к постепенному переходу от одной кристаллической формации к другой с изменением линейных структурных констант кп. Поэтому в каждой ОТР объемные структурные постоянные К„ имеют свои численные значения.
ОТР-1 (х = 0+0.4). КО - Сг
Переходу от Сг (ОЦК-2), кОцК = ^/З -1 ] к Сг5С2 (ГПУ-1), кГПУ_х=^- (координационное число кот=4) соответствует объемная структурная постоянная Кх = коцк' ^гпу-1 ' ккч = = Uy-i\ — -4 = 1,79315.
-
Ур. (1) принимает вид:
1,79315(0,4-8,554 + 23,550)
C;*(CrCj= 0,04246-0,02163х. (2)
Результаты расчетов по уравнению (2) даны в табл. 1 и на рис. 1.
ОТР-2 (х = 0,4+0,66667). КО - Сг7С3
В качестве кристаллообразующего выбран хорошо изученный карбид Сг7С3. переходу от
, V6
структуры Сг7С3(ГПУ-8) крпУ-8 =--- к ромби-
Таблица1
Стандартная теплоемкость карбидов хрома
|
Вещество |
Структура |
С° [9-12] |
С-1 |
С-1 ур.(2,3) |
z-<0 Ср.расч. |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
|
|
1 |
С |
ГПУ-4 |
8,554+0,167 |
|||
|
2 |
Сг |
ОЦК-2 («■Fe) |
23,550+0,126 |
0,04246+0,00022 |
0,04246 (2) |
23,552 |
|
3 |
Сг4С СгСо25 |
ОЦК-1 ГЦК-4 |
107,816+0,418 26,954+0,105 |
0,03710+0,00014 |
0,03705 (2) |
107,955 26,989 |
|
4 |
Сг23Сб СгСо,26087 |
ГЦК-4 |
624,253+2,929 27,141+0,128 |
0,03684+0,00018 |
0,03682 (2) |
624,660 27,159 |
|
5 |
Сг5С2 СгС0,4 |
ГПУ-2 |
147,695+1,255 29,539+0,251 |
0,03385+0,00028 |
0,03381 (2) 0,03386 (3) |
147,885 29,577 147,665 29,533 |
|
6 |
Сг7С3 СгС0.42857 |
ГПУ-8 |
208,865+0,837 29,838+0,119 |
0,03351+0,00013 |
0,03351 (3) |
208,901 29,843 |
|
7 |
Сг3С2 СгСо.66667 |
ромб.-4 |
98,150+0,209 32,817+0,069 |
0,03047+0,00006 |
0,03053 (3) |
98,264 32,755 |
|
8 |
Сг6С СгСо. 16667 |
0,03886 (2) |
154,398 25,733 |
|||
|
9 |
Сг3С СгСо,33333 |
0,03525 (2) |
85,107 28,369 |
ческой Сг3С2 с кромб = —— (координационное 8
число кКч = 6) отвечает объемная структурная постоянная Кг = кгпу • кромб • кКЧ =
= 2^.^.6 = 2,38649.
Для ОТР-2 ур. (1) принимает вид: с;1(сгс,)=с;1(сгсо42857)-__х-0,42857 .
^2 [х2 Ср (с) + Ср (СгС0 42857 )] с;1 (СгС,) = 0,03351
__х-0,42857.
2,38649(0,66667-8,554 + 24,838) ’ сДСгС,^ 0,03351-0,01251х.(3)
Результаты расчетов по уравнению (3) приведены в табл. 1 и на рис. 1.
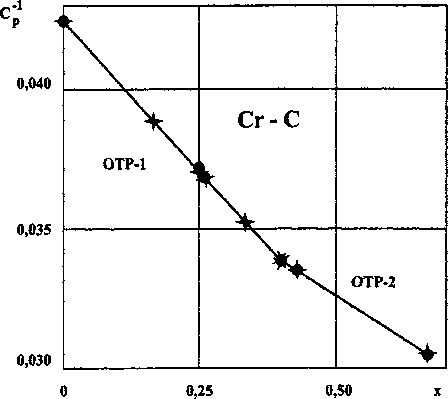
Рис. 1. Зависимость обратной теплоемкости от состава карбидов хрома (• - эксперимент, х - расчет)
Из сравнения расчетных (колонка 6) и справочных (колонка 3) величин Ср карбидов хрома следует их хорошее согласие, не выходящее за пределы доверительных интервалов последних. Расчеты С°(О502) по уравнениям для ОТР-1 и ОТР-2 согласуются между собой С°(Сг5О2) - 147,775 ±0,110. Эта средняя расчетная величина больше справочной на 0,080. В табл. 1 (строки 8, 9) даны величины Ср карбидов, о которых имеются упоминания в литературе, но отсутствуют величины теплоемкостей.
ЭНТРОПИЯ
Математическая модель
-
1. Энтропия вещества складывается из двух независимых величин: ASm (от mass), связанной с массой и ASin (от interaction), определяемой межчастичным взаимодействием.
-
2. Обратная величина 4Sin бинарного вещества (AS~^) равна сумме обратных величин А8^ компонентов с учетом состава и кристаллических структур. Бинарным является сложное вещество, если в нем можно выделить структурные составляющие. Все расчеты относятся к одному молю металла, то есть состав выражается как МеАх, энтропия - в Дж-К"1-моль-1. Физический смысл величины AS^n- изменение температуры моля вещества при изменении энтропии взаимодействия на единицу [1].
-
3. В зависимости от кристаллических структур, определяемых составом и изменяющимся атомно-молекулярным взаимодействием, диаграмма AS^-x делится на области твердых растворов (ОТР). В каждой ОТР выделяется кристаллообразующий компонент (КО) - устойчивое вещество с известной энтропией и структурой. В ОТР-1 кристаллообразующим компонентом всегда является металл.
-
4. В общем виде расчетное уравнение зависимости А8^ от х выглядит так:
S = ASm + ASin. (4)
У частиц в кристаллическом веществе имеется только одна степень свободы поступательного движения (вдоль пути реакции), поэтому
A5m=|/?lnM,(5) где М - относительная атомная, молекулярная масса; R - универсальная газовая постоянная.
48^ определяется из уравнения (4). В зависимости от условий она может иметь положительное или отрицательное значение, 4Sm - только положительное.
^-ДМеА>88"ДК0^
± х-х^КО^
к^аМ+^^о)]’ где К - объемная структурная постоянная, количественно характеризующая пространственное расположение взаимодействующих частиц и структурных составляющих. Величина К в каждой ОТР определяется сочетанием структурных компонентов [1], х„ - координата границы рассматриваемой ОТР.
Уравнение (6) можно привести к удобному виду
А$7„ (МеАх ) = a ±Ьх. (7)
Эта модель была проверена на простых и сложных оксидах [4, 13-15]. Результаты расчетов энтропий стехиометрических и нестехиометрических оксидов согласуются со справочными данными в пределах точности экспериментов.
При образовании соединения АВХ из компонентов А и В, находящихся при стандартных условиях в кристаллическом состоянии, между ними возникает конкуренция за место кристаллообразующего компонента. Возможные варианты: А внедряется в В (например, уран в кристаллическую серу) или В в А (сера - в уран). По определению в ОТР-1 кристаллообразующим всегда является металл, поэтому в основном ур. (6) вклад в AStn второго компонента учитывается его долей (х), приходящейся на 1 моль металла. В других ОТР учет аналогичен. В этом заключается принципиальное отличие от соединений типа АВХ, в которых компонент В при стандартных условиях находится в газообразном состоянии. Однако значительный интерес представляет выяснение пригодности модели для расчета энтропии веществ, в которых компонент А является при стандартных условиях кристаллическим, а не газовым. Это явилось одной из причин выбора в качестве объектов изучения карбидов хрома СгСх.
В табл. 2 (колонки 1-3) приведены исходные справочные сведения о составе, структуре и энтропии карбидов. Все они являются бертоллидами. Из анализа данных колонки 2 следует, что в системе Сг-С должно быть две ОТР: первая включает соединения с кубической структурой, вторая - с более сложной.
ОТР-1 (х - 0*0,4). КО - Сг
В этой ОТР по мере внедрения углерода происходит переход от структуры ОЦК (Ст) к структуре ГПУ (Сг5С2). Вероятно, это вещество находится на границе между Областями твердых растворов. Для ОЦК структурная константа
^оцк ®я ГПУ кгпу - -j=.
Объемная
структурная постоянная ОТР-1:
^1 - коцк ‘ кгпу ■ Ккч ~ "^
4=-4 = 1,15470
V3
(координационное число к№=4).
Ур. (6) принимает форму:
Д^ (CrCx) = AS"1 (Сг)-х - 0 "^AS^cJ^AS^j]’ Д5Г1(СгСЛ) = 0,13933
X
1,15470 [-4,594-0,4+7,177]’
Решая уравнение (7), например, относительно Д5ги(СгС02б087) получим Ь- 0,14484 и уравнение (8) примет вид:
AS"1 (CrCj = 0,13933 -0,14484 х. (9)
Результаты расчетов приведены в табл. 2 и на рис. 2. Расчетные величины хорошо согласуются с экспериментальными. '
Таблица 2
Энтропия карбидов хрома
|
Вещество |
Структура |
S, [9, Ю, Гб] |
4Sm, УР- (2) |
А8,„, ур.(1) |
^гЛ УР-(6, 8) |
S, расч. |
||
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
|
|
1 |
С |
ГПУ |
5,740±0,126 |
10,334 |
-4,594 |
|||
|
2 |
Сг |
ОЦК (a-Fe) |
23,640±0,209 |
16,426 |
7,219 |
0,13853 |
■ 0,13933 |
23,603 |
|
3 |
Сг4С СгСо,25 |
ГЦК-4 |
105,855 26,464 |
16,659 |
9,795 |
0,10209 |
0,10312 |
105,426 26,356 |
|
4 |
Сг23С6 СгСо.26087 |
ГЦК-4 |
610,027±2,924 26,523 |
16,669 |
9,854 |
0,10148 |
0,10167 |
609,891 26,517 |
|
5 |
Сг5С2 СгСо.4 |
ГПУ-4 |
144,766±1,255 28,953 |
16,793 |
12,160 |
0,08224 |
0,08230 |
144,720 28,944 |
|
6 |
Сг7Сэ СгСо, 42857 |
ГПУ-8 |
202,087±1,255 28,870 |
16,818 |
12,052 |
0,08248 |
0,08297 |
202,097 28,871 |
|
7 . |
Сг3С2 СгСо.66667 |
ромб.-4 |
84,935±0,412 28,3117 |
17,021 |
11,2907 |
0,08857 |
0,08854 |
84,945 28,315 |
|
8 |
Сг6С СгСо.16667 |
16,583 |
0,11519 |
151,585 25,264 |
||||
|
9 |
Сг3С СгСо,ззззз |
16,734 |
0,09105 |
83,151 27,717 |
ОТР-2 (х - 0,4-0.66667). КО - Сг2Сз
В этой области переходу от структуры ГПУ Оглу = ^) к ромбической <кромб = -^У отвечает объемная структурная постоянная ^2 = ^гпу ‘ ^ромб. • Ккч ~ ~^" ~^ " 6 = 4,24264.
В качестве КО используем Сг7С3 как хорошо изученный. Ур. (6) примет вид:
^/V (CrCx^ - AS^1 (CrC042857) +
__________X- 0,42857.
K2[x2AS,„(C) + AS„(CrC0,4285?)]
AS",(CrCx) = 0,08297 +
+_____r -M28L7
4,24264 [-4,594 ■ 0,66667 + 7,177]
Используя данные по Сг3С2, получим b = 0,02338. Уравнение (10) преобразуется:
AS71 (СгСх) = 0,07295 - 0,02338%.(11)
Вычисленные значения AS”1 и 5 помещены в табл. 2 и на рис. 2. Согласие расчетов и экспериментов хорошее.
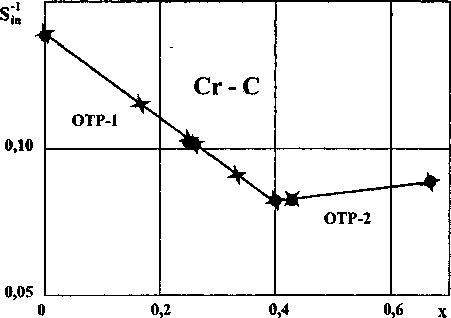
Рис. 2. Зависимость обратной энтропии взаимодействия карбидов хрома (СгСх) от состава (• - эксперимент, х - расчет)
Совместное решение уравнений (9) и (11) дает х 0,395, что практически совпадает с х = 0,4 (различие 1,25%). Этому соответствует S(Cr5C2) = 144,810, отличающееся от рассчитанного по ур. (11) на 0,090.
Полученные результаты подтверждают возможность использования разработанной модели для расчетов энтропии бинарных соединений, в частности, карбидов.
Выводы
-
1. Разработаны математические модели расчетов стандартной теплоемкости и энтропии бинарных кристаллических соединений металлов, содержащих компоненты, являющиеся кристаллическими в стандартных условиях.
-
2. Адекватность модели справочным данным подтверждена расчетами теплоемкости и энтропии карбидов хрома.
-
3. Математические уравнения модели позволяют рассчитать С® и 5° карбидов хрома произвольного состава, что особенно важно для соединений с малым содержанием углерода.
-
4. Модель обладает предсказательностью.
-
5. Обоснована возможность использования модели для расчета Ср и S0 бинарных кристаллических соединений типа МеАы где А - В, Si, Р, S, Ge, As, Sb, Bi, существующих при стандартных условиях в кристаллическом состоянии, что особенно важно для теории и практики легирования низкоуглеродистых сталей и сплавов.
Список литературы Стандартные теплоемкости и энтропии карбидов хрома переменного состава
- Рябухин А.Г., Олейников М.А. Теплоемкость кристаллических оксидов. Монография. -Челябинск: Изд. ЮУрГУ, 2004. -84 с.
- Рябухин А.Г., Груба О.Н Сравнительный анализ приближенных методов расчета абсолютной энтропии на примере оксидов d-элементов IV периода//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 41-45.
- Рябухин А.Г. Стандартные теплоемкости оксидов дальтонидов и бертоллидов s-и р-элементов//Изв. ЧНЦ УрО РАН. -2004. -Вып. 3(24). -С. 49-52.
- Рябухин А.Г. Математическая модель расчета энтропии кристаллических оксидов//Вестник ЮУрГУ. Серия «Математика, физика, химия». -2005. -Вып. 6(46). -С. 179-186.
- Рябухин А.Г., Стенников М.А. Расчет стандартных тетоемкостей нестехиометрических оксидов триады марганца (Мп, Тс и Re)//Изв. ЧНЦ УрО РАН.-2004. -Вып. 2(23). -С. 74-77.
- Григорьева В.В., Клименко В.Н. Свойства карбидов хрома и металлокерамических сплавов на их основе. Исследования жаропрочных сплавов. -T. IV. -М: Изд. АН СССР, 1959. -С. 79-82.
- Рысс М.А. Производство ферросплавов. -М.: Металлургия, 1985. -344 с.
- Рябухин А.Г. Модель расчета стандартных тетоемкостей С0р нестехиометрических соединений//Изв. ЧНЦУрОРАН.-2003.-Вып. 4(11).-С. 38-42.
- Термические константы веществ: Справочник в 10 вып./Под ред. В.П. Глушко. -М.: АН СССР. ВИНИТИ, 1967-1977.
- Уикс К.Е., Блок Ф.Е. Термодинамические свойства 65 элементов, их окислов, галогенидов, карбидов и нитридов./Пер. с англ. -М.: Металлургия, 1965. -240 с.
- Матюшенко И.Н. Кристаллические структуры двойных соединений. -М.: Металлургия, 1969. -303 с.
- Нарита К. Кристаллическая структура неметаллических включений в стали/Пер. с япон. -М.: Металлургия, 1969. -190 с.
- Рябухин А.Г., Груба О.Н. Энтропия кристаллических оксидов хрома//Изв. ЧНЦ УрО РАН. -2005. -Вып. 4(30). -С. 36-40.
- Рябухин А.Г. Расчет энтропии кристаллических оксидов титана//Вестник ЮУрГУ, Серия «Металлургия» (в печати).
- Рябухин А.Г., Груба О.Н. Энтропия взаимо действия и магнитная восприимчивость катионов в соединениях типа МеО//Высокие технологии, фундаментальные исследования, образование. Т. 5: Сборник трудов Второй Международной научно-практической конференции «Исследование, разработка и применение высоких технологий в промышленности». 7-9 февраля 2006 г. С.-Петербург, Россия/Под ред. А.П. Кудинова, Г.Г. Матвиенко, В.Ф. Самохина. -СПб.: Изд-вo Политехн., ун-та, 2006. -С. 285-287.
- Латимер В.М. Окислительные состояния элементов и их потенциалы в водных растворах. Пер. с англ./Под ред. проф. К.В. Астахова. -М.: Изд-во иностр. лит., 1954. -400 с.


