Стандартный протокол проведения нутритивной поддержки в хирургическом отделении реанимации и интенсивной терапии. Первые результаты внедрения
Автор: Поляков Игорь Вячеславович, Золотухин Константин Николаевич, Лейдерман Илья Наумович
Журнал: Хирургическая практика @spractice
Рубрика: Оригинальные исследования
Статья в выпуске: 2, 2013 года.
Бесплатный доступ
Предварительные результаты применения протокола нутритивной поддержки в ХОРИТ, основанного на современных методических рекомендациях, способствует оптимизации лечебного процесса и улучшению результатов терапии у пациентов хирургического профиля с нутритивной недостаточностью.
Нутритивная поддержка, парентеральное питание, нутритивная недостаточность
Короткий адрес: https://sciup.org/142211512
IDR: 142211512 | УДК: 616-036.882-08
Текст научной статьи Стандартный протокол проведения нутритивной поддержки в хирургическом отделении реанимации и интенсивной терапии. Первые результаты внедрения
Актуальность проблемы
У пациентов хирургического профиля в критическом состоянии нутритивная поддержка является важной составной частью интенсивной терапии [1, 7, 11, 12]. Пациенты хирургических отделений реанимации и интенсивной терапии, находящиеся в критическом состоянии и имеющие клинические проявления органной несостоятельности, являются той группой больных, где наиболее часто предпринимаются попытки использовать методы нутритивной коррекции расстройств белкового и энергетического обмена – энтеральное и парентеральное питание [4, 6, 8, 13]. Несмотря на существующие практические рекомендации, некоторые исследования в нашей стране и за рубежом описывают неадекватную практику нутритивной поддержки в отделениях интенсивной терапии [2, 4].
Нерациональное назначение препаратов для энтерального и парентерального питания, доказано, приводит к увеличению частоты госпитальной инфекции, длительности системного воспалительного ответа, сроков искусственной вентиляции легких, увеличению длительности пребывания больного в отделении интенсивной терапии [3, 9, 10].
Цель исследования
Повышение эффективности интенсивной терапии и сокращение затрат на лечение больных в хирургическом ОРИТ с помощью внедрения системы оригинальных стандартных протоколов проведения нутритивной поддержки.
Материалы и методы
Исследование проводилось на базе 16-коечного отделения хирургической реанимации и интенсивной терапии Республиканской клинической больницы имени Г.Г. Куватова (г. Уфа). Все пациенты, поступающие в отделение интенсивной терапии, подвергались скринингу с помощью шкалы MUST [14]. В исследование включались пациенты с оценкой по шкале MUST более 3 баллов, длительностью пребывания в отделении интенсивной терапии более 72 часов и признаками нутритивной недостаточности любой степени [5].
В результате проспективного исследования были сформированы 2 группы (табл. 1 и рис. 1).
В первой группе пациенты получали «традиционную» нутритивную поддержку, во второй – согласно созданному в отделении оригинальному протоколу.

Таблица 1.
Характеристика больных в ХОРИТ, M±SD
|
Показатели |
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
|
Шкала АPACHE-II, баллы, (1 день) |
14,2±2,8 |
14,4±3,1 |
|
Шкала SOFA, баллы (1 день) |
5,8±1,7 |
5,2±1,4 |
|
Пол |
м – 60% |
м – 56% |
|
ж – 40% |
ж – 44% |
|
|
Возраст, лет |
59,7±9,6 |
57,3±9,2 |
|
СПОН |
58% |
52% |
|
ИВЛ (paO2/FiO2 в 1 сутки) |
54% (229,7) |
49% (244,3) |
|
ИМТ, кг/м2 |
21,8 |
22,3 |
|
Нозологический профиль пациентов: |
||
|
Операции на органах брюшной полости |
42,2% |
40% |
|
Сепсис |
48,9% |
53,3% |
|
Политравма |
8,9% |
6,7% |
|
Доступы |
||
|
Энтеральный |
35% |
66% |
|
Парентеральный |
37% |
9% |
|
Смешанный |
28% |
25% |
|
Начало энтерального питания, часы |
37,4 (32,5–41,3) |
20,1 (18,9–24,3) |
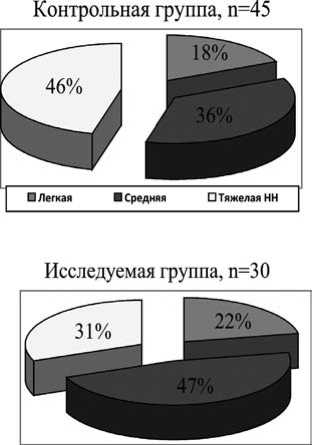
Рис. 1. Нутритивный статус пациентов
«Традиционная» нутритивная поддержка включала назначение сред нутритивной поддержки врачом отделения, основываясь на личном практическом опыте и теоретических знаниях.
В исследуемой группе пациенты хирургического отделения реанимации и интенсивной терапии получали нутритивную поддержку согласно разработанному оригинальному протоколу. Внедряя в клиническую практику наш протокол нутритивной поддержки, мы основывались на следующих показаниях:
-
1. Гастроэнтерологические – морфофункциональные дефекты различных структур желудочно-кишечного тракта, не позволяющие пациенту питаться адекватно: операции на органах желудочно-кишечного тракта, стриктура пищевода, желудочно-кишечные стенозы, панкреатит, разлитой перитонит, синдром Крона, язвенный колит и другие.
-
2. Метаболические – выраженный гиперметаболизм и катаболизм: политравма, ожоги, перитонит, сепсис, полиорганная недостаточность.
-
3. Смешанные – сочетание метаболических и гастроэнтерологических проблем (некротизирующий панкреатит, разлитой перитонит, острая кишечная непроходимость).
Противопоказания к проведению нутритивной поддержки определялись как: отрицательные результаты скрининга, рефрактерный к терапии шоковый синдром, непереносимость нутритивных сред, метаболический ацидоз – рН артерия < 7,2, тяжелая некупируемая гипоксемия – раО2 < 55 мм рт. ст.
Ключевые положения протокола нутритивной поддержки в ХОРИТ:
-
1. Раннее выявление белково-энергитической недостаточности.
-
2. Начало в первые 12–24 часа после оперативного вмешательства.
-
3. Предпочтение энтеральному способу проведения нутритивной поддержки.
-
4. Начальная скорость введения энтеральной смеси 10–20 мл/час, с последующим ее увеличением на 10–40 мл/час в сутки до достижения целевой энергетической потребности.
-
5. Парентеральное питание показано пациентам с недостаточностью питания, которым невозможно проводить энтеральное питание (непроходимость кишечника любой этиологии, множественные кишечные свищи, несостоятельность анастомоза, мезентериальная ишемия) в течении 3 дней или индивидуальной непереносимостью компонентов энтеральной смеси.
-
6. Парентеральные смеси вводили со скоростью 25–150 мл в час в течение 12–20 часов в сутки.
-
7. Смешанное парентеральное питание проводили пациентам с нутритивной недостаточностью, у которых более 60% потребности в энергии не могло быть удовлетворено энтеральным питанием.
Всем пациентам с нутритивной недостаточностью расчет энергетических потребностей проводили в 2 этапа: в первые сутки начиналась стартовая терапия из расчета 25ккал/кг идеальной массы тела с последующим проведением метаболического мониторинга и расчетом величины истинной энергопотребности при наличии показаний. Показания к проведению метаболического мониторинга определялись следующие:
-
1. Продленная ИВЛ.
-
2. Острое легочное повреждение.

-
3. Осложненное течение послеоперационного периода.
-
4. Острая церебральная недостаточность.
-
5. Тяжелый сепсис.
-
6. Стойкая гипоальбуминемия и отсутствие эффекта от эмпирически проводимой нутритивной поддержки.
Суточная потребность в белке пациента рассчитывалась по экскреции азота с мочой. Количество углеводов составляло 50–70 % от небелковых калорий. Количество жиров – 30–50 %.
В таблице 2 приведен стандарт назначения сред для проведения нутритивной поддержки пациентам хирургического профиля в отделении реанимации и интенсивной терапии.
Таблица 2
Стандарт назначения сред для проведения нутритивной поддержки
|
Метод нутритивной поддержки |
Суточное количество вводимых питательных сред |
|
Энтеральное пероральное питание |
Диета №… + Сбалансированная энтеральная смесь с пищевыми волокнами «энергия» (1,5 ккал/мл) 100–150 мл – 3–4 раза в день между приемами пищи |
|
Энтеральное зондовое питание |
Сбалансированная энтеральная смесь с пищевыми волокнами «энергия» (1,5 ккал/мл). 1 сутки 500 мл, 2 сутки 1000 мл, 3 – 1500 мл, 4 – 2000 мл, 5 и т.д. |
|
Смешанное энтеральнопарентеральное питание |
Сбалансированная энтеральная смесь с пищевыми волокнами «энергия» (1,5 ккал/мл) 1500 мл и менее + Парентерально: контейнер «Три в одном» от 800 до1500 мл. |
|
Полное парентеральное питание |
Контейнер «Три в одном» от 1000 до 2000 мл |
Во время исследования ежедневно оценивали клинические и биохимические показатели, а также отмечали степень усвоения питательных сред.
Результаты исследования обработаны с применением статистического пакета Statistica 8,0. Проверку на нормальность распределения выполняли с помощью критерия Шапиро– Уилка. Дисперсионный анализ проводили с помощью критерия Краскела–Уоллиса и Фридмена. Критический уровень значимости р принимали равным 0,05.
Результаты и их обсуждение
В ходе исследования получены следующие результаты.
Средний объем потребления энергии за 7 суток достоверно был выше у пациентов в исследуемой группе по всем нозологиям. Доставленная энергия на день 3 достоверна была выше у пациентов исследуемой группы. Суммарный энергетический дефицит за 7 суток был достоверно ниже у пациентов исследуемой группы.
Средняя доставка белка за 7 суток достоверна ниже была у пациентов контрольной группы. Доставленный белок от целевого на день 3 был достоверно выше у пациентов исследуемой группы.
Азотистый баланс во 2 группе был положительным на 5 день и статистически достоверно был выше, чем в 1 группе. Энергетический баланс во 2 группе был достоверно выше с первых суток пребывания в отделении интенсивной терапии и более оптимален на 5 и 10 сутки.
Длительность ИВЛ у пациентов исследуемой группы, несмотря на близкие значения, имела тенденцию к уменьшению (рис. 3А). Длительность пребывания в ХОРИТ в исследуемой группе уменьшалась (рис. 3Б).
Как видно из таблицы 5, частота нежелательных явлений в исследуемой группе не отличалась от контрольной группы.
Выводы
Время инициации нутритивной поддержки в исследуемой группе больных было достоверно меньше. Доставка энергии и белковое обеспечение были достоверно меньше в контрольной
Таблица 3
Динамика энергетического статуса пациентов контрольной и исследуемой групп
|
Нозология |
Средний объем потребления энергии в ХОРИТ за 7 суток, ккал/сут |
Доставленная энергия на день 3 ХОРИТ в % от целевых показателей |
Суммарный энергетический дефицит за 7 суток ХОРИТ, ккал |
||||||
|
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
р |
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
р |
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
р |
|
|
Операции на органах брюшной полости |
864,2 (769,6–984,5) |
1127,7 (1014,3–1456,1) |
0,0078 |
27,8 (22,6–34,2) |
80,6 (74,2–93,6) |
0,0073 |
7340 (6704–8320) |
1480 (1170–1650) |
0,0009 |
|
Сепсис |
1103,8 (874,2–1448,3) |
1485,9 (1279,6–1538,2) |
0,01 |
43,7 (39,2–46,8) |
76,5 (68,4–83,1) |
0,0003 |
6240 (4690–7840) |
2980 (2200–3570) |
0,0001 |
|
Политравма |
1141,8 (985,8–1312,6) |
1658,3 (1469,1–1872,4) |
0,004 |
32,2 (29,4–43,7) |
61,4 (51,1–72,4) |
0,006 |
5468 (5179–6840) |
2340 (2160–2790) |
0,006 |
Примечание: р – уровень значимости различий контрольной и исследуемой группы.
Таблица 4
|
Нозология |
Средняя доставка белка в ХОРИТ за 7 суток, г/сут |
Доставленный белок от целевого на день 3 ХОРИТ, % |
||||
|
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
р |
Контрольная группа, n=45 |
Исследуемая группа, n=30 |
р |
|
|
Операции на органах брюшной полости |
34,2 (31,7–39,2) |
48,9 (41,3–56,4) |
0,002 |
28,3 (23,3–34,7) |
92,5 (85,2–100,4) |
0,00005 |
|
Сепсис |
34,2 (31,7–39,2) |
48,9 (41,3–56,4) |
0,002 |
40,8 (32,4–46,9) |
86,7 (84,3–91,2) |
0,006 |
|
Политравма |
31,3 (27,3–39,2) |
51,4 (47,8–54,6) |
0,007 |
35,5 (31,5–40,2) |
76,8 (69,3–81,1) |
0,0003 |

Динамика белкового статуса пациентов контрольной и исследуемой групп
Примечание: р – уровень значимости различий контрольной и исследуемой группы.
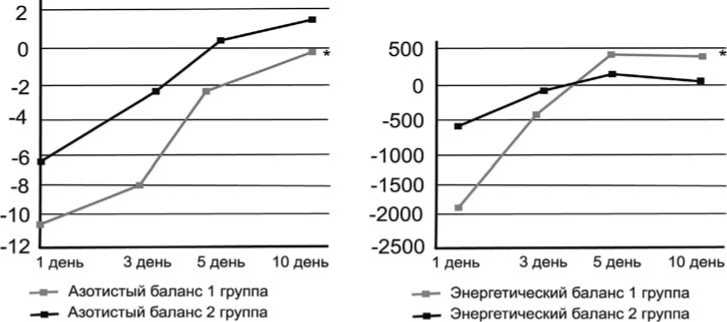
Примечание: * - уровень значимости различий на 10 сутки р<0,05.
Рис. 2. Азотистый и энергетический баланс.
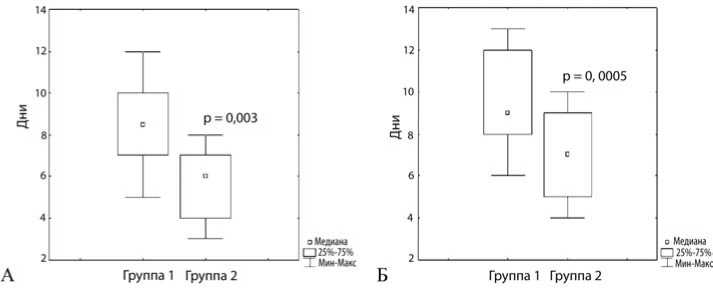
Примечание: р - уровень значимости различий контрольной и исследуемой группы.
Рис. 3. А. Длительность пребывания на ИВЛ. Б. Длительность пребывания в ХОРИТ
Таблица 5
Побочные реакции при проведении нутритивной поддержки, %
Заключение
Таким образом, предварительные результаты применения протокола нутритивной поддержки в ХОРИТ, основанного на современных методических рекомендациях, способствует оптимизации лечебного процесса и улучшению результатов терапии у пациентов хирургического профиля с нутритивной недостаточностью.
Список литературы Стандартный протокол проведения нутритивной поддержки в хирургическом отделении реанимации и интенсивной терапии. Первые результаты внедрения
- Лейдерман И.Н. Современная нутритивная поддержка в коррекции комплекса метаболических расстройств при синдроме системного воспалительного ответа у больных в критических состояниях. Автореф. дис.. докт. мед. наук. Екатеринбург, 2003. 23 c.
- Лейдерман И.Н. Современная концепция нутритивной поддержки при критических состояниях. 5 ключевых проблем//Интенсивная терапия. 1-12. Примечание: р -уровень значимости различий контрольной и исследуемой группы. Рис. 3. А. Длительность пребывания на ИВЛ. Б. Длительность пребывания в ХОРИТ
- Лейдерман И.Н., Левит А.Л., Белкин А.А. Принципы создания стандартных алгоритмов нутритив-ной поддержки в практике отделений реанимации и интенсивной терапии//Российский медицинский журнал. 2006.
- Лейдерман И.Н., Левит А.Л., Левит Д.А., Евреш М.А. Современная нутритивная поддержка в хирургии и интенсивной терапии. Стандартные алгоритмы и протоколы. Руководство для врачей. Екатеринбург, 2010. 37 c.
- Лейдерман И.Н., Николенко А.В., Сивков О.Г. Нутритивная поддержка в отделении реанимации и интенсивной терапии. Стандартные алгоритмы и протоколы. Екатеринбург, 2010.
- «Методические рекомендации. Парентеральное питание в интенсивной терапии и хирургии» (утв. Минздравсоцразвития РФ 29.08.2006 N 4630-РХ). DE ACTl/TT VrSfJ
- «Организация лечебного питания в лечебно-профилактических учреждениях. Методические рекомендации» (утв. Минздравсоцразвития РФ 03.02.2005).
- Приказ Минздрава РФ от 05.08.2003 N 330 (ред. от 26.04.2006) «О мерах по совершенствованию лечебного питания в лечебнопрофилактических учреждениях Российской Федерации» (Зарегистрировано в Минюсте РФ 12.09.2003 N 5073).
- A.S.P.E.N. Board of Directors. Clinical Guidelines for the Use of Parenteral and Enteral Nutrition in Adult and Pediatric Patients//J. Parenter. Enteral. Nutr. 2009. Vol. 33. P. 255-259.
- Gaddis G.M., Greenwald P., Huckson S. Theme 1a. Toward improved implementation of evidence-based clinical algorithms: clinical practice guidelines, clinical decision rules, and clinical pathways//Acad. Emerg. Med. 2007. Vol. 14. P. 1015-1022.
- Lochs H., Valentini L., Schutz T. et al. ESPEN Guidelines on adult enteral nutrition//J. Clinical Nutrition. 2005. Vol. 24. P. 848-861.
- Cano N.J.M., Aparicio M., Brunori G. et al. ESPEN Guidelines for adult parenteral nutrition//J. Clinical Nutrition. 2009. Vol. 28. P. 359-479.
- Bankhead R., Boullata J., Brantley S. et al. A.S.P.E.N. Enteral Nutrition Practice Recommendations//Parenter. Enteral Nutr. 2009. Vol. 3, № 2.
- Lochs L., Valentini T., Schutz S.P. et al. ESPEN Guidelines on adult enteral nutrition//J. Clinical Nutrition. 2005. Vol. 24. P. 848-861.
- Malnutrition Advisory Group (2003) The ‘MUST’ Report. Nutritional Screening for Adults: A Multidisciplinary Responsibility. www.bapen.org. uk.


