Стандарты анализа метастатического поражения костных структур по данным современных методов лучевой диагностики
Автор: Сергеев Николай Иванович, Котляров Петр Михайлович, Солодкий Владимир Алексеевич
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Клинические исследования
Статья в выпуске: 1 т.17, 2018 года.
Бесплатный доступ
Целью исследования явилась попытка создания универсальных критериев диагностики метастатического поражения костей по данным современных методов медицинской визуализации, позволяющих избежать биопсии. Проанализированы данные 90 больных с верифицированными первичными злокачественными опухолями с очаговыми изменениями в костях (n=278), минимальный размер очага составлял 1 см. Методами обследования являлись мультипараметрическая магнитно-резонансная томография с применением модифицированного протокола сканирования, однофотонно-эмиссионная компьютерная томография, совмещённая с компьютерной томографией. Исследования проводились перед началом лечения, через 1 мес после начала терапии, далее через каждые 3 мес сроком до 1 года. Результаты. Сформулирован оригинальный «принцип 8 диагностических элементов», позволяющий оценивать основные патологические состояния и процессы, происходящие в костных структурах. На основании анализа и статистической обработки 236 очагов метастатического поражения рассчитана диагностическая информативность каждого из методов и алгоритма в целом, определены референсные значения. Данный подход позволяет повысить точность ранней диагностики за счет более достоверной оценки костных метастазов на ранней стадии, что позволяет снизить или полностью избежать дополнительных биопсий.
Онкология, метастазы в кости, лучевая диагностика, мрт
Короткий адрес: https://sciup.org/140254161
IDR: 140254161 | УДК: 616-006.6-033.2:611.71]-073 | DOI: 10.21294/1814-4861-2018-17-1-5-10
Текст научной статьи Стандарты анализа метастатического поражения костных структур по данным современных методов лучевой диагностики
Актуальность проблемы обусловлена высокой частотой метастазирования в кости всех наиболее часто встречаемых злокачественных опухолей. По данным ряда авторов, у 40 % больных со злокачественными новообразованиями определяются костные метастазы [1, 2]. Ранняя и точная диагностика костных поражений позволяет проводить адекватное лечение, результатом которого является удовлетворительное качество жизни онкологического больного, а при отсутствии метастазов в паренхиматозные органы значительное продление жизни [3, 4]. Стремительное развитие медицинской инженерии обусловливает совершенствование и модернизацию всех методов диагностической визуализации, позволяет комбинировать новые и существующие методы между собой, проводя так называемое гибридные исследования [5, 6]. Это обусловливает большое количество новой диагности- ческой информации, что затрудняет интерпретацию данных и применение их на практике врачами клинических специальностей [7]. Это, в свою очередь, формирует необходимость создания универсальных подходов к прочтению и подаче диагностической информации, что является одним из приоритетных направлений в современной рентгенологии [8, 9]. При этом общепринятых систем, разработанных для прицельной диагностики и оценки костных метастазов, нет, а существующие стандарты затрагивают только воспалительные и дегенеративнодистрофические заболевания суставов, такие как ревматоидный артрит и остеоартрит [10].
Цель исследования – разработать универсальный алгоритм диагностики костных метастазов по данным современных лучевых методов исследования у пациентов с верифицированными злокачественными новообразованиями.
Материал и методы
В работу включены результаты обследования 90 больных с очаговым поражением скелета, с морфологически верифицированным первичным злокачественным новообразованием различной степени дифференцировки, из которых рак молочной железы определялся у 49 больных, рак предстательной железы – у 19, рак легкого – у 14, рак почки – у 8. С учетом множественного поражения общее количество очагов составило 278.
Период наблюдения не менее 12 мес с оценкой эффекта от проводимой терапии по данным сочетанного анализа всех методов исследования позволил достоверно подтвердить характер выявленных костных изменений. Календарь наблюдения содержал не менее 4 исследований – перед началом лечения, первый месяц после начала лечения, далее каждые три месяца. Морфологическая верификация была проведена у четверых умерших больных по данным аутопсии и прижизненно у 8 больных.
Магнитно-резонансная томография выполнялась на 1,5Т аппарате «Атлас Х» с использованием диффузионно-взвешенных изображений и динамическим контрастным усилением с введением 15–20 мл парамагнетика с помощью двух-колбового автоматического шприца. Проведение однофотонно-эмиссионной компьютерной томографии подразумевает обязательное выполнение на первом этапе стандартной остеосцинтиграфии с использованием дифосфатов 99мТс активностью 400–500 МБк. После этого всем пациентам проводилась однофотонно-эмиссионная компьютерная томография с выполнением компьютерной томографии на зону интереса.
Результаты
На основании сочетанного анализа всех методов исследования установлен тип метастатического поражения у 81 больного, 236 очагов наблюдения. У 9 пациентов изменения в костях носили неметастатический характер, у 14 пациентов наблюдалось сочетание патологий – всего 42 очага. Из них дегенеративно-дистрофические изменения, в том числе с наличием отека, определялись в 23 случа- ях, посттравматические изменения, в том числе с наличием переломов и репаративных костных проявлений, визуализировались в 12 наблюдениях, а общее количество гемангиом у 4 больных равнялось 7. По данным стандартных методик магнитнорезонансной томографии (Т1ВИ, Т2ВИ, STIR) все виды метастазов имеют гипоинтенсивный сигнал в Т1ВИ и наличие гиперинтенсивных включений в STIR – 236 (100 %). При этом остеолитические метастазы имеют незначительно повышенный сигнал на Т2ВИ – 81 (34,3 %), остеобластические – пониженный сигнал – 39 (16,5 %), смешанный тип поражения характеризовался гетерогенным МР-сигналом 116 (49,1 %). Анализ данных диффузионно-взвешенных последовательностей оценивался качественно и количественно. Во всех 236 наблюдениях на изображениях с высоким значением b-фактора определялась высокая интенсивность МР-сигнала, с незначительным повышением полутонов яркости в остеолитических поражениях и снижением в остеобластических. На ADC-построениях были определены значения измеряемого коэффициента диффузии в остеолитических, остеобластических очагах, в экстраос-сальных мягкотканных компонентах с наличием полостей распада (табл. 1).
Полученные результаты позволяют говорить о высоких значениях ИКД в костных метастазах, равных 0,7–2,1×10-3 (доверительный интервал = 95 %, P ген.=91,5 ± 3,22 %). Достаточно большой диапазон значений обусловлен типом метастаза: остеобластические очаги имели сниженный ИКД (0,7–1,1×10-3), 39 наблюдений (16,5 %), а для остеолитических и смешанных поражений были характерны более высокие значения (1,2–2,1×10-3) – 197 (83,5 %) наблюдений. Для дифференциальной диагностики отдельно были проанализированы значения ИКД в желтом костном мозге (0,1– 0,2×10-3), в красном костном мозге (0,3–0,4×10-3), в зонах инволютивного остеосклероза (0), а также не в специфических изменениях (0,37–1,26×10-3), результаты которого варьировались в зависимости от патологии.
Для динамического контрастного усиления применялся оригинальный 5-фазный протокол ФГБУ «РНЦРР» (с) с использованием нативной
Таблица 1
Значения измеряемого коэффициента диффузии в очагах костного метастатического поражения и мягкотканных компонентов
ИКД>1,2×10-3
<1,2×10-3
с высоким B-фактором (900+) Низкие значения ИКД (<1,1×10-3) (по аналогии с солидными опухолями)
(0 сек), артериальной (25 сек), венозной (25 сек), ранней отсроченной (50 сек) и поздней отсроченной фаз (150 сек). На основании анализа 236 очагов поражения удалось установить 3 основных типа кровоснабжения, характерных для метастатического поражения, получивших свои названия в зависимости от распределения парамагнетика в сосудистом русле. Первый тип – «быстрое накопление – быстрое вымывание», отличительным признаком которого является отсутствие визуализации дополнительных фазовых компартменов, 74 (31,3 %) наблюдения. Второй тип – «быстрое накопление – медленное вымывание», характерным признаком которого может являться так называемый эффект повторения – общий тип кривой аналогичен неизмененной костной ткани, однако максимальный уровень фиксации парамагнетика в артериальную фазу повышен в 2 и более раза – 121 (51,3 %) очаг. Третий тип «быстрое накопление – медленное накопление», характеризуется отсутствием выведения контрастного агента на 5+ минуте, 41 (17,4 %) очаг.
По данным гибридного исследования, ОФЭКТ/ КТ на КТ-фрагменте остеолитические очаги визуализировались в виде зоны снижения костной плотности в диапазоне +15–+75 единиц Хаунсфилда с неровными, нечеткими контурами, что наблюдалось в 81 (34,3 %) случае. Остеобластический тип по данным компьютерной томографии определялся в 39 (16,5 %) наблюдениях в виде участков неоднородного повышения плотности в диапазоне
+200–+650 единиц Хаунсфилда очагового или диффузного характера. Зоны смешанного поражения в 116 (49,1 %) наблюдениях определялись участками неравномерно сниженной и повышенной плотности в пределах +90–+230 ЕХ, имели нечеткие, неровные контуры.
По данным радионуклидных исследований очаги метастатического поражения с наличием элементов активного остеобластического процесса имеют повышенный процент гиперфиксации радиофармпрепарата – от +100 % до +730 %, что определялось суммарно в 155 (63,7 %) наблюдениях. При этом представляется достаточно затруднительным провести четкую грань между метастазами остеобластического и смешанного характера, однако это можно косвенно предположить по сниженному уровню накопления индикаторов в смешанных метастазах, не превышающих половины максимальных значений. При анализе очагов с преобладанием литического компонента 81 (34,3 %) коэффициент дифференцированного накопления РФП зависел от характера и выраженности процесса и имел отрицательные значения относительно 100 % нормы контралатеральной неизмененной стороны (эффект гипонакопления) или имел значения, не превышающие +65 %, т.е. суммарно 165 % (рис. 1).
Общая диагностическая информативность комплексного подхода составила 97,8 % (231/236) при первичном нативном исследовании и 99,5 % (235/236) при повторном исследовании.
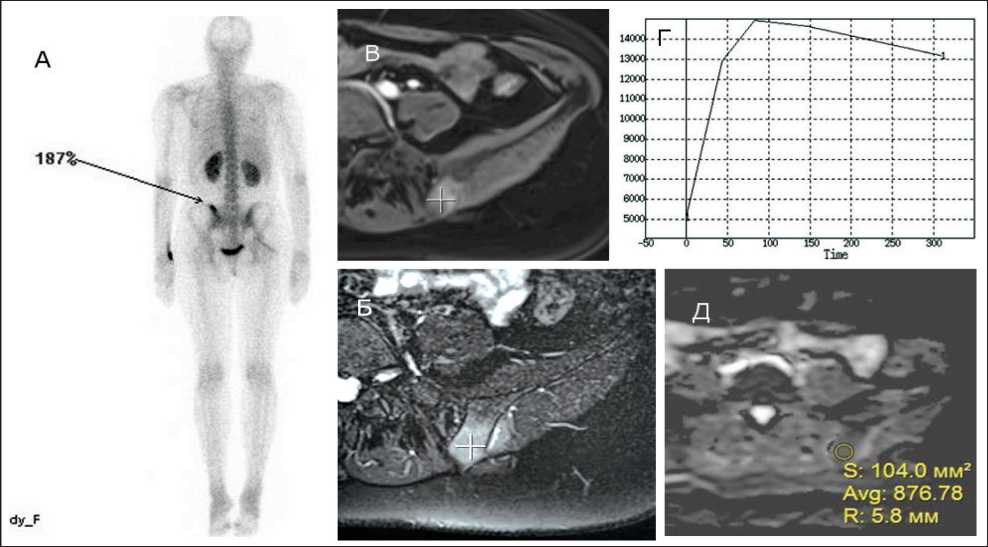
Рис. 1. Пациентка Н., 1971 г.р., с диагнозом аденокарцинома молочной железы, метастатическое поражение левой подвздошной кости. По данным ОСГ (А) отмечается умеренно повышенный процент фиксации РФП в левой подвздошной кости. По данным МРТ в режиме STIR (Б) отмечается равномерно повышенный сигнал в этой зоне, с повышенным накоплением парамагнетика при ДКУ (В) со вторым патологическим вариантом микроциркуляции (Г), ИКД в очаге поражения равен 0,87×10-3 (Д)
Таблица 2
«Принцип восьми диагностических элементов»
|
Название группы |
Количество элементов |
Название элементов |
Модальность / Характеристика |
|
Первая группа « Визуализация» |
3 |
Т1ВИ, Т2ВИ, STIR |
МРТ. Дает общее представление о характере изменений и позволяет предположить начальный диагноз |
|
Вторая группа «Клеточная организация» |
2 |
ДВИ, ИКД |
МРТ. Позволяет выявить дополнительные очаги, оценить их клеточную плотность |
|
Третья группа «Васкуляризация» |
1 |
ДКУ |
МРТ. Характер кровоснабжения изучаемого объекта |
|
Четвертая группа «Пролиферация» |
2 |
HU, КДН |
ОСГ. Количество активных остеобластов нормального или атипического строения. КТ. Оценка структуры очага |
Предлагаемые стандарты анализа метастатического поражения костных структур
Анализ результатов обследования метастатического поражения костных структур позволил сформулировать так называемый « принцип 8 диагностических элементов » для решения вопросов дифференциальной диагностики. Он заключается в выделении наиболее значимых измеряемых элементов изучаемых методов, влияющих на формирование диагноза. К ним относятся уровень интенсивности МР-сигнала на Т1, Т2, STIR взвешенных изображениях, тип патологического накопления при ДКУ, интенсивность сигнала и значения измеряемого коэффициента диффузии на диффузионно-взвешенных изображениях. По данным КТ наиболее целесообразно использовать количественный элемент плотности, измеряемый в единицах Хаунсфилда, а по данным радионуклидных методов – коэффициент или процент дифференцированного накопления. Каждый из изучаемых элементов характеризует определённый функционально-анатомический параметр происходящих процессов в изучаемой костной ткани и не дублирует остальные. Это позволило определить последовательность применения элементов и логично разделить их на 4 группы в зависимости от их диагностического значения (табл. 2).
В разделе «Результаты» на основании анализа 236 измерений в метастатических костных очагов приведены диапазоны референсных значений диагностических элементов, выраженные в качественных и количественных критериях. Каждому диагностическому элементу соответствует среднее процентное значение 12,5 %, при совпадении всех значений обусловливающее 99,9 % (условные 100 %) метастатическое поражение костной ткани у больных с верифицированным диагнозом первичной злокачественной опухоли. При этом ценность каждого элемента может варьироваться в зависимости от степени выраженности в диапазоне 10–15 %.
Обсуждение
Заключение
Предложенный алгоритм обследования и новый диагностический принцип могут иметь решающее значение в определении метастатического поражения костных структур любой локализации, в ситуациях, когда биопсия кости затруднена или невозможна.
Список литературы Стандарты анализа метастатического поражения костных структур по данным современных методов лучевой диагностики
- Padalkar P., Tow B. Predictors of survival in surgically treated patients of spinal metastasis. Indian J Orthop. 2011 Jul; 45 (4): 307-13. DOI: 10.4103/0019-5413.82333
- Pearce T., Philip S., Brown J., Koh D.M., Burn P.R. Bone metastases from prostate, breast and multiple myeloma: differences in lesion conspicuity at short-tau inversion recovery and diffusion-weighted MRI. Br J Radiol. 2012 Aug; 85 (1016): 1102-6. DOI: 10.1259/bjr/30649204
- Klaff R., Berglund A., Varenhorst E., Hedlund P.O., Jǿnler M., Sandblom G.; Scandinavian Prostate Cancer Group (SPCG) Study No. 5. Clinical characteristics and quality-of-life in patients surviving a decade of prostate cancer with bone metastases. BJU Int. 2016 Jun; 117 (6): 904-13. DOI: 10.1111/bju.13190
- Wu J.S., Monk G., Clark T., Robinson J., Eigl B.J., Hagen N. Palliative radiotherapy improves pain and reduces functional interference in patients with painful bone metastases: a quality assurance study. Clin Oncol (R Coll Radiol). 2006 Sep; 18 (7): 539-44.
- Сергеев Н.И., Фомин Д.К., Котляров П.М., Солодкий В.А. Сравнительное исследование возможностей ОФЭКТ/КТ и магнитнорезонансной томографии всего тела в диагностике костных метастазов. Вестник РНЦРР. 2015; 3: 8.


