Статистический анализ иммунного статуса у здоровых лиц и больных опухолью головного мозга
Автор: Бейн Б.Н., Мухачева М.В., Кочмашев В.Ф.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: История медицины, юбилейные даты
Статья в выпуске: 2 т.8, 2012 года.
Бесплатный доступ
Цель: исследовать различия иммунного гомеостаза в норме и патологии в фазе клинической манифестации опухоли головного мозга. Материал и методы. Изучены иммунограммы 50 здоровых лиц в сравнении с группой из 117 нейроонкологических больных для отражения состояния здоровья и патологии в системе иммунитета. Результаты. Посредством математического анализа вычислены различия параметров иммунитета в группах испытуемых, которые интерпретированы у больных как перестройка иммунного гомеостаза с функциональной иммунной недостаточностью. Заключение. Установленные иммунологические нарушения у нейроонкологиче-ских пациентов свидетельствуют о преморбидном снижении некоторых показателей иммунитета.
Иммуннограмма у здоровых и больных, опухоль головного мозга
Короткий адрес: https://sciup.org/14917542
IDR: 14917542
Текст научной статьи Статистический анализ иммунного статуса у здоровых лиц и больных опухолью головного мозга
1 Введение. Иммунная система, так же как эндокринная и вегетативная системы, регулируется головным мозгом, модифицируя по обратной связи его деятельность. Опухоли головного мозга являются сборной группой заболеваний (внемозговые и внутримозговые). Вместе с тем они оказывают во многом сходные патогенетические влияния на вещество мозга и его функцию посредством механической компрессии, токсического воздействия, дисгемических нарушений, повреждения гематоэнцефалического барьера. При этом возникают как локальные, так и дисрегуляторные расстройства, вызывающие общеорганизменные симптомы «опухолевой болезни» [1-2], в частности, в системе иммунного надзора.
Цель: Исследовать различия иммунного гомеостаза двух состояний организма — нормы (физиологический уровень) и патологии — в фазе клинической манифестации новообразования головного мозга.
Методы. Диагностика мозговой опухоли осуществлялась на основании возникновения у пациентов клинических локальных и общемозговых нарушений, нарастающего течения заболевания и чётких признаков объёмного процесса при нейровизуализации (КТ или МРТ головного мозга с накоплением контраста в очаге поражения). Все больные были оперированы, с гистологическим уточнением новообразования.
Для уточнения уровня иммунной защиты сравнивались иммунограммы у 117 больных внутричерепными опухолями в периоде клинической манифестации внутричерепной опухоли (т.е. на высоте заболевания) и 50 здоровых доноров сходного воз раста. Анализ включал исследование показателей
Адрес: 610027, г. Киров, ул. Воровского, 42.
Тел.: (8+8332) 67-92-37.
клеточного и гуморального иммунитета, неспецифического звена, цитокинового статуса, всего 26 маркёров. Методика исследования иммунных составляющих описана ранее [3].
Применены математические методы: сравнение параметров иммунограммы (M±σ) в группах по Шеф-фе, с вычислением достоверности различий параметрическим методом (по t-критерию Стьюдента) и непараметрическим по Манну — Уитни (U-тест). Изучены корреляционные связи между показателями иммунитета в каждой группе испытуемых [4]. Это позволило охарактеризовать состояние группы здоровья и опухолевой болезни по показателю иммунной защиты и тем самым дополнить клиническую характеристику опухолевых больных.
Результаты и обсуждение. Изменения средних величин иммунитета представлены в табл. 1, в которой сравнены параметры иммунитета у здоровых испытуемых и больных внутричерепными опухолями — глиомами и менингиомами, рассматриваемыми как типовое патологическое явление [2]. При рассмотрении уровней каждого из 26 индексов иммунной защиты найдены достоверные различия, относящиеся ко всем звеньям иммунитета — клеточному, гуморальному, неспецифической резистентности и регуляторному звену.
Так, среди показателей клеточного иммунитета отмечено повышение, в сравнении с нормой, уровня абсолютного числа лимфоцитов, образующих массив иммунокомпетентных клеток. Вместе с тем достоверно снижено содержание клонов СД4+ и СД8+, что может свидетельствовать о понижении у больных клеточного иммунного ответа на растущее новообразование.
Отмечена тенденция у нейроонкологических пациентов к понижению уровня В-лимфоцитов и осо-
Таблица 1
Сравнение средних показателей иммунитета у 50 здоровых лиц (контроль) и в сборной группе 117 больных опухолью головного мозга
Регулятор роста и дифференциации В-лимфоцитов — СД25+ — оказался у пациентов значительно снижен, что может ослаблять функциональное состояние В-клеток и их гуморальные реакции на туморозные клетки. Одновременно достоверно возрастал уровень индикатора апоптоза — СД95+, свидетельствуя о реактивном усилении «увядания» лимфоидных клеток в ответ на прогредиентное повреждение мозга опухолью у больных.
Состояние неспецифической защиты обнаруживает снижение ряда показателей, таких, как фагоцитарная активность нейтрофилов и в меньшей степени кислородзависимая микробицидность фагоцитов в тесте с нитратетразолевым синим. Более чем в 3 раза падало содержание натуральных киллеров, как наиболее типичное следствие опухолевой инвазии организма больных. Снижение уровня СД16+ наиболее значимо среди критериев неспецифической резистентности, как по степени угнетения, функциональной специфичности, так и высокой встречаемости среди туморозных больных. Системное супрессивное влияние опухоли на иммунитет, по-видимому, обусловлено нарушением нейроиммунных взаимоотношений, а также, возможно, и общетоксическим влиянием новообразования (деструктивное влияние на перифокальную мозговую зону, развитие отёка мозга, нарушения церебральной гемодинамики, вызывание вторичного аутоиммунного ответа). Об этом косвенно свидетельствует увеличение почти в 2 раза числа циркулирующих иммунных комплексов в крови нейроонкологических больных.
Облигатно происходили изменения в регуляторном звене иммуногенеза, которые характеризовались понижением уровня противовоспалительного фактора — ИФН-α и, напротив, возрастанием содержания провоспалителдьных показателей (ИФН-γ, ИЛ-4, ИЛ-6). Подобный сдвиг цитокинов свидетельствовал о том, что клиническая манифестация мозговой опухоли сопровождалась скрытым воспалительным процессом, усиливающим повреждение чужеродных клеток. Значительное повышение ФНО-α, оказывающего противоопухолевое воздействие, очевидно, вызвано развитием патологического процесса и закономерной реакцией на новообразование. Однако адекватного усиления иммунных механизмов в сыворотке крови при этом не происходило, как это следует из содержания у больных клеточных, гуморальных и неспецифических факторов. Кроме того, отмеченное возрастание концентрации ИЛ-4 может подавлять синтез ИЛ-2 и ИЛ-12 как необходимых факторов клеточной защиты, активирующих киллер-ные механизмы разрушения опухоли.
Для наглядности различий профиля иммунного статуса в искомых группах испытуемых построена лепестковая диаграмма (рис. 1), в которой в виде «розетки» по радиусам отложены значения сходных показателей иммунограммы больных и здоровых лиц. Значения параметров иммунограммы у здоровых лиц приняты за 100%. Отклонения у больных образовали иную форму «профиля иммунитета», рельефно отличающуюся от соответствующей фигуры в контрольной группе.
Перестройка иммунной системы у больных церебральной опухолью, по данным математического анализа, проявлялась изменениями не только средних значений показателей иммунитета, но и их корреляционных взаимоотношений в матрице иммунограмм в каждой из групп. Это следует из табл. 2. Установлены линейные взаимосвязи между некоторыми признаками, свидетельствующие о том, что изменение одного элемента в паре приводит к соответствующей перестройке значения другого показателя иммунитета. При этом у пациентов мозговой опухолью и здоровыми лицами выявляются различия связей в матрицах иммунограмм, как по знаку, так и по
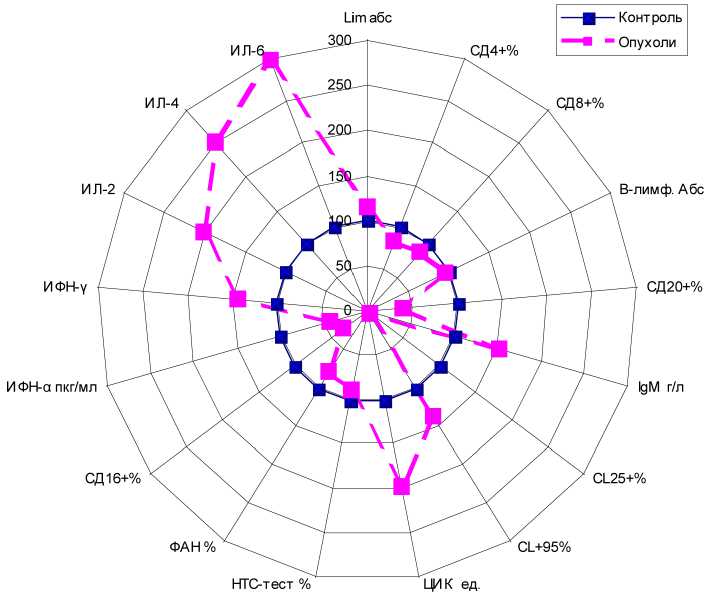
Рис. 1. Лепестковая диаграмма профиля иммунитета у больных мозговой опухолью (относительно здоровых лиц, принятых за 100%)
количественной величине коэффициентов кросскорреляции (табл. 2).
Как видно, в норме преобладали отрицательные взаимосвязи между показателями иммунитета, тогда как в условиях патологии эти связи перерастают в положительные. Данная закономерность отчётливо просматривается на рис. 2: по оси абсцисс отложены значения коэффициентов корреляции между парами признаков, а по оси ординат — количество таких коэффициентов для разных групп. Видно, что у нейро-онкологических больных коэффициенты распределены больше в положительном диапазоне, тогда как у здоровых лиц они смещены в отрицательную сторону.
У больных увеличена и степень сцепления показателей иммунитета, на что указывает большее значение и большее число коэффициентов кросскорреляции. Это видно из табл. 2, в которой сравниваются достоверные взаимосвязи в группах здоровых лиц и опухолевых пациентов.
Заключение. Установленные иммунологические нарушения у нейроонкологических пациентов позволяют говорить о возможном преморбидном снижении некоторых показателей иммунитета, в частности неспецифической резистентности. Кроме того, отмечено формирование к моменту клинической манифестации
Таблица 2
Значимые корреляционные связи между парами показателей иммунитета в группе здоровых лиц и больных мозговой опухолью.
|
Показатели иммунитета |
Коэффициенты корреляции |
Значимость - Р |
|
|
Норма |
Опухоль |
||
|
Lim-Вл. Абс. |
-0,29742 |
0,42718157 |
4,52526E-05 |
|
Lim-Тс. Абс. |
-0,24772 |
0,53079986 |
6,74527E-06 |
|
Lim-CD8 |
-0,58379 |
0,1106908 |
3,13011E-05 |
|
Lim-ЦИК |
0,621871 |
-0,103536 |
9,08373E-06 |
|
Lim абс-Вл. Абс. |
-0,0877 |
0,53852891 |
0,000220633 |
|
Lim абс-Тс. Абс. |
0,301501 |
0,78467889 |
6,596E-05 |
|
Вл. Абс-Тх/Тс |
-0,74975 |
-0,1917836 |
3,21357E-05 |
|
CD16-Ig G |
0,699404 |
0,12049869 |
6,77579E-05 |
|
Крит. зн.=0 .000385 |
|||
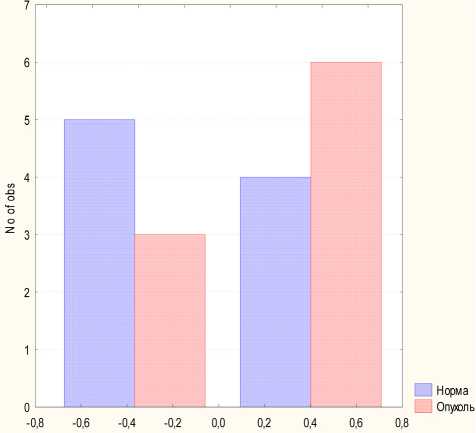
Рис. 2. Гистограмма распределения частоты и мощности коэффициентов парной корреляции: от –0,8 до +0,8. В группе здоровых испытуемых столбцы синего, а в группе больных — красного цвета.
мозговой опухоли симптомов вторичной иммунологической недостаточности противоопухолевой защиты. Это косвенно провоцирует ускоренное нарастание объёма новообразования, с соответствующим повышением внутричерепного давления, повреждением гематоэнцефалического барьера, активизацией аутоиммунного процесса в отношении собственного мозга и иммунокомпетентных клеток крови, что ещё более нарушает иммунный гомеостаз и приводит к стадии декомпенсации организма больных.
Найденное увеличение тесноты связей свидетельствует о формировании в условиях патологического гомеостаза более жёсткой схемы взаимоотно- шений между отдельными переменными матрицы, о сужении степени свободы функционирования системы. «Ограничительное поведение» системы иммунной защиты означает сокращение адаптивных возможностей больного организма и приводит к большей его дезадаптации.
Список литературы Статистический анализ иммунного статуса у здоровых лиц и больных опухолью головного мозга
- Бейн Б. Н., Мухачева М. В., Ежова А. А., Татарен-ко С. А. Нарушение адаптации больных церебральной опухолью//Вестник неврологии, психиатрии и нейрохирургии. 2011. № 11. С. 54 -64
- Бейн Б. Н., Шардаков В. И., Селюкова М. В. Характеристика иммунного статуса при глиомах и менингиомах полушарий головного мозга//Пермский медицинский журнал. 2006. Т. 23. № 3. С. 76 -79
- Противоопухолевый иммунитет и его нарушения при церебральных опухолях: учебное пособие для клинических ординаторов/сост.: Б. Н. Бейн, В. И. Шардаков, М. В. Селюко-ва. Киров: КГМА, 2005. 50 с.
- Реброва О. Ю. Статистический анализ медицинских данных. М.: МедиоСфера, 2002. 305 с.


