Стентирование главного панкреатического протока в лечении пациентов с острым деструктивным панкреатитом в раннюю фазу заболевания
Автор: Бедин В.В., Коржева И.Ю., Шиков Д.В., Колотильщиков А.А., Калашникова Е.А.
Журнал: Московский хирургический журнал @mossj
Рубрика: Клинические случаи
Статья в выпуске: 4 (82), 2022 года.
Бесплатный доступ
Введение. В статье описывается уникальный клинический случай применения эндоскопического стентирования главного панкреатического протока в лечении пациента с острым деструктивным панкреатитом (в раннюю фазу заболевания). Учитывая наличие признаков разобщения панкреатической протоковой системы (диагностированной по данным инструментальных методов исследования), было принято решение о применении эндоскопического стентирования главного панкреатического протока пластиковым стентом.Обсуждение. Острый деструктивный панкреатит остается актуальной хирургической проблемой в связи с сохраняющимся значительным количеством разнообразных осложнений и высокими показателями летальности, несмотря на достигнутые успехи в лечении данной группы пациентов. В настоящее время отмечена тенденция к появлению в публикации статей, посвященных использованию эндоскопического стентирования главного панкреатического протока в раннюю фазу заболевания у пациентов с признаками разобщения протоковой системы. Кроме того, описаны случаи применение комбинированных методик с целью наиболее эффективного лечения данной группы пациентов.Вывод. Применение по строгим показаниям эндоскопического стентирования главного панкреатического протока является оптимальным малотравматичным способом лечения пациентов с острым деструктивным панкреатитом (в раннюю фазу заболевания) и признаками разобщения проксимальных и дистальных отделов панкреатической протоковой системы.
Острый деструктивный панкреатит, синдром разобщения панкреатической протоковой системы, эндоскопическое стентирование панкреатического протока
Короткий адрес: https://sciup.org/142236457
IDR: 142236457 | УДК: 616.37-002 | DOI: 10.17238/2072-3180-2022-4-90-96
Текст научной статьи Стентирование главного панкреатического протока в лечении пациентов с острым деструктивным панкреатитом в раннюю фазу заболевания
В последние годы отмечается неуклонный рост заболеваемости острым панкреатитом, который является одной из наиболее часто встречающихся ургентных хирургических патологий (22,8 %), уступая лишь острому аппендициту (23,9 %) (Неотложная абдоминальная хирургия, данные ОМО по хирургии ДЗМ, 2021 год). Наиболее частой этиологией является алиментарная (алкоголь), а также билиарная (желчекаменная болезнь). Указанная проблема является чрезвычайно актуальной, поскольку значительная часть пациентов – лица трудоспособного возраста [1, 2].
В настоящее время приоритетным направлением развития современной панкреатологии является улучшение результатов лечения больных с острым деструктивным панкреатитом и уменьшение количества инфицированных форм панкреоне-кроза. За последние годы достигнуты значительные успехи в диагностике и лечении данной категории больных, связанные с применением высокоинформативных инструментальных методов исследования, мультидисциплинарным подходом, совершенствованием комплексной интенсивной терапии, а также внедрением в практику малотравматичных способов хирургического лечения [3].
В хирургической клинике Боткинской больницы разработан и внедрен в практику принцип диагностического моделирования панкреонекроза, основанный на результатах точной клинико-инструментальной и морфологической диагностики.
Все это позволяет разделить пациентов с диагностированным панкреонекрозом (в раннюю фазу развития заболевания) на 4 «Модели» в зависимости от локализации некротических изменений паренхимы поджелудочной железы и забрюшинной клетчатки [4].
«Модель» 1, характеризующаяся наличием мелкоочагового некроза ткани поджелудочной железы с формированием па-рапанкреатического инфильтрата по «центральному типу», «Модель» 2 – некроз дистальных отделов поджелудочной железы с формированием парапанкреатического инфильтрата по «левому типу», «Модель» 3 – некроз проксимальных отделов поджелудочной железы, парапанкреатический инфильтрат по «правому типу», а также «Модель» 4, при которой наблюдается некроз поджелудочной железы с разобщением главного панкреатического протока и развитием парапанкреатического инфильтрата по «смешанному типу» (рис. 1).
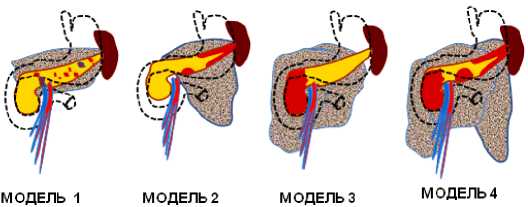
Рис. 1. Схематичное изображение моделей панкреонекроза
Fig. 1. Schematic representation of models of pancreatic necrosis
Особого внимания требуют пациенты, относящиеся к «Модели 3» панкреонекроза, при которой наибольшие патологические изменения паренхимы поджелудочной железы и парапанкреатической клетчатки локализованы в проксимальных отделах. К данной группе, в первую очередь, относятся больные с разобщением протоковой системы поджелудочной железы, обусловленном резким увеличением давления в главном панкреатическом протоке [5, 6].
Несмотря на отработанность общепринятых алгоритмов для лечения больных панкреонекрозом в ранней фазе, остаются вопросы оптимальной хирургической тактики при диагностировании признаков разобщения главного панкреатического протока.
Материалы и методы
Пациент К., 54 лет, 06.06.2021 г. В 23:15 доставлен бригадой СМП в приемное отделение ГКБ им. С.П. Боткина с жалобами на боли в эпигастральной области, тошноту, однократную рвоту, гипертермию до 37,8 С. Из анамнеза известно, что вышеуказанные жалобы появились за 10 часов от момента обращения в стационар после погрешности в диете. Комплексно обследован.
По данным лабораторного обследования выявлены следующие показатели – общий анализ крови: эритроциты 5,7х1012/л, гемоглобин 159 г/л, лейкоциты 18,9х109/л, тромбоциты 297х109/л. Биохимический анализ крови: -амилаза 899 ед/л, креатинин 87 мкмоль/л, мочевина 4,6 ммоль/л, СРБ 187 мг/л, общий билирубин 34 мкмоль/л, щелочная фосфатаза 103 ед/л, АЛТ 43 ед/л, АСТ 58 ед/л, ГГТ 30 ед/л.
По результатам инструментального обследования выявлены следующие изменения – ультразвуковое исследование органов брюшной полости: поджелудочная железа с неровными, относительно четкими контурами, сниженной эхогенности, неоднородной структуры, рыхлая. Размеры: головка – 40 мм (норма 11–32), тело – 24 мм (норма 4–21), хвост – не лоцируется (норма 7–28). Жидкости в сальниковой сумке нет. В брюшной полости свободная жидкость определяется в виде тонкой каемки в правой подвздошной области.
Наличие сопутствующей патологии у пациента не отмечено.
Для дальнейшего лечения пациент, по тяжести состояния, был госпитализирован в отделение реанимации (SOFA 6 баллов), где начата комплексная инфузионно-корригирующая, антибактериальная, антисекреторная, противовоспалительная терапия по протоколу лечения острого панкреатита тяжелой степени, установлен эпидуральный блок.
07.06.2021 в 03:35 выполнена спиральная компьютерная томография (СКТ) органов брюшной полости с внутривенным контрастированием (Компьютерный томограф Toshiba Aquilion 64, толщина среза 0,5 мм). Получены следующие данные: поджелудочная железа увеличена, ее паренхима диффузно пониженной плотности, преимущественно в проекции головки и перешейка структура диффузно-неоднородная – зоны некроза.
Главный панкреатический проток визуализируется фрагментарно, несколько расширен в области головки. Парапанкре-атическая клетчатка отечна, инфильтрирована, отмечается распространение вдоль фасции Герота справа до малого таза, слева – менее выражено. В брюшной полости определяется небольшое количество жидкости под печенью, около селезёнки, межпетельно и в малом тазу (Balthazar C) (рис. 2).
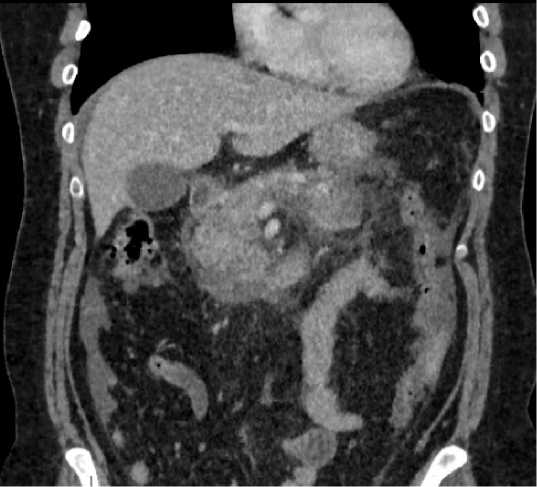
Рис. 2. КТ-картина деструктивного панкреатита, с формированием парапанкреатического инфильтрата в области головки поджелудочной железы
Fig. 2. CT-images of necrotizing pancreatitis, with the formation of parapancreatic infiltrate in the head of the pancreas
В определении оперативной тактики важная роль принадлежит принципу моделирования панкреонекроза, основанному на данных инструментальных исследований (СКТ, УЗИ), заключающемуся в определении распространенности и локализации некротического процесса в забрюшинном пространстве и, в зависимости от этого, позволяющему выбрать оптимальный способ лечения.
Нами определены следующие показания к возможности стентирования главного панкреатического протока (ГПП): ранняя фаза течения панкреонекроза (в срок до 72 часов от начала заболевания). Диагностированные патологические изменения, локализованные в проксимальных отделах поджелудочной железы, с признаками разобщения панкреатической протоковой системы («Модель» 3).
Пациент был обсужден на хирургическом консилиуме, по результатам которого принято решение о проведении эндоскопического стентирования главного панкреатического протока, показанием для которого послужила диагностированная «Модель» 3.
07.06.2021 в 05:44, через 6 часов от момента поступления в стационар и через 30 часов от начала заболевания, по срочным показаниям, выполнена эндоскопическая ретроградная холангиография (ЭРХГ), эндоскопическая ретроградная панкреатография (ЭРПГ), стентирование главного панкреатического протока.
Протокол вмешательства : под комбинированным эндо-трахеальным наркозом видеодуоденоскоп свободно проведен в двенадцатиперстную кишку (ДПК). Детальный осмотр желудка и ДПК аппаратом с боковой оптикой не проводился. В просвете ДПК светлая желчь. Большой дуоденальный сосочек (БДС) несколько уплощен, размерами до 1,5*1,0см. Слизистая БДС не изменена. Устье округлой формы, диаметром до 0,2 см. Желчь поступает. Транспапиллярная канюляция холедоха. Под рентгенологическим контролем введен контраст.
ЭРХГ: при контрастировании желчных протоков холедох с ровными четкими контурами, диаметром до 0,4 см при наполнении. В проекции холедоха дефектов наполнения не выявлено. Параллельно струнному проводнику под рентгенологическим контролем выполнена канюляция ГПП. Дозированно введен контраст.
ЭРПГ: ГПП контрастируется на всем протяжении, с неровными контурами 2–3мм в диаметре, нарушения проходимости ГПП, определяется затек в панкреатическую клетчатку (рис. 3). По струнному проводнику выполнено стентирование ГПП панкреатическим мультиперфорированным пластиковым стентом 7Fr – 12см. При контрольной рентгеноскопии, сброс контраста ускорен, полный. Стент фиксирован удовлетворительно (рис. 4).
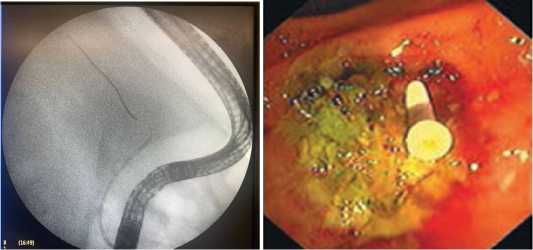
Рис. 3, 4. Изображения установки эндоскопического стента в главный панкреатический проток и эндоскопической картины после установки стента
Fig. 3, 4. Images of endoscopic stent placement in the main pancreatic duct and endoscopic picture after stent placement
Процедура завершена установкой назоинтестинального зонда для питания. Эффективная дозовая радиологическая нагрузки составила 45.8мЗв.
Течение послеоперационного периода стабильное. Через 2 дня отмечена полная нормализация лабораторных показателей (табл. 1).
Таблица 1
Динамика лабораторных показателей
Table 1
Dynamics of laboratory parameters
|
Признак; Sign |
При поступлении; Upon admission |
Через 2 дня; After 2 days |
|
Лейкоциты; Leukocytes |
18,9х109/л |
7,3х109/л |
|
α-амилаза; α-amylase |
899 ед/л |
65 ед/л |
|
СРБ; CRP |
187 мг/л |
15 мг/л |
В последующем УЗИ выполнялось 1 раз в 3 дня. Описание: поджелудочная железа с ровными, четкими контурами, нормальной эхогенности, однородной структуры. Размеры: головка – 32 мм (норма 11–32), тело – 20 мм (норма 4–21), хвост – 22 мм (норма 7–28). Жидкости в сальниковой сумке нет. В брюшной полости свободная жидкость определяется в виде тонкой каемки в правой подвздошной области. Контрольная СКТ органов брюшной полости с внутривенным контрастированием выполнена на 10 сутки от операции: картина панкреонекроза с формированием острых некротических скоплений в области головки и тела поджелудочной железы (размером до 1 см), субтотальный регресс инфильтрации парапанкреатической клетчатки (Balthazar B) (рис. 5, 6).
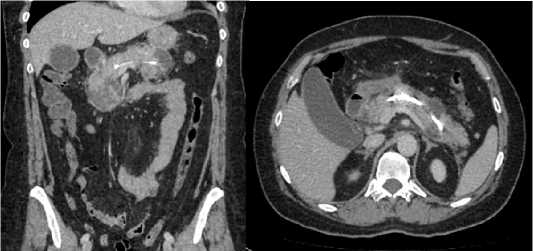
Рис. 5, 6. КТ-картина после применения эндоскопического стентирования главного панкреатического протока
Fig. 5, 6. CT-image after endoscopic stenting of the main pancreatic duct
Болевой, интоксикационный синдромы полностью купированы к 5 суткам. Время нахождения в реанимационном отделении составило 6 дней. Пациент был выписан под дальнейшее динамическое амбулаторное наблюдение. Через 2 недели амбулаторно выполнена контрольная компьютерная томография органов брюшной полости с внутривенным контрастирование на которой отмечен полный регресс воспалительных изменений поджелудочной железы. Последующее удаление панкреатического стента выполнено в амбулаторных условиях на 6 недели от момента установки. В контрольных анализах – без особенностей. Через 3 месяца амбулаторно выполнена контрольная компьютерная томография органов брюшной полости с внутривенным контрастированием, на которой воспалительных изменений поджелудочной железы и парапанкреатической клетчатки не отмечено (рис. 7).
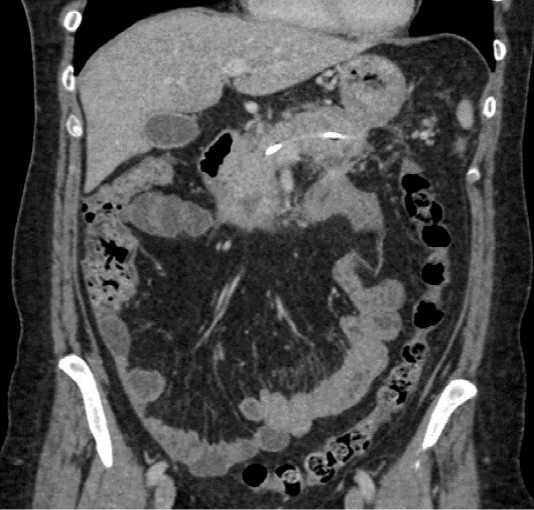
Рис. 7 . КТ-картина через 3 месяца после применения эндоскопического стентирования главного панкреатического протока
Fig. 7. CT scan 3 months after endoscopic stenting of the main pancreatic duct
Обсуждение
Показатели общей летальности и послеоперационных осложнений острого деструктивного панкреатита остаются достаточно высокими (до 39 % и 95 % соответственно) [7, 8], что обусловлено тяжестью течения заболевания и высокой травматичностью хирургического лечения. В настоящее время на фоне активного развития медицинских технологий и совершенствования инструментальной диагностики все более широкое применение находят малотравматичные способы лечения. У пациентов с панкреонекрозом наряду с миниинва-зивными способами секвестрэктомии, которые применяют в фазе гнойно-септических осложнений, на ранних этапах развития заболевания начали использовать малотравматичный способ – эндоскопическое стентирование главного панкреатического протока [9].
Клинически подтверждено, что данная методика позволяет добиться уменьшения давления в панкреатической протоковой системе, поступления панкреатического сока в парапанкреа-тическую клетчатку и прервать прогрессирование и нарастание инфильтративно-воспалительных изменений паренхимы поджелудочной железы и забрюшинной клетчатке [10], которые определяют тяжесть и дальнейший прогноз течения заболевания. Исходя из накопленного опыта можно сделать вывод, что ранняя диагностика патологического процесса и своевременное применение эндоскопического стентирования главного панкреатического протока, по строго обоснованным показаниям, способствуют достижению положительных результатов в лечении острого деструктивного панкреатита.
Следует отметить, что успех выполнения данного вмешательства во многом зависит от степени подготовленности профильных специалистов (а именно врача-эндоскописта), что обусловлено технической сложностью проводимого эндоскопического вмешательства. Кроме того, необходимо высокотехнологическое современное оснащение клиники для достижения поставленных задач. Все это осуществимо в многоцентровых учреждениях, где мультидисциплинарная команда специалистов участвует в комплексном лечении данной тяжелой группы больных.
Выводы
Таким образом, применение эндоскопического стентирования ГПП возможно у пациентов: в раннюю фазу течения панкреонекроза (в срок до 72 часов от начала заболевания). При диагностированных патологических изменениях, локализованных в проксимальных отделах поджелудочной железы, с признаками разобщения панкреатической протоковой системы («Модель 3»).
Методика эндоскопического стентирования ГПП в последующем позволяет снизить риск развития инфицированной формы панкреонекроза, добиться уменьшения числа проводимых хирургических вмешательств (в том числе открытых секвестрэктомий), а также позволяет улучшить результаты лечения больных панкреонекрозом.
Список литературы Стентирование главного панкреатического протока в лечении пациентов с острым деструктивным панкреатитом в раннюю фазу заболевания
- Isaji S., Takada T., Mayumi T., Yoshida M., Wada K., Yokoe M., Gabata T. Revised Japanese guidelines for the management of acute pancreatitis 2015: Revised concepts and updated points. J. Hepatobiliary Pancreat. Sci., 2015, № 22 (6), рр. 433-445.
- Baron T.H., DiMaio C.J., Wang A.Y., Morgan K.A. American Gastroenterological Association clinical practice update: management of pancreatic necrosis. Gastroenterology, 2020, № 158 (1), pp. 67-75.
- Дюжева Т.Г., Шефер А.В., Джус Е.В., Новоселова Е.В., Котовский А.Е., Гальперин Э.И. Роль конфигурации некроза поджелудочной железы в дифференцированном подходе к лечению больных острым панкреатитом. Материалы пленума правления Ассоциации гепатопанкреатобилиарных хирургов стран СНГ. М., 2015. С. 49-51.
- Шабунин А.В., Араблинский А.В., Лукин А.Ю. Панкреонекроз. Диагностика и лечение. М.: ГЭОТАР-Медиа, 2014. 89 с.
- Maatman T.K., Roch A.M., Lewellen K.A., Heimberger M.A., Ceppa E.P., House M.G., Nakeeb A., Schmidt C.M., Zyromski N.J. Disconnectedpancreatic duct syndrome: spectrum of operative management. J. Surg. Res., 2020, № 247, pp. 297-303.
- Machado N.O. Disconnected duct syndrome: a bridge to nowhere. Pancreat. Disord. Ther., 2015, № 5 (2), pp. 15-19.
- Shyu J., Sainani N., Sahni V. et al. Necrotizing Pancreatitis: Diagnosis, Imaging, and Intervention. RadioGraphics., 2014, № 34 (5), pp. 1218-1239.
- Werge M., Novovic S., Schmidt P., Gluud L. Infection increases mortality in necrotizing pancreatitis: A systematic review and meta-analysis. Pancreatology, 2016, № 16 (5), pp. 698-707.
- Шабунин А.В., Бедин В.В., Тавобилов М.М., Шиков Д.В., Колотильщиков А.А., Маер Р.Ю. Эндоскопическое стентирование протока поджелудочной железы в лечении больных панкреонекрозом. Анналы хирургической гепатологии, 2021. № 26 (2). С. 32-38.
- Yang Y., Yao W., Lan Zh., Zhao Ch., Peng B., Dong T., Shi J., Wang Z. Early endoscopic transpapillary drainage through the minor papilla in the treatment of acute pancreatitis. Gland Surg., 2022, № 11 (2), pp. 442-450.


