Стентирование пациента с протяженным стенозом коронарной артерии под контролем оптической когерентной томографии (клинический случай)
Автор: Суслов И. В., Пекарский С. Е., Тарасова М. Г., Баев А. Е., Винтизенко С. И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические случаи
Статья в выпуске: 2 т.38, 2023 года.
Бесплатный доступ
Одним из актуальных вопросов при выполнении чрескожных коронарных вмешательств (ЧКВ) остается стентирование протяженных поражений. В настоящий момент существует два основных подхода: стентирование одним длинным стентом (ОДС) и стентирование двумя и более стентами с перекрытием (СП). Однако ввиду конической геометрии сосуда стентирование ОДС при большой разнице между проксимальным и дистальным референсными диаметрами артерии может привести к худшим результатам, чем стентирование СП за счет более низкой комплаентности устройств к сосуду. В статье представлен клинический случай, иллюстрирующий предлагаемый нами алгоритм принятия решения в пользу ОДС или СП на основе данных, полученных при помощи оптической когерентной томографии (ОКТ).
Ишемическая болезнь сердца, чрескожное коронарное вмешательство, протяженный стеноз, оптическая когерентная томография, клинический случай
Короткий адрес: https://sciup.org/149142532
IDR: 149142532 | УДК: 616.132.2-007.271-072.1-089.472.5.032.13-073.756.8 | DOI: 10.29001/2073-8552-2023-38-2-286-292
Текст научной статьи Стентирование пациента с протяженным стенозом коронарной артерии под контролем оптической когерентной томографии (клинический случай)
informed consent was obtained from the patient. The study was approved by the Ethics Committee of Cardiology Research Institute of Tomsk NRMC (protocol No. 232 from 26.10.2022). Suslov I.V., Pekarskiy S.E., Tarasov M.G., Baev A.E., Vintizenko S.I. Stenting of a patient with long coronary artery lesion under the control of optical coherence tomography (clinical case). The Siberian Journal of Clinical and Experimental Medicine. 2023;38(2):286–292. https://doi. org/10.29001/2073-8552-2023-38-2-286-292.
Гемодинамически значимый протяженный стеноз коронарных артерий (КА) остается актуальным вопросом в современной интервенционной кардиологии. При стентировании важно максимально полное покрытие атеросклеротической бляшки, а посадочные зоны стента должны находиться в интактных участках артерии. Однако в ряде исследований продемонстрирован более высокий риск тромбоза длинных стентов [1, 2]. Нерешенной проблемой стентирования длинных поражений является выбор между стентированием одним длинным стентом (ОДС) и стентированием двумя и более стентами с перекрытием (СП).
Недавние исследования с современными стентами с лекарственным покрытием (СЛП) продемонстрировали сопоставимость клинических исходов между группами ОДС и СП [3, 4]. Ключевое значение при стентировании протяженных стенозов имеет значительная разница в диаметре/площади проксимального и дистального референсных сегментов. В случае ОДС диаметр последнего рекомендовано определять по дистальному референсному сегменту артерии. Однако при этом проксимальный диаметр артерии может оказаться значительно больше номинального диаметра стента. В таком случае выполняют проксимальную оптимизацию стента баллоном большего диаметра, что приводит к его перерастяжению выше номинального размера.
При этом возникают следующие проблемы:
-
1. Плоское ангиографическое изображение с низким разрешением и невидимыми стенками артерии не позволяет точно определить диаметр референсных сегментов и, соответственно, их разницу и возможность компенсировать эту разницу с помощью перерастяжения стента, т. е. сделать обоснованный выбор между ОДС и СП.
-
2. Современные стенты имеют более тонкие и редкие балки, в результате чего при перерастяжении может появляться достаточно большой просвет между балками, способствующий протрузии тканей в ячейки стента, уменьшаться радиальная устойчивость стента, вслед за чем может последовать частичное спадение (recoil) с пропорциональной потерей просвета стентированного участка, т. е. реальная эффективная степень перерастяжения может оказаться меньше номинальной технически возможной.
-
3. Восстановление просвета артерии пропорционально увеличивает кровоток и ассоциированное с ним напряжение сдвига (shear stress); последний запускает по-ток-вызванную дилатацию сосуда, которая со временем может привести к отложенной мальаппозиции.
Оптическая когерентная томография (ОКТ) предоставляет возможность визуализировать морфологию целевого поражения сосуда и с высокой точностью определить локализацию референсных сегментов, а также их диаметр, т. е. определить возможность компенсации разницы дистального и проксимального референсных диаметров за счет перерастяжения стента с учетом снижения его радиальной устойчивости и повышения риска протрузии, что, свою очередь, позволяет максимально точно определить тактику стентирования: ОДС или СП, возможно, изменить изначальную тактику, основанную на ангиографическом изображении, с целью повышения качества технического исполнения чрескожных коронарных вмешательств (ЧКВ).
В частности, такая информация помогла нам сформировать алгоритм выбора между стентированием ОДС и СП. При значимой разнице проксимального и дистального референсных диаметров техника ОДС с выбором диаметра стента по дистальному референсному диаметру с последующей проксимальной оптимизацией не позволит обеспечить плотное прилегание балок стента к стенке артерии в проксимальной части, что увеличивает риск тромбоза и/или рестеноза стента и частоту повторных реваскуляризаций [5, 6]. А перерастяжение стента больше указанного значения несет риск его деформации и повреждения. В таком случае предпочтительным может оказаться стентирование СП.
Клинический случай
Информация о пациенте. Пациентка К., 65 лет, поступила планово в НИИ кардиологии Томского НИМЦ 08.12.2022 г. с жалобами на давящие боли за грудиной с иррадиацией в левую руку, умеренной интенсивности при физических нагрузках, повышении артериального давления (АД), купирующиеся самостоятельно (нитроглицерин не принимает), на одышку смешанного характера при умеренных физических нагрузках, постоянные боли в животе, преимущественно в правом подреберье.
Anamnesis morbi. Вышеуказанный болевой синдром беспокоит на протяжении 1 года, к врачу не обращалась, амбулаторно не обследовалась. С середины июля 2022 г. стала отмечать ухудшение состояния в виде неконтролируемого повышения АД, усиления сердечно-болевого синдрома, появления болей в животе (в правом подреберье). Обратилась к кардиологу, обследовалась амбулаторно. Длительное повышение АД, регулярно принимала гипотензивные препараты, на момент поступления АД не контролируется, целевые уровни АД не достигнуты.
В ноябре 2022 г. в кардиологическом отделении г. Анжеро-Судженск – выполнена мультиспиральная компьютерная томография брюшного отдела аорты с контрастированием, диагностирована аневризма инфраренального отдела аорты без признаков диссекции, консультирована эндоваскулярным хирургом: рекомендована имплантация стент-графта. Направлена в НИИ кардиологии (Томск).
Диагноз при поступлении: Атеросклероз аорты: аневризма инфраренального отдела аорты без признаков диссекции. На момент поступления принимала Моксони-дин – 0,8 мг 1 раз в сут, Индапамид – 2,5 мг 1 раз в сут, Аторвастатин – 20 мг 1 раз в сут, Амлодипин – 5 мг 1 раз в сут, Мексидол 125 мг 3 раза в сут.
Anamnesis vitae. Без значимых событий. Из вредных привычек: курение коло 50 лет, 5 сигарет в сутки, индекс курения – 12,5.
Семейный анамнез: мать умерла от острого инфаркта миокарда в возрасте 64 лет.
Хронические заболевания и операции. Сморщенная правая почка. Кисты почек. Хронический гастрит, ремиссия. Хронический геморрой, вне обострения. Гемико-лонэктомия справа. Резекция правого яичника, сальпин-гэктомия по поводу параколонического абсцесса справа от 1983 г. Резекция илеотрансверзоанастомоза по поводу острой кишечной непроходимости, стеноза илеотран-сверзоанастомоза, ректального перитонита от 2008 г. Спаечная болезнь.
Объективное обследование
Общий осмотр. Состояние удовлетворительное, рост – 156 см, масса тела – 69 кг, индекс массы тела – 28,4 (избыточная масса тела); подкожно-жировой слой развит избыточно, преимущественно на животе.
Органы дыхания. Частота дыхательных движений – 17/мин. В остальном без особенностей.
Сердечно-сосудистая система. Частота сердечных сокращений – 80/мин. Акцент II тона над аортой. Усилена пульсация брюшного отдела аорты. Пульс – 80/мин удовлетворительного наполнения и напряжения, одинаков на обеих руках. АД – 150/90 мм рт. ст. справа, 140/80 мм рт. ст. слева.
Органы брюшной полости. Без особенностей.
Данные лабораторных и инструментальных методов на момент поступления
Общий анализ крови, коагулограмма – без патологических изменений.
Общий анализ мочи: эритроциты 7–9 в п/з, эпителий 2–3 в п/з, лейкоциты 2–2 в п/з, слизь 1(+).
Анализ мочи по Нечипоренко: эритроциты 10750 кл/ мл, лейкоциты 500 кл/мл, цилиндры 0 кл/мл.
Биохимический анализ крови: мочевина – 9,4 ммоль/л, креатинин – 124 мкмоль/л (скорость клубочковой фильтрации (СКФ) – 39 мл/мин/1,73 м2 по формуле CKD-EPI).
ЭхоКГ: Диастолическая дисфункция 1 типа. Фракция выброса (В-режим) 73%.
Ультразвуковое исследование (УЗИ) брюшного отдела аорты: аневризма инфраренального отдела брюшной аорты, протяженность – 10 см, максимальный диаметр 5,6 см.
Рентгенография органов грудной клетки, УЗИ сонных и бедренных артерий, эзофагогастродуоденоскопия: без значимых патологических изменений.
В качестве предварительного этапа перед оперативным вмешательством на брюшном отделе аорты назначена коронарная ангиография.
Коронарная ангиография: стенозирующий атеросклероз коронарных артерий: стеноз проксимального сегмента передней нисходящей артерии (ПНА) – 75%, среднего сегмента ПНА – 75%, I диагональной ветви – 50%, I ветви тупого края – 60%, среднего сегмента правой КА – 30%. На рисунке 1 представлено изображение целевого поражения ПНА. По данным количественной ангиографии, стеноз в области максимального сужения составил 40% по диаметру и 69% – по площади. Данный результат представлялся нам сомнительным ввиду протяженности поражения и невозможности выбрать дистальный референсный участок.
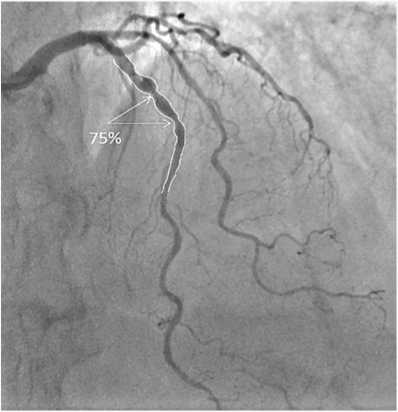
Рис. 1. Снимок целевого поражения передней нисходящей артерии.
На схеме белым контуром выделен патологический участок артерии с обозначением зон максимального стеноза
Fig. 1. Image of the target lesion of anterior descending artery. The diagram presents the pathological section of the artery with the designation of zones of maximum stenosis highlighted with a white outline
Учитывая однососудистый характер поражения и низкий Syntax Score (15 баллов), в соответствии с действующими Рекомендациями МЗ РФ № 155 «Стабильная ишемическая болезнь сердца, 2022» принято решение о реваскуляризации методом ЧКВ. Ввиду протяженного поражения ПНА данное ЧКВ классифицировано как сложное. На этапе перед вмешательством выполнена ОКТ. Морфологически бляшка была представлена фиброа-теромой с включением кальция. На дистальном участке пораженного сегмента сосуда визуализировать наружную эластическую мембрану (НЭМ) по дуге более 180° не удалось, ввиду чего дистальный референсный диаметр измерялся по просвету референсного сегмента. Тем же образом был измерен проксимальный референсный диаметр. Длина участка, выбранная для стентирования, составила 51 мм. Референсные диаметры следующие (рис. 2):
-
– диаметр дистального референсного сегмента – 2,70 мм;
-
– диаметр проксимального референсного сегмента – 3,24 мм;
-
– разница – 0,74.
Морфология атеросклеротической бляшки целевого поражения (по данным ОКТ): фиброатерома с включением кальция; в области максимального сужения сосуда минимальный внутрипросветный диаметр артерии составил 1,1 мм (стеноз – 63%).
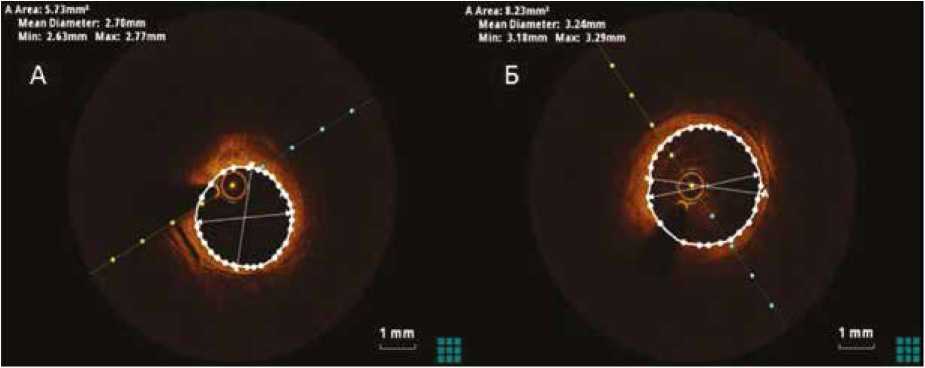
Рис. 2. ОКТ-изображения дистального (А) и проксимального (Б) референсных участков с указанием среднего (mean diametr), минимального (min) и максимального (max) диаметров
Примечание: ОКТ - оптической когерентной томографии.
Fig. 2. OCT images of the distal (A) and proximal (Б) reference areas with indicating of the mean, minimum (min) and maximum (max) diameters
Note: OCT – optical coherence tomography.
С целью подбора диаметра стента на основании внутрипросветного диаметра сосуда к полученным по ОКТ значениям необходимо прибавить 0,25 мм с округлением в большую сторону. Следовательно, диаметр стента должен составлять 3,0 мм. При этом требуемая длина стента как ангиографически, так и по данным ОКТ составила 51 мм.
На основе полученных данных, в особенности в связи с высокой разницей между референсными проксимальным и дистальным диаметрами (0,74 мм), было приня- то решение об имплантации двух стентов с перекрытием: XIENCE Alpine 3,0 × 28 мм в дистальную позицию и XIENCE Alpine 3,5 × 28 мм в проксимальную позицию.
После имплантации дистального стента проведен промежуточный ОКТ-контроль с целью выявления дефектов стентирования. Выявлены недораскрытие стента, протрузия ткани через страты стента, незначимая острая мальаппозиция. Данные дефекты проиллюстрированы на рисунке 3.
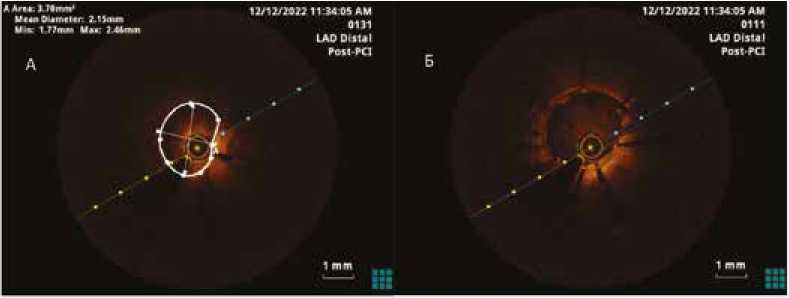
Рис. 3. Промежуточная запись оптической когерентной томографии после установки дистального стента перед его оптимизацией. (А) Поперечный срез в области недораскрытия стента (раскрытие составило 71,7%). (Б) Поперечный срез в области острой мальаппозиции стента (мальаппозиция составила 0,25 мм, что не определяет ее как высокорисковую). (В) Поперечный срез в области протрузии ткани через ячейку стента
Fig. 3. Intermediary OCT recording after distal stenting before its optimization. (A) Cross-section view in the area of stent underexpansion (stent expansion was 71,7%). (Б) Cross-section view in the area of acute malapposition of the stent (malapposition was 0.25 mm, which does not define it as high-risk). (B) Cross-section view in the area of tissue protrusion through the stent cell
Note: OCT – optical coherence tomography.
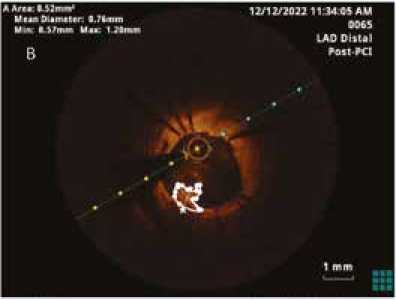
Выполнена баллонная постдилатация, по результатам которой описанные выше явления редуцировали. После имплантации проксимального стента при ОКТ-контроле выявлено недораскрытие стента.
Выполнена баллонная постдилатация проксимального стента. При контрольном выполнении ОКТ минимальное раскрытие стента составило 94,05%: минимальная площадь стентированного участка – 6,64 мм2, при площади стента диаметром 3 мм – 7,06 мм2. Краевые диссекции при контрольной ОКТ не выявлены. Окончательный результат, по данным ОКТ, представлен на рисунке 4.
При наблюдении до момента выписки контраст-ин-дуцированной нефропатии и прочих осложнений ЧКВ не выявлено. Пациентка выписана в удовлетворительном состоянии с рекомендациями.
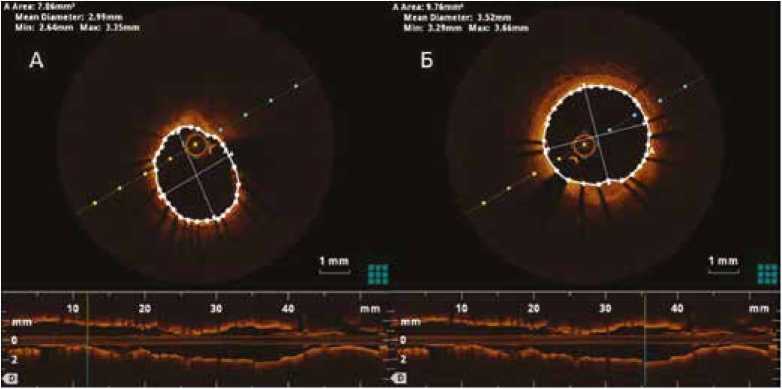
Рис. 4. Контрольная запись оптической когерентной томографии после установки дистального стента и его оптимизации (А) и после установки проксимального стента и его оптимизации (Б). Указаны средний (mean diametr), минимальный (min) и максимальный (max) диаметры раскрытия стентов на выбранных срезах
Fig. 4. Final OCT recording after distal stenting and its optimization (A) and after proximal stenting and its optimization (Б). The mean, minimal (min) and maximal (max) diameter of the stent opening on the selected sections are indicated
Note: OCT – optical coherence tomography.
Обсуждение
ОКТ – метод, введенный в интервенционную кардиологию относительно недавно. На основе получаемых данных можно с высокой точностью подобрать размеры используемого оборудования. В настоящее время ОКТ-ассистированные ЧКВ выполняют лишь при сложных поражениях. В частности таковым является и протяженное поражение КА. У данной пациентки протяженность составила 51 мм.
Для стентирования протяженного поражения на сегодня существует два метода. Первый – стентирование ОДС. Его диаметр подбирают в соответствии с дистальным референсным диаметром артерии. Однако при этом проксимальный диаметр стента может оказаться значительно меньше диаметра артерии в этой зоне. В таком случае рекомендуется выполнить проксимальную оптимизацию стента баллоном большего диаметра. Однако при значительной разнице между номинальным размером стента и проксимальным референсным диаметром сосуда возникает риск перерастяжения стента с последующей его деформацией, что в совокупности с отложенным расширением просвета сосуда в результате восстановления кровотока может стать причиной проксимальной мальап-позиции. Последняя в свою очередь является фактором риска развития острого тромбоза и/или рестеноза [5].
Из этого следует вывод: техника проксимальной оптимизации при разнице проксимального и дистального диаметров не всегда позволяет обеспечить плотное прилегание балок стента к стенке артерии, что увеличивает риск тромбоза/рестеноза стента и частоту повторных реваскуляризаций.
Современные технологии, по которым изготавливаются стенты, в ряде случаев позволяют перерастягивать стенты до двух раз без потери структурной прочности и целостности антипролиферативного покрытия. Однако сегодня отсутствуют убедительные данные о том, что исходы стентирования с перерастяжением стентов не отличаются от исходов стентирования в пределах номинальных размеров. В отсутствие результатов прямого head-to-head сравнения по твердым конечным точкам в рандомизированных параллельных группах безопасность перерастяжения стентов выше номинального значения остается не доказанной.
Второй вариант – стентирование протяженного стеноза несколькими СП. При таком подходе удается решить вопрос разницы проксимального и дистального референсных диаметров, поскольку стент, установленный в проксимальную позицию, имеет больший диметр, чем стент, установленный в дистальную позицию. Несмотря на наличие перекрытия, мы предполагаем, что у описанной пациентки такой подход имеет намного меньший риск развития осложнений, связанных с ЧКВ, чем стентирование супердлинным стентом > 5 см с перерастяжением.
В проанализированной нами литературе при сравнении стентирования ОДС и СП с использованием совре- менных стентов значимой разницы в наступлении MACE (major adverse cardiac events) не было выявлено. При этом нам не удалось найти какие-либо алгоритмы выбора между упомянутыми методиками.
Главным ограничением является тот факт, что предлагаемый нами алгоритм не был изучен в каких-либо клинических исследованиях, а пороговое значение раскрытия стента, вероятнее всего, является уникальным для каждой системы. Данный параметр необходимо верифицировать в дальнейших исследованиях с достаточной мощностью. По своей сути, описанный случай является первым клиническим применением предлагаемого алгоритма.
Заключение
Описанный клинический случай демонстрирует эффективное решение актуальной проблемы имплантации стентов при протяженных стенозах КА. Во-первых, ангиографическое определение диаметров референсных сегментов, их разницы и выбор между стентированием ОДС и СП осуществляются с большой случайной ошибкой вследствие ограничений ангиографической визуализации. Предлагаемый нами простой алгоритм измерений ОКТ позволяет с высокой точностью определять референсные размеры сосудов и эффективно выбирать между ОДС и СП. Предполагаемую эффективность данного алгоритма целесообразно верифицировать в проспективном клиническом исследовании с твердыми конечными точками, а также определить оптимальные пороговые значения относительной/абсолютной разницы между проксимальным и дистальным референсными диаметрами для принятия решения в пользу того или иного метода.
Список литературы Стентирование пациента с протяженным стенозом коронарной артерии под контролем оптической когерентной томографии (клинический случай)
- Tommaso C.L. Long stents as a risk factor for late stent thrombosis size does matter. JACC Cardiovasc. Interv. 2010;3(4):390-391.
- Suh J., Park D.W., Lee J.Y., Jung I.H., Lee S.W., Kim Y.H. et al. The relationship and threshold of stent length with regard to risk of stent thrombosis after drug-eluting stent implantation. JACC Cardiovasc. Interv. 2010;3(4):383-389.
- Sim H.W., Thong E.H., Loh P.H., Lee C.H., Chan M.Y., Low A.F. et al. Treating very long coronary artery lesions in the contemporary drugeluting-stent era: Single long 48 mm stent versus two overlapping stents showed comparable clinical outcomes. Cardiovasc. Revasc Med. 2020;21(9):1115-1118.
- Balachandran A., Gopinath K.S., Gupta N.P., Koshy A.G., Viswanathan S. Clinical Profile and outcomes of overlapping v/s single long stent in long coronary lesions - The Trivandrum Long Stent (TRILO) Study. Indian Heart Journal. 2014;66(S2):S102-S103.
- Souteyrand G., Amabile N., Mangin L., Chabin X., Meneveau N., PESTO Investigators et al. Mechanisms of stent thrombosis analysed by optical coherence tomography: insights from the national PESTO French registry. Eur. Heart J. 2016;37(15):1208-1216.
- Adriaenssens T., Joner M., Godschalk T., Malik N., Alfonso F., Xhepa E. et al. Prevention of late stent thrombosis by an interdisciplinary Global European Effort (PRESTIGE) Investigators. Optical coherence tomography findings in patients with coronary stent thrombosis: a report of the PREvention of Late Stent Thrombosis by an Interdisciplinary Global European Effort (PRESTIGE) Consortium. Circulation. 2017;136(11):1007-1021.


