Стевиозид как антистрессовый регулятор роста и развития растений
Автор: Михайлов Александр Леонидович, Невмержицкая Юлия Юрьевна, Тимофеева Ольга Арнольдовна
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биотехнология
Статья в выпуске: 3-5 т.15, 2013 года.
Бесплатный доступ
Изучена способность дитерпенового гликозида стевиозида повышать устойчивость к низким температурам и тяжелым металлам проростков озимой пшеницы сорта Мироновская 808. Проведены полевые испытания стевиозида в качестве регулятора роста и развития яровой пшеницы Омская 33
Стевиозид, регулятор роста и развития растений, пшеница, морозоустойчивость, тяжелые металлы
Короткий адрес: https://sciup.org/148202066
IDR: 148202066 | УДК: 581.1
Текст научной статьи Стевиозид как антистрессовый регулятор роста и развития растений
Исследование биологической активности вторичных метаболитов растений имеет важное научное и прикладное значение для поиска и создания на их основе новых полифункциональных регуляторов роста, обладающих как рострегулирующей, так и антистрессовой активностью. К таким биологическим соединениям относятся сладкие дитерпе-ноидные гликозиды растения Stevia rebaudiana Bertoni, агликоном которых является стевиол (13-гидрокси-энт-каур-16-ен-19-овая кислота) [1]. Сте-виол относили к предшественникам гибберелловой кислоты благодаря характерному для гиббереллинов цис-сочленению В и С колец тетрациклической углеводородной системы. Однако было установлено, что грибок Gibberelle Fujikuroi не превращает стевиол в гибберелловую кислоту, а метаболизирует его в гиббереллино-подобное соединение [2]. В литературе есть сведения о том, что производные стевиол-гликозидов проявляют гиббереллиноподобную активность [3]. В связи с возрастающим техногенным загрязнением сельскохозяйственных экосистем тяжелыми металлами актуальным становится использование экологически безопасных регуляторов роста и физиологически активных веществ, способных не только уменьшать токсические эффекты тяжелых металлов, но и снижать их поступление в растения. В связи с этим целью данной работы было выявление протекторных свойств гиббереллиноподобного дитерпеноидного гликозида стевиозида на растения озимой пшеницы при действии низких температур и тяжелых металлов.
Объектом исследования служили растения озимой пшеницы сорта Мироновская 808 и яровой пшеницы сорта Омская 33. Исследуемые дитерпеновые гликозиды были синтезированы в ИОФХ им. А.Е. Арбузова (КНЦ РАН, г. Казань). Растения выращивали в лабораторных условиях в кюветах на водопроводной воде при освещении 100 Вт/м 2 и 12-
часовом фотопериоде при температуре 23 0 С в течение 9 сут. В опытных вариантах растения росли на растворе стевиозида (10 –8 М). Затем 5-суточные растения переносили на растворы тяжелых металлов CdSO 4 и ZnSO 4 в концентрации 10мкМ и 1мМ. Концентрации стевиозида и тяжелых металлов были подобраны в предварительных экспериментах.
Растворимые лектины экстрагировали 0.05н HCl, лектины клеточной стенки – 0.05% раствором тритона-Х-100. Лектиновую активность определяли с помощью реакции гемагглютинации с эритроцитами 1 группы крови [4]. Белок определяли по методу Bradford [5]. Морозоустойчивость тестировали по выходу электролитов [6].
Содержание тяжелых металллов анализировали в корнях и листьях проростков масс-спектрометре с индуктивно-связанной плазмой Elan DRC II (PerkinElmer, США). Опыты проводили в 3-х биологических повторностях. Результаты опытов представлены на рисунках и в таблицах как средние арифметические и их стандартные ошибки.
Мелкоделяночные опыты были проведены в СПХК «Агрофирма «Рассвет» Кукморского района Республики Татарстан. Опрыскивание растений стевиозидом (10 -8 М) проводили с помощью ранцевых опрыскивателей. Сроки опрыскивания яровой пшеницы – в начале фазы выхода в трубку и в фазе кущения. При постановке мелкоделяночных опытов каждый вариант закладывали в четырехкратной повторности. Для учета структуры урожая на каждой делянке закладывали по две метровые площадки, с которых собирали снопы и проводили анализ. Биометрические показатели и площадь листьев определяли по [7].
На первом этапе исследований нами было выявлено соединение, обладающее наибольшей антистрессовой активностью у растений озимой пшеницы Мироновская 808. Для этого определяли LT 50 у проростков, выращенных на растворах стевиози-да (10 –8 М) и его производных: стевиола (10 –8 М), дигидростевиола (10 –8 М), стевиолбиозида (10 –8 М) и бис(дигидростевиоил)малоната (10 –8 M).
Как видно из таблицы 1, все изучаемые соеди- нения повышали морозоустойчивость растений по сравнению с контролем. Эффект производных сте-виозида на морозоустойчивость проростков сравним с АБК (LT50 проростков пшеницы до –7.6 0С) [8], а действие самого стевиозида даже несколько превышало влияние АБК (LT50 до –8 0С).
Выращивание растений озимой пшеницы на растворе стевиозида (10 –8 М) вызывало увеличение длины листьев проростков на 14%, а корней – на 18% по сравнению с контролем (табл. 2). Как высокая (1мМ), так и низкая (10мкМ) концентрации CdSO 4 и ZnSO 4 уменьшали длину корней и листьев проростков озимой пшеницы (табл. 2).
Известно, что торможение роста является общим проявлением токсичности тяжелых металлов для растений, что связано в первую очередь с их прямым действием на деление и растяжение клеток [9]. Согласно нашим данным, наибольшее токсическое действие на рост растений пшеницы оказывает кадмий.
Модификация действия тяжелых металлов на культурные растения при применении различных регуляторов роста показана в ряде работ [10]. Пре- добработка стевиозидом растений Мироновской 808 в течение 5 сут снизила ингибирующий эффект обеих концентраций сульфата кадмия и сульфата цинка на рост проростков (табл. 2).
Анализ накопления металлов в проростках через 4 сут выращивания на средах с тяжелыми металлами показал (табл. 3), что и в корни, и в листья тяжелые металлы поступали в заметных количествах уже при концентрации солей 10 мкМ. В корнях содержание тяжелых металлов было значительно выше по сравнению с листьями. Известно, что корни являются первым барьером на пути транспорта металлов из почвы в растение, и именно корень берет на себя основную функцию по их аккумуляции и детоксикации. Способность корней задерживать тяжелые металлы снижает их транспорт в надземные органы растений [9]. Предварительная обработка растений стевиозидом (10 -8 М) вызвала увеличение содержания Cd в корнях проростков озимой пшеницы при концентрации этого металла в среде выращивания 1мМ, во всех остальных вариантах стевиозид снизил аккумуляцию тяжелых металлов в корнях и листьях (табл. 3).
Таблица 1. Влияние стевиозида и его производных на показатель LT 50
|
Вариант |
LT 50 , 0С |
|
Н 2 О |
–6.2 ± 0.2 |
|
Стевиозид (10–8 М) |
–8.0 ± 0.2 |
|
Стевиол (10–8 М) |
–7.4 ± 0.1 |
|
Дигидростевиол (10–8 М) |
–6.9 ± 0.3 |
|
Стевиолбиозид (10–8 М) |
–7.3 ± 0.1 |
|
Бис(дигидростевиоил)малонат (10–8 М) |
–7.5 ± 0.1 |
Таблица 2. Влияние стевиозида на длину корней и первых настоящих листьев 9-суточных проростков озимой пшеницы Мироновская 808
|
Вариант |
Н 2 О |
Стевиозид |
||
|
Длина листьев, мм |
Длина корней, мм |
Длина листьев, мм |
Длина корней, мм |
|
|
Контроль |
159 ± 2.0 |
90 ± 2.3 |
180 ± 2.1 |
107 ± 3.3 |
|
CdSO 4 (1 мМ) |
69 ± 2.5 |
45 ± 3.8 |
100 ± 3.5 |
67 ± 2.7 |
|
CdSO 4 (10 мкМ) |
129 ± 1.5 |
64 ± 2.5 |
134 ± 3.0 |
71 ± 1.7 |
|
ZnSO 4 (1 мМ) |
133 ± 2.7 |
73 ± 1.5 |
141 ± 2.3 |
87 ± 2.5 |
|
ZnSO 4 (10 мкМ) |
157 ± 3.5 |
76 ± 1.5 |
172 ± 1.8 |
98 ± 3.1 |
Таблица 3 . Содержание тяжелых металлов в корнях и листьях проростков озимой пшеницы Мироновская 808 (% от сухого веса)
|
вариант |
-стевиозид |
+стевиозид |
||||
|
Н О |
Ме (1Мм) |
Ме (10мкМ) |
Н О |
Ме (1мМ) |
Ме (10мкМ) |
|
|
Корни |
||||||
|
Cd |
0,0002 + + 0,00001 |
0,7050 + + 0,01000 |
0,1750 + + 0,00400 |
0,0003 + + 0,00001 |
0,7450 + + 0,04000 |
0,1520 + + 0,00500 |
|
Zn |
0,0025 + + 0,00080 |
0,8828 + + 0,06000 |
0,4404 + + 0,00400 |
0,0150 + + 0,00007 |
0,3080 + + 0,01000 |
0,0541 + + 0,07000 |
|
Листья |
||||||
|
Cd |
0,0001 + + 0,00001 |
0,0090 + + 0,00030 |
0,0045 + + 0,00004 |
0,0002 + + 0,00001 |
0,0010 + + 0,00050 |
0,0026 + + 0,00040 |
|
Zn |
0,0050 + + 0,00050 |
0,0183 + + 0,00400 |
0,0069 + + 0,00001 |
0,0045 + + 0,00080 |
0,0133 + + 0,00030 |
0,0066 + + 0,00001 |
Действие регуляторов роста, прежде всего, осуществляется через изменения в синтезе и активности различных белков. В литературе имеются сведения о наличии у молекул растительных лектинов сайтов связывания фитогормонов, отличных от центров связывания углеводов. Так, агглютинин зародыша пшеницы (АЗП) обладает высоким сродством к ауксинам, цитокининам и гибберелловой кислоте [11]. Исследователи полагают, что комплекс «лектин-фитогормон» является не только транспортной формой гормонов, но и может быть вовлечен в регуляцию процессов роста и развития растений [11]. В связи с этим мы определяли активность лектинов у растений, выращенных на среде с добавлением тяжелых металлов и стевиозида (10 –8 М) (рис. 1, 2).
Тяжелые металлы снижали активность лектинов клеточной стенки (рис. 1). Эти изменения могут быть следствием как адсорбции тяжелых металлов в клеточных стенках корней [9], так и взаимодействием ионов металлов с сульфгидрильными группами белков, приводящим к ингибированию их активности и/или разрушению структуры [12].
В то же время CdSO 4 и ZnSO 4 вызывали значительное возрастание активности растворимых лектинов (рис. 2), под которыми мы понимаем, прежде всего, агглютинин зародыша пшеницы. В работе [13] было показано увеличение содержания АЗП в корнях проростков пшеницы при воздействии ацетата кадмия, сопровождающееся усилением выхода этого лектина в окружающую среду.
После предварительной обработки растений в течение 5 сут стевиозидом (10 –8 М) эффект тяжелых металлов на активность лектинов клеточной стенки был сходен с изменениями ростовых параметров – на фоне стевиозида восприимчивость связанных с клеточной стенкой лектинов к CdSO 4 и ZnSO 4 уменьшалась (рис. 1). Активность растворимых лектинов при совместном действии стевиозида и тяжелых металлов значительно подавлялась (рис. 2). В настоящее время практически отсутствуют сведения о механизмах действия стевиозида, однако в экспериментах с животными показано, что этот гликозид является антагонистом кальция и уменьшает проницаемость кальциевых каналов [14]. Можно предположить, что именно таким образом стевиозид изменяет поглощение и транспорт Cd и Zn в клетках корня.
Таким образом, согласно проведенному нами исследованию стевиозид (10-8М) снижал аккумуляцию кадмия и цинка в проростках, уменьшал эффект тяжелых металлов на рост растений и изменения активности лектинов, что свидетельствует о его протекторном действии на растения озимой пшеницы в условиях стресса, вызываемого тяжелыми металлами. В связи с этим в следующей части нашей работы нами были проведены полевые испытания стевиозида в качестве регулятора роста и развития растений.
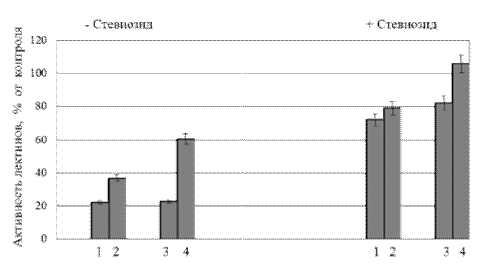
Рис. 1. Влияние CdSO4 и ZnSO4 на активность лектинов клеточной стенки в предварительно обработанных стевиозидом (10–8М) (+Стевиозид) и необработанных стевиозидом (–Стевиозид) корнях проростков озимой пшеницы сорта Мироновская 808: 1 – CdSO4 (1мМ), 2 – ZnSO4 (1мМ), 3 – CdSO4 (10мкМ), 4 – ZnSO4 (10мкМ)
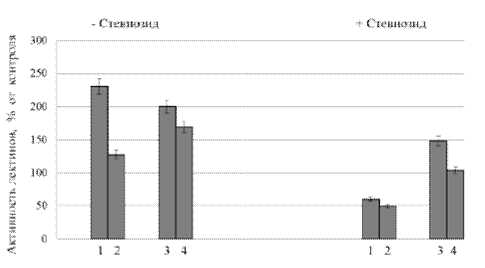
Рис. 2. Влияние CdSO 4 и ZnSO 4 на активность растворимых лектинов в –8 предварительно обработанных стевиозидом (10 М) (+Стевиозид) и необработанных стевиозидом (–Стевиозид) корнях проростков озимой пшеницы сорта Мироновская 808: 1 – CdSO 4 (1мМ), 2– ZnSO 4 (1мМ), 3 – CdSO 4 (10мкМ), 4 – ZnSO 4 (10мкМ)
По результатам мелкоделяночных опытов, опрыскивание растений яровой пшеницы стевиози-дом (10 -8 М) в начале фазы выхода в трубку и в фазе кущения повысило урожайность на 4,02 ц/га или 15% (контроль – 26,8 ц/га, опыт – 30,82 ц/га) (табл. 4). Полученная прибавка урожая обусловлена в значительной степени увеличением массы зерен в колосе, а также озерненности колоса. При этом стевиозид практически не влиял на количество продуктивных стеблей и число колосков в колосе.
В процессе вегетации растения варианта, обработанного стевиозидом, отличались более высоким ростом: в фазу выхода в трубку высота опытных растений была выше на 6,82 %, в фазу колошения – на 26,95% по сравнению с контролем (табл. 5). Площадь листьев растений опытного варианта была на 10,2% больше в фазу выхода в трубку и на 12,9% больше в фазу колошения по сравнению с контрольными растениями. Под влиянием стевио- зида особенно значительно увеличился сырой вес растений в фазу колошения: на 38% по сравнению с контролем. При этом сухой вес увеличился на 6,47%, а содержание воды в растениях – на 60%. Содержание белка и фотосинтетических пигментов под влиянием стевиозида не изменилось. По-видимому, увеличение высоты растений и площади листовой поверхности, более эффективное накоп- ление сухой массы способствовало в конечном итоге формированию более крупных зерен и формированию более озерненного колоса.
Таким образом, согласно проведенным полевым испытаниям на растениях яровой пшеницы Омская 33, установлена эффективность применения сте-виозида в качестве регулятора роста.
Таблица 4 . Величина и структура урожая яровой пшеницы Омская 33
|
Ё cd s m |
s о a a )S ° S У о 4 О ^ |
cd Л cd О m |
§ cd" О w cd 4 |
О 5 w M о о о к о о ы |
о о 5 м СО О о |
о й м cd со О m |
cd" О О О cd со о m |
СО cd S |
2 "ст о cd S О |
|
контроль |
393± ±0,06 |
81± ±0,04 |
8,2± ±0,01 |
15,35± ±0,03 |
24,98± ±0,05 |
0,75± ±0,01 |
271,45± ±0,06 |
34,93± ±0,06 |
26,8± ± 0,05 |
|
стевиозид (108М) |
409± ±0,07 |
92,45± ±0,05 |
8,9± ±0,02 |
16,2± ±0,04 |
30,15± ±0,06 |
1,03± ±0,01 |
306,2± ±0,05 |
34,06± ±0,05 |
30,82± ±0,06 |
Таблица 5 . Биометрические показатели яровой пшеницы Омская 33
|
О S 6 g ц 5 |
cd )S 8 ® м |
масса растений, г |
S cd л & со Ч о и |
& 2-0 Ч и о v § о ю S |
Содержание фотосинтетических пигментов, % массы сырых листьев |
|||||
|
сырая |
сухая |
хл. а |
хл. b |
хл. а + хл. b |
каро-тино-иды |
|||||
|
Фаза выхода в трубку |
||||||||||
|
Контроль |
5875,20 |
70,60± |
5,73± |
1,74± |
3,99± |
1226± |
14,39± |
5,34± |
19,7± |
4,63± |
|
±0,09 |
0,04 |
0,05 |
0,01 |
0,05 |
0,06 |
0,06 |
0,01 |
0,06 |
0,01 |
|
|
Стевиозид |
6275,70 |
77,80± |
6,07± |
1,76± |
4,31± |
1441± |
14,67± |
5,94± |
20,6± |
6,71± |
|
±0,1 |
0,02 |
0,03 |
0,01 |
0,03 |
0,07 |
0,07 |
0,02 |
0,04 |
0,01 |
|
|
Фаза колошения |
||||||||||
|
Контроль |
2605,26 |
96,80± |
4,15± |
1,70± |
2,45± |
1071± |
15,17± |
5,21± |
20,28± |
4,35± |
|
±0,1 |
0,05 |
0,04 |
0,02 |
0,02 |
0,04 |
0,05 |
0,01 |
0,04 |
0,02 |
|
|
Стевиозид |
3307,46 |
108,50± |
5,73± |
1,81± |
3,92± |
1166± |
15,48± |
5,25± |
20,73± |
4,41± |
|
±0,1 |
0,04 |
0,05 |
0,03 |
0,03 |
0,03 |
0,06 |
0,01 |
0,05 |
0,03 |
|
-
1. Катаев В.Е., Хайбуллин Р.Н., Шарипова Р.Р., Стробы-кина И.Ю . Дитерпеноиды и гликозиды энт-кауранового ряда: выделение, свойства, химическая трансформация // Обзорный журнал по химии. 2011. Т. 1. № 1. С. 99-167.
-
2. Ruddat M., Heftman E., Lang A . Conversion of steviol to a gibberellin-like compound by Fusarium moniforme // Arch. Biochem. Biophys. 1965. V. 111. P. 187-190.
-
3. Тимофева О.А., Невмержицкая Ю.Ю., Мифтахова И.Г., Стробыкина А.С., Михайлов А.Л., Стробыкина И.Ю., Миронов В.Ф. Производные дитерпеноида стевиола регулируют рост и повышают морозоустойчивость озимой
пшеницы // Доклады Академии наук. 2010. Т. 435. № 2. С. 282-285.
-
4. Тимофеева О.А. Лектины как активные компоненты адаптивных реакций озимой пшеницы к неблагоприятным условиям среды: Автореф. дис. … д-ра биол. наук. Уфа, 2009. 38 с.
-
5. Bradford M.A . A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding // Biochem. 1976. V. 72. P. 248-254.
-
6. Uemura M., Steponkus P.L . Parallel Effects of Freezing and Osmotic Stress on the ATPase Activity and Protein Composition of the Plasma Membrane of Winter Rye Seedlings //
Plant Physiol. 1989. V. 91. N 3. P. 961-969.
-
7. Третьяков Н.Н., Карнаухова Т.В., Паничкин А.А. и др . Практикум по физиологии растений. М.: Агропромиз-дат, 1990. 271 с.
-
8. Хохлова Л.П., Олиневич О.А., Тараканова Н.Ю., Тимофеева О.А., Воловник И.Л., Палих Э., Раудаскоски М. Цитоскелет-зависимые изменения водного статуса и морозоустойчивости разных генотипов озимой пшеницы // Грани сотрудничества. К 10-летию Соглашения о сотрудничестве между Казанским и Гиссенским университетами: Сб. научн. статей и обз. материалов. Казань: Унипресс. 1999. С. 275-298.
-
9. Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Петрозаводск: КарНЦ РАН, 2007. 172 с.
-
10. Башмаков Д.И., Пыненкова Н.А., Сазанова К.А., Лукат-кин А.С . Влияние синтетического регулятора роста ци-
тодеф и тяжелых металлов на окислительный статус растений огурца // Физиол. раст. 2012. Т. 59. № 1. С. 6773.
-
11. Bogoeva V.P., Radeva M.A., Atanasova L.Y., Stoitsova L.Y., Boteva R.N . Fluorescence analysis of hormone binding activities of wheat germ agglutinin // Biochim. Biophys. Acta. 2004. V. 1698. N 2. P. 213-218.
-
12. Van Assche F., Clijsters H. Effect of metals on enzyme activity in plants // Plant Cell Environ. 1990. V. 13. P. 195-206.
-
13. Безрукова М.В., Фатхутдинова Р.А., Лубянова А.Р., Мур-забаев А.Р., Федяев В.В., Шакирова Ф.М . Участие лектина в формировании устойчивости пшеницы к токсическому действию кадмия // Физиол/ раст. 2011. Т. 58. № 6. С. 907-914.
-
14. Melis M.S . Influence of calcium on the blood pressure and renal effects of Stevioside // Braz. J. Med. Biol. Res. 1992. V. 25. N 9. P. 943-949.
STEVIOSIDE AS ANTI-STRESS CONTROL OF GROWTHAND DEVELOPMENT OF PLANTS
Список литературы Стевиозид как антистрессовый регулятор роста и развития растений
- Катаев В.Е., Хайбуллин Р.Н., Шарипова Р.Р., Стробыкина И.Ю. Дитерпеноиды и гликозиды энт-кауранового ряда: выделение, свойства, химическая трансформация//Обзорный журнал по химии. 2011. Т. 1. № 1. С. 99-167.
- Ruddat M., Heftman E., Lang A. Conversion of steviol to a gibberellin-like compound by Fusarium moniforme//Arch. Biochem. Biophys. 1965. V. 111. P. 187-190.
- Тимофева О.А., Невмержицкая Ю.Ю., Мифтахова И.Г., Стробыкина А.С., Михайлов А.Л., Стробыкина И.Ю., Миронов В.Ф. Производные дитерпеноида стевиола регулируют рост и повышают морозоустойчивость озимой пшеницы//Доклады Академии наук. 2010. Т. 435. № 2. С. 282-285.
- Тимофеева О.А. Лектины как активные компоненты адаптивных реакций озимой пшеницы к неблагоприятным условиям среды: Автореф. дис. … д-ра биол. наук. Уфа, 2009. 38 с.
- Bradford M.A. A Rapid and Sensitive Method for the Quantitation of Microgram Quantities of Protein Utilizing the Principle of Protein-Dye Binding//Biochem. 1976. V. 72. P. 248-254.
- Uemura M., Steponkus P.L. Parallel Effects of Freezing and Osmotic Stress on the ATPase Activity and Protein Composition of the Plasma Membrane of Winter Rye Seedlings//Plant Physiol. 1989. V. 91. N 3. P. 961-969.
- Третьяков Н.Н., Карнаухова Т.В., Паничкин А.А. и др. Практикум по физиологии растений. М.: Агропромиздат, 1990. 271 с.
- Хохлова Л.П., Олиневич О.А., Тараканова Н.Ю., Тимофеева О.А., Воловник И.Л., Палих Э., Раудаскоски М. Цитоскелет-зависимые изменения водного статуса и морозоустойчивости разных генотипов озимой пшеницы//Грани сотрудничества. К 10-летию Соглашения о сотрудничестве между Казанским и Гиссенским университетами: Сб. научн. статей и обз. материалов. Казань: Унипресс. 1999. С. 275-298.
- Титов А.Ф., Таланова В.В., Казнина Н.М., Лайдинен Г.Ф. Устойчивость растений к тяжелым металлам. Петрозаводск: КарНЦ РАН, 2007. 172 с.
- Башмаков Д.И., Пыненкова Н.А., Сазанова К.А., Лукаткин А.С. Влияние синтетического регулятора роста цитодеф и тяжелых металлов на окислительный статус растений огурца//Физиол. раст. 2012. Т. 59. № 1. С. 67-73.
- Bogoeva V.P., Radeva M.A., Atanasova L.Y., Stoitsova L.Y., Boteva R.N. Fluorescence analysis of hormone binding activities of wheat germ agglutinin//Biochim. Biophys. Acta. 2004. V. 1698. N 2. P. 213-218.
- Van Assche F., Clijsters H. Effect of metals on enzyme activity in plants//Plant Cell Environ. 1990. V. 13. P. 195-206.
- Безрукова М.В., Фатхутдинова Р.А., Лубянова А.Р., Мурзабаев А.Р., Федяев В.В., Шакирова Ф.М. Участие лектина в формировании устойчивости пшеницы к токсическому действию кадмия//Физиол/раст. 2011. Т. 58. № 6. С. 907-914.
- Melis M.S. Influence of calcium on the blood pressure and renal effects of Stevioside//Braz. J. Med. Biol. Res. 1992. V. 25. N 9. P. 943-949.


