Стимуляция диафрагмального нерва посредством модифицированного имплантируемого устройства в комплексе реабилитационных мероприятий после повреждения шейного отдела спинного мозга (случай из практики)
Автор: Ерохин Александр Николаевич, Кобызев Андрей Евгеньевич, Сергеенко Ольга Михайловна, Туровинина Елена Фаридовна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Случай из практики
Статья в выпуске: 1, 2020 года.
Бесплатный доступ
Актуальность. При реабилитации больных с тяжелыми повреждениями шейного отдела позвоночного столба и спинного мозга актуальным становится устранение расcтройств внешнего дыхания. Цель. Разработать режимы для имплантируемого генератора электрических импульсов и посредством эпидуральной стимуляции диафрагмального нерва уменьшить зависимость пациента от аппарата внешнего дыхания. Материалы и методы. Стимуляцию диафрагмального нерва проводили у мальчика 9 лет с травматической болезнью спинного мозга при его полном анатомическом перерыве на уровне С2 позвонка. Реализацию режимов искусственного и вспомогательного дыхания у пациента осуществляли посредством комплекса LTV 1200 CareFusion (USA). Для тестирования функционального состояния диафрагмального нерва использовали систему «ISIS IOM» (Inomed Medizintechnik GmbH, Германия). Для статистического анализа первичных данных использовали парный t-критерий Стьюдента. Анализ проводили в среде программного обеспечения Microsoft Office Excell 2007 и программы AtteStat, версия 13.1...
Хроническая стимуляция диафрагмального нерва, реабилитация
Короткий адрес: https://sciup.org/142224272
IDR: 142224272 | УДК: 616.832.12-001-089.844:[616.833.336:615.847] | DOI: 10.18019/1028-4427-2020-26-1-89-94
Текст научной статьи Стимуляция диафрагмального нерва посредством модифицированного имплантируемого устройства в комплексе реабилитационных мероприятий после повреждения шейного отдела спинного мозга (случай из практики)
На современном этапе развития реабилитации больных с тяжелыми повреждениями шейного отдела позвоночного столба и спинного мозга актуальным становится выбор оптимальной тактики восстановительного лечения на основе синдромального подхода [1] и устранение расстройств внешнего дыхания. Одним из методов ликвидации гипоксии является искусственная вентиляция легких, но она не компенсирует снижение вентиляционной способности легких, что отражает ее нефизиологичность [2] и делает актуальным сокращение сроков пребывания пациентов на ИВЛ [3]. Известно несколько подходов к электростимуляции дыхания: чре-
скожная, радиочастотная или непосредственная активация межреберных дыхательных мышц [4]; стимуляция сегментов спинного мозга [5]; непосредственная или чрескожная стимуляция структур дыхательного центра [6]; стимуляция диафрагмы или диафрагмального нерва с помощью трансвенозной, радиочастотной, непосредственной и транскутанной методик [7]. Об актуальности и уникальности каждого случая при использовании электрической стимуляции дыхания при травматическом повреждении ствола головного мозга и шейного отдела спинного мозга свидетельствует опыт использования диафрагмального стимулятора как альтернативы традиционной ИВЛ при вентиляционной дыхательной недостаточности у трех детей с травматическим повреждением спинного мозга на уровне С1–С2 [8].
В связи с вышесказанным, целью настоящего исследования явилась разработка режимов для имплантируемого генератора электрических импульсов и посредством эпидуральной стимуляции диафрагмального нерва уменьшение зависимости пациента от аппарата внешнего дыхания у мальчика 9 лет с травматической болезнью спинного мозга в позднем периоде при полном анатомическим перерыве спинного мозга на уровне С2 позвонка. С момента травмы прошел год и три месяца, после оперативного вмешательства (окципитоспондилодез С0–С4) – два месяца.
МАТЕРИАЛЫ И МЕТОДЫ
Стимуляцию диафрагмального нерва проводили у мальчика 9 лет с травматической болезнью спинного мозга при его полном анатомическом перерыве на уровне С2 позвонка. При проведении исследования были соблюдены все этические стандарты Хельсинкской декларации Всемирной медицинской ассоциации с соответствующими поправками. Реализацию режимов искусственного и вспомогательного дыхания у пациента осуществляли посредством комплекса LTV 1200 CareFusion (USA). Для тестирования функционального состояния диафрагмального нерва использовали систему «ISIS IOM» (Inomed Medizintechnik GmbH, Германия). Электростимуляцию диафрагмального нерва проводили посредством устройства для тестовой нейростимуляции [9] после оперативного вмешательства и введения стимулирующего 4-х контактного цилиндрического электрода эпидурально на уровне С2– С4 позвонков. Уровень сатурации кислорода в тканях определяли посредством пульсоксиметра Nonin Onyx (USA). Аудиовизуальную поддержку (виртуальное погружение) реализовали посредством ЖК-телевизора со встроенным DVD-плеером и Stereo 3D Multimedia video glasses (China). Вычисляли среднюю (М) и стандартное отклонение (σ). Подсчитывали среднее число дыхательных циклов в минуту: за минуту до начала электростимуляции, в середине сеанса электростимуляции и сразу после окончания электростимуляции. Число «n» отражает количество указанных измерений за первую неделю (электростимуляция проводилась два раза в день) и аналогичным образом за вторую неделю. Процентное выражение сигмы определяли по отношению к средней за данную минуту, а процентное отношение средней вычисляли по отношению к средней за минуту перед началом сеанса стимуляции. При таком подсчете среднее значение за минуту до начала стимуляции принимали за сто процентов. Для статистического анализа первичных данных использовали парный t-критерий Стьюдента [10]. Нормальность распределения характеристик в выборках определяли посредством критерия Шапиро-Уилка. При сравнении двух выборок нулевую гипотезу отвергали при уровне значимости критерия р ≤ 0,05. Анализ проводили в среде программного обеспечения Microsoft Office Excell 2007 и программы AtteStat, версия 13.1.
РЕЗУЛЬТАТЫ
При оценке неврологического статуса по шкале ASIA были получены следующие результаты. В соответствии с алгоритмом оценки по данной шкале чувствительность на уровне С2 (на 1 см кнаружи от затылочного бугра) справа пониженная (1 балл), слева – пониженная (1 балл); на уровне С3 (надключичная ямка) – справа пониженная (1 балл), слева – отсутствует (0 баллов). Далее, начиная с сенсорной точки С4 (вершина акромиально-ключичного сустава), справа и слева чувствительность отсутствовала.
При оценке двигательной активности, начиная с мышц-сгибателей предплечья (соответствуют сегменту спинного мозга С5) и последующих мышечных групп был диагностирован полный паралич, что соответствует по шкале ASIA 0 баллов.
В соответствии с тем, что у пациента отсутствовало произвольное сокращение ануса и ощущение аноректального надавливания, было диагностировано полное повреждение спинного мозга. Вместе с тем, была предпринята попытка определения сохранности диафрагмальных нервов. Посредством малоинвазивной операции пациенту имплантировали в эпидуральное пространство 4-х контактный цилиндрический электрод на уровне С2– С4 позвонков, была проведена процедура выбора оптимальной зоны расположения действующих контактов.
Процедура проводилась под контролем регистрации вызванных потенциалов с мышечного массива диафрагмы. При этом был получен ответ порядка 150–200 мкВ с правого диафрагмального нерва. Оптимальными контактами для электростимуляции были определены № 1 и № 2, захватывающие зону C2–C3 шейного отдела позвоночника. После этого был начат курс электростимуляции два раза в день по 15 минут. Клинической особенностью в данном случае явилась полная зависимость пациента от аппарата искусственного дыхания, и при попытках самостоятельного дыхания длительность периода не превышала 2-х минут. Процесс увеличения возможностей самостоятельного дыхания пациента осуществлялся в четыре последовательных этапа. Первый – разработка и реализация режимов электростимуляции, соответствующих дыхательным паттернам с частотой следования 12, 15 и 20 циклов в минуту. При формировании режимов электростимуляции нами был учтен опыт применения данного фактора для профилактики функциональных состояний, возникающих при гипертракционных нейропатиях [11]. Для всех режимов длительность импульсов составила 2500 мкс, частота следования импульсов – 10 Гц. Для последовательности дыхательных движений из 12 циклов в минуту длительность пачки импульсов составила 2 с., паузы – 3 с.; для 15 циклов длительность пачки составила
2 с., паузы – 2 с.; для 20 циклов длительность пачки составила 1 с., паузы 2 с. Стабилизацию выполняли по току при генерации тестовым устройством. Электростимуляцию проводили два раза в день по 15 минут при поддержке вспомогательного дыхания с понижением функции с 11 до 7 мм вд. ст. Была выявлена характерная подстройка частоты дыхания пациента при стимуляции к задаваемому ритму (рис. 1 и 2). Феномен подстройки частоты дыхания к задаваемому ритму особенно четко проявился на втором этапе, когда различия частоты дыхания в промежутках «начало – середина» и «середина – окончание» сеанса были статистически значимы (табл. 1). В течение второго этапа электростимуляцию проводили при аудиовизуальной поддержке посредством образованных синглов из мультфильмов, без вспомогательного дыхания, с контролем уровня сатурации кислорода в периферических сегментах верхней конечности. В течение пяти дней второго периода способность пациента к самостоятельному дыханию при стабильном уровне сатурации кислорода (98–100 %) выросла с 9 до 16 минут и 30 секунд, что составило более 80 процентов прироста (рис. 3). На данном рисунке отражена динамика самостоятельного дыхания пациента без поддержки аппаратного дыхания Pressure Support на третьем этапе (третья неделя). Был выбран для анализа период за пять дней, поскольку процедура стимуляции дыхания проводилась два раза в день, постольку на графике отражены девять значений. Первый день соответствует одному значению. Девять минут были приняты за сто процентов, по отношению к которым вычисляли процентный прирост. Общая длительность второго этапа составила две недели.
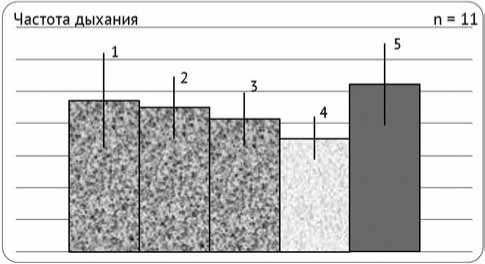
Рис. 1. Динамика частоты дыхания пациента У., 9 лет, при электростимуляции в режиме 20 дыхательных циклов в минуту при вспомогательном аппаратном дыхании Pressure Support (девиация от 11 до 7 мм вд. ст.): 1 – перед началом сеанса ЭС; 2 – в середине сеанса ЭС; 3 – после окончания сеанса ЭС; 4 – минимум; 5 – максимум. Первая неделя электростимуляции

Рис. 2. Частота дыхания при электростимуляции пациента У., 9 лет, в режиме 20 дыхательных циклов в минуту при вспомогательном аппаратном дыхании Pressure Support (стабильно 7мм. вд. ст) (1 – перед началом сеанса ЭС; 2 – в середине сеанса ЭС; 3 – после окончания сеанса ЭС; 4 – минимум; 5 – максимум). Вторая неделя электростимуляции
Таблица 1
Динамика частоты дыхания (количество дыхательных движений в минуту) в течение сеанса электростимуляции
(в % от значения средней перед началом сеанса, M ± σ )
|
Период |
Первая неделя |
Вторая неделя |
|
Перед началом сеанса |
100 ± 31,1 |
100 ± 6,0 |
|
Середина сеанса |
95 ± 21,2 |
105,7 ± 7,5 |
|
После окончания сеанса |
87,7 ± 20 |
98,5 ± 7,7 |
|
р, перед началом – середина |
0,280219091 |
0,045566238 |
|
р, середина – после окончания |
0,14555315 |
0,005639159 |
Примечание: парный t-критерий Стьюдента.
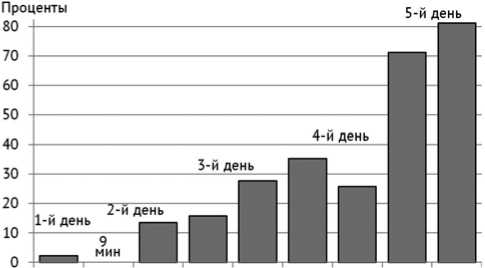
Рис. 3. Прирост длительности периода самостоятельного дыхания пациента У., 9 лет, при электростимуляции + аудиовизуальная поддержка в процентах от 9 минут (длительность самостоятельного дыхания первого сеанса стимуляции второго дня) за пять дней
Длительность самостоятельного дыхания (без аппаратной поддержки), но при стимуляции диафрагмального нерва достигла двадцати минут. На третьем этапе электростимуляцию проводили четыре раза в день по пятнадцать минут при самостоятельном дыхании пациента одновременно с аудиовизуальной поддержкой.
Длительность этапа составила четыре недели. У пациента расширился круг функциональных возможностей, который проявился в увеличении амплитуды активных поворотов головы, улучшении дикции и повышении громкости речи, а также качательных движений туловища в положении сидя.
В начале четвертого этапа пациенту имплантировали устройство для хронической электростимуляции с версией программы V18.6.2 (рис. 4). На протяжении всех четырех этапов пациенту ежедневно проводили массаж и ЛФК – по 20 и 60 минут соответственно. Через шесть месяцев после выписки из стационара при общении с матерью пациента по телефону выяснилось: пациент самостоятельно дышит при одновременной стимуляции 3 раза в день по 20 минут и поддерживает тот уровень функциональной активности, который был достигнут в стационаре.
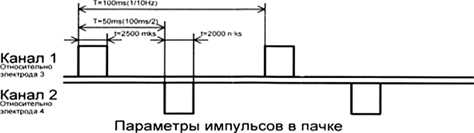
Был использован стандартный 4-х контактный электрод для эпидуральной стимуляции. В целях захвата большей территории воздействия по двум каналам активировали 1–3 контакты (электроды) и 1–4 контакты (электроды). На схеме также отражены параметры стимуляции для трех режимов: режим №15 соответствует 20-ти дыхательным циклам в минуту (1 секунда – пачка импульсов, 2 секунды – пауза); режим № 16 соответствует 15-ти дыхательным циклам в минуту (2 секунды – пачка импульсов, 2 секунды – пауза); режим № 16 соответствует 15-ти дыхательным циклам в минуту (2 секунды – пачка импульсов, 2 секунды – пауза); режим № 17 соответствует 12-ти дыхательным циклам в минуту (2 секунды – пачка импульсов, 3 секунды – пауза).
4 3 2 1
~ П П П П )
Ik- lk+
,,к* Электрод ,|к-
sb-' lin’iinT " 'Iiiiiih iiiiiih
SB-2 lllllllll "■ ■
Режим 15
sb’ II......iiiiiinT " I...........пн
SB# lllllllllllllllll lllllllllllllllll
Режим 16
»llllllllllllllll___________________llllllllllllllll
Рис. 4. Медико-технические требования к нейростимулятору
SB-2 lllllllllllllllll llllllllllllllll
Режим 17
ОБСУЖДЕНИЕ
Представленное клиническое наблюдение демонстрирует возможности электростимуляции диафрагмального нерва и аудиовизуальной поддержки при увеличении периода длительности самостоятельного дыхания у мальчика 9 лет с травматической болезнью спинного мозга в позднем периоде при полном анатомическим перерыве спинного мозга на уровне С2 позвонка. После оперативного вмешательства – окципитоспондилодеза на уровне С0–С4 – был поставлен вопрос об определении сохранности диафрагмальных нервов. Воздействие импульсным электрическим током (посредством генератора электрических импульсов с помощью 4-х контактного цилиндрического электрода, помещенного в эпидуральном пространстве на уровне С2–С4 позвонков) позволило получить вызванный ответ с правого диафрагмального нерва. Это обстоятельство послужило основой для дальнейшего проведения курса электростимуляции и констатации факта о том, что в данном клиническом случае речь идет не о полном анатомическом перерыве спинного мозга на уровне С2 позвонка, а о субтотальном перерыве с частичной сохранностью нервных волокон, формирующих правый диафрагмальный нерв. При установлении оптимальных параметров режима стимуляции было принято во внимание то, что среднее число дыхательных циклов пациента в минуту на первой неделе первого этапа перед началом сеанса электростимуляции составило 23,6 ± 7,3 дых/мин., а среднее дыхательных циклов в минуту на второй неделе первого этапа перед началом сеанса электростимуляции – 23,9 ± 1,4 дых/мин. Другими словами, из трех разработанных режимов стимуляции с частотой 12, 15 и 20 дыхательных циклов в минуту, последний был наиболее близок по своим параметрам к спонтанному дыханию пациента.
При анализе результатов наблюдения обращают на себя внимание такие характеристики дыхания как «минимум» и «максимум» частоты в минуту. Характеристики «максимум» и «минимум» являются статистическими параметрами, которые позволяют описать размах значений переменной. В первую неделю минимум составил
17,2 ± 32 дых/мин., максимум – 26,0 ± 6,3 дых/мин. Во вторую неделю – минимум 19,2 ± 1,6 дых/мин., а максимум – 29,6 ± 1,2 дых/мин. Если размах остался практически прежним (незначительное увеличение во вторую неделю – на 1,5 дых/мин.), то диапазон размаха существенно сместился в зону более высоких значений. Это обстоятельство объясняется, на наш взгляд, тем, что поддержка дыхания на протяжении сеанса самостоятельного дыхания во вторую неделю была меньше, чем в первую неделю (стабильно 7 мм вд. ст. против 11–7 мм вд. ст.), что потребовало больших усилий самого пациента, а смещение размаха в зону более высоких значений свидетельствует о значительном функциональном резерве пациента.
Заслуживает внимания различие в динамике частоты дыхания на протяжении сеанса электростимуляции в первую и вторую недели первого этапа. Если в первую неделю, в условиях более выраженной поддержки, проявилось стабильное приближение к задаваемому ритму, но с большим размахом (о чем свидетельствует величина стандартного отклонения), то во вторую – регистрируется сначала повышение, а затем приближение к задаваемому ритму, с гораздо меньшим значением стандартного отклонения, чем в первую неделю. Указанная динамика частоты дыхания отражает, на наш взгляд, то, что функциональная возможность пациента в реализации самостоятельного дыхания во вторую неделю возросла, и, несмотря на меньшую поддержку, которая обусловила флуктуацию в середине сеанса, к концу сеанса стимуляции приблизилась к задаваемому ритму. После курса эпидуральной стимуляции отмечалась позитивная динамика функции самостоятельного дыхания, данные по шкале ASIA не изменились.
Отражением, в целом, позитивной динамики функционального состояния пациента может служить то обстоятельство, что в течение стационарного реабилитационного периода произошло улучшение функции тех мышц, иннервация которых реализуется за счет структур, расположенных либо выше уровня повреждения (подбородочно-подъязычная мышца, щито-подъязычная мышца, передняя прямая мышца головы, боковая прямая мышца головы) либо реализуется черепными нервами (подкожная мышца шеи, двубрюшная мышца, челюстно-подъязычная мышца, шило-подъязычная мышца). Об этом свидетель- ствуют субъективно отмеченные матерью мальчика увеличение амплитуды активных поворотов головы, улучшение дикции и повышение громкости речи, а также появление качательных движений туловища в положении сидя.
ЗАКЛЮЧЕНИЕ
Стимуляция дыхания при травматическом повреждении ствола головного мозга и шейного отдела спинного мозга у ребенка девяти лет потребовало разработки специального имплантируемого модуля, в котором были заложены три базовых режима стимуляции, реализующие последовательности пачек импульсов в ритме, близком к естественному при дыхании в покое. Моделирование естественного акта дыхания в состоянии покоя при бодрствовании с последовательностью паттернов частотой 12, 15 и 20 дыхательных циклов в минуту позволило задавать данный ритм пациенту и инициировать процесс его подстройки к внешнему ритму дыхания. Воздействие посредством максимально возможной для данного модуля длительностью импульсов – 2500 мкс было обусловлено необходимостью возбуждения как можно большего числа сохранившихся волокон диафрагмального нерва. Частота следования импульсов в пачке (10 гц) позволила смоделировать паттерны импульсов, близкие по ритмической структуре к естественным. Модификация программного
Конфликта интересов нет.
блока имплантируемого устройства, предложенная нами, позволила расширить функциональные возможности генератора электрических импульсов и в конечном итоге значительно увеличить временной диапазон самостоятельного дыхания пациента. Использование имплантируемого устройства с автоматически запускаемой программой стимуляции диафрагмального нерва послужило основой для продолжения курса в домашних условиях. Этому способствовали несложный дизайн внешнего модуля имплантируемого устройства и доступность его технического использования.
Таким образом, электростимуляция диафрагмального нерва у пациента с высоким уровнем повреждения спинного мозга посредством модифицированного нами имплантируемого устройства с использованием элементов виртуального погружения и соответствующего функциональным возможностям комплекса ЛФК увеличила диапазон его автономии и повысила уровень контроля самостоятельного дыхания.
Список литературы Стимуляция диафрагмального нерва посредством модифицированного имплантируемого устройства в комплексе реабилитационных мероприятий после повреждения шейного отдела спинного мозга (случай из практики)
- Синдромальный подход при оценке хирургической патологии шейного отдела позвоночника / А.В. Бурцев, А.В. Губин, С.О. Рябых, А.О. Котельников, О.М. Павлова // Гений ортопедии. 2018. Т. 24, № 2. С. 216-220. DOI: 10.18019/1028-4427-2018-24-2-216-220
- Сафонов В.А., Тарасова Н.Н. Электрическая стимуляция дыхания // Физиология человека. 2010. Т. 36, № 4. С. 130-142.
- Прогностическая значимость мониторинга респираторной биомеханики в дифференцированной терапии вентилятор-ассоциированных легочных осложнений у пациентов с тяжелой сочетанной травмой с поражением органов грудной клетки / Н.С. Давыдова, П.Г. Болтаев, С. Ю. Лукин, Е.А. Беседина, Л.А. Скороходова, Н.П. Шень, С.Ю. Мухачева // Медицинская наука и образование Урала. 2016. Т. 17, № 2. С. 17-22.
- Убайдуллаева К.М. Эффективность методов восстановления функций респираторных мышц у больных ХОБЛ: материалы IV нац. конгр. по болезням органов дыхания // Клиническая медицина Казахстана. 2013. № 2 (28). С. 98.
- Inspiratory muscle pacing in spinal cord injury: case report and clinical commentary / A.F. DiMarco, R.P. Onders, A. Ignagni, K.E. Kowalski // J. Spinal Cord Med. 2006. Vol. 29, No 2. P. 95-108. DOI: 10.1080/10790268.2006.11753863
- Сафонов В.А., Тарасова Н.Н. Восстановление дыхания посредством чрезкожной электростимуляции дыхательного центра // Патогенез. 2008. Т. 6, № 1. С. 42-45.
- Shehu I., Peli E. Phrenic nerve stimulation // Eur. J. Anaesthesiol. Suppl. 2008. Vol. 42. P. 186-191.
- DOI: 10.1017/S0265021507003377
- Сирота С.И., Кафанова М.Ю., Половников Е.В. Опыт использования диафрагмального стимулятора как альтернатива традиционной искусственной вентиляции легких при вентиляционной дыхательной недостаточности // Педиатрическая анестезиология и интенсивная терапия: Шестой Российский конгресс: [сб. материалов]. Тверь, 2011. С. 127.
- Спосiб лiкування хворих з паралiчем плечового сплетення та пристрiй для його здiйснення: пат. 59569 України. А61N1/18; заявл. 08.08.2002; опубл. 15.09.2003, Бюл. № 9. 4 с.
- Петри А., Сэбин К. Наглядная статистика в медицине / пер. с англ. В.П. Леонова. М.: ГЭОТАР-МЕД, 2005. 139 c.
- Ерохин А.Н., Сайфутдинов М.С. Профилактика гипертракционных нейропатий у больных при чрескостном дистракционном остеосинтезе // Журнал неврологии и психиатрии им. C.C. Корсакова. 2013. Т. 113, № 7. С. 52-54.


