Стохастическое имитационное моделирование механизмов укорочения теломер клеток в процессах старения и развития патологических отклонений
Автор: Бутов Александр Александрович, Карев Михаил Андреевич, Хрусталв Сергей Александрович
Журнал: Advanced Engineering Research (Rostov-on-Don) @vestnik-donstu
Рубрика: Технические науки
Статья в выпуске: 1 (76) т.14, 2014 года.
Бесплатный доступ
Рассматриваются вопросы применения стохастического имитационного моделирования к описанию и исследованию механизмов укорочения концевых структур ДНК - теломер. Целью настоящей работы является исследование на основе стохастического и имитационного моделирования протекающих в клетках явлений, которые приводят к уменьшению длины теломер и, как следствие, к снижению пролиферативного потенциала и возникновению патологий, в том числе онкологических. Математическая модель описывается в семимартингальных терминах. Анализ результатов моделирования основан на сопоставлении со статистическими данными биологических экспериментов. Построенные распределения клеток по длинам их теломер сопоставлялись с экспериментальными данными, полученными на культурах фибробластов человека с использованием метрики Леви-Прохорова. Результаты работы могут найти применение в медико-биологических исследованиях старения и возникновения различных патологий, а также при решении ряда вопросов в области геронтологии.
Стохастическое имитационное моделирование, семимартингал, компенсатор, днк, теломера, теломераза, старение, канцерогенез, оксидативный стресс, свободные радикалы
Короткий адрес: https://sciup.org/14250054
IDR: 14250054 | УДК: 519.216:576.366:57.017.67 | DOI: 10.12737/3509
Текст научной статьи Стохастическое имитационное моделирование механизмов укорочения теломер клеток в процессах старения и развития патологических отклонений
Введение. В последние годы выявлены неизученные ранее механизмы старения и процессов опухолевой трансформации клеток. Этому способствовало развитие современных биотехнологий, а также большой интерес к изучению роли теломер и фермента теломеразы в клеточном цикле. Раскрыты механизмы, связанные с теломерами, которые служат причиной канцерогенеза. Теломеры — участки ДНК на концах хромосом, состоящие из одинаковых нуклеотидных повторов. Главная роль теломер в клетке связана с их участием в процессе клеточного деления. Деление клетки сопровождается потерей части концевых участков ДНК. При этом возникает так называемая проблема «недорепликации» концевых участков ДНК — теломер [1]. Но кроме участия в процессах деления клетки теломеры защищают геном, образуя защитный нуклеопротеидный комплекс на концах хромосом. Этот комплекс стабилизирует хромосомы и предохраняет их от разрушительных воздействий — таких, например, как деградация и слипание концевых участков хромосом, повреждение ДНК на концах хромосом, нарушение рекомбинации [1, 2]. В случае повреждения защитного нуклеопротеидного комплекса, образованного теломерами, хромосомы начинают сливаться с большей частотой, что в результате приводит к тяжелым генетическим аномалиям, к хромосомным перестройкам и деградации хромосом. Кроме того, изменения или нарушения в структуре теломер могут затрагивать не только их собственные функции, но и экспрессию жизненно важных генов, находящихся в других районах хромосом [3].
Восстановление теломерных участков хромосом осуществляет фермент теломераза. Благодаря этому механизму хромосомная ДНК и связанные с ней гены защищены от повреждения во время деления клетки. Теломераза — специфический клеточный рибонуклеопротеин, который по механизму реакции является обратной транскриптазой. Теломераза принимает участие в синтезе активных центров для связывания теломерной ДНК с теломерными защитными белками [4]. В эмбриональных и стволовых клетках благодаря экспрессии теломеразы поддерживается постоянный уровень длины теломер. Кроме того, повышенные уровни теломеразы содержатся в большинстве опухолей человека. В соматических клетках уровень теломеразы постепенно снижается, и, как следствие, происходит уменьшение длины теломер.
В настоящее время возникновение и развитие многих патологий в организме человека, в том числе онкологических, связывают с нарушениями механизмов регулирования длины теломер [5]. Поэтому исследования данных механизмов, выявление зависимостей между характеристиками развития заболеваний и динамикой изменений теломерных участков ДНК — актуальные и важные задачи. Эффективным инструментом описания и изучения таких задач является математическое и имитационное моделирование.
Цель настоящей работы — исследование протекающих в клетках явлений, которые приводят к уменьшению длины теломер. Как следствие, снижается пролиферативный потенциал и возникают различные патологии, в том числе онкологические. На основе настоящего исследования разрабатывается математическая имитационная модель. Она позволяет не только вскрыть и качественно объяснить механизмы развития данных патологий, но и рассчитать их количественно — на основе анализа стохастических деградационных процессов теломер.
Важным отличием настоящей работы от указанных выше является применение семимар-тингальных методов и теории случайных процессов при построении математической модели механизмов укорочения теломер клеток. Это позволяет наиболее адекватно отражать стохастическую природу явлений, протекающих в клетках. Компьютерные имитационные реализации данной модели дают возможность обнаружить различные зависимости между характеристиками процессов, протекающих в клетках, и патологическими явлениями в исследуемых организмах.
Основная часть. Анализ последних исследований. Моделирование клеточных циклов и процессов, приводящих к старению клеток и потере ими способности к пролиферации, изучалось во многих работах [6 ‒ 16]. Рассматривались различные подходы к отражению протекающих в клетках явлений с помощью математических методов и их компьютерной реализации.
Комплексный подход к рассмотрению механизмов укорочения теломер клеток представлен в статьях [6, 7]. Авторы этих работ предполагают, что теломеры клеток укорачиваются не только при делении, но и вследствие оксидативного стресса. Механизм увеличения скорости укорочения теломер, возникающий при повреждении митохондрий клеток, рассмотрен в [7]. В [6] в качестве дополнительной причины уменьшения длины теломер представлено накопление однонитевых повреждений теломер свободными радикалами.
Модель снижения пролиферативного потенциала культуры клеток при развитии определяется вероятностями изменения состояний клеток (как способных к делению, так и неспособных). В результате моделирования для каждого поколения клеток в некоторых работах получены соотношения чисел делящихся и не способных к пролиферации клеток. Однако в данной модели не рассматривается природа явлений, которыми обусловлена потеря клетками способности к делению. Похожие результаты дают модели, рассмотренные в работах [8, 9]. Методы моделирования основаны здесь на ветвящихся процессах, что не всегда адекватно отражает природу процессов, протекающих в клетках.
Марковские ветвящиеся процессы также были использованы при построении математической модели укорочения теломер в [10]. Здесь получены зависимости соотношения числа делящихся клеток, а также средней длины теломер от достигаемого популяцией PD (Population doubling).
В работе [11] представлена модель, основанная на предположении, что основной причиной снижения уровня пролиферативной активности клеток является укорочение их теломер. Причем полагается, что не все теломеры клетки влияют на её способность к делению, а только их часть. К сожалению, в этой модели предполагается единственный механизм укорочения теломер, возникающий при делении клеток. Однако в реальных культурах наблюдаются и другие причины изменения длины теломер [12].
Математическая модель механизмов поддержания длины теломер, а следовательно, и пролиферативного потенциала клеток за счёт комбинации неравного обмена теломер у сестринских хроматид рассмотрена в работе [13].
В [14] рассматривается динамика укорочения длин теломер в клетках, объясняющая старение организмов, синдром Вернера и бессмертие клеток, обусловленное ферментом теломеразой. При математическом моделировании здесь использованы численные методы Монте-Карло. Сравниваются математические модели четырёх возможных механизмов укорочения теломер. Простейшая модель предполагает, что фиксированный участок теломеры теряется при каждой репликации. Вторая модель основана на гипотезе, согласно которой динамика укорочения теломер зависит от их длины. В третьей модели величина укорочения теломеры фиксирована при каждом делении, но вероятность деления клетки зависит от длины теломеры. В четвёртой и укорочение теломеры, и вероятность деления зависят от длины теломеры.
В основе работы голландских учёных [15] лежит гипотеза о прямой пропорциональной зависимости интенсивности укорочения теломер от их длины. Здесь математическая модель представлена в терминах нелинейных дифференциальных уравнений, описывающих процессы укорочения теломер, динамика которых, в свою очередь, связана с пуассоновскими потоками.
В рамках исследования учёного из США [16] проделана огромная работа по изучению развития рака. В результате построена математическая модель процессов канцерогенеза, основанная на системе уравнений в частных производных. Она учитывает многие аспекты данного явления, в том числе и механизмы укорочения теломер.
Математическая модель. Математическая модель развития клеточной популяции построена на основе траекторных семимартингальных методов. Суть этих методов — описание закономерностей протекающих в клетках процессов в терминах стохастического исчисления. Факторы, влияющие на состояние клеток, но не известные биологу или не учитываемые при исследовании развития клеток, представлены в таком описании в форме стохастических компонент случайных процессов. Это даёт возможность формулировать в строгом математическом виде биологические закономерности, определяющие динамику развития клеток. Данные закономерности в форме стохастических уравнений легко алгоритмизуются. Таким образом возникает возможность компьютерного имитационного моделирования процессов развития клеточных популяций.
В настоящей модели процесс изменения числа клеток в популяции практически представляет собой многомерный семимартингал. Изменения состояния клеток определяются скачками точечных (считающих) процессов. Такое представление позволяет моделировать независимые реализации процесса развития популяции. Также это даёт возможность в любой момент времени строить эмпирические функции распределения клеток по длинам их теломер и выявлять зависимости показателей популяции от параметров модели. Например, можно устанавливать, в частности, следующие зависимости:
-
— достигаемая популяцией клеток величина удвоений численности (PD) — от уровня свободных радикалов или интенсивности деления клеток;
-
— время прекращения пролиферации популяции — от соотношения параметров модели;
-
— относительное число делящихся клеток, а соответственно, и пролиферативный потенциал культуры — от PD.
В модели рассматриваются следующие механизмы изменения длины теломер:
-
— регулярное укорочение теломер, возникающее при делении клетки;
-
— укорочение вследствие накопления однонитевых повреждений теломер, вызванных оксидатив-ным стрессом.
Также учитывается деление клеток с активной теломеразой, которое происходит без укорочения длины теломер вследствие наращивания концевых участков ДНК перед репликацией.
Предполагается, что популяция клеток состоит из двух групп.
-
I. Клетки с активной теломеразой. Деление происходит с последующим восстановлением теломерных участков ферментом теломеразой.
-
II. Клетки, в которых отсутствует теломераза. При каждом делении происходит регулярное уменьшение длины теломеры. По мере укорочения теломерных участков снижается интенсивность деления клеток, а при достижении теломерами критической длины клетки утрачивают способность к пролиферации.
Все клетки подвержены повреждениям ДНК свободными радикалами, вследствие чего также происходит уменьшение длины теломер.
Количество клеток в каждой группе в момент времени t определяется функциями G ( t ) и F ( t ) соответственно. Общее число клеток в популяции представляет собой сумму этих величин. Каждая группа клеток — это совокупность подгрупп, которые составляют клетки с различной длиной теломеры. Подобное представление даёт возможность наблюдать распределение популяции клеток по длинам теломер в любой момент времени.
Пусть считающий процесс BG = (BG) представляет собой число актов деления клеток при активной теломеразе (группа I). Процесс RG = (RG) — есть число клеток группы I, у кото рых произошло повреждение теломеры свободными радикалами. Процессы BF = (BF) >о , RF = (RF) представляют собой число актов деления и повреждения теломер клеток в группе II. Число апоптозов клеток в группах I и II определяются точечными процессами DG = (DG) и DF = DF соответственно.
V t 't >0
В ходе развития клеток снижается активность теломеразы (например, при дифференцировке стволовых клеток). Затем, по прохождении определённого числа актов деления (лимит Хейфлика) утрачивается возможность пролиферации. В рассматриваемой модели число клеток, утративших активность теломеразы (т. е. перешедших из I во II группу), определяется считающим процессом S = ( S t ) t >0 (см. приложение).
Таким образом, соотношения процессов BG , RG , BF , RF , DG , DF , S определяют значения функций G ( t ) и F ( t ) (см. приложение).
Все точечные (считающие) процессы, используемые в модели, являются неубывающими, поэтому представляют собой субмартингалы. Например, субмартингал BG =(BG) согласно тео- t реме Дуба — Мейера, допускает точное разложение BG = BG + MG , где BG = J b G (s)ds — ком-0
пенсатор, возрастающий процесс ограниченной вариации, MtG — мартингал.
При моделировании непрерывного точечного процесса BtG используется его дискретная модель, которая основана на следующем факте. Если компенсатор процесса BtG представим в t виде интеграла некоторой функции G (t): BG = J bGG (s)ds, то вероятность скачка процесса BtG 0
за малый промежуток времени Δ t равна:
P { B G + ы - B G = 1 } = b G G ( t ) A t + o ( A t ) , при A t ^ 0.
Поэтому процессы, построенные по последовательности случайных величин
~g L« J 1 1, с вер.
Δ tb G G i Δ t
1 - K tb G GiL t'
5, = 1,2,3,...:
В t = £ 5 ,, где 5 , =j
7 =1 1 0, с вер.
сходятся к распределениям процесса Bt при Д t ^ 0.
При моделировании использовался шаг дискретизации Д t = 0,001. Случайные величины 5(, i = 1,2,3,... строились с помощью генератора псевдослучайных чисел с периодом 2 48 .
Величина bGG (t) — интенсивность скачков (деления клеток) процесса BG. Это означает, что в момент t за малое время Д произойдет приблизительно bGG (s)• Д актов деления клеток.
Интенсивности скачков остальных точечных процессов в модели определяются параметрами rG , bF , rF , dG , dF и s соответственно. То есть для процесса RG интенсивность скачков имеет вид: rGG ( t ) , для процесса B F — bF F ( t ) и т. д.
Подобная конструкция позволяет построить модель эволюции культуры клеток с учётом рассматриваемых факторов, влияющих на изменение их состояний. Параметры модели имеют определённый биологический смысл и могут быть оценены в ходе анализа экспериментальных данных. Например, величины 1 и 1 имеют смысл средней продолжительности клеточного bG bF цикла в группах I и II соответственно. Параметры rG и rF представляют собой интенсивность повреждения свободными радикалами теломер клеток в группах I и II соответственно. Параметры dG и dF — средние скорости апоптоза клеток в группах I и II соответственно. Величина s — интенсивность утраты клетками теломеразной активности.
Обсуждение результатов моделирования. Компьютерное моделирование развития клеточной популяции позволило проследить динамику распределений клеток по длинам их теломер. При этом рассмотрены параметры, которые соответствуют предположениям о приоритете различных факторов, определяющих характер распределений. Таким фактором может быть, во-первых, регулярное укорочение теломер из-за недорепликации концов ДНК в процессе деления. Во-вторых, это случайные разрывы, происходящие вследствие нерепарации свободнорадикальных повреждений или, например, воздействия ионизирующей радиации. Так, в ходе моделирования была установлена линейная зависимость средней длины теломер клеток от концентрации свободных радикалов в ткани (см. выше параметры rG и rF ). Данный результат обобщает выводы, полученные в [17].
Заметим, что теломеры клеток человека и других млекопитающих укорачиваются в разных тканях с различной интенсивностью. Например, в печени при циррозах скорость укорочения возрастает при усилении пролиферативных процессов. При этом необходимо учитывать оба фактора укорочения теломер, что позволяет в процессе моделирования воспроизвести особенности реально наблюдаемых распределений.
В некоторых тканях основную роль в укорочении теломер может играть неспособность клеток репарировать свободнорадикальные повреждения. Поэтому основным фактором, определяющим динамику распределений клеток по длинам их теломер, является механизм случайных разрывов. Примером такой популяции клеток, адекватно моделируемой предложенным методом, являются диплоидные фибробласты человека [18].
Построенные распределения клеток по длинам их теломер сопоставлялись с экспериментальными данными, полученными на культурах фибробластов человека [18] с использованием метрики Леви — Прохорова. Данная вероятностная метрика используется в качестве критерия достоверности выбранных параметров с заданным значением ошибки е* :
-
е * = L ( F exp , F mod ) = inf { е > 0: F exp ( x - E ) - E < F mod ( x ) < F exp ( x + E ) + E, V x e R } , (1)
где F exp ( x ) — функция распределения популяции клеток по длинам теломер, построенная на основе экспериментальных данных; F mod ( x ) — функция распределения, полученная в результате компьютерного моделирования.
Использование данной метрики позволяет сравнивать эмпирические и модельные функции распределения и фиксировать те параметры, при которых отличие одной функции распределения от другой не будет превышать заранее заданную ошибку.
На рис. 1 представлено качественное соответствие характеров моделируемых и реальных экспериментальных распределений. Это свидетельствует о возможности применения и развития данного подхода к моделированию воздействий различных факторов на популяции клеток — в частности, на раковые клетки при действии лекарственных препаратов или ионизирующего излучения.
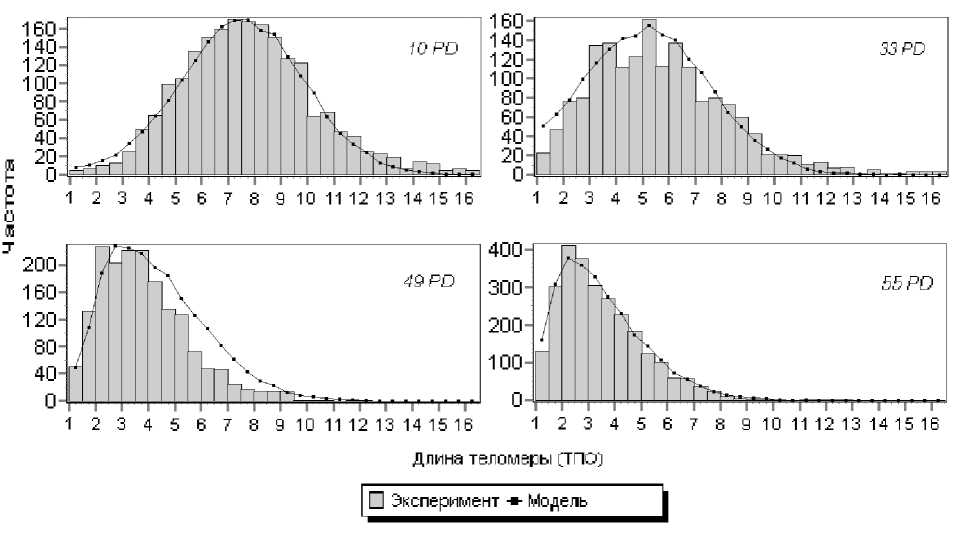
Рис. 1. Экспериментальная и модельная кривые распределений диплоидных фибробластов человека по длинам теломер (тысяч пар оснований — ТПО) для популяций различных возрастов
В табл. 1 представлены начальные данные и время моделирования. Выбор размерности параметров моделирования зависит от типа исследуемых клеток.
Итоги имитационного моделирования позволили установить, что данная модель явилась косвенным подтверждением физиологического объяснения предела Хейфлика. Определено среднее время достижения данного предела для популяции фибробластов человека. Выявлены зависимости распределения времени прекращения пролиферативной активности популяции клеток от их распределения по длинам теломер.
На самом деле предел Хейфлика трактуется в литературе достаточно примитивно, т. е. как определённое число делений клеток, после которого пролиферация прекращается. Однако, как показала и настоящая работа, развитие клеточной популяции представляет собой сложный процесс, природа которого стохастична. Если рассматривать вероятностную суть данного явления, то всегда присутствует некоторое распределение времени прекращения пролиферации клеток, т. е. её старения. Поэтому предел Хейфлика не чётко обозначен, и могут возникать различные эффекты продолжительности пролиферативной истории клеток в зависимости от параметров клеточной популяции и условий её развития (скорость деления клеток, величина укорочения теломеры при делении клетки, концентрация свободных радикалов в ткани и т. д.). Эти особенности можно наблюдать с помощью имитационного моделирования и предложенной математической модели. Так, в ходе моделирования были получены зависимости скорости роста популяции от концентрации свободных радикалов в ткани и от средней длины теломер клеток.
Таблица 1
Параметры имитационного моделирования процессов развития клеточной популяции
|
Параметр |
Группа, обозначение |
PD10 |
PD10 |
PD49 |
PD55 |
|
Начальное количество клеток |
I группа gk ( 0 ) k = 1,2, ..., M ( t ) |
4000 |
4000 |
4000 |
4000 |
|
II группа fk ( 0 ) k = 1,2, ^ , M ( t ) |
4000 |
4000 |
4000 |
4000 |
|
|
Интенсивность деления |
I группа b G |
0,158 |
0,151 |
0,161 |
0,163 |
|
II группа b F |
0,1485 |
0,153 |
0,163 |
0,173 |
|
|
Интенсивность гибели |
I группа d G |
0,18 |
0,18 |
0,18 |
0,18 |
|
II группа d F |
0,17 |
0,17 |
0,172 |
0,172 |
|
|
Интенсивность свободнорадикальных повреждений |
I группа r G |
10 -4 |
10 -4 |
10 -4 |
10 -4 |
|
II группа r F |
10-5 |
10-5 |
10-5 |
10-5 |
|
|
Интенсивность утраты клетками теломерной активности |
s |
0,11 |
0,11 |
0,11 |
0,11 |
|
Время |
T |
63 |
77 |
87 |
94 |
Заключение. В настоящей работе рассматривались модели, применимые к описанию и исследованию механизмов укорочения концевых структур ДНК — теломер. В качестве основы для моделей использовались стохастические дифференциальные уравнения. Цель настоящей работы — исследование на основе стохастического имитационного моделирования протекающих в клетках явлений, которые приводят к уменьшению длины теломер, следовательно, к снижению пролиферативного потенциала и возникновению различных патологий, в том числе онкологических. На основе данного исследования разработана математическая имитационная модель, которая позволяет не только вскрыть и качественно объяснить механизмы развития этих патологий, но и рассчитать их количественно — на основе анализа стохастических деградационных процессов теломер. Адекватность данной модели подтверждает сопоставление с экспериментальными данными, полученными на культурах фибробластов человека с использованием метрики Леви — Прохорова. Результаты работы могут найти применение в исследованиях старения и возникновения различных патологий, а также при решении ряда вопросов в области геронтологии.
Приложение. Подробное математическое описание модели. Пусть N ( t ) — общее число клеток в момент времени t в популяции, которая включает в себя клетки двух групп:
N ( t ) = G ( t ) + F ( t ) , (2)
где G ( t ) — число клеток с активной теломеразой; F ( t ) — число клеток, в которых данный фермент не действует.
Число клеток популяции, способных к восполнению теломерных участков при делении за счёт активности теломеразы, выражается равенством:
M ( t )
g ( t ) = z g k ( t ) . (3)
k =1
Здесь M ( t ) — максимальная (по всем клеткам популяции) длина теломеры в момент времени t . Она выражена в условных единицах, которые представляют собой среднее число пар оснований (ПО) нуклеотидов, теряемых вследствие «недорепликации» при делении клетки. Выражение gk ( t ) — число клеток с активной теломеразой (группа I), длина теломеры которых равна к .
Значение процесса g k ( t ) , к = 1,2,3, ..., M ( t ) в каждый момент времени t выражается следующим соотношением:
M ( t )
gk (t ) = gk (0) + Bk (t) + I RG,j - к (t)-Sk (t)-Dk (t), к = 1, j=k+1
k - 1 M ( t ) __________________
U ( t ) = g k ( 0 ) + B G ( t ) - I R G ( t ) + I R Gj - k ( t ) - S k ( t ) - D G ( t ) , k = 2, M ( t ) - 1, (4)
i = 1 j = k + 1
k gk (t) = gk (0) + BG (t) -1 RG (t) - Sk (t) - DG (t), k = M (t).
i = 1
Опишем подробнее каждое слагаемое в (4). Начальное количество клеток группы I с теломерой длиной k равно gk ( 0 ) . Процесс B k ( t ) , где k = 1,2, ..., M ( t ) , представляет собой число делений клеток с теломерой длиной k . Процесс R Gi ( t ) , где k = 1,2, ..., M ( t ) , i = 1,2, ..., k - 1, определяет число клеток, которые вследствие случайных повреждений свободными радикалами утратили участок теломеры длиной i . Поэтому общее число клеток, имевших теломеру длиной k , в которых укорочение произошло из-за свободнорадикальных повреждений, равно fx i ( t ) . Соответ- i = 1 '
ственно, число клеток, теломера которых имела длину, большую k , и уменьшилась до размера k M ( t )
вследствие случайных повреждений, равно I R iGi - k ( t ) .
i = k + 1 '
Процесс Sk ( t ) , k = 1,2, ..., M ( t ) представляет собой число клеток с активной теломеразой и длиной теломеры k , которые в ходе развития утратили действие данного фермента (перешли в число клеток группы II). Число апоптозов клеток группы I определяется процессом D G ( t ) , k = 1,2, ..., M ( t ) .
Аналогично определяется число клеток, утративших теломеразную активность (группа II): M ( t )
F ( t ) = j f k ( t ) , (5)
k = 1
где fk ( t ) — число клеток, длина теломеры которых равна k .
Соотношение, определяющее значения процесса fk ( t ) , имеет вид:
M ( t )
fk (t) = fk (0) + 2BF+1 (t)+ I RF j-k (t) + Sk (t)-DF (t), k = 1, j=k+1
k - 1 M ( t ) -------------------
^ f k ( t ) = f k ( 0 ) - B F ( t ) + 2 B F + 1 ( t ) - I R F ' i ( t ) + I R F j - k ( t ) + S k ( t ) - D F ( t ) , k = 2, M ( t ) - 1, (6) i = 1 j = k + 1
k fk (t) = fk (0) - Bk (t) - I RF' i (t) + Sk (t) - DF (t), k = M (t).
i = 1
Также приведём описание слагаемых в (6). Процесс B F ( t ) , где k = 1,2, „., M ( t ) , представляет собой число клеток, при делении которых происходит регулярное укорочение теломер двух образовавшихся дочерних клеток на одну условную единицу. То есть длина теломеры этих клеток уже 105
равна к - 1, и следовательно, выражение вычитается. Соответственно, число дочерних клеток, длина теломеры которых стала равной к после деления клеток с теломерой длиной к + 1, равно 2BL ( t ) .
Предполагается, что все клетки подвержены свободнорадикальным повреждениям, поэтому смысл значений процессов RiF , j аналогичен описанным выше процессам RiG , j .
Процесс Sk ( t ) также участвует в соотношении (4) и описан выше. Число апоптозов клеток группы II определяется процессом DFk ( t ) , к = 1,2, ..., M ( t ) .
Распределения всех описанных выше стохастических процессов, участвующих в построении математической модели, характеризуются своими компенсаторами*. Ниже приведены уравнения компенсаторов рассматриваемых процессов.
Компенсатор процесса, определяющего число делений клеток группы I, имеет вид: t
В к ( t ) = b G J g k ( t ) dt . (7)
Здесь b G > 0 — интенсивность деления клеток, задаваемая как регулируемый параметр модели.
Величина b1G имеет смысл средней продолжительности клеточного цикла клеток с активной те- ломеразой.
Компенсатор процесса, представляющего число случайных повреждений теломеры клеток, имеет вид:
t
R G i ( t ) = r G i J g k ( t ) dt ,
где rk Gi , к = 2,3, ..., M ( t ) , i = 1,2, ..., к - 1 — интенсивность свободнорадикальных повреждений теломер, которая пропорциональна концентрации свободных радикалов в клетках.
Компенсатор процесса, представляющего число клеток, утративших теломеразную активность, имеет вид:
t
S k ( t ) = s J д к ( t ) dt , (9)
где s — интенсивность перехода клеток из группы I в группу II.
Компенсатор процесса, считающего апоптозы клеток группы I, равен:
t
D ^ ( t ) = d G J д к ( t ) dt , (10)
где dG — интенсивность гибели клеток.
Аналогичный вид имеют компенсаторы точечных процессов в соотношении (6), которое описывает динамику изменений клеток группы II. Соответствующие интенсивности ( bF , riF , j , dF )
также являются изменяемыми параметрами модели.
Список литературы Стохастическое имитационное моделирование механизмов укорочения теломер клеток в процессах старения и развития патологических отклонений
- Blackburn, E.-H. Telomeres and telomerase: their mechanisms of action and the effects of altering their functions/E.-H. Blackburn//FEBS Letters. -2005. -Vol. 579. -Pp. 859-862.
- Blasco, M.-A. Telomere length, stem cells and aging/M.-A. Blasco//Nature Chemical Biology. -2007. -Vol. 3. -Pp. 640-649.
- Proteins induced by telomere dysfunction and DNA damage represent biomarkers of human aging and disease/H. Jiang [et al.]//Proceedings of the National Academy of Sciences of the United States of America. -2008. -Vol. 105. -Pp. 11299-11304.
- Sex hormones, acting on the TERT gene, increase telomerase activity in human primary hematopoietic cells/R.-T. Calado [et al.]//Blood. -2009. -Vol. 114. -Pp. 2236-2243.
- Calado, R.-T. Telomere Diseases/R.-T. Calado, N.-S. Young//The New England Journal of Medicine. -2009. -Vol. 361. -P. 2353-2365.
- Proctor, C.-J. Modelling telomere shortening and the role of oxidative stress/C.-J. Proctor, T.-B.-L. Kirkwood//Mechanisms of Ageing and Development. -2002. -Vol. 123. -Pp. 351-363.
- Sozou, P.-D. A stochastic model of cell replicative senescence based on telomere shortening, oxidative stress, and somatic mutations in nuclear and mitochondrial DNA/P.-D. Sozou, T.-B.-L. Kirkwood//Journal of Theoretical Biology. -2001. -Vol. 213. -Pp. 573-586.
- Rubelj, I. Stochastic mechanism of cellular aging -abrupt telomere shortening as a model for stochastic nature of cellular aging/I. Rubelj, Z. Vondracek//Journal of Theoretical Biology. -1999. -Vol. 197. -Pp. 425-438.
- Wein, L.-M. Estimation of replicative senescence via a population dynamics model of cells in culture/L.-M. Wein, J.-T. Wu//Experimental Gerontology. -2001. -Vol. 36. -Pp. 79-88.
- Arino, O. Mathematical modeling of the loss of telomere sequences/O. Arino, M. Kimmel, G.-F. Webb//Journal of Theoretical Biology. -1995. -Vol. 177. -Pp. 45-57.
- Tan, Z. Simulated shortening of proliferation-restricting telomeres during clonal proliferation and senescence of human cells/Z. Tan//Experimental Gerontology. -2001. -Vol. 36. -Pp. 89-97.
- Zglinicki, T. Stress, DNA damage and ageing -an integrative approach/T. Zglinicki, A. Burkle, T.-B.-L. Kirkwood//Experimental Gerontology. -2001. -Vol. 36. -Pp. 1049-1062.
- Blagoev, K. B. Telomere exchange and asymmetric segregation of chromosomes can account for the unlimited proliferative potential of ALT cell populations/K. B. Blagoev, E. H. Goodwin//DNA Repair. -2008. -Vol. 7. -Pp. 199-204.
- Qi, Q. Mathematical modelling of telomere Dynamics/Q. Qi//Thesis submitted to The University of Nottingham for the degree of Doctor of Philosophy. -Nottingham, 2011. -210 p.
- Grasman, J. Stochastic modelling of length dependent telomere shortening in Corvus monedula/J. Grasman, H.-M. Salomons, S. Verhulst//Journal of Theoretical Biology. -2011. -Vol. 282. -Pp. 1-6.
- Kapitanov, G. A. Mathematical Model of Cancer Stem Cell Lineage Population Dynamics with Mutation Accumulation and Telomere Length Hierarchies/G. A. Kapitanov//Mathematical Modelling of Natural Phenomena. -2012. -Vol. 7. -Pp. 136-165.
- Tchirkov, A. Role of oxidative stress in telomere shortening in cultured fibroblasts from normal individuals and patients with ataxia-elangiectasia/A. Tchirkov, P. M. Lansdorp//Human Molecular Genetics. -2003. -Vol. 12. -Pp. 227-232.
- Accumulation of short telomeres in human fibroblasts prior to replicative senescence/U.-M. Martens [et al.]//Experimental Cell Research. -2000. -Vol. 256. -Pp. 291-299.


