Сторожевые лимфатические узлы при злокачественных новообразованиях
Автор: Ермаков Анатолий Викторович, Сарибекян Эрик Карлович, Аблицова Наталья Валерьевна, Усов Федор Николаевич
Журнал: Злокачественные опухоли @malignanttumors
Рубрика: Собственные исследования
Статья в выпуске: 1 (22), 2017 года.
Бесплатный доступ
В работе нашли отражения предпосылки возникновения концепции, история развития лимфографии, а также современное представление о состоянии дел в свете изучения концепции сторожевого лимфатического узла при злокачественных новообразованиях. Статус регионарного лимфатического узла имеет диагностическое значение для определения интенсивности злокачественного роста, так как метастазирование опухоли к регионарным лимфатическим узлам представляет собой первый шаг распространения опухоли большинства злокачественных новообразований. Комбинация и усовершенствование двух методик визуализации позволяет идентифицировать сторожевой лимфатический узел практически во всех случаях, в том числе при локализации опухоли в участках с неясным направлением лимфооттока. При отрицательных данных гистологического исследования сторожевого лимфатического узла с большой степенью надежности можно говорить об отсутствии метастазов в других лимфатических узлах. Рутинное гистологическое исследование лимфатического узла необходимо дополнять проведением иммуногистохимического исследования. Лечебная лимфаденэктомия должны быть выполнена только при гистологическом и иммуно-гистохимическом обнаружении метастазов опухоли в удаленных лимфоузлах. При обнаружении микрометастазов в удаленном лимфатическом узле вопрос о преимуществе выполнения лимфаденэктомии требует дополнительного обсуждения.
Сторожевой лимфатический узел, метастазирование, лимфаденэктомия
Короткий адрес: https://sciup.org/140223029
IDR: 140223029 | DOI: 10.18027/2224-5057-2017-1-70-77
Текст научной статьи Сторожевые лимфатические узлы при злокачественных новообразованиях
Лимфатические узлы являются основными гомеостатиру-ющими органами внутренней среды организма [1]. В связи с тем, что их структурно-функциональный ответ на средовые влияния носит черты общей стереотипии, морфо-функциональный статус лимфатических узлов может быть маркером средового прессинга на лимфатическую систему [1, 2]. В современной концепции лимфатического региона для определения состояния дренируемого им органа большое прогностическое значение отводится структурно-функциональному состоянию лимфатического узла [3, 4].
Статус регионарного лимфатического узла имеет диагностическое значение и для определения интенсивности злокачественного роста, так как метастазирование опухоли к регионарным лимфатическим узлам представляет собой первый шаг распространения опухоли большинства злокачественных новообразований [5].
Одним из важных прогностических факторов метастазирования опухоли признан статус сторожевого лимфатического узла (Sentinel Lymph Node – SLN) [6–11].
ПРЕДПОСЫЛКИ ВОЗНИКНОВЕНИЯ КОНЦЕПЦИИ СТОРОЖЕВЫХ ЛИМФАТИЧЕСКИХ УЗЛОВ
Начало хирургической дискуссии о целесообразности профилактического удаления клинически неизмененных регионарных лимфатических узлов, в частности, при меланоме кожи было положено H. Snow в 1892 году после публикации своей работы Melanotic cancerous disease в журнале Lancet [12]. Он предполагал, что раннее иссечение «инфицированных» лимфатических узлов будет предупреждать последующее распространение опухоли во внутренние органы и, таким образом, способствовать излечению пациентов. В связи с этим на протяжении десятилетий во многих онкологических клиниках проводилась так называемая профилактическая регионарная лимфо-диссекция. Показанием к ее проведению была толщина меланомы кожи по Breslow от 1 до 4 мм, так как при толщине опухоли менее 1 мм выживаемость больных приближалась к 98%, а толщина более 4 мм ассоциировалась с преимущественным развитием отдаленных гематогенных метастазов.
Сторонники профилактической лимфодиссекции настаивали на ее прогностическом значении, так как от количества вовлеченных в опухолевый процесс лимфатических узлов зависит общая выживаемость больных, и ретроспективно демонстрировали повышение общей 5-летней выживаемости среди пациентов, подвергшихся профилактической лимфодиссекции по сравнению с отсроченной (терапевтической) лимфодиссекцией. Противники данного вмешательства отмечали, что в 80% случаев гистологи в удаленных тканях не находили метастазов опухоли, то есть объем операции превышал необходимый. Кроме того, регионарная лимфодиссекция сопровождается большим числом осложнений: лимфостазом, болью, парестезиями, косметическим дефектом [13]. В ряде исследований 70–80-х годов было показано ее преимущество, однако эти исследования были ретроспективными и не учитывали ряд прогностических факторов. Следует отметить, что в двух исследованиях (Duke University, 1983 и Sydney Melanoma Unit, 1985) вначале было сообщено о преимуществе профилактической лимфодиссекции для меланомы средней толщины, однако через 10 лет эти данные были опровергнуты самими авторами [14].
|
Таблица 1. Результаты исследований по профилактической лимфодиссекции |
||
|
Исследование |
Дизайн |
Результаты |
|
Memorial Sloan-Kettering, 1975 |
Ретроспективное |
Преимущество для меланомы средней толщины |
|
Duke University, 1983 |
Ретроспективное |
Преимущество для меланомы средней толщины |
|
Sydney Melanoma Unit, 1985 |
Ретроспективное |
Преимущество для меланомы средней толщины |
|
University of Pennsylvania, 1983 |
Ретроспективное |
Нет преимущества |
|
Duke University, 1994 |
Ретроспективное |
Нет преимущества |
|
Sydney Melanoma Unit, 1995 |
Ретроспективное |
Нет преимущества |
|
World Health Organization, 1977 |
Проспективное |
Нет преимущества |
|
Mayo clinic, 1986 |
Проспективное |
Нет преимущества |
|
Intergroup melanoma, 1996 |
Проспективное |
Нет преимущества, кроме больных с меланомой 1–2 мм и моложе 60 лет |
Целесообразность профилактической лимфодиссекции обсуждалась на протяжении многих лет (табл. 1).
В 1994 г. C. Slingluff и соавторы [15] опубликовали данные ретроспективного анализа хирургического лечения 4682 больных меланомой кожи, среди которых 911 пациентов подверглись профилактической лимфодиссек-ции. Только у 143 (16%) были выявлены метастазы в регионарных лимфатических узлах непосредственно после оперативного вмешательства, у 71 (7,8%) больного метастазы появились в отсроченный период. В 90-х годах были опубликованы результаты четырех рандомизированных исследований по изучению влияния профилактической лимфодиссекции на общую выживаемость больных меланомой кожи. Ни одно из этих исследований не показало преимущество ее выполнения. Однако в одном из них (WHO-14) было продемонстрировано повышение общей выживаемости больных, подвергшихся профилактической лимфодиссекции, у которых были обнаружены метастазы в регионарных лимфатических узлах, по сравнению с больными, которым была выполнена отсроченная (терапевтическая) регионарная лимфодиссекция после появления клинических признаков метастазирования. Эти данные свидетельствовали в поддержку так называемой концепции биопсии сторожевого лимфатического узла как идеального метода стадирования меланомы кожи и гипотезы о потенциальном влиянии на общую выживаемость путем выполнения регионарной лимфодиссекции у больных с метастазами в сторожевой лимфатический узел.
ИСТОРИЯ РАЗВИТИЯ ЛИМФОГРАФИИ И БИОПСИИ СТОРОЖЕВОГО ЛИМФАТИЧЕСКОГО УЗЛА
История лимфографии началась в XIX столетии, когда известный французский анатом Marie Philibert Constant Sappey в 1874 году опубликовал анатомический атлас, который включал подробное исследование кожного лимфатического дренажа. Он разработал процедуру для определения и разграничения лимфатической системы путем введения ртути в кожу трупа, чтобы получить возможность прослеживать отдельные лимфатические сосуды [16]. Лимфосцинтиграфию описали Sherman A. I., Ter-Pogossian M. в 1953 году, подтвердив гипотезу Sappey о том, что отток лимфы из органа имеет упорядоченный характер и его можно предсказать [17]. Следующим большим шагом в этой области было применение принципов лимфографии при меланоме у пациенток с раком молочной железы в онкологическом центре Джона Вейна (John Wayne Cancer Center). Их успех привел к революции в лечении пациентов с солидными новообразованиями любой локализации, бросив вызов старой концепции прогностического и терапевтического значения традиционной лимфаденэктомии при злокачественных опухолях. В 1998 году эта группа исследователей опубликовала результаты использования концепции сторожевого узла при опухолях пищеварительного тракта, щитовидной железы, гинекологических опухолях и плоскоклеточном раке головы и шеи. Сторожевой узел удалось выявить у 96% данных пациентов, что было стимулом для широкого применения метода в других центрах при различных опухолях. Несмотря на технические отличия методики локализации узла при различных локализациях опухолей, общие принципы остаются неизменными. Малоинвазивная операция биопсии сторожевого узла позволяет получить оптимальное количество ткани для гистологического исследования, что в свою очередь является источником новой и ценной информации для определения стадии и прогноза (табл. 2).
В 1977 году R. M. Cabanas предложил концепцию сторожевого лимфатического узла после того, как ему удалось идентифицировать первый лимфатический узел, через который оттекала лимфа от опухоли полового члена. Изучив данные лимфангиографии и анатомические сре-
Таблица 2. Показатели частоты локализации, ложно-отрицательных результатов и частоты увеличения стадии при биопсии сторожевого лимфатического узла (СЛУ) при различных эпителиальных опухолях
НД – нет данных
* Процент пациентов, у которых исследование СЛУ приводит к увеличению стадии заболевания, чего бы не случилось при использовании традиционных методов определения стадии
** Пациенты имели метастазы в лимфатические узлы средостения, которые были выявлены при лимфографии
зы удаленных регионарных лимфатических узлов у 100 больных раком полового члена, он высказал предположение о существовании «лимфатического центра», в который в первую очередь осуществляется отток лимфы из определенных участков ткани [18]. Он предложил гипотезу, что в случае лимфогенного метастазирования опухоли вероятность появления метастаза наиболее высока в сторожевом лимфатическом узле. Гипотеза была также подтверждена путем сопоставления результатов гистологического исследования сторожевого лимфатического узла с отдаленными результатами. У 40 пациентов с раком полового члена без вовлечения сторожевого лимфатического узла исследователь засвидетельствовал 90% выживаемость, что значительно выше, нежели у пациентов с метастазами в лимфоузлах [18]. Труды R. M. Cabanas стали основой современной методики интраоперационного выявления сторожевого лимфатического узла при помощи лимфографии с применением синего красителя и радиоактивного коллоида серы, тогда как выраженная корреляция между результатом гистологического исследования сторожевого лимфатического узла и прогнозом заболевания вызвала заинтересованность среди врачей и мотивировала дальнейшие исследования методики при различных опухолях. Тем не менее метод лимфангиографии, предложенный R. M. Cabanas, не получил широкого применения в практике, поскольку был дорогим, технически сложным и не всегда информативным.
В 1977 году Е. Holmes [19] сообщил об успешном применении предоперационной лимфосцинтиграфии для идентификации регионарных лимфатических узлов у 32 больных меланомой кожи. Во время исследования на лимфосцинтиграммах отмечалось накопление изотопа в одном или нескольких лимфатических узлах, ко- торые получили название сторожевых. Было высказано предположение, что так как сторожевой лимфатический узел является первым регионарным лимфоузлом, получающим лимфу от первичной опухоли, то в него в первую очередь попадают опухолевые клетки при распространении по лимфатическим путям. Следовательно, биопсия сторожевого лимфатического узла может быть использована для оценки поражения всего регионарного лимфатического коллектора. Целесообразность лимфо-графии при меланоме основана на гипотезе последовательного и прогнозированного метастазирования меланомы в регионарные лимфатические узлы. Согласно биологическому определению, сторожевой лимфатический узел всегда будет первым узлом, в котором появятся метастазы, то есть клетки опухоли никогда не пройдут мимо этого узла в процессе метастазирования. Признание этой концепции не только изменило тактику лечения, но и привело к переоценке онкологического подхода к лечению пациентов с меланомой в целом.
В 1990 году Morton D. L. представил на Обществе хирургов-онкологов первые результаты клинического исследования, в котором для визуализации сторожевого лимфатического узла использовался специальный лимфотропный краситель «Isosulfan blue due». Было установлено, что сторожевые лимфатические узлы окрашиваются через 30–60 мин после введения препарата по периметру опухоли, что делало возможным использовать предложенный метод непосредственно перед операцией. Morton D. L. и соавт. описали методику введения синего красителя вокруг опухоли перед операцией для визуализации сторожевого лимфатического узла и лимфатического протока. Morton D. L. и соавт. впервые применили концепцию сторожевого лимфатического узла при меланоме кожи у больных различной локализации в 1992 году, надеясь избавить пациентов с отрицательным статусом лимфатических узлов (около 80% больных) от необходимости проведения плановой лимфаденэктомии. Правильность гипотезы была засвидетельствована путем сравнения результатов биопсии и гистологического исследования сторожевого лимфатического узла с состоянием остальных узлов коллектора, удаляемых для контроля. Ранние результаты были отличными – практически не было обнаружено «скачущих» метастазов, и частота ложно-отрицательных результатов была низкой [20]. Со временем Morton D. L. c соавт. [21] и другие исследователи независимо подтвердили эти результаты [22, 23]. При помощи синего красителя им удалось идентифицировать сторожевые лимфатические узлы в 194 из 237 лимфатических бассейнов. Все больные после биопсии сторожевого лимфатического узла подверглись регионарной лимфодис-секции, при гистологическом исследовании метастазы были выявлены: у 40 пациентов (21%), при этом у 38 – в СЛУ, и только в двух несторожевых из общего количества 3000 исследуемых лимфатических узлов. Такая стратегия была эффективной у большинства пациентов, однако имела также ряд недостатков. Во-первых, при такой лимфографии необходимо было выполнять большой разрез кожи для возможности обзора всего коллектора, включая сторожевой лимфатический узел и лимфатический проток. Во-вторых, она не позволяла хирургу идентифицировать сторожевой лимфатический узел в реальном времени и у него не было информации относительно полноты биопсии сторожевого лимфатического узла.
Понимание этих недостатков заставило Алекса и Крага (Alex J. C., Krag D. N.) впервые применить сочетание предоперационной лимфосцинтиграфии и гамма-детектора во время операции. Следующим шагом явилось внедрение в практику портативного гамма-сканера для интраоперационного поиска сторожевого лимфатического узла, который был описан Alex J. C. в моделях на животных. В 1993 году Алекс и Краг (Alex J. C., Krag D. N.) описали методику лимфографии при меланоме с использованием ручного гамма-детектора для более точной локализации радиоактивного коллоида Tc99 в сторожевом лимфатическом узле [24]. Исследователи отметили значительные преимущества радиоактивного маркера: меньшая продолжительность процедуры, возможность ее проведения хирургами с минимальным опытом работы в этой области и меньшая инвазивность по сравнению с использованием только синего красителя. Они открыли уникальные преимущества интраоперационного использования гамма-детектора: (1) возможность точной локализации узла через кожу, (2) упрощение поиска узла во время биопсии, (3) возможность быстрого опреде- ления точности биопсии, (4) возможность выявления дополнительных сторожевых лимфатических узлов, (5) выполнение биопсии через маленький кожный разрез и (6) упрощение операции и уменьшение ее продолжительности. Клиническое же использование данного метода было представлено в 1994 году R. Essner с соавт. обществу хирургов-онкологов. При этом предоперационная лимфосцинтиграфия осуществлялась при помощи стационарного гамма-томографа, а интраоперационный поиск сторожевого лимфатического узла – при помощи портативного гамма-сканера. Важным преимуществом метода явилась возможность определять расположение сторожевого лимфатического узла непосредственно через кожу. Кроме того, стало возможным контролировать локализацию узла при разрезе тканей, а также удостовериться, что удален действительно сторожевой лимфатический узел по степени накопления в нем радиофармпрепарата, определяемого гамма-датчиком.
Комбинация двух методик визуализации впоследствии позволила Албертини (Albertini J. J. et al. 1996) идентифицировать сторожевой лимфатический узел практически у всех пациентов с меланомой, в том числе при локализации опухоли в участках с неизвестным направлением лимфооттока [25]. Со временем обе методики локализации узла были объединены и усовершенствованы [26], вследствие чего частота ложно-отрицательных результатов уменьшилась до уровня, позволившего внедрить метод в других медицинских центрах.
ВИЗУАЛИЗАЦИЯ И ИДЕНТИФИКАЦИЯ СТОРОЖЕВОГО ЛИМФАТИЧЕСКОГО УЗЛА
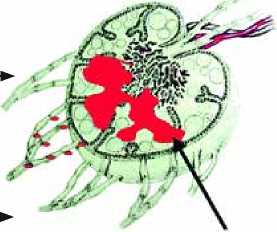
Для визуализации сторожевого узла применяется ультразвуковое исследование, предоперационная лимфосцинтиграфия (подкожное введение коллоидной взвеси сульфата 99mTc с последующей визуализацией лимфоузлов при помощи портативного гамма-детектора) и, непосредственно в момент биопсии, используются специальные красители (рис. 2). Лучшими из них оказались patent blue-V (Laboratoire Guerbert, France) и usosulfan blue (1% in aqueouse solution, Zenith Parenterals, Rosemont, III). Примерно через 5 мин после подкожного введения вокруг раны после иссечения первичной опухоли препарат с током лимфы достигает зоны регионарных лимфатических узлов, при этом сначала накапливаясь в сторожевом лимфоузле [27], который удаляется из небольшого разреза.
Рутинное гистологическое исследование удаленного препарата дополняется проведением иммуногистохимического исследования. Если в данном лимфатическом узле обнаруживаются микрометастазы меланомы, то
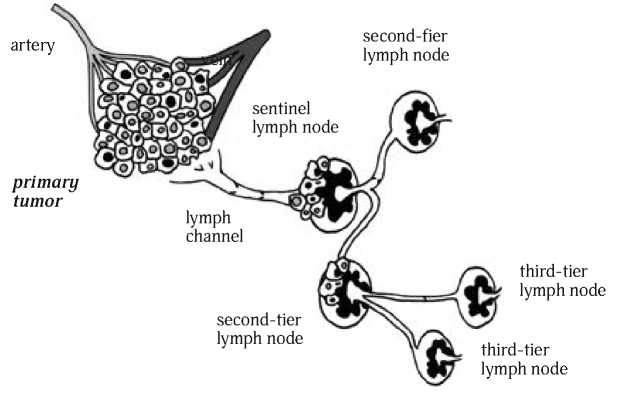
Рис. 1. Схематичная концептуализация сторожевого лимфатического узла. Первый узел дренирует первичную опухоль. Последующие группы лимфатических узлов получают лимфу и возможно опухолевые клетки от сторожевого лимфатического узла (Mariani G. et al., 2001) [27]. Концепция сторожевого лимфатического узла разработана Morton et al. [23]. Основанием для SLN [22] послужили данные о том, что отток лимфы от первичной меланомы по направлению к регионарным лимфатическим узлам всегда идет через первый на этом пути лимфатический узел (или несколько узлов)
efferent lymph and vascular hilus
afferent lymph
sinusoid spaces
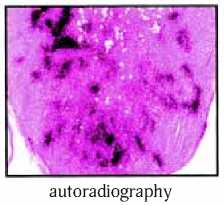
Рис. 2. Визуализация сторожевого лимфатического узла при введении коллоидной взвеси сульфата 99mTc и авторадиографии (Mariani G. et al., 2001) [27]
Blue dye containing carbon particles enters lymph node
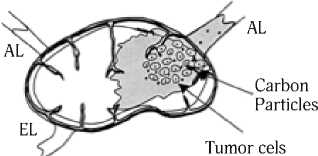
Blue dye exits lymph node but carbon particles remain near tumor cels
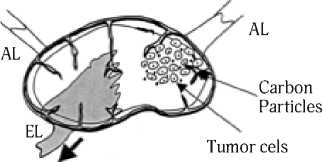
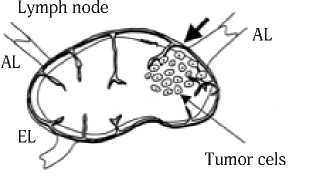
Рис. 3. Пути перемещения синего красителя, содержащего частицы углерода. Краситель проходит через узел, а частицы углерода депонируются в области вхождения афферентного лимфатического сосуда (AL). Присутствие этих углеродных частиц подтверждает статус сторожевого лимфатического узла и идентифицирует наиболее вероятную область в пределах узла для накопления опухолевых клеток. EL – выносящий лимфатический сосуд (Cochran A. J. et al., 2004) [33]
больному производится выборочная регионарная лим-фодиссекция щадящего объема в зоне регионарного метастазирования или стандартная лимфаденэктомия [28, 29]. По данным D. Morton [22], при отрицательных данных гистологического исследования сторожевого узла можно с большой степенью надежности говорить об отсутствии метастазов в других лимфатических узлах и, следовательно, необходимость в профилактической лимфаденэктомии отпадает. Лечебная лимфаденэктомия в этом случае проводится только при гистологическом и иммуно-гистохимическом обнаружении метастазов опухоли в удаленных лимфоузлах [30–32]. В качестве маркера сторожевого лимфатического узла применяют частицы углерода [33]. Поскольку сторожевой лимфатический узел получает лимфу от первичной опухоли, то, по мнению авторов [33], использование инертного маркера типа углерода может указать, какая часть этого узла является наиболее вероятным участком метастазирования клетками опухоли. Было показано, что введенные с синим красителем частицы углерода накапливаются исключительно в подкапсульном синусе и в лимфоидной ткани в области вхождения афферентного лимфатического сосуда в сторожевом лимфатическом узле (рис. 3). Однако данная метка не может быть применена, если пациент имеет постоянную татуировку, расположенную по ходу лимфатического дренажа, потому что частицы углерода от татуировки часто мигрируют к регионарным лимфатическим узлам [33].
ЗАКЛЮЧЕНИЕ
-
1. Согласно биологическому определению, сторожевой лимфатический узел всегда будет первым узлом, в котором появятся метастазы, то есть клетки опухоли никогда не пройдут мимо этого узла в процессе метастазирования и, следовательно, биопсия сторожевого лимфатического узла может быть использована для оценки поражения всего регионарного лимфатического коллектора.
-
2. Комбинация и усовершенствование двух методик визуализации позволяет идентифицировать сторожевой лимфатический узел практически у всех пациентов, в том числе при локализации опухоли в участках с неясным направлением лимфооттока.
-
3. При отрицательных данных гистологического исследования сторожевого лимфатического узла можно с большой степенью надежности говорить об отсутствии метастазов в других лимфатических узлах. В таких случаях необходимость в профилактической лимфаденэктомии отпадает. Лечебная лимфаденэктомия должна быть выполнена только при гистологическом и иммуно-гистохимическом обнаружении метастазов опухоли в удаленных лимфоузлах.
-
4. Рутинное гистологическое исследование удаленного препарата необходимо дополнять проведением иммуногистохимического исследования. При обнаружении микрометастазов в удаленном лимфатическом узле вопрос о преимуществе выполнения лимфаденэктомии требует дополнительного обсуждения.
Список литературы Сторожевые лимфатические узлы при злокачественных новообразованиях
- Бородин Ю. И. Экологическая лимфология: морфофункциональная характеристика лимфатической системы//Бюлл. СО РАМН.-1989 -N3. С. 5-11.
- Бородин Ю. И. Лимфатический узел как маркер средового прессинга на биосистему//Бюлл. СО РАМН.-1993 -N2. С. 3-10.
- Бородин Ю. И. Регионарный лимфатический дренаж и лимфодетоксикация//Морфология.-2005.-N40 -С. 25-28.
- Бородин Ю. И. Лимфология в Сибири: некоторые итоги и перспективы//Бюлл. СО РАМН.-2007 -N2.-С. 54-59.
- Ахметов И. Р., Важенин А. В., Привалов А. В., Анищенко И. С. Меланома кожи: тактика хирургического лечения в отношении регионарных лимфатических узлов (обзор литературы)//Сибирский онкологический журнал.-2006.-№ 3.-С. 68-73.
- Leong S. P., Stemmetz I., Habib A. et al. Optimal selective sentinel lymph node dissection in primary malignant melanoma//Arch. Surg. 1997. Vol. 132. P. 666-673.
- Buzaid A. C., Balch C. M. Prognostic Factors and the New American Joint Committee on Cancer Staging System for Cutaneous Melanoma//Thirty-Eighth Annual Meeting May 18-21. Orlando, 2002. P. 421-427.
- Aihara T., Munakata S., Morino H., Takatsuka Y. Comparison of Frozen Section and Touch Imprint Cytology for Evaluation of Sentinel Lymph Node Metastasis in Breast Cancer//Annals of Surgical Oncology, 2004.-Vol.11.-N.8.-P. 747-750.
- Newman E. A., Sabel M. S., Nees A. V., Schott A., Diehl K. M., Cimmino V. M., Chang A. E., Kleer C., Hayes D. F., Newman L. A. Sentinel Lymph Node Biopsy Performed After Neoadjuvant Chemotherapy is Accurate in Patients with Documented Node-Positive Breast Cancer at Presentation//Annals of Surgical Oncology. 2007.-Vol.14.-P. 2946-2952.
- Tsujimoto M., Nakabayashi K., Yoshidome K., Kaneko T., Iwase T., Akiyama F., Kato Y., Tsuda H., Ueda Sh., Sato K., Tamaki Y., Noguchi Sh., Kataoka T. R., Nakajima H., Komoike Y., Inaji H., Tsugawa K., Suzuki K., Nakamura S., Daitoh M., Otomo Y., Matsuura N. One-step Nucleic Acid Amplification for Intraoperative Detection of Lymph Node Metastasis in Breast Cancer Patients//Clinical Cancer Research. 2007.-Vol.13.-P. 4807-4816.
- Snow H. (1892) Melanotic cancerous disease. Lancet., 2: 872.
- Пак Д. Д., Лазутина Т. Н. (2008) Определение сторожевых лимфатических узлов при лечении больных меланомой кожи. Сибирский онкологический журнал, 1 (25): 23-28.
- de Vita V. T., Lawrence T. S., Rosenberg S. A. (2011) Cancer: Principles and Practice of Oncology. 8th ed.Wolters Kluwer, Health., 3035 p.
- Slingluff L. J., Stidham K. R., Ricci W. M. et al. (1994) Surgical management of regional lymph nodes in patients with melanoma. Experience with 4682 patients. Ann. Surg. Oncol., 2(219): 120-130.
- Sappey M. P.C. Anatomie, physiologie, pathologie des vaisseaux lymphatiques considerees chez l'homme et les vertebres. Paris, A. Delahaye & E. Lacrosnier, 1874.
- Sherman A. I., Ter-Pogossian M. 1953. Lymph-node concentration of radioactive colloidal gold following interstitial injection. Cancer 6:1238-1240.
- Cabanas R. M. (1977) An approach for the treatment of penile carcinoma. Cancer., 39: 456-465.
- Holmes E. C., Moseley H. S., Morton D. L. et al. (1977) A rational approach to the surgical management of melanoma. Ann. Surg., 186: 481-490.
- Morton D. L. Technical details of intraoperative lymphatic mapping for early stage melanoma//Arch. Surg. 1992. Vol. 127 P.-392-399.
- Morton D. L., Thompson J. F., Essner R. H. (1999). Validation of the accuracy of intraoperative lymphatic mapping and sentinel lymphadenectomy for early-stage melanoma: a multicenter trial. Multicenter Selective Lymphadenectomy Trial Group. Ann. Surg., 4 (230): 453-63.
- Morton D. L., Thompson J. F., Alistair J. (2006). Sentinel Node Biopsy or Nodal Observation in Melanoma. N. Engl. J. Med., 13(355): 1307-1317.
- Morton D. L., Hoon D. S., Cochran A. J. et al. (2003). Lymphatic mapping and sentinel lymphadenectomy for early-stage melanoma: therapeutic utility and implications of nodal microanatomy and molecular staging for improving the accuracy of detection of nodal micrometastases. Ann Surg., 4(238): 538-549.
- Alex J. C., Krag D. N. (1993) Gamma-probe guided localization of lymph nodes. Surg. Oncol., 3 (2): 137-143.
- Albertini J. J., Cruse C. W., Rapaport D. et al. Intraoperative radiolymphoscintigraphy improves sentinel lymph node identification for patients with melanoma. Ann Surg. 1996; 223:217-224.
- Albertini J. J., Cox C., Yeatman T. et al. Lymphatic mapping and sentinel node biopsy in the patient with breast cancer -1996.-Vol.3.-P. 235-340.
- Mariani G., Moresco L., Viale G. et al. Radioguided Sentinel Lymph Node Biopsy in Breast Cancer Surgery//Journal of Nuclear Medicine.-b2001.-Vol. 42.-No. 8.-P. 11981215.
- Jiao X., Eslami A., Ioffe O., Kwong K. F., Henry M., Zeng O., Refaely Y., Burrows Wh., Gamliel Z., Krasna M. J. Immunohistochemistry analysis of micrometastasis in pretreatment lymph nodes from patients with esophageal cancer//Ann Thorac Surg. 2003.-Vol.76.-P. 996-1000.
- Menes T. S., Tartter P. I., Mizrachi H., Smith Sh.R., Estabrook A. Touch Preparation or Frozen Section for Intraoperative Detection of Sentinel Lymph Node Metastases From Breast Cancer//Annals of Surgical Oncology. 2003.-Vol.10.-N10.-P. 1166-1170.
- Cascinelli N., Morabito A., Santinami M. et al. (1998) Immediate or delayed dissection of regional nodes in patients with melanoma of the trunk: a randomised trial. WHO Melanoma Programme. Lancet., 351: 793-796.
- Cook M. G., Palma S. D. (2008) Pathology of sentinel lymph nodes for melanoma. J. Clin. Pathol., 61: 897-902.
- Dewar D. J., Newell.B., Green M. A. et al. (2004) The Microanatomic Location of Metastatic Melanoma in Sentinel Lymph Nodes Predicts Nonsentinel Lymph Node Involvement. J. Clin. Oncol., 22: 3345-3349.
- Cochran A. J., Roberts A., Wen D.R., Huang R.R., Itakura E., Luo F., Binder S. W. Optimized Assessment of Sentinel Lymph Nodes for Metastatic Melanoma: Implications for Regional Surgery and Overall Treatment Planning//Annals of Surgical Oncology. 2004.-Vol.11.-P. 156S-161.


