Стратегия разработки таргетных препаратов для терапии HER2-позитивного рака молочной железы
Автор: Боденко В.В., Ларькина М.С., Третьякова М.С., Белоусов М.В., Чернов В.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Обзоры
Статья в выпуске: 3 т.24, 2025 года.
Бесплатный доступ
Цель исследования – определить современные стратегии, достижения и проблемы в разработке таргетных HER2-направленных терапевтических конъюгатов и текущие клинические результаты терапии на их основе. Материал и методы. Изучено 247 литературных источников в пределах 7 лет, из которых для обзора отобрано 60. Поиск источников проведен в информационных базах данных Scopus (n=35), PubMed (n=121), WOS (n=91). Для получения полнотекстовых документов использованы электронные ресурсы PubMed Central (PMC), Science Direct, Research Gate. Результаты. Перспективность применения терапевтических HER2-направленных конъюгатов клинически подтверждена для таких препаратов, как трастузумаб эмтанзин (T-DM1, Kadcyla®), трастузумаб дерукстекан (T-DXd, Enhertu®). Разработка новых HER2-направленных конъюгатов включает ряд подходов, направленных на улучшение характеристик препаратов и повышение эффективности терапии: увеличение аффинности связывания с мишенью, одновременное блокирование двух доменов HER2, различные механизмы цитотоксического воздействия на опухолевую клетку (ингибирование тубулина, РНК-полимеразы II, ДНКтопоизомеразы I, повреждение ДНК), увеличение соотношения цитотоксических агентов на молекулу антитела, использование «эффекта свидетеля», повышение стабильности конъюгата в кровотоке. На стадии клинических исследований изучаются такие препараты, как трастузумаб дуокармазин (SYD985), Диситамаб ведотин (RC48, Aidixi®), Занидатамаб зоводотин (ZW49), ARX788, MRG002. Заключение. Совершенствование конструкции и понимание нюансов взаимодействия таргетных конъюгатов и опухоли способствуют новым клиническим успехам, что может обеспечить не только преимущество в выживании по сравнению с традиционной терапией, но и значительно улучшить качество жизни пациентов с HER2-положительным статусом.
Рак молочной железы, анти-HER2 терапия, таргетный конъюгат, цитотоксический агент, трастузумаб эмтанзин, трастузумаб дерукстекан, трастузумаб дуокармазин
Короткий адрес: https://sciup.org/140310581
IDR: 140310581 | УДК: 618.19-006.6:615.277.3:615.065 | DOI: 10.21294/1814-4861-2025-24-3-135-148
Текст научной статьи Стратегия разработки таргетных препаратов для терапии HER2-позитивного рака молочной железы
Рак молочной железы (РМЖ) представляет собой гетерогенное заболевание, включающее в себя молекулярные подтипы c различными гистологическими моделями, паттернами развития и прогрессирования. Активация мутаций HER2 является ранним событием онкогенеза молочной железы, приводящим к гиперэкспрессии HER2 у 20–25 % больных РМЖ. В результате амплификации гена HER2/neu или нарушения регуляции транскрипции РМЖ может иметь до 50 копий гена HER2 и достигать 100-кратного увеличения экспрессии белка HER2, что приводит к появлению 2–10 млн рецепторов, экспрессируемых на поверхности опухолевых клеток [1]. При этом гиперэкспрессия HER2, в дополнение к усилению передачи сигналов посредством лиганд-зависимой гетеродимеризации, приводит к лиганд-независимой димеризации рецептора и аномальной передаче сигналов. В результате аномальных молекулярных взаимодействий HER2-положительный статус способствует развитию агрессивных фенотипов заболеваний, сокращению общей выживаемости пациентов, а также устойчивости к химиотерапии, гормональной и лучевой терапии. HER2-положительный статус способствует метастазированию и повышает вероятность рецидива заболевания [2].
Клиническое значение диагностики HER2-положительного подтипа РМЖ изменилось с момента появления анти-HER2-таргетной терапии. Повышенная экспрессия HER2 при РМЖ несет важную прогностическую информацию, которая позволяет использовать таргетную анти-HER2-направленную терапию, способную улучшить результаты лечения. Наличие побочных эффектов, первичная и приобретенная резистентность являются основными ограничениями такого лечения. Еще одной проблемой, препятствующей применению анти-HER2-направленной терапии в монорежиме, является гетерогенность опухоли, когда клетки с гиперэкспрессией рецепторов HER2 соседствуют с HER2-отрицательными [3]. Вследствие этого сохраняется актуальность продолжения исследований, направленных на создание таргетных лекарственных препаратов для лечения опухолей с HER2-положительным статусом.
Стратегия разработки таргетных препаратов для терапии HER2-позитивных злокачественных новообразований
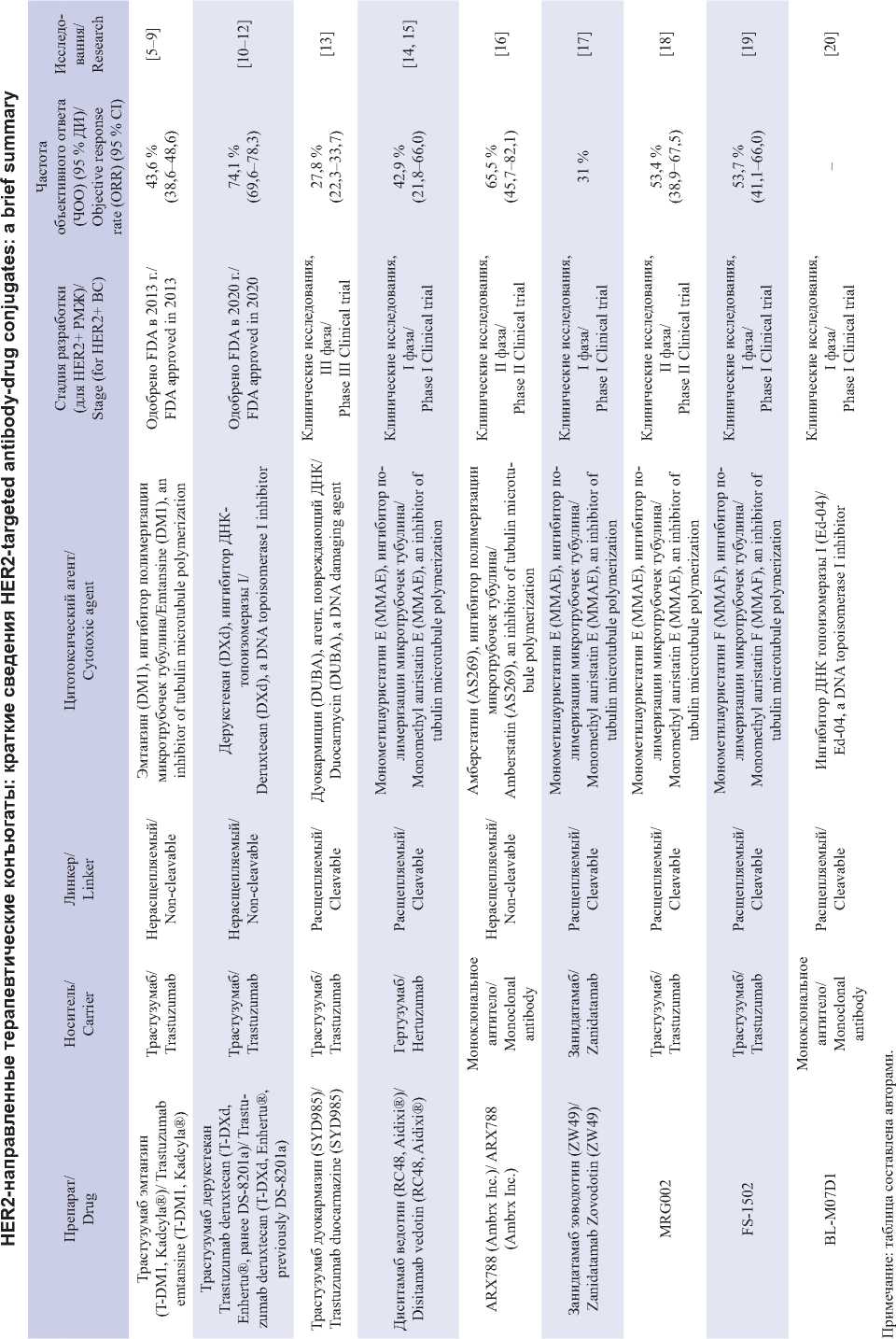
Технологическим прорывом в таргетной анти-HER2-терапии стали конъюгаты моноклональных антител (мкАТ) с цитотоксическими агентами (таблица), первым из которых стал трастузумаб эмтанзин. Если ранее в таргетной терапии целевая мишень рассматривалась только как биологический переключатель, включаемый или выключаемый с помощью антител и низкомолекулярных ингибиторов тирозинкиназы, то на данный момент мишень рассматривается в качестве якоря для стыковки и связывания с конъюгатами, несущими цитотоксический агент и способными не просто ингибировать нижестоящую передачу сигналов, но и приводить к гибели целевой опухолевой клетки, а для определенных препаратов и соседствующих опухолевых клеток. Перспективность данного подхода для HER2-положительного РМЖ клинически подтверждена для таких препаратов, как трастузумаб эмтанзин, трастузумаб дерукстекан [4].
Разработка новых HER2-направленных конъюгатов включает различные подходы, направленные на улучшение характеристик препаратов и повышение эффективности терапии: увеличение аффинности связывания с мишенью, одновременное блокирование двух доменов HER2, различные механизмы цитотоксического воздействия на опухолевую клетку, увеличение соотношения цитотоксических агентов на молекулу антитела, использование «эффекта свидетеля», повышение стабильности конъюгата в кровотоке. Данные подходы позволяют снижать токсические эффекты, являются способом воздействия на опухоли с развившейся резистентностью к лечению и расширяют спектр использования препаратов при различных уровнях экспрессии HER2 [4]. За последние 30 лет разработан достаточно широкий спектр новых линкеров, цитотоксических агентов и стратегий конъюгации [21]. К сожалению, немногие из них дошли до применения в клинической практике. Это демонстрирует степень сложности оптимизации ключевых параметров таргетных конъюгатов. В данном обзоре мы попытались представить существующие подходы, обсудить достижения и проблемы в разработке терапевтических конъюгатов и текущие клинические результаты терапии на их основе.
Структура конъюгатов
Конъюгаты антител с лекарственным средством представляют собой моноклональное антитело (мкАТ), ковалентно связанное с низкомолекулярным цитотоксическим агентом посредством синтетического линкера. Антитело в результате связывания с целевой мишенью на поверхности опухолевой клетки и последующей интернализации конъюгата высвобождает высокоэффективный цитотоксический агент внутрь опухолевой клетки, обеспечивая ее гибель. Гибель пролиферативных клеток опухоли обеспечивается посредством ряда механизмов, таких как блокирование сборки тубулиновых микротрубочек с последующей остановкой клеточного цикла в фазе G2/M (эм-танзин), повреждение ДНК на различных фазах клеточного цикла (дуокармазин), ингибирование РНК-полимеразы II (аманитин) или топоизомеразы I (дерукстекан, говитекан). Цитотоксические агенты с направленной доставкой обладают в 100–1000 раз более выраженным терапевтическим эффектом по сравнению со стандартной химиотерапией, сохраняя допустимый уровень токсичности. Выбор структурных компонентов и их правильное сочетание в одном препарате являются ключом к созданию успешного лекарственного средства [22].
Носитель
При разработке и выборе носителя для терапевтического конъюгата необходимо учитывать множество факторов, каждый из которых оказывает прямое влияние на конечные характеристики препарата. В случае правильного выбора специфично нацеленная молекула-носитель опосредует точность воздействия на целевые опухолевые клетки, увеличивает терапевтический индекс и минимизирует возможные нецелевые токсические эффекты. Первым важным аспектом является выбор подкласса и изотипа мкАТ. В составе одобренных к применению препаратов в качестве молекулы-носителя преимущественно используют терапевтические, полностью гуманизированные мкАТ изотипа IgG, в частности IgG1. Изотипы IgG2 и IgG4 менее эффективны в модуляции эффекторных функций по сравнению с IgG1. Изотипы IgG3 обладают сравнительно коротким периодом полувыведения (~7 дней), имеют расширенную шарнирную область по сравнению с другими изотипами и склонны к полиморфизму и иммуногенным реакциям [23].
Структура мкАТ содержит антигенсвязывающий фрагмент (Fab), специфично взаимодействующий с антигеном опухолевой клетки, и кристаллизующийся фрагмент (Fc). Связывание Fc-домена мкАТ с лейкоцитарными Fc-рецепторами (FcRn) запускает иммунные эффекторные функции: антителозависимую клеточную цитотоксичность (ADCC) и комплемент-зависимую цитотоксичность (CDC). Адаптивный иммунный ответ оказывает дополнительный, не зависимый от воздействия цитотоксического агента, терапевтический эффект для устранения злокачественных клеток [24]. Доказано, что ADCC значительно увеличивает терапевтическую активность трастузумаба [25].
Другим аспектом влияния Fc-фрагмента IgG является FcRn-опосредованная рециркуляция, значительно увеличивающая период полувыведения мкАТ по сравнению с другими белками плазмы крови (~21 день) [26]. Fc-фрагмент IgG связывается
Òàблицà /Table
Note: created by the authors.
с неонатальным рецептором FcRn рН-зависимым образом (в подкисленной среде эндосом, рН=~6,0). После интернализации IgG внутрь клетки процесс FcRn-опосредованной рециркуляции сохраняет эндосомальный IgG от деградации посредством связывания в просвете эндосомы и последующего высвобождения во внеклеточную среду [27].
Дальнейший выбор мкАТ для создания терапевтических конъюгатов основан как на аффинности их связывания с целевой мишенью (kd<10 нМ), экспрессируемой на поверхности опухолевой клетки, так и на способности проникать внутрь опухоли. Как обособленный показатель высокая аффинность связывания антитела с целевым антигеном не гарантирует высокое опухолевое поглощение. Было обнаружено, что мкАТ с высокой аффинностью локализуются в периваскулярных пространствах, тогда как мкАТ с более низким уровнем связывания могут более эффективно интернализовываться внутри опухолевой клетки [28]. Феномен объясняется формированием «барьера сайта связывания», повышение уровня которого коррелирует с увеличением плотности целевых антигенов и аффинности направленных макромолекул. Таким образом, только баланс между скоростями интернализации и диссоциации комплексов «антиген-антитело» может обеспечить эффективную доставку цитотоксического агента в опухолевую клетку. Важны также такие базисные фармакокинетические параметры выбранного носителя, как длительный период полувыведения и медленный клиренс из плазмы крови [28]. Данные показатели, как правило, обеспечиваются большим размером макромолекул мкАТ (~150 кДа) и механизмами FcRn-опосредованной рециркуляции.
Несмотря на многочисленные достоинства, у мкАТ, используемых в качестве носителя цитотоксической нагрузки, существует ряд недостатков – нелинейное распределение и выведение, а также иммуногенность. Поэтому в качестве носителя также рассматриваются фрагменты антител и пептидные молекулы [29]. Малый размер таких носителей способствует эффективному нацеливанию на мишень и проникновению в солидные опухоли, и они продемонстрировали успех в доклинических и клинических исследованиях в качестве транспортных тераностических молекул [30, 31]. Однако конъюгируемый цитотоксический агент, размер которого сопоставим с размером носителя, вносит большие коррективы в биохимические и биофизические характеристики соединения и существенно, зачастую неблагоприятно, влияет на способность проникать внутрь опухолевой клетки и дальнейшее биораспределение конъюгата [29]. Данное направление является перспективным для терапии, но требует новых разработок и скурпулезных исследований влияния структурных компонентов конъюгата на его свойства. Пример успешных доклинических исследований терапевтических молекул на основе полипептидов, таких как каркасные белки аффибоди, продемонстрировали V. Tolmachev et al. [32–35].
Линкер
Основные требования к линкеру в составе терапевтического конъюгата включают возможность обеспечения стабильности конструкции препарата в системном кровообращении в течение длительного периода и целевое высвобождение цитотоксического агента после интернализации в опухолевой клетке. По механизму высвобождения цитотоксической нагрузки линкеры подразделяются на два обширных класса: расщепляемые и нерасщепляемые [22].
Расщепляемые линкеры длительное время стабильны в кровообращении и высвобождают цитотоксический агент в микроокружении опухоли. К ним относят химически лабильные линкеры (гидролизующиеся в кислой среде эндосом и лизосом, чувствительные к глутатиону), а также линкеры, расщепляемые лизосомальными протеазами (пептидные, расщепляемые β-глюкуронидазой, β-галактозидазой или фосфатазой). К основному преимуществу расщепляемых линкеров относится «эффект свидетеля» – воздействие на соседние опухолевые клетки с низкой экспрессией целевой мишени. При этом химически лабильным линкерам свойственна ограниченная стабильность в плазме, что грозит преждевременным высвобождением цитотоксина. Альтернативная стратегия использования линкеров, расщепляемых ферментами клеточных компартментов, увеличивает потенциал контролируемого высвобождения химиотерапевтического агента.
Нерасщепляемые линкеры, представителями которых являются тиоэфиры или малеимидокапро-илы (mc), характеризуются стабильными связями. Для высвобождения цитотоксина таким линкерам необходима полная лизосомальная ферментативная деградация в результате интернализации терапевтического конъюгата. Преимуществами нерасщепляемых линкеров являются их высокая стабильность в плазме и возможность увеличения терапевтического окна с минимизацией нецелевых токсических эффектов [36].
Цитотоксический агент
Используемый химиотерапевтический агент должен отвечать комплексу требований, первым из которых является чрезвычайно высокая эффективность в пикомолярных или наномолярных концентрациях. Это требование связано с ограничением количества опухолеспецифических мишеней в новообразовании, особенно в солидных опухолях. Кроме того, ввиду невысокой проницаемости и плохой интернализации мкАТ количество молекул цитотоксических агентов, которые могут быть эндоцитозированы в опухолевые клетки, может быть небольшим. Другими немаловажными требованиями являются стабильность цитотоксического агента в крови, среде эндосом и лизосом с низким pH; наличие функциональной группы, предназначенной для связывания с носителем посредством линкера и доступной для модификаций без значительного влияния на эффективность; низкая иммуногенность [37]. Для реализации «эффекта свидетеля» перспективными являются низкомолекулярные цитотоксические молекулы, проницаемые для гидрофобных клеточных мембран.
Ингибиторы тубулина
Одними из часто используемых в терапевтических конъюгатах цитотоксинов являются агенты, воздействующие на структуру микротрубочек. Микротрубочки представляют собой динамические полимеры цилиндрической формы, состоящие из гетеродимеров α-, β-тубулина. После митоза происходит деполимеризация микротрубочек, составляющих веретено деления. Следовательно, при нарушении равновесия процессов полимеризации и деполимеризации тубулиновых микротрубочек митоз останавливается в фазе G2/M. Химиотерапевтические агенты, нацеленные на тубулин, нарушая фазу полимеризации микротрубочек и разрушая митотическое веретено, останавливают G2/M фазу клеточного цикла и приводят к митотической катастрофе с последующим апоптозом клетки. Как следствие, токсичность ингибиторов тубулина направлена преимущественно на высокопролиферативные опухолевые клетки. В зависимости от механизма действия среди антимитотических агентов выделяют промоторы полимеризации тубулина (стабилизаторы микротрубочек) и ингибиторы полимеризации тубулина (дестабилизаторы микротрубочек). Ауристатины, стабилизаторы микротрубочек, представляют собой водорастворимые синтетические аналоги морского продукта доластатина 10, полученного из моллюска Dolabella auricleria . Производные ауристатинов, такие как MMAE (монометил ау-ристатин E), MMAF (монометил ауристатин F), нарушают функционирование микротрубочек, воздействуя на β-субъединицу димеров тубулина и определяя их нерегулируемый рост. Производные майтанзина, дестабилизаторы микротрубочек, представляют собой класс бензоансамкролидных антибиотиков, первоначально были выделены из коры африканского кустарника Maytenus ovatus . Наиболее известными представителями на данный момент являются DM1 (эмтанзин) и DM4 (равтанзин), которые, напротив, блокируя полимеризацию димеров тубулина, дестабилизируют микротрубочки и нарушают образование зрелых микротрубочек [37, 38].
Цитотоксины, повреждающие ДНК
Другим широко применяемым классом химиотерапевтических агентов являются цитотоксины, повреждающие ДНК. Ингибиторы ДНК связыва- ются с малой бороздкой двойной спирали ДНК и разрушают ее посредством ряда механизмов: двуцепочечного разрыва (калихеамицины), алкилирования (пирролобензодиазепины и дуокармицины), интеркаляции (камптотецины и антрациклины) или перекрестного сшивания ДНК. Для соединений, повреждающих ДНК, выделяют два главных преимущества: эффективность механизма действия на протяжении всего клеточного цикла и высокую цитотоксичность. Данный класс обладает особо высокоактивными цитотоксическими свойствами со значениями IC50 в пикомолярном диапазоне, в отличие от преимущественно наномолярного диапазона для ингибиторов микротрубочек, и, следовательно, может быть более эффективным в отношении солидных опухолей, а также в клетках с низкой экспрессией целевого антигена [37]. Аналог дуокармицина DUBA (дуокармицин-гидроксибензамид-азаиндол) использован в нескольких терапевтических конъюгатах нового поколения, в частности в HER2-направленном трастузумабе дуокармазине (SYD985).
Ингибиторы РНК-полимеразы II
РНК-полимераза II – фермент, осуществляющий синтез мРНК и многих ядерных РНК, играет ключевую роль в экспрессии генов и клеточной регуляции. Ингибиторы РНК-полимеразы II напрямую блокируют транскрипцию ДНК в мРНК, что в конечном итоге приводит к более чем 1000-кратному снижению транскрипции и синтеза белка с последующим апоптозом как делящихся, так и покоящихся клеток [38, 39]. Амантины, ингибиторы РНК-полимеразы II, представляют собой макроциклические пептиды, вырабатываемые грибами Amanita phalloides, и обладают высокой термостойкостью, устойчивостью к ферментативному и кислотному разложению. Фермент РНК-полимераза II является критичным компонентом основных путей клеточного метаболизма, что снижает вероятность развития механизмов резистентности [38]. В качестве цитотоксической молекулы терапевтических конъюгатов на основе антител α-амантин показал эффективность в моделях опухолей, экспрессирующих EpCAM, ПСМА и HER2 [21, 38].
Ингибиторы ДНК-топоизомеразы I
Топоизомеразы I регулируют топологическое состояние клеточной ДНК путем разрыва и последующего за релаксацией суперспиралей лигирования цепей ДНК [40, 41]. Ингибиторы ДНК-топоизомеразы I оказывают цитотоксическое действие на реплицирующиеся клетки, предотвращая повторное лигирование ДНК и приводя к повреждению ДНК и последующей гибели клеток в результате апоптоза [37]. Производное камптоте-цина дерукстекан (DX-8951f) – пример ингибитора ДНК-топоизомеразы I с благоприятными характеристиками, обладающего мощной противоопухо- левой активностью широкого спектра. Цитотоксин DX-8951f не является субстратом гена MDR1 (Multi-Drug Resistance 1) и, следовательно, может быть эффективен в лечении резистентных для эм-танзина (DM1) клеток посредством механизмов, от которых зависит отток лекарственного средства транспортерами ABC (ATP-binding cassette transporters). Сацитузумаб говитекан (IMMU-132), нацеленный на TROP2, и HER2-направленный конъюгат трастузумаб дерукстекан (DS-8201) являются двумя наиболее современными терапевтическими конъюгатами на основе камптотецина и входят в число «прорывных» лекарственных препаратов для лечения HER2-положительного метастатического РМЖ и трижды негативного рака молочной железы (ТНРМЖ) [42].
Интернализация терапевтических конъюгатов и возможные подходы к ее усилению
Канонический механизм действия конъюгатов антител с цитотоксическими агентами включает связывание с целевым антигеном, интернализацию комплекса «антиген-конъюгат» внутрь опухолевой клетки, метаболизм комплекса в лизосомах и эндосомах с последующим высвобождением цитотоксического агента. Эффективная интернализация комплекса «антиген-конъюгат» имеет решающее значение для расщепления линкера лизосомальными протеолитическими ферментами или восстановительными условиями и, следовательно, для противоопухолевой активности препарата.
Скорость интернализации HER2 может регулироваться уровнем его экспрессии, посредством связывания антител с HER2 и взаимодействием с его партнерами по димеризации. Рецептор HER2 существует в состоянии динамического равновесия между эндоцитозом и рециркуляцией на поверхности клетки. Кластеризация рецепторов на поверхности клетки может приводить к быстрой интернализации рецепторов. Связывание рецептора HER2 с антителом способствует кластеризации HER2 и эндоцитозу комплекса рецептора и антитела внутрь клетки. Интересно, что биспецифические антитела способны индуцировать кластеризацию рецептора HER2 и усиливать интернализацию по сравнению с мкАТ, нацеленными на один домен [43]. Другой фактор – высокая плотность экспрессии HER2, способствует образованию гомодимеров и олигомеров HER2, а также высокой плотности кластеризации, а следовательно, повышает скорость интернализации HER2. Так, интернализация трастузумаба наиболее эффективна в областях мембранных складок опухолевых клеток, где плотность HER2 самая высокая [44].
Однако даже при высокой экспрессии HER2 комплекс «HER2-антиген» не всегда может подвергаться интернализации и высвобождению полезной нагрузки, находясь в зависимости от конформации и расположения рецептора. Так, повышенная экспрессия рецептора эпидермального фактора роста 1 типа (EGFR) способствует образованию гетеродимеров «EGFR/HER2», уменьшает количество гомодимеров «HER2/HER2» и эффективность кластеризации HER2, что снижает как эффективность интернализации, так и противоопухолевую эффективность лекарственных препаратов на основе трастузумаба. В свою очередь, фармакологическое ингибирование EGFR посредством связывания с цетуксимабом усиливает их интернализацию и противоопухолевую активность [45].
Другим примером фармакологического воздействия усиления интернализации является способность нератиниба, необратимого ингибитора пан-HER-киназы, увеличивать полиубиквитиниро-вание и последующую интернализацию рецептора HER2 посредством диссоциации белков теплового шока 90 (HSP90) в HER2-амплифицированных или мутантных опухолевых клетках [46].
Лекарственные препараты, одобренные для клинического применения
Первым конъюгатом «антитело-лекарственное средство», одобренным FDA (U.S. Food and Drug Administration) в 2013 г. для терапии распространенного HER2-положительного РМЖ, стал трастузумаб эмтанзин (T-DM1, Kadcyla®) . Трастузумаб эмтанзин представляет собой молекулу трастузумаба, конъюгированную через нерасщепляемый малеимидный линкер малеимидометилциклогексан-1-карбоксилата (mcc) с высокоактивным цитотоксином эмтанзи-ном (DM1) в соотношении (DAR) 3,5 молекулы цитотоксина на антитело.
На основании данных двух крупных клинических исследований EMILIA и TH3RESA трастузумаб эмтанзин показан к применению при метастатическом HER2-положительным РМЖ в качестве терапии второй линии [6, 47]. Согласно рандомизированному многоцентровому клиническому исследованию III фазы EMILIA (NCT00829166), у пациентов с HER2-положительным РМЖ, прогрессирующим после терапии трастузумабом и таксаном, эффективность терапии трастузумабом эмтанзином выше по сравнению c терапией ка-пецитабином и лапатинибом (медиана ОВ – 29,9 мес [95 % ДИ 26,3–34,1] vs 25,9 мес [95 % ДИ 22,7–28,3], коэффициент риска – 0,75 [95 % ДИ 0,64–0,88]) [47]. Рандомизированное открытое исследование III фазы TH3RESA (NCT01419197), включавшее в себя пациентов, получавших ранее две или более схемы лечения, показало, что терапия трастузумабом эмтанзином приводила к значительному улучшению общей выживаемости по сравнению с лечением по выбору врача (медиана ОВ – 22,7 мес [95 % ДИ 19,4–27,5] vs 15,8 мес [13,5–18,7]; коэффициент риска – 0,68 [95 % ДИ 0,54–0,85] [6]. Данные рандомизированного многоцентрового открытого исследования III фазы KATHERINE (NCT01772472) указали на возможность расширения спектра применения трастузумаба эмтанзина [7]. Cреди пациенток с HER2-положительным РМЖ, у которых после завершения неоадъювантной терапии сохранялась опухоль, риск прогрессирования заболевания или смерти при применении трастузумаба эмтанзина в адъювантном режиме был на 50 % ниже, чем при монотерапии трастузумабом [7]. Однако при рассмотрении трастузумаба эмтанзина в качестве основной неоадъювантной терапии рандомизированное многоцентровое открытое исследование III фазы KRISTINE (NCT02131064) выявило, что трастузумаб эмтанзин в сочетании с пертузума-бом уступает традиционной неоадъювантной системной химиотерапии в комбинации с двойной HER2-блокадой трастузумабом и пертузумабом. Полный ответ на лечение был достигнут у 44,4 % больных в группе трастузумаба эмтанзина в сочетании с пертузумабом по сравнению с 55,7 % в группе доцетаксела, карбоплатина в сочетании с трастузумабом и пертузумабом (95 % ДИ от -20,5 до -2,0 p=0,016). При этом в группе трастузумаба эмтанзина в сочетании с пертузумабом реже наблюдались нежелательные явления III–IV степени (13 vs 64 %) или серьезные нежелательные явления (5 vs 29 %), чем в группе контроля [8].
Трастузумаб дерукстекан
(T-DXd, Enhertu®, ранее DS-8201a)
Новым многообещающим HER2-направленным терапевтическим препаратом, разработанным для улучшения характеристик конъюгатов «антителолекарственное средство» и одобренным FDA, является трастузумаб дерукстекан (T-DXd, Enhertu®, ранее DS-8201a). Трастузумаб дерукстекан представляет собой молекулу трастузумаба, конъюгированную с дерукстеканом (DXd) – ингибитором ДНК-топоизомеразы I – через малеимидный тетрапептидный линкер (Gly-Gly Phe-Gly), избирательно расщепляемый катепсинами, активность которых повышена в раковых клетках и в опухолевом микроокружении. После высвобождения внутри клетки цитотоксин дерукстекан связывается с расщепляемыми топоизомеразой I ДНК-комплексами и стабилизирует их, что приводит к индукции двухцепочечных разрывов ДНК и апоптозу клетки [48]. Трастузумаб дерукстекан обладает соотношением цитотоксина к антителу (DAR), равным 8, что более чем в 2 раза превышает DAR трастузумаба эм-танзина и обеспечивает мощный цитостатический эффект. Кроме того, дерукстекан обладает высокой проницаемостью мембраны, что позволяет оказывать цитотоксическое воздействие посредством «эффекта свидетеля» на опухолевые клетки в непосредственной близости от клеток-мишеней, независимо от уровня их экспрессии HER2. Данные особенности способствуют противоопухолевому эффекту препарата как при опухолях с высоким уровнем экспрессии HER2, так и в новообразованиях с низкой экспрессией [49].
Дополнительно обнаружено усиление противоопухолевого иммунитета при применении трастузумаба дерукстекана. Исследование с использованием иммунокомпетентной мышиной модели с опухолью человека, экспрессирующей HER2, на клеточной линии CT26.WT показало повышенную экспрессию CD86 на дендритных клетках, повышенную экспрессию PD-L1 и главного комплекса гистосовместимости (MHC) класса I в опухолевых клетках с последующим отторжением опухолевых клеток адаптивными иммунными клетками [50, 51].
По результатам исследования фазы II DESTINY-Breast01 (NCT03248492), трастузумаб дерукстекан одобрен в FDA в 2020 г. в рамках ускоренного одобрения для лечения больных неоперабельным или метастатическим HER2-положительным РМЖ, получивших две или более линии анти-HER2-терапии [52, 53]. В 2022 г. получены дополнительные результаты, доказывающие эффективность трастузумаба дерукстекана: частота объективного ответа (ЧОО) составила 62,0 % [95 % ДИ 54,5–69,0 %] у пациенток, получавших 5,4 мг/кг трастузумаба дерукстекана каждые 3 нед (n=184), медиана общей выживаемости (OВ) – 29,1 мес (95 % ДИ 24,6–36,1 мес), медиана выживаемости без прогрессирования (ВБП) – 19,4 мес [95 % ДИ 14,1–25,0 мес) [10].
В многоцентровом открытом рандомизированном исследовании III фазы с активным контролем DESTINY-Breast03 проведена оценка эффективности и безопасности трастузумаба дерукстекана по сравнению с трастузумабом эм-танзином. В исследование включены пациентки с HER2-положительным неоперабельным или метастатическим РМЖ, у которых наблюдалось прогрессирование в процессе лечения трастузумабом и таксанами или после проведенной терапии. Монотерапия трастузумабом дерукстеканом показала практически в 4 раза большую эффективность по сравнению с монотерапией трастузумабом эмтанзином на момент окончания сбора данных. При этом медиана ВБП в группе трастузумаба дерукстекана составила 29,0 мес (95 % ДИ 23,7– 40,0 мес) против 7,2 мес (95 % ДИ 6,8–8,3 мес) в группе трастузумаба эмтанзина [КР 0,30; 95 % ДИ 0,24–0,38]. Через 36 мес ВБП составила 45,7 % (95 % ДИ, 38,9–52,2 %) против 12,4 % (95 % ДИ 8,1–17,7 %). Наблюдалась тенденция к увеличению ОВ: медиана ОВ составила 52,6 мес (95 % ДИ 48,7 мес – нд) при применении трастузумаба деруксте-кана против 42,7 мес (95 % ДИ 35,4 мес – нд) при терапии трастузумабом эмтанзином, риск смерти был снижен на 27 % [КР 0,73; 95 % ДИ 0,56–0,94]; ЧОО составила 78,9 % (95 % ДИ 73,5–83,7 %) для трастузумаба дерукстекана по сравнению с 36,9 %
(95 % ДИ 31,0–43,0 %) для трастузумаба эмтанзина. Прогрессирование наблюдалось у 1,1 % пациенток, леченных трастузумабом дерукстеканом, и у 17,5 % больных из группы трастузумаба эмтанзина [54]. Количество нежелательных явлений ≥III степени было схожим – у 56 и 52 % больных соответственно. Характерные для трастузумаба дерукстекана лекарственно-ассоциированное интерстициальное заболевание легких или пневмонит установлены у 15 % пациенток, принимавших трастузумаб де-рукстекан, и у 3 % пациенток, получавших трастузумаб эмтанзин, при этом ни в одной из групп не было нежелательных реакций IV–V степени [11]. Исследование подтвердило удовлетворительный профиль безопасности трастузумаба дерукстекана, отсутствие кумулятивной токсичности при его применении и показало клиническое преимущество этого препарата перед трастузумабом эмтанзином, включенным в стандарты HER2-направленной терапии.
Инновационные лекарственные средства
Трастузумаб дуокармазин (SYD985) представляет собой молекулу трастузумаба, нековалентно связанную с цитотоксином дуокармицином посредством расщепляемого линкера (vc-seco-DUBA). Цитотоксический агент дуокармицин (DUBA), связываясь с малой бороздкой ДНК, необратимо алкилирует ДНК как в делящихся, так и в неде-лящихся клетках. Повреждение ДНК приводит к митохондриальному стрессу, нарушению транскрипции ДНК и апоптозу. При этом, благодаря мембранопроницаемой природе цитотоксина в комплексе с линкером, расщепляемым цистеиновыми протеазами, такими как катепсин B, присутствующими в эндосомах и лизосомах опухолевых клеток, последующее высвобождение дуокармици-на путем диффузии способствует «эффекту свидетеля», обеспечивающего активность препарата и в опухолевых клетках с низкой экспрессией HER2.
Эффективность и безопасность трастузумаба дуокармазина оценена в рандомизированном многоцентровом исследовании 3 фазы TULIP III (NCT03262935) в сравнении с препаратами, назначенными по выбору лечащего врача у пациенток с HER2-положительным местнораспространенным или метастатическим РМЖ, получивших две или более линии терапии или терапию трастузумабом эмтанзином. Медиана ВБП при терапии трастузумаба дуокармазина значительно отличалась и составила 7,0 мес [95 % ДИ 5,4–7,2] по сравнению с 4,9 мес [95 % ДИ 4,0–5,5] при лечении по выбору врача. Наиболее частыми побочными эффектами трастузумаба дуокармазина явились офтальмологическая токсичность (конъюнктивит –38,2 %, кератит – 38,2 %) и интерстициальные заболевания легких/пневмонит – 7,6 % [13].
ARX788 (Ambrx Inc.). Конъюгат нового поколения, разработанный для обеспечения гомогенности и химической стабильности, ARX788, представляет собой HER2-направленное моноклональное антитело, ковалентно связанное с ингибитором тубулина амберстатином (AS269, является запатентованной версией монометилауристатина F (MMAF)) с соотношением лекарственного средства к антителу (DAR) 1,9. Традиционное конъюгирование антитела и цитотоксина предполагает использование нативных, экспонированных на поверхности антитела, лизинов или цистеинов. Неспецифическая конъюгация приводит к образованию смеси с переменным соотношением лекарственного средства к антителу (DAR) и неопределенными сайтами конъюгации, которые часто нестабильны в пуле крови. От других разработанных терапевтических конъюгатов ARX788 отличает использование технологии сайт-специфической оксимной конъюгации посредством включения в антитело неприродной аминокислоты пара-ацетилфенилаланина (pAF), которая лишает препарат описанных выше недостатков [55]. Другой отличительной чертой является наличие нерасщепляемого высокогидрофобного линкера с ограниченной клеточной проницаемостью. Стабильный линкер снижает системную токсичность разрабатываемого препарата, но лишает эффекта «уничтожения свидетеля», который используется в таких HER2-нацеленных конъюгатах, как трастузумаб дерукстекан и трастузумаб дуокармазин, для цитотоксического воздействия на опухолевые клетки с низким уровнем HER2. В то же время доклинические исследования показали высокую активность ARX788 в опухолях с различной экспрессией HER2, а также T-DM1-резистентных новообразованиях [56]. Клиническое исследование I фазы подтвердило эффективность и низкую системную токсичность ARX788. При рекомендуемой дозе для II фазы 1,5 мг/кг частота объективного ответа составила 65,5 % [95 % ДИ], а медиана выживаемости без прогрессирования – 17,02 мес (95 % ДИ, 10,09 – не достигнуто) [16]. На данный момент продолжается рандомизированное исследование II фазы у HER2-положительных пациенток с метастатическим раком молочной железы ACE-Breast-03 (NCT04829604).
Занидатамаб зоводотин (ZW49). В новом исследуемом конъюгате занидатамабе зоводадотине (ZW49) молекулой-носителем является биспецифическое моноклональное антитело занидатамаб (ZW25), нацеленное на II и IV субдомены HER2 (субдомены, на которые нацелены пертузумаб и трастузумаб соответственно). Занидатамаб способствует кластеризации рецепторов, при которой каждый рецептор HER2 может быть мишенью для двух молекул антител занидатамаба [57]. Занида-тамаб нековалентно связан через расщепляемый линкер с ингибитором сборки тубулиновых микротрубочек, монометилауристатином E (MMAE). Доклинические данные продемонстрировали ускоренную интернализацию занидатамаба зо- водотина по сравнению с конъюгатами на основе моноспецифического трастузумаба, а также противоопухолевый эффект на клеточных моделях с высокой и низкой экспрессией HER2, моделях с метастазами в головной мозг [58]. Безопасность и переносимость ZW49 оцениваются в I фазе клинического исследования при метастатическом РМЖ, экспрессирующем HER2 (NCT03821233) [17].
MRG002 – новый HER2-направленный конъюгат, состоящий из модифицированного сахаром трастузумаба и разрушающего микротрубочки агента монометилауристатина E (ММАЕ), соединенных через расщепляемый валин-цитруллиновый (vc) пептидный линкер. В доклинических исследованиях доказана эффективность MRG002 при HER2-положительном РМЖ, а также при РМЖ с низкой экспрессией HER2. Конъюгат продемонстрировал схожую с трастузумабом аффинность связывания, но значительно более низкую активность антителозависимой клеточной цитотоксичности (ADCC). В дополнение к мощной цитотоксичности in vitro , применение MRG002 вызывало регрессию опухоли в моделях ксенотрансплантатов in vivo с высокой и средней/низкой экспрессией HER2. Кроме того, установлена повышенная противоопухолевая активность при использовании MRG002 в сочетании с антителом против рецептора PD-1 (Programmed cell death-1, CD279) [59]. На данный момент в Китае проходят клинические исследования II фазы MRG002 в качестве терапии пациенток с HER2-положительным неоперабельным местнораспространенным или метастатическим РМЖ, получавших ранее терапию трастузумабом и ингибитором тирозинкиназы HER2, у пациенток с местнораспространенным или метастатическим РМЖ с низким уровнем HER2, а также у больных HER2-положительным неоперабельным местнораспространенным или метастатическим раком уротелия [18].
Диситамаб ведотин (RC48, Aidixi ® ) так же, как и MRG002, представляет собой мАТ, связанное через расщепляемый валин-цитруллиновый линкер с цитотоксическим агентом MMAE. Отличительной чертой является использование в качестве носителя мАТ гертузумаба, воздействующего на различные эпитопы рецептора HER2.
FS-1502 представляет собой HER2-напра-ленный конъюгат на основе мкАТ, аналога трастузумаба, и цитотоксического агента MMAF, ингибирующего полимеризацию тубулина, соединенных через расщепляемый β-глюкуронидный линкер с соотношением DAR=2. Для данного терапевтического конъюгата разработан новый запатентованный метод сайт-специфичной конъюгации и высокостабильный линкер. Продемонстрировано, что сайт-специфичная конъюгация с низким значением DAR=2 превосходит другие терапевтические конъюгаты с более высоким DAR благодаря меньшей агрегации, медленному системному клиренсу и меньшей токсичности. FS-1502 продемонстрировал эффективную остановку клеточного цикла и повышенную HER2-направленную цитотоксичность по сравнению с трастузумабом эмтанзином в доклинических исследованиях in vitro . На данный момент продолжается многоцентровое одногрупповое открытое клиническое исследование фазы I с фазой эскалации дозы для оценки безопасности и переносимости FS-1502 у пациентов с HER2-выраженными злокачественными солидными опухолями на поздних стадиях (фаза 1a) и с расширенной когортой (фаза 1b) для оценки эффективности FS-1502 у пациенток с метастатическим HER2-положительным РМЖ.
По предварительным опубликованным данным, ЧОО – 53,7 % (95 % ДИ, 41,1–66,0 %), включая подтвержденную ЧОО, равную 37,5 %. FS-1502 также показал противоопухолевую активность при РМЖ с низкой экспрессией HER2, ЧОО составила 26,1 %. Наиболее частыми НЯ ≥III степени были гипокалиемия (15,3 %) и снижение количества тромбоцитов (8,0 %), у 3,3 % пациентов наблюдался пневмонит; у 2,7 % – обратимые глазные явления III степени. В целом, FS-1502 характеризовался хорошей переносимостью и продемонстрировал многообещающую противоопухолевую эффективность при HER2-положительном РМЖ [19].
BL-M07D1 – конъюгат HER2-направленного мкАТ и нового ингибитора топоизомеразы I (Ed-04), соединенных линкером, расщепляемым катепсином B. Соотношение DAR составляет 8. В доклинических исследованиях in vivo BL-M07D1 продемонстрировал более высокую противоопухолевую активность в различных моделях HER2-экспрессирующих опухолей по сравнению с трастузумабом эмтанзином и трастузумабом дерукстеканом. При этом BL-M07D1, продемонстрировав выраженный «эффект свидетеля», оказался более эффективным в моделях in vivo с низкой экспрессией HER2 и смешанных моделях ксенотрансплантатов HER2-положительных/ отрицательных по сравнению с трастузумабом дерукстеканом. На данный момент проводится фаза I клинического исследования для изучения


