Строение диоксиматов триарилсурьмы и оценка степени заполнения координационной сферы атома металла
Автор: Ефремов А.Н., Шарутина О.К., Шарутин В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Неорганическая химия
Статья в выпуске: 4 т.16, 2024 года.
Бесплатный доступ
На основании данных рентгеноструктурного анализа (РСА) ряда диоксиматов триарилсурьмы Ar3Sb(ON=CHR)2 проведено сравнительное описание их молекулярных структур и установление особенностей строения. В молекулах диоксиматов триарилсурьмы наблюдаются внутримолекулярные контакты Sb···N (2,728(4)-2,900(6) Å), которые иногда меньше примерно на 1 Å суммы ван-дер-ваальсовых радиусов атомов-партнеров (3,61 Å). Сокращенное расстояние Sb×××N не сопровождается ожидаемым удлинением связей N-O в иминокси-группе и не зависит от длин связей Sb-O. Однако укорочение расстояний Sb···N коррелирует с уменьшением валентного угла NOSb. В структурах, содержащих метоксигруппы в арильных лигандах при атоме сурьмы, наблюдаются внутримолекулярные взаимодействия типа Sb···OMe. В диоксиматах триарилсурьмы, содержащих разные арильные лиганды при атоме сурьмы, но одинаковые оксиматные зависимости геометрических параметров координационного узла [SbO2C3] от природы арильных лигандов не наблюдается, но в некоторых структурах имеет место закономерное удлинение внутримолекулярных расстояний Sb···N. Впервые в программе Solid-G для диоксиматов триарилсурьмы проведена количественная оценка степени заполнения координационного пространства атома сурьмы в модели телесных углов лигандов (G-параметр) с учетом геометрии молекул в кристаллическом состоянии по результатам РСА, который составил 80,19-85,70 %. Максимальное насыщение координационной сферы (90,93 ) имеет место в структуре, где наблюдаются внутримолекулярные взаимодействия Sb···OMe. В бис(μ3-2-оксибензальдоксимато-О,O',N)-(μ2-оксо)-тетраарил)дисурьме, где 2-гидроксибензальдоксиматный лиганд является тридентатным мостиковым, а атомы сурьмы гексакоординированы, степень заполнения координационного пространства превышает 90 %.
Диоксиматы триарилсурьмы, молекулярная структура, рентгеноструктурный анализ, стерический фактор, координационная сфера, g-параметр
Короткий адрес: https://sciup.org/147246053
IDR: 147246053 | УДК: 546.865+547.47+548.312.5 | DOI: 10.14529/chem240409
Текст научной статьи Строение диоксиматов триарилсурьмы и оценка степени заполнения координационной сферы атома металла
Органические соединения сурьмы(V) представляют интерес с фундаментальной точки зрения, поскольку для них характерны разнообразные структуры, в которых проявляются внутри- и межмолекулярные взаимодействия. К таким соединениям относятся диоксиматы триарилсурьмы, в молекулах которых наблюдаются внутримолекулярные взаимодействия атома металла с атомами азота оксиматных лигандов. Однако диоксиматы триарилсурьмы в литературе представлены относительно небольшим рядом соединений [1–17], при этом большинство из них являются производными трифенил-, три( орто -толил)- и три( мета -толил)сурьмы. Диоксиматы три( пара -толил)- и трис (5-бром-2-метоксифенил)сурьмы представлены единичными примерами, диоксиматы трис (4-фторфенил)- и трис (3-фторфенил)сурьмы ранее не были известны.
Установлено, что объем лигандов, окружающих центральный атом в элементоорганических соединениях, влияет на их реакционную способность. Одним из методов оценки заполнения координационного пространства центрального атома лигандами в металлоорганических комплексах является расчет G-параметра, который характеризует стерические размеры лигандов и может быть использован как для уже синтезированных комплексов, так и для предсказания возможности получения неизвестных соединений [18]. Расчет G-параметра для диоксиматов триарилсурмы ранее не проводился.
Экспериментальная часть
Расчет степени заполнения координационной сферы атома металла всеми лигандами (G-параметр, %), доля координационного пространства, занимаемого каждым лигандом на расстоянии в 2,28 Å от атома металла (параметр G 2,28 , %), а также перекрывания телесных углов лигандов (G γ , %) проводили в программе Solid-G [18]. Погрешность рассчитанных параметров составила ±0,02 %.
Файл с расширением .xyz , необходимый для расчетов в программе Solid-G , формировали с помощью программ OLEX2 [19] и SHELXL/PC [20].
Расчет искомых параметров проводили очередностью команд, отображаемых в интерфейсе программы Solid-G :
-
1. Select Atom – выбор центрального атома, относительно которого будут проводиться расчёты всех параметров.
-
2. Identify Ligands – определение лигандов, связанных с центральным атомом.
-
3. Calculate Angles – запуск расчетов телесных углов и G-параметров.
-
4. Start Viewer – визуализация рассчитанных G-параметров лигандов.
Методики синтеза соединений 1-13 и рентгеновские эксперименты кристаллов осуществлены ранее и опубликованы в работах [21–24].
Расчет G-параметров проведен с учетом геометрии молекул в кристаллическом состоянии по результатам РСА.
Рентгеноструктурный анализ (РСА) кристаллов соединений проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo Kα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 293 К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены с помощью программ SMART и SAINTPlus [25]. Все расчеты по определению и уточнению структур выполнены с помощью программ SHELXL/PC [20] и OLEX2 [19]. Структуры определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). В некоторых структурах отдельные фрагменты молекул, сольватные молекулы растворителя были разупорядочены при условиях ограничений на их геометрию и параметры колебаний эллипсоидов смещений. Заселенности разупорядоченных атомов были вычислены автоматически. В кристалле соединения 11 присутствуют два типа кристаллографически независимых молекул (а и б). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№№ 1465384 (1), 1062231 (2), 1059962 (3), 1060054 (4), 2178726 (5), 1471842 (6), 1465109 (7), 1471948 (8), 1060387 (9), 2064391 (10), 1820147 (11), 1834110 (12), 1835929 (13); ; . Основные длины связей и валентные углы соединений 1–10 приведены в табл. 1, соединений 11–13 – в табл. 2.
Таблица 1
Основные геометрические параметры молекул диоксиматов триарилсурьмы Ar 3 Sb(ON=CHAr') 2
|
№ |
Ar, Аr' |
Интервал изменения φ(СSbС), град. |
φ(NOSb), град. |
Ср. знач. d (Sb–C), Å |
d (Sb–О), Å |
d (N–О), Å |
d (Sb···N), Å |
|
1 |
p -Tol, С 6 Н 4 Br-2 |
116,1(2)–122,3(2) |
109,1(2), 109,3(2) |
2,107(4) |
2,072(3), 2,075(3) |
1,372(5), 1,386(5) |
2,841(3), 2,844(4) |
|
2 |
p -Tol, С 6 Н 4 OH-2 |
118,3(1)–121,0(1) |
107,9(2), 108,2(2) |
2,103(4) |
2,081(2), 2,086(2) |
1,387(3), 1,402(3) |
2,839(4), 2,850(3) |
|
3 |
p -Tol, С 6 Н 4 NO 2 -2 |
116,3(2)–123,4(2) |
102,7(2), 109,2(2) |
2,104(4) |
2,069(3), 2,071(3) |
1,381(5), 1,390(4) |
2,728(4), 2,849(3) |
|
4 |
p -Tol, С 4 Н 3 O |
116,2(2)–123,8(3) |
108,6(5), 109,6(4) |
2,114(6) |
2,075(5), 2,076(5) |
1,372(8), 1,374(10) |
2,831(7), 2,847(6) |
|
5 |
p -Tol, С 4 Н 2 O-NO 2 -5 |
117,4(5)–121,5(4) |
108,5(3), 115,3(7) |
2,121(8) |
2,083(4), 2,109(2) |
1,381(7), 1,369(2) |
2,840(5), 2,900(6) |
|
6 |
3-FC 6 H 4 , С 6 Н 4 Br-2 |
117,5(2)–122,6(2) |
110,3(2), 112,1(2) |
2,111(4) |
2,062(3), 2,068(3) |
1,385(5), 1,391(4) |
2,865(4), 2,883(4) |
|
7 |
3-FC 6 H 4 , С 6 Н 4 OH-2 |
119,6(2)–120,2(1) |
111,4(2), 111,4(2) |
2,106(5) |
2,081(3), 2,081(3) |
1,397(4), 1,397(4) |
2,900(1), 2,900(1) |
|
8 |
4-FC 6 H 4 , С 6 Н 4 Br-2 |
117,5(2)–122,7(2) |
112,1(3), 110,0(3) |
2,113(5) |
2,108(6), 2,112(5) |
1,384(6), 1,385(6) |
2,884(6), 2,860(5) |
|
9 |
4-FC 6 H 4 , С 6 Н 4 NO 2 -2 |
116,2(1)–122,9(1) |
104,0(2), 110,5(2) |
2,113(3) |
2,065(2), 2,085(2) |
1,382(4), 1,391(3) |
2,765(3), 2,866(3) |
|
10 |
2-MeO-5-BrC 6 H 3, С 6 Н 4 Br-2 |
115,2(2)–125,2(2) |
112,3(3), 112,9(3) |
2,122(6) |
2,069(3), 2,072(3) |
1,372(6), 1,374(5) |
2,887(4), 2,895(4) |
Таблица 2
Основные геометрические параметры молекул бис ( μ 3 -2-оксибензальдоксимато-О,O',N)-( μ 2 -оксо)- тетракис (арил)дисурьмы 11–13
|
№ |
Ar |
φ(СNO), град. |
Интервал изменения d (Sb–C), Å |
d (Sb–Oмост), Å |
d (Sb–Oоксимат.), Å |
d (Sb–Oокси), Å |
d (Sb···N), Å |
|
11а |
p -Tol |
115,7(2) |
2,108(7)-2,128(6) |
1,943(3) |
2,101(4) |
2,016(4) |
2,257(3) |
|
12 |
3-FC 6 H 4 |
115,7(2), 115,0(2) |
2,117(3)-2,136(3) |
1,948(2), 1,954(2) |
2,076(2), 2,097(2) |
2,002(2), 2,010(2) |
2,257(3), 2,230(3) |
|
13 |
4-FC 6 H 4 |
115,7(2), 115,0(2) |
2,130(6)-2,139(7) |
1,954(4), 1,958(4) |
2,094(5), 2,082(4) |
2,015(5), 2,019(4) |
2,257(3), 2,230(3) |
Обсуждение результатов
В мол е к у ла х д и о к с и ма то в три а ри лс у рьмы 1 – 10 атом сурьмы имеет координацию тригональной бипирамиды с а томами к и с лорода оксиматных лигандов в аксиальных п оложе н и ях [21–23] (рис. 1). Молек ул ы с оеди н е н ия 7 симметричны и содержат винтовую ось четвертого порядка, проходящую через атомы Sb (1) , С ( 11 ) , С ( 14 ) .
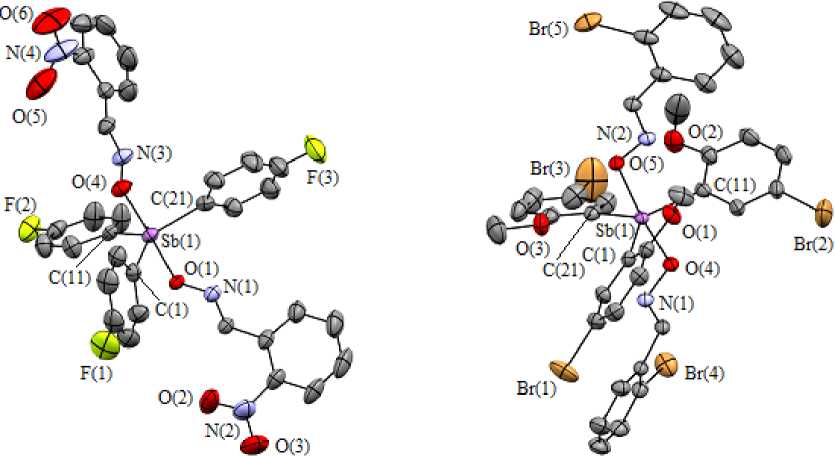
Рис. 1. Молекулярные структуры 9 (слева) и 10 (справа) (атомы водорода не приведены)
В 1 – 10 суммы э к в а то ри альн ы х угл ов CSbC равны 360º (в пределах погрешности экспери мента) , зн а че н и я и н д и видуальн ы х углов отклоняются от теоретического не бол е е, чем на 5º. Аксиальные углы OSbO б ли з ки к и деа льн ому ( 180º) (уменьшение не более, чем на 10º).
Фрагменты SbC3 в с трукту ра х диоксиматов триарилсурьмы практически плоские. Наибольшие расстояния Sb···[С 3 ] н а б люд аю тс я в с тру к ту ра х 5 и 10 и составляют 0,068 и 0,073 Å соответственно. В молекуле 7 атом Sb р а с п о ла г а е тс я в п л ос к ос ти [ С 3 ].
В интервале 2,103(4)– 2 , 122(6) Å находятся средние значения длин связей Sb–C. При этом наибо л ь шие з нач ения наб л юдают ся в м о л ек ул ах 5 (среднее значение 2,121(8) Å ) и 10 (2,122(6) Å ) . Расстояния Sb–O и зме н яю тс я в н еш и ро к ом д иа п азон е ( 2, 0 62( 3 ) - 2,112(5) Å) и незначительно (не более чем на 0,062 Å) п р е в ышаю т с у мму к ов але н т н ых рад и у с ов Sb и O (2,05 Å [26]). Длины связей Sb–C в о в с е х струк т у ра х п ревы ша ю т ра сс тоя н и я Sb–O, т. е. экваториальные лиганды при атом е с у рьмы р а с п ол ож ен ы д а л ьш е , че м ак с и альные , что является особенностью строения диок-симатов триарилсурьмы.
В молекулах 1 – 10 н аблюд а ю тс я в н у три моле к у лярн ые к он та к т ы Sb···N (2,728(4)–2,900(6) Å), кот оры е ин ог д а м еньш е п ри ме рн о на 1 Å суммы ван-дер-ваальсовых радиусов атомов-партнеров (3,61 Å [27 ] ) . С ок ращ е н ное рас с тоян и е Sb ⋅⋅⋅ N не сопровождается ожидаемым удлинением связей N–O и н е за в и с и т от дли н с в язе й Sb–O. Однако укорочение расстояний Sb···N приводит к уменьшению валентного угла NOS b.
Расстояния Sb···OMe в стру к ту ре 10 составляют 3,035(4), 3,074(6) и 3,165(5) Å, что не превышает сумму ван-дер- в аальс ов ых радиусов атомов металла и кислорода (3 , 58 Å) [27]. Данные зн а чени я н е мн ого боль ш е а на логи чных в трис (5-бром-2-метоксифенил)сурьме (2,985(1), 3,051(1), 3,052(1) Å) [28].
А н а л и з д а н н ых геоме трических параметров диоксиматов триарилсурьмы, сод е р жа щ и х р аз н ы е а ри льн ы е ли га н ды п ри а томе с у рьмы, н о од и н а к ов ые окс и ма тн ые , п озв оляет сделать вывод о том, что за в и с и мос ти геоме три че ск их п а рам е тров к оорд и н а ц ион н ого узл а [SbO 2 C 3 ] от природы ари льн ых ли г а н д ов н е н аб лю да ется. В структурах с одинаковыми оксиматными ли г а н д а ми и м е ет мес то н е к ото рое у д ли н е ни е в н у три моле к у лярн ых ра с с тоян и й Sb···N в ряду молекул 1 , 8 , 6 , 10 . В соединении 10, с о д е р ж а щ е м ме токс и гру п п у в о 2-м положении и бром в 5-м положении, обсуждаемые расстояния са м ые д ли н ные в ряд у бис (4-бром-бензальдоксиматов) триарилсурьмы.
Р анее было п о к а за н о, что 2-гидроксибензальдоксим в присутствии пероксида водорода реаг иру е т с три фе н и лс у рьмой с об ра зов а н и е м д и ок с има та три фе н и лс у рьмы [ 2], а с трис (5-бром-2-мет окс ифе н и л)с у рьмой ре а к ц и я и д е т п о д ру гой с хе ме , д а в а я бис ( μ 3 -2-оксибензальдоксимато-О,O',N)-( μ 2 -оксо)- тетракис (5-б ром -2-метоксифенил)дисурьму [29]. Мы установили, что взаимодействие трис (3-фторфенил)- и трис (4-метилфенил)сурьмы с этим же оксимом в присутствии трет - бути л гидроп е рокс ид а п ри в од и т к о б ра зов а н ию с оед и н е н и й 7 и 2 соответственно. При проведении реакций с 30%-ны м в од н ым ра с тв ором п е рок с ид а в одоро да 2-гидроксибензальдоксим п рояв ляе т б и фун к ц и он а л ьн ые с в ойства. С повышением степени окисления атома сурьмы наблюдаетс я рас ще п ле н и е од н о й с в язи Sb–C, при этом продуктом реакции является биядерный сурьма-о рга н ическ и й к омпл е кс , в к отором а томы ме т алла ш е с ти коорд и н и ров а ны [24].
Пред п олага е м ый н а ми меха н и зм р е а к ц и и можно представить схемой:
Ar3Sb + H2O2
OH
Ar 3 Sb
OH
HON=CHC6H4OH-2 OH
----------------> Ar3Sb
- H 2 O
ON=CHC6H4OH-2
Ar3Sb(OH)ON=CHC6H4OH-2
- H 2 O
HO
Ar
N
Ar O
/ уO I Ar
O Ar Ar
- 2 ArH
Схема 1
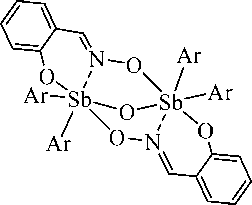
Характер 2- о к с и б е н за л ьдок с и ма тн ы х лига н д ов в м оле к у ла х 11 - 13 определяется как триден-татны й , за с че т с в языв а ни я с од н и м и з а томов Sb через атом кислорода иминоксигруппы, а с другим – ч е ре з атом к и сл орода ги д роксильной группы и координационной связи Sb···N (рис. 2–4).
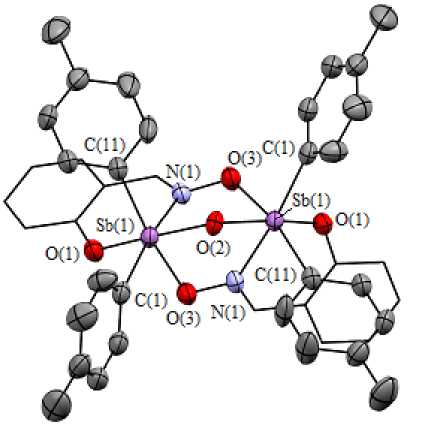
Рис. 2. Молекулярная структура 11а (атомы водорода и сольватная молекула толуола не приведены)
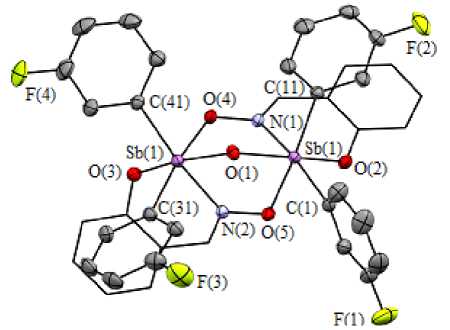
Рис. 3. Молекулярная структура 12 (атомы водорода не приведены)
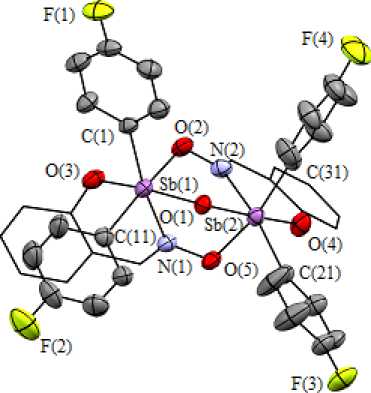
Рис. 4. Молекулярная структура 13 (атомы водорода не приведены)
Координация атомов м ет а лла в 11 - 13 искаженная октаэдрическая: транс -углы составляют 162,0(2)º-172,2(2)º. Дли ны с в язе й Sb-C варьируют в интервале 2,108(7)- 2,139(7) Å. Три типа расстояний Sb-О н ес коль к о ра зли чаю тс я : Sb–O(N=C) – 2,076(2) - 2,097(4) Å; Sb-О мост – 1,943(3) 1,958(4) Å; Sb–O(C Ar ) – 2, 002( 2 ) - 2,020(4) Å. Достаточно короткие расстояния Sb···N (2,230(3) 2,267(5) Å при сумме ван-дер- в аа льс ов ых р а д и у с о в Sb и N 3,61 Å [27]) являются доказательством си льн ого не в а ле н тн о го в за и модействия, которое вызывает уменьшение у глов CNO (до 115,0(2)º - 116,2(5)º) п о с р а в н е н и ю с 12 0 º.
Э лек трон ны е э ф фек ты за ме с ти те ле й в а ри льных радикалах при атоме металла не являются ф а к тором, вл и я ющ и м н а и с к аже н и е в а ле н тных у глов и д ли н у с в язе й Sb-О в 11 - 13 . Наиболее короткие расстояния Sb-С н а б л ю даю тс я в молекуле 11 , содержащей пара -толильные лиганды.
Ра с с т оян и е меж д у а том а ми с у рьмы жесткого [2.2.1]гептанового фрагмента составляет 3,361(2) - 3,378(1) Å, что зн а чи те льно ме ньше у дв ое н ного в а н -дер-ваальсового радиуса Sb (4,12 Å [27]).
На осно ван ии данны х РС А впервые была проведена количественная оценка ст ер ич еског о ф а ктора в молекулах дио ксим ат о в триарилсурьмы по степени заполнения координацио нно й сф ер ы ат о м а сур ь м ы в м о дел и т е л есны х углов лигандов и выявлена взаимосвязь с нал ич ием вн ут р и м о ле кул я р ны х в з аим о действи й , пр иво дящих к искажению геометрических характерист ик м о л екул .
Параметр G (%) ха рак те р и зует процент заполнения координационной сф е р ы а тома ме т а л л а в се ми ли га н д а ми с у че том об ла с те й п е р е к р ыв а н и я (G γ , %) телесных углов двух и более лигандов. Параметр G 2,28 (%) оценив а ет с тепень заполнения координационного простр а н с тв а лигандом на расстоянии в 2,28 Å о т а т ома металла, что позволяет сравнить между собой вк лад р а зн ых ли га ндов в заполнение коорд и на ц и онн ой с ф е ры це н тра л ьн ого а том а .
Согласно расчетам степень заполнения координационного пространства центрального атома (G-параметр) в диоксиматах триарилсурьмы 1-9 составляет 80,19 - 85,70 % (табл. 3). Параметр G 2,28 (Ar) практически одинаков во всех структурах и не зависит от наличия заместителей в арильных группах, поэтому заполнение координационной сферы в 1-9 определяется оксиматны-ми лигандами и расстояниями Sb ⋅⋅⋅ N. Так, в группах или парах соединений с одинаковыми окси-матными лигандами ( 1 , 6 , 8 ; 2 , 7 и 3 , 9 ) наибольшие значения параметра G 2,28 для оксиманых лигандов имеют место в 1 , 2 и 3 , где расстояния Sb ⋅⋅⋅ N наименьшие (2,841(3), 2,844(4) Å в 1 ; 2,839(4), 2,850(3) в Å 2 ; 2,728(4), 2,849(3) в Å 3 ). В структуре 10 более полное насыщение координационной сферы (90,93 %) обеспечивается, напротив, арильными лигандами, которые формируют внутримолекулярные взаимодействия Sb···OMe.
В структурах 11–13 , в которых оксиматный лиганд является тридентатным мостиковым, а атомы сурьмы гексакоординированы, степень заполнения координационного пространства превышает 90 % (G ср. 93,89 % 11 , 92,30 % 12 , 91,81 % 13 ).
Таблица 3
Значения параметров G и G 2,28 для молекул диоксиматов триарилсурьмы Ar 3 Sb(ON=CHAr') 2
|
№ |
Ar, Аr' |
G, % |
G 2,28 (Ar), % |
G 2,28 (ON=CHAr'), % |
|
1 |
p -Tol, С 6 Н 4 Br-2 |
83,55 |
15,25, 15,33, 15,27 |
14,02, 14,00 |
|
2 |
p -Tol, С 6 Н 4 OH-2 |
85,70 |
15,28, 15,33, 15,33 |
15,24, 15,10 |
|
3 |
p -Tol, С 6 Н 4 NO 2 -2 |
84,60 |
15,28, 15,24, 15,27 |
14,09, 14,94 |
|
4 |
p -Tol, С 4 Н 3 O |
83,56 |
15,51, 15,36, 15,32 |
13,58, 13,66 |
|
5 |
p -Tol, С 4 Н 2 O-NO 2 -5 |
80,19 |
15,30, 15,41, 15,33 |
13,68, 13,62 |
|
6 |
3-FC 6 H 4 , С 6 Н 4 Br-2 |
82,51 |
15,31, 15,23, 15,35 |
13,69, 13,83 |
|
7 |
3-FC 6 H 4 , С 6 Н 4 OH-2 |
82,95 |
15,36, 15,57, 15,35 |
14,66, 14,66 |
|
8 |
4-FC 6 H 4 , С 6 Н 4 Br-2 |
82,32 |
15,17, 15,32, 15,37 |
13,66, 13,85 |
|
9 |
4-FC 6 H 4 , С 6 Н 4 NO 2 -2 |
83,58 |
15,30, 15,35, 15,36 |
13,93, 14,74 |
|
10 |
2-MeO-5-BrC 6 H 3, С 6 Н 4 Br-2 |
90,93 |
18,08, 17,97, 17,67 |
13,65, 13,74 |
Выводы
С учетом геометрии молекул в кристаллическом состоянии (по данным РСА) впервые проведен количественный расчет степени заполнения координационной сферы атома сурьмы лигандами (G-параметр, %) в диоксиматах триарилсурьмы, что позволяет оценить стерический фактор. G-параметр в молекулах 1-9 варьирует в пределах 80,19 - 85,70 %. Установлено, что арильные группы, не имеющие координирующих центров, способных образовывать невалентные взаимодействия с атомом сурьмы, вносят примерно одинаковый вклад в насыщение координационной сферы центрального атома, и поэтому G-параметр определяется, главным образом, вкладами ок-симатных лигандов. Насыщение координационного пространства центрального атома в соединении 10 (G 90,93 %) обусловлено арильными лигандами, которые образуют внутримолекулярные невалентные взаимодействия Sb···OМе. Заполняемость координационной сферы металла в соединениях 11–13 , в которых атомы сурьмы гексакоординированы, превышает 90 %.
Список литературы Строение диоксиматов триарилсурьмы и оценка степени заполнения координационной сферы атома металла
- Sharutin V.V., Molokova O.V., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2004. V. 74, No. 10. Р. 1485. DOI: 10.1007/s11176-005-0041-4.
- Sharutin V.V., Sharutina O.K., Molokova O.V. // Russ. J. Inorg. Chem. 2012. V. 57, No. 6. P. 832. DOI: 10.1134/S0036023612010226.
- Gupta A., Sharma R.K., Bohra R. et al. // Polyhedron. 2002. V. 21. P. 2387. DOI: 10.1016/S0277-5387(02)01155-5.
- Yin H, Quan L., Li L. // Inorg. Chem. Commun. 2008. V. 11. P. 1121. DOI: 10.1016/j.inoche.2008.06.017.
- Dodonov V.A., Gushchin A.V., Gor'kaev D.A. et al. // Russ. Chem. Bull. 2002. V. 51. P. 1051. DOI: 10.1023/A: 1019634307064.
- Sharutin V.V., Sharutina O.K., Molokova O.V. et al. // Russ. J. Coord. Chem. 2002. V. 28, No. 7. P. 464. DOI: 10.1023/A:1016293009968.
- Sharutin V.V., Sharutina O.K., Molokova O.V. et al. // Russ. J. Gen. Chem. 2001. V. 71, No. 8. P. 1243. DOI: 10.1023/A: 1013220911661.
- Sharutin V.V., Sharutina O.K., Artem'eva E.V. et al. // Bull. South Ural State Univ. Ser. Chem. 2014. V. 6, No. 2. P. 5. EDN: SAUKZV
- Sharutin V.V., Sharutina O.K., Artem'eva E.V. et al. // Russ. J. Inorg. Chem. 2015. V. 60, No. 2. P. 170. DOI: 10.1134/S0036023615020138.
- Sharutin V.V., Sharutina O.K., Gabitova D.M. et al. // Russ. J. Inorg. Chem. 2017. V. 62, No. 1. Р. 55. DOI: 10.1134/S003602361701017X.
- Sharutin V.V., Sharutina O.K., Artem'eva E.V. et al. // Russ. J. Gen. Chem. 2016. V. 86, No. 12. P. 2671. DOI: 10.1134/S1070363216120161.
- Sharutin V.V., Sharutina O.K., Artem 'eva E.V. et al. // Bull. South Ural State Univ. Ser. Chem. 2015. V. 7, No. 2. P. 17. EDN: TQIWUT
- Sharutin V.V., Sharutina O.K., Artem 'eva E.V. et al. // Bull. South Ural State Univ. Ser. Chem. 2016. V. 8, No. 2. P. 61. DOI: 10.14529/chem160207.
- Artem'eva E.V., Makerova M.S., Sharutin V.V. et al. // Bull. South Ural State Univ. Ser. Chem. 2017. V. 9, No. 2. P. 50. DOI: 10.14529/chem170207.
- Молокова О.В. Оксиматы тетра- и триарилсурьмы. Синтез и строение: дис.... канд. хим. наук. Благовещенск, 2001. 118 с.
- Sharutin V.V., Poddel'sky A.I., Sharutina O.K. // Russ. J. Coord. Chem. 2020. V. 46. P. 663. DOI: 10.1134/s1070328420100012.
- Cambridge Crystallographic Database. Release 2023. UK: University of Cambridge.
- Guzei I.A., WendtM. // Dalton Trans. 2006. V. 33. P. 3991. DOI: 10.1039/b605102b.
- Bruker. SHELXTL/PC. Versions 5.10. An Integrated System for Solving, Refining and Displaying Crystal Structures from Diffraction Data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726.
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Бутлеровские сообщения. 2016. Т. 47. С. 145. EDN: XHTWFD
- Sharutin V.V., O.K. Sharutina, A.N. Efremov // Russ. J. Coord. Chem. 2017. V. 43. Р. 526. DOI: 10.1134/S1070328417080073.
- Ефремов А.Н. // Вестник ЮУрГУ. Серия «Химия». 2022. Т. 14. С. 34. DOI: 10.14529/chem220403.
- Sharutin V.V., Sharutina O.K., Efremov A.N. et al. // Russ. J. Inorg. Chem. 2019. V. 64. Р. 597. DOI: 10.1134/S0036023619050188.
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and Processing Software for the SMART System. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Cordero B., Gómez V., Platero-Prats A.E. et al. // Dalton Trans. 2008. V. 21. P. 2832. DOI: 10.1039/B801115J.
- MantinaM., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113. P. 5806. DOI: 10.1021/jp8111556.
- Sharutin V.V., Senchurin V.S., Sharutina O.K. et al. // Russ. J. Gen. Chem. 2011. V. 81. Р. 2102. DOI: 10.1134/S1070363211100100.
- Sharutin V.V., Sharutina O.K. // Russ. J. Inorg. Chem. 2014. V. 59. P. 1263. DOI: 10.1134/S0036023614110229.


