Структура и ионообменные свойства полисурьмяной кристаллической кислоты
Автор: Меженина Ольга Александровна, Бурмистров Владимир Александрович, Балыкин Владимир Петрович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Физическая химия
Статья в выпуске: 13 (272), 2012 года.
Бесплатный доступ
Приведены результаты исследования изменения структурных характеристик Me, Н-форм полисурьмяной кристаллической кислоты (Me - Li, Na, К, Ag, Ва, Pb) в зависимости от степени замещения а противоионов на ионы металлов, проанализированы дифракционные картины Ме, Н-форм полисурьмяной кристаллической кислоты, установлены границы существования твердых растворов, образующихся при замещении протонов ионами одно-, двухвалентных металлов.
Полисурьмяная кристаллическая кислота, ионный обмен, структура типа пирохлор, твердые растворы
Короткий адрес: https://sciup.org/147160225
IDR: 147160225 | УДК: 544.169
Текст научной статьи Структура и ионообменные свойства полисурьмяной кристаллической кислоты
Полисурьмяная кристаллическая кислота (ПСКК) относится к классу неорганических ионообменных материалов, которые используются для создания композиционных ионообменных мембран [1]. По данным [2, 3] ПСКК имеет структуру пирохлора (пр.гр. симметрии Fd 3 m ), трехмерный остов которой образован сочлененными по вершинам [SbVO 6 ]-октаэдрами. В этой структуре ионы сурьмы и кислорода занимают 16 с - и 48 f - правильные системы точек, а противоионы (ионы оксония) [2] статистически размешаются в 16 d -позициях [4].
Известно, что ионообменные свойства ПСКК обусловлены диффузионной подвижностью протонных группировок [5]. В щелочных растворах и растворах солей протонные группировки могут быть замещены на ионы одно- и двухвалентных металлов (Li, Na, К, Ag, Ва, Pb). При этом следует ожидать изменение структурных параметров кристаллической решетки [6]. Однако подобные исследования в литературе отсутствуют. Целью настоящей работы являлось исследование структурных параметров при замещении протонных группировок на ионы Ме (Ме – Li, Na, К, Ag, Ва, Pb).
Экспериментальная часть
Ионозамещенные формы ПСКК (в дальнейшем Ме, Н-формы ПСКК; Men+-Li+, Na+, K+, Ag+, Ba2+, Pb2+) получали путем ионного обмена на ПСКК в растворах солей или гидроксидов вышеуказанных металлов. Для этого навеску исходного высушенного образца ПСКК состава Sb 2 O 5 ^2H 2 O массой 3,000±0,002 г помещали в 100 см3 соответствующего водного раствора известной концентрации и выдерживали при перемешивании в течение 24 часов. При получении Ag, Н- и Pb, Н-форм ПСКК использовали растворы AgNO 3 и Pb(NO 3 ) 2 , а остальных Ме, Н-форм – растворы гидроксидов NaOH, KOH, LiOH, Ba(OH) 2 . По окончании ионного обмена Ме, Н-формы промывали дистиллированной водой и высушивали.
Для получения Ме, Н-форм ПСКК с различной степенью ионного обмена изменяли концентрацию растворов. Степень ионного обмена а рассчитывали двумя независимыми методами:
-
а) из уравнений ионного обмена [7] по изменению концентрации Ме n +- или Н+-ионов в растворе:
H 2 Sb 2 O 6 . 2H 2 O + ( 2% ) Me ( NO 3 ) n ^ Me 2 „ n H 2 - 2 АО б ' 2^O + 2all\<> 3 .
-
б) для Ag, Н- и Pb, Н-форм, плотность которых существенно изменяется с ростом а, величину а рассчитывали также и из данных гравиметрического анализа по изменению массы A m образцов до и после ионного обмена из соотношений:
Ki
а- /К , K 0
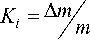
, ис
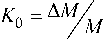
ПСКК
где NM - теоретически рассчитанное по реакции (1) изменение молекулярной массы ПСКК при ионном обмене; М ПСКК – молекулярная масса ПСКК. Взвешивание образцов осуществляли на аналитических весах второго класса точности. Титрование суспензии исходной ПСКК проводили по известной методике в статическом режиме [2]. Измерение pH растворов осуществляли милливольтметром pH-121.
Фазовый состав контролировали методом рентгеновского анализа, который проводили на дифрактометре ДРОН 3 (фильтрованное CuKa-излучение) в диапазоне углов дифракции 20 от 10 до 140 град. Параметр a элементарной ячейки определяли по рефлексу (10 6 2). Ошибка в определении параметра a составила ±0,003Å.
Результаты и их обсуждение
На кривых титрования ПСКК растворами щелочей соответствующих металлов (Li, Na, К, Ba) выделяются два участка, на которых рН суспензии практически не изменяется с приливанием щелочи, и участок, обусловленный резким увеличением рН (рис. 1). Постоянные значения рН суспензии в широком интервале изменений количества приливаемой щелочи однозначно указывают на поглощение из раствора ионов щелочных металлов, бария полисурьмяной кристаллической кислотой. Увеличение рН на втором участке обусловлено увеличением в растворе гидроксильных групп, что свидетельствует о появлении в растворе щелочи. Величину максимальной ионообменной емкости ПСКК для данного иона рассчитывали из результатов кривой титрования и холостого опыта.
При помещении образцов ПСКК в растворы азотнокислого свинца и серебра наблюдается монотонное уменьшение рН исходной суспензии с увеличением степени ионного обмена от 3,7 до 1,3 (при максимальном замещении), что свидетельствует об увеличении концентрации протонов в растворе [8]. При этом отмечено монотонное возрастание массы образцов с увеличением концентрации растворов, что свидетельствует о замещении протонных группировок в структуре ПСКК более тяжелыми ионами серебра и свинца. Полученные данные позволяют заключить, что при ионном обмене происходит эквивалентное замещение ионов водорода, входящих в структуру ПСКК, ионами серебра и свинца. Однако при ионном обмене не все ионы поглощаются твердой фазой ПСКК, часть из них остаётся в растворе. Наблюдается стадийность процесса замещения. Наиболее ярко она проявляется при ионном обмене ПСКК в растворах азотнокислого серебра [8].
Так, на изотерме ионного обмена (рис. 2) выделяются 3 участка, характеризующиеся различным видом зависимости концентрации Ад+-ионов в твердой ( у) и жидкой (у ) фазах. На первом участке происходит «быстрый» ионный обмен, при этом практически все ионы серебра из раствора поглощаются твердой фазой, а концентрация ионов серебра в растворе практически равна нулю. Концентрационная область первого участка ионного обмена - 0,4 < у < 2,2 мг-экв/г. На втором участке (2,2 < у < 5,2 мг-экв/г) количество ионов серебра в твердой фазе монотонно увеличивается с увеличением у и асимптотически приближается к значению 5,2 мг-экв/г (рис. 2). На
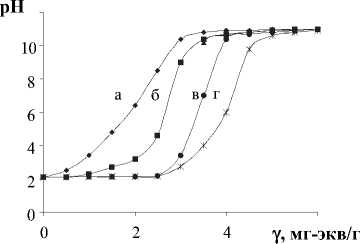
Рис. 1. Кривые титрования ПСКК растворами: (a) – LiOH; (б) – KOH; (в) – NaOH; (г) – Ba(OH) 2
У ,
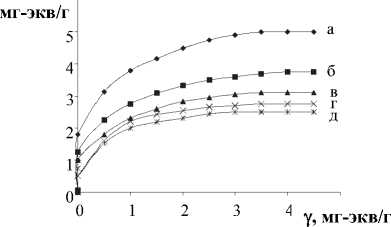
Рис. 2. Изотермы обмена Н+ на Ме+-ионы в ПСКК:
(а) – Ag+; (б) – Na+; (в) – Li+; (г) – K+; (д) – Ba2+
третьем участке изотермы (у >3 ,5 мг-экв/г) количество ионов серебра в твердой фазе не меняется. Процесс ионного обмена протекает в две стадии. Концентрационные интервалы для первой и второй стадии составляют 0,4 < у < 2,2 мг-экв/г и 2,2 < у< 5,2 мг-экв/г соответственно.
Полученные данные коррелируют с результатами других авторов [8, 9]. Так, в [8] приводится кривая изотермы ионного обмена, на которой также выделяются две стадии. При этом у составляет 0,4 у0 (у0 — теоретическая ионообменная ёмкость). В [9] две стадии ионного обмена авторы связывают с неэквивалентным состоянием противоионов в ПСКК. Согласно этим данным, у=5/14 у0.
Таким образом, ионообменная емкость у ПСКК, рассчитанная согласно (1), в данном случае составляет 5,2 мг-экв/г и близка к теоретической (у0 =5,3 мг-экв/г [10]).
Это свидетельствует о практически полном замещении противоионов ионами серебра. При этом степень ионного обмена а составляет 0,98, что соответствует соотношению заместившихся ионов серебра и ионов сурьмы 1:1.
Проведенные исследования по изменению массы образцов К i и изотермы ионного обмена позволили получить образцы с различным содержанием ионов металлов и определить составы Ме, Н-форм ПСКК (см. таблицу).
Количество заместившихся ионов металла в ПСКК состава Sb 2 О 5 ·3Н 2 О по данным ионного обмена ( у i ) и гравиметрии (К i )
|
№ п/п |
У i , г[Ме]/г |
K i , г[Ме]/г |
у, мг-экв/г |
а, от. ед |
|
– |
Ag, Н-формы ПСКК |
|||
|
1 |
0,29 |
0,293 |
2,7 |
0,51 |
|
2 |
0,56 |
0,601 |
5,2 |
0,98 |
|
– |
Pb, Н-формы ПСКК |
|||
|
3 |
0,30 |
0,295 |
1,44 |
0,54 |
|
4 |
0,55 |
0,549 |
2,6 |
0,98 |
|
– |
Na, Н-формы ПСКК |
|||
|
5 |
0,09 |
0,088 |
3,8 |
0,72 |
|
– |
Ba, Н-формы ПСКК |
|||
|
6 |
0,14 |
0,16 |
1,1 |
0,40 |
|
7 |
0,32 |
0,317 |
2,3 |
0,86 |
|
– |
К, Н-формы ПСКК |
|||
|
8 |
0,10 |
0,102 |
2,6 |
0,49 |
|
– |
Li, H-формы ПСКК |
|||
|
9 |
0,02 |
– |
3,1 |
0,58 |
На рентгенограммах исходного ПСКК, а также частично либо полностью замещенных его Ме, Н-форм (рис. 3) присутствует одинаковый набор дифракционных максимумов ( h , k , l ). С увеличением количества Ме-ионов в пирохлорной фазе происходит закономерное перераспределение относительных интенсивностей между различными группами рефлексов.
По мере увеличения степени ионного обмена а отмечено уменьшение относительных интенсивностей ( I hkl ) всех рефлексов с нечетными индексами Миллера (рис. 4).
Из анализа полученных данных следует, что при a=const величина интенсивности I hkl монотонно уменьшается с ростом атомного фактора рассеяния ионов [11]. С учетом рентгеновских данных о сохранении симметрии катионита при ионном обмене перераспределение интенсивностей однозначно свидетельствует о том, что с увеличением количества ионов металлов в твердой фазе меняется структурная амплитуда пирохлорной фазы, а следовательно, изменяется и базис элементарной ячейки. Из этого следует, что ионы металлов проникают внутрь кристаллической структуры, т. е. сорбция носит объемный характер.
I i /Im, %
а)
511, 333
711, 731,
551 553
444 .
444 800
б)

0 10 20 30 40 50 60 70 2 0 , град
Рис. 3. Штрих-рентгенограммы образцов Ме, Н-форм, где Ме: (а) – Li; (б) – Na; (в) –Ba; (г) –Pb; (д) – Ag
Форма и полуширина одноименных максимумов ПСКК и её Ме, Н-форм (Ме – Li, Na, К, Ag, Ва, Pb) в пределах ошибки экспериментальных данных не изменяются. Это позволяет заключить, что при ионном обмене:
-
а) сохраняется симметрия кристаллической решетки катионита;
-
б) не происходит существенного изменения размеров областей когерентного рассеяния.
Таким образом, при ионном обмене объемная сорбция ионов металлов происходит не за счет химического взаимодействия между ПСКК и растворами, сопровождающаяся разрушением исходных кристалликов и ростом новых, а осуществляется путем встречной диффузии ионов металлов внутрь кристаллической структуры и ионов водорода – из неё. Встречная диффузия этих ионов, имеющих различный ионный радиус, но одинаковый заряд, приводит к изменению базиса элементарной ячейки пирохлорной фазы без нарушения локальной электронейтральности и симметрии кристаллической структуры.
Кривые зависимости параметра элементарной ячейки воздушно-сухих образцов Ме, Н-форм ПСКК от степени ионного обмена представляют собой прямые, угол наклона которых различный в зависимости от интервала замещения и иона, принимающего участие в ионном обмене (рис. 5). По мере увеличения степени ионного обмена а величина и знак изменения параметра а зависит от значений ионного радиуса ( ri ) Me n+ -ионов.
В частности, из исследованных Ме, Н-форм ПСКК наибольшие по величине изменения параметра а наблюдаются для Li, Н- (параметр а уменьшается с ростом а) и К, Н-форм ПСКК (параметр а возрастает с ростом а), в состав которых входят Me n +_ ионы с наименьшим и наибольшим ионным радиусом соответственно ( r i (Li + )=0,060 нм; r i (K + )=0,133 нм), а у Na, H- и Ag,
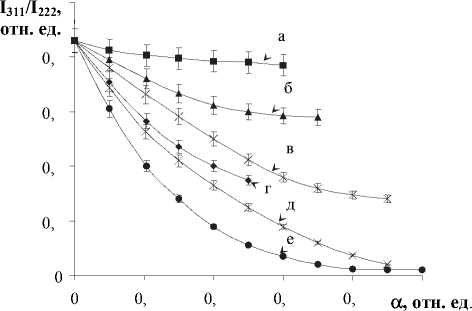
Рис. 4. Изменение относительной интенсивности рефлексов I 311 /I 222 ПСКК от степени замещения Н+ на Ме+-ионы, где Ме+: (а) – Li+; (б) – Na+; (в) – Ва2+; (г) – К+; (д) – Pb2+; (е) – Ag+
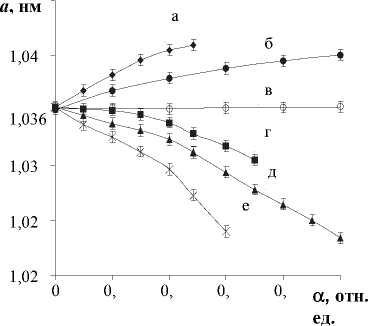
Рис. 5. Изменение параметра а элементарной ячейки ПСКК состава Sb2O 5 - 3H 2 O от степени замещения ( а ) Н + на Ме + -ионы, где Ме + : (а) – К+; (б) – Ва2+; (в) – Pb2+; (г) – Na+; (д) – Ag+; (е) – Li+
H-форм ПСКК ( r i (Na + )=0,095 нм; r i (Ag + )=0,110 нм [12]) изменения параметра а с ростом а менее ярко выражены (рис. 5).
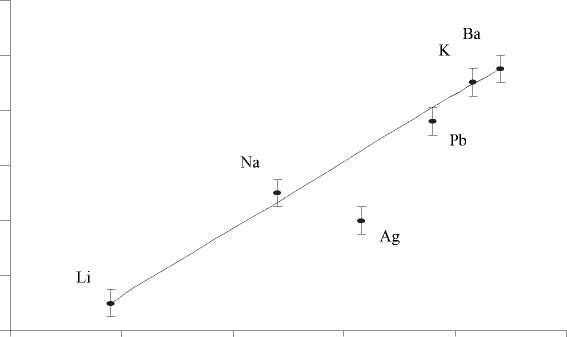
Из полученных экспериментальных данных о линейном изменении структурных параметров Ме, Н-форм ПСКК с ростом степени замещения а протонсодержащих группировок в ПСКК на Меn+-ионы следует, что в исследуемой области концентрации ионы металлов статистически распределяются в 16 d- позициях пространственной группы симметрии Fd3m. Полученные экспериментальные данные позволили построить зависимость параметра элементарной ячейки ПСКК от ионного радиуса металлов, принимающих участие в ионном обмене для одинаковой степени замещения а (рис. 6). Как видно из приведенной зависимости, параметр элементарной ячейки для всех исследованных ионов металла при одинаковом коэффициенте заполнения 16 d -позиций (8 позиций из 16) линейно возрастает с увеличением радиуса ионов.
a , нм
1,030
1,040
1,036
1,034
1,032
0,05
0,07
0,09
0,11
0,13
r, нм
Рис. 6. Зависимость параметра элементарной ячейки а ПСКК от величины ионного радиуса r ионов, статистически расположенных в восьми из 16 d -позиций структуры пространственной группы симметрии Fd 3 m
Заключение
На основании выявленных закономерных изменений дифракционной картины Ме, Н-форм ПСКК и зависимости параметра а элементарной ячейки от радиуса Ме n + -ионов можно сделать однозначный вывод о том, что сорбция Ме n +-ионов кристаллической полисурьмяной кислотой носит объемный характер, а сами Меn+-ионы в структуре Ме, Н-форм ПСКК статистически распределены по 16 d -позициям. Монотонная зависимость межионных расстояний и параметра а элементарной ячейки от степени ионного обмена а и ионного радиуса металлов свидетельствует о том, что с кристаллохимической точки зрения Ме, Н-формы ПСКК следует рассматривать как твердые растворы гипотетических гидратированных антимонатов металлов состава Ме 16/n Sb 16 O 48 ·8H 2 O в кристаллической полисурьмяной кислоте с ограниченной областью растворимости.
Список литературы Структура и ионообменные свойства полисурьмяной кристаллической кислоты
- Особенности гидратации ионов H+, Li+, Na+, Cs+ в перфторированных сульфокатионных мембранах МФ-4СК, модифицированных неорганическими допантами/Е.Ю. Сафронова, B.И. Волков, А.А. Павлов и др.//Журнал неорганической химии. -2011. -Т. 56, № 2. -C. 192-198.
- Белинская, Ф.А. Неорганические ионообменные материалы на основе труднорастворимых соединений сурьмы (V)/Ф.А. Белинская, Э.А. Милицина//Успехи химии. -1980. -Т. 49. Вып.10. -С. 1904-1936.
- Abe, M. Synthetic inorganic ion exchange materials. XVIII. Ionexchange equilibria of crystalline antimonic (V) acid with alkali metals/M. Abe//J. Inorg and Nucl. Chem. -1979. -V. 41, № 1. -P. 85-89.
- Изменение протонной структуры гидрата пентаоксида сурьмы при термолизе и ионном обмене/В.А. Бурмистров, Д.Г. Клещев, В.Н. Конев, Р.Н. Плетнев//Журнал неорганической химии. -1985. -Т. 30, № 8. -С. 1959-1963.
- Протонная составляющая в гидрате пентаоксида сурьмы и её роль в процессе термолиза и ионном обмене/В.А. Бурмистров, Д.Г. Клещев, А.А. Бауэр, Г.В. Клещев//Ионный обмен и ионометрия: сб. науч. тр. -Л., 1984. -Вып. 2. -С. 28-36.
- Рентгенографические исследования Ме-форм гидрата пентаоксида сурьмы/А.А. Бауэр, Д.Г. Клещев, В.А. Бурмистров и др.//Журнал неорганической химии. -1984. -Т. 20. -Вып. 10. -С. 2471-2475.
- Кокотов, Ю.А. Равновесие и кинетика ионного обмена/Ю.А. Кокотов, В.А. Пасечник. -Л.: Химия, 1970. -336 с.
- Две стадии ионного обмена в системе ГПС -Н2О/В.А. Бурмистров, Д.Г. Клещев, А.А. Бауэр и др. -Люберцы, 1981. -Деп. в ВИНИТИ, № 3464-81.
- Baetsle, L.H. Structure and ion-exchange characteristics of polyantimonic acid/L.H. Baetsle, D. Huys//J. Inorg and Nucl. Chem. -1968. -V. 30, № 2. -P. 639-649.
- Abe, M. Synthetic inorganic ion-exchange materials. XXI. Ion-exchange properties on crystalline antimonic (V) acid/M. Abe, M. Tsuji, N. Kimura//Bull. Chem. Soc. Japan. -1981. -V. 54. -P. 1300-1324.
- Миркин, Л.И. Справочник по рентгеноструктурному анализу поликристаллов/Л.И. Миркин. -М.: ГИФ-ФЛ, 1961. -863 с.
- Бурмистров, В.А. Структурные изменения гидрата пентаоксида сурьмы при ионном обмене в системе ГПС -AgNO3 -H2O/В.А. Бурмистров, В.Н. Конев, Е.А. Иванова//Труды Челябинской научно-практической конференции по физики и химии твёрдого тела: тез. докл. -Челябинск, 1981. -С. 60.


