Структура и разнообразие микробной солевой корки в сульфатном озере Гуджирганское Баргузинской котловины (Бурятия)
Автор: Лаврентьева Е.В., Буянтуева Л.Б., Валова Е.Э., Банзаракцаева Т.Г., Дамбаев В.Б., Иванов В.Л.
Журнал: Природа Внутренней Азии @nature-inner-asia
Рубрика: Биология
Статья в выпуске: 4 (22), 2022 года.
Бесплатный доступ
Озеро Гуджирганское - это уникальный природный комплекс экстремальных экологических условий, где резкие сезонные и суточные перепады температуры, нестабильный водный режим, значительные колебания солености и температуры воды, выпадение солей на поверхности озера, в свою очередь, определяют структуру микробного сообщества в озере. С использованием технологий высокопроизводительного секвенирования изучено разнообразие прокариот в солевых корках. Основу микробного сообщества составили представители y-Proteobacteria;a-Proteobacteria, Firmicutes и Bacteroidetes. На родовом уровне представлены галофильные и умеренно галофильные алкалофильные бактерии, а также обнаружены последовательности генов 16S рРНК, которые не могут быть классифицированы на уровне родов, что указывает на потенциально новых представителей Bacteria, присутствующих в этой экстремальной экосистеме.
Сульфатное озеро, микробное сообщество, солевые корки, разнообразие, высокопроизводительное секвенирование, ген 16s ррнк
Короткий адрес: https://sciup.org/148325510
IDR: 148325510 | УДК: 579.26 | DOI: 10.18101/2542-0623-2022-4-50-58
Текст научной статьи Структура и разнообразие микробной солевой корки в сульфатном озере Гуджирганское Баргузинской котловины (Бурятия)
Микробные сообщества обладают удивительной способностью выживать в экстремальных условиях. Соленые озера являются одним из таких примеров и представляют собой одни из самых обширных биомов нашей планеты. В настоящее время в соленых озерах существует значительный интерес к микробным сообществам, колонизирующим солевую корку на поверхности эвапоритовых отложений [Wierzchos et al., 2006]). Известно, что среды, которые когда-то считались безжизненными, теперь содержат организмы, приспособленные к различным физическим и химическим воздействиям [Ротшильд и Манчинелли, 2001].
Соленое озеро Гуджирганское, расположенное в Баргузинской котловине, относится к группе Алгинских озер. Эти озера образуются в результате разгрузки термальных трещинно-жильных вод, относящихся к сульфатному натриевому химическому типу [Плюснин и др., 2019]. Сульфатное озеро Гуджирганское характеризуется нестабильным водным режимом, полным промерзанием в зимний период и значительными колебаниям солености и температуры воды. В течение сухого сезона большая часть озера покрыта солевыми корками и при понижении температуры наблюдается осаждение мирабилита.
Цель данного исследования — установить структуру микробного сообщества в солевой корке озера Гуджирганское.
Объекты и методы исследования
Исследуемое соленое озеро Гуджирганское (54º01'890" с. ш. 110º16'537" в. д., высота 493 м. над уровнем моря) входит в группу Алгинских озер, мелководное и имеет относительно малые площади — 0,3 км2.
На момент отбора проб (август 2019 г.) площадь озера Гуджирганское была покрыта сухой солевой коркой толщиной от 0,5 до 5 см. На ее поверхности наблюдалось выпадение кристаллов тенардита (Na2SO4). В небольших углублениях была обнаружена вода.


Рис. 1. Район расположения группы Алгинских озер и места отбора образцов в озере Гуджирганское
Для исследований были отобраны образцы солевых корок на станциях (Gudzh-1 и Gudzh-2). На станции Gudzh-1 была отобрана плотная сухая корка белого цвета с толщиной до 1 см, на станции Gudzh-2 образец был представлен сухим зеленым микробным матом с толщиной не более 0,5 см.
В воде на месте отбора проб были измерены рН и температура с помощью портативного рН метра рН-200 HM Digital (Южная Корея) с сенсорным термометром. Минерализацию определяли при помощи тест-кондуктометра TDS-4 (Сингапур). Для химического анализа воду отбирали в стерильную пластиковую бутылку. Макрокомпонентный состав воды определяли с помощью гидрохимических методов в ЦКП ГИН СО РАН (г. Улан-Удэ).
Для молекулярно-генетического анализа пробы осадков и микробных образований отбирали в стерильные пластиковые 15 мл пробирки типа Falkon и фиксировали этанолом до конечной концентрации 50% (об./об.). Пробу воды фильтровали через стерильный мембранный фильтр с порами размером 0,22 мкм. Фильтр затем помещали в стерильную пластиковую микропробирку и фиксировали этанолом. Пробы до выделения ДНК находились в холодильнике при + 4° С.
Выделение ДНК из соляных корок проводили с помощью набора DNeasy-PowerSoil Kit (Qiagen, США) по протоколу производителя. Качественную и количественную оценку полученных препаратов ДНК проводили с помощью спектрофотометра Nanodrop 1000 (Thermo Fisher Scientific, США). Регион V3-V4 гена 16S рРНК был амплифицирован с помощью праймеров 343F (5’-CTCCTACG-GRRSGCAGCAG-3’) и 806R (5’-GGACTACNVGGGTWTCTAAT-3’), содержащих адаптерные последовательности (Illumina), линкер и баркод (Fadroshetal., 2014). Амплификацию проводили вусловиях описанных ранее (Brouchkovetal., 2017). Ампликоны смешивали по 200 нг каждый и чистили в 1% агарозном геле с помощью набора MinEluteGelExtraction Kit (Qiagen). Секвенирование проводили в ЦКП “Биоспарк” (г. Москва) на секвенатореMiSeq (Illumina), используя набор Reagent Kit v3 (2х300, Illumina).
Полученные парные последовательности анализировались с помощью UPARSE скриптов при использовании Usearch v11.0 [Edgar, 2013]. Биоинформа-тическая обработка включала перекрывание парных ридов, фильтрацию по качеству и длине, учет одинаковых последовательностей, отбрасывание синглетонов, удаление химер и получение ОТЕ (Операционные Таксономические Единицы) с помощью алгоритма кластеризации UPARSE. Таксономическая принадлежность последовательностей OTU определялась с помощью SINTAX [Edgar, 2016] и референсной базы 16SRDPtrainingsetv16 [Wangetal., 2007]. Альфа разнообразие анализировали Usearch.
Референсные и ОТЕ последовательности выравнивались с помощью Clustal W. Филогенетический анализ проводили с использованием метода максимального правдоподобия (maximum likelihood phylogeny) в MEGA 6 [Tamura et al., 2013] (бутстреп 1000 альтернативных деревьев, модель Tamura-Nei ).
Результаты и обсуждение
Вода озера Гуджирганское в летний период (август 2019 г.) характеризовалась высокими значениями рН 9,2–9,3, значения минерализации воды в период исследований составили от 132 до 136 г/дм3. В период отбора проб значения температуры воды в озере составили + 19,2 – +23,1 °С. Исследуемое озеро характеризуется восстановленными условиями, окислительно-восстановительный потенциал был в пределах -0,76 мВ. Исследование ионно-солевого состава воды озера показало преобладание ионов натрия — 42 578,5–43 856,9 мг/дм3, что свойственно высокоминерализованным водам. В условиях сухого климата натрий — характерный элемент испарительной концентрации и определяет многие геохимические особенности степных районов. Содержание ионов магния составило 231–243 мг/дм3. В анионном составе доминирующим ионом являлся сульфат-ион. В воде озера обнаружено значительное содержание сульфатов (86 127–83 820 мг/дм3), содержание карбонатов не превышает 510 мг/дм3, гидрокарбонатов — 3 051 мг/дм3). Хлориды — постоянный компонент воды, его содержание в озере составило 2 570 мг/дм3. В воде озера Гуджирганское определены фториды, ионы кремния.
Прокариотические сообщества в озере Гуджирганское
Наши анализы показали, что большинство последовательностей генов 16S рРНК были отнесены к домену Bacteria (до 98%) и сгруппированы в 4 449 OTU.
В образце солевой корки Gudzh-1 было показано, что основу микробного сообщества составляют представители следующих филумов: Proteobacteria, Firmicutes, Bacteroidetes, Actinobacteria, Acidobacteria и Deinococci . В образце солевой корки Gudzh-2 доминировали представители Proteobacteria, Bacteroidetes, Firmicutes Cyanobacteria, Actinobacteria, Verrucomicrobiae, Gemmatimonadetes и Mollicutes. Для архей все последовательности были классифицированы на Euryarchaeota, Asgardaeota (Gudzh-1) и Euryarchaeota и Nanoarchaeaeota (Gudzh-2).
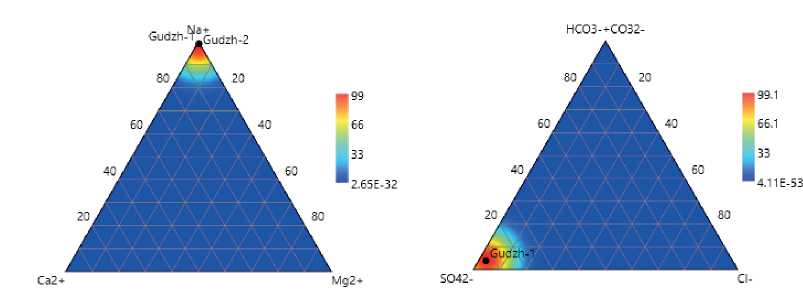
Рис. 2. Диаграмма катионного и анионного состава воды в озере Гуджирганское
Proteobacteria являлись наиболее распространенным бактериальным таксоном в изученных образцах. В нашем наборе данных 81% последовательностей Gudzh-1 были отнесены к представителям этого филума. Представители класса γ-Proteobacteriam доминировали, на их долю приходилось 56% всех обнаруженных последовательностей. Большинство последовательностей были отнесены к уже известному роду Halomonas . Доля α-Proteobacteria составила 24% общего числа всех последовательностей и представлена родами Rhodobaca, Rhodobacu-lum, Actibacterium и др. Представители δ -Proteobacteria составили 0,7% общего числа всех последовательностей и были представлены следующими родами: Desulfonatronovibrio, Bdellovibrio, Desulfomicrobium и др.
В образце Gudzh-2 доля класса γ-Proteobacteria составила 24% общего числа всех последовательностей и состояла из представителей различных родов, относящихся к Halomonas, Marinospirillum, Nitrincola, Wenzhouxiangella, Methylonatrum и др. Класс α-Proteobacteria представлен многочисленными родами Salinarimonas, Rhodobaca, Roseinatronobacter, Marispirillum и др.
ε-Proteobacteria в образце Gudzh-1 представлена хемолитотрофными Sulfuri-curvum и Sulfurimonas. Представители ε-Proteobacteria обнаружены в различных наземных и морских средах, включая глубоководные гидротермальные источники.
Представители филума Bacteroidetes составили от 4 до 26% общего числа всех последовательностей в изученных микробных сообществах. Доминирующими родами были Planktosalinus, Anditalea, Cyclobacterium, Aquiflexum, Mongoliibacter и Cyclobacterium . Следует отметить у Bacteroidetes обнаружена большая доля бактерий, отнесенных к некультивируемым формам.
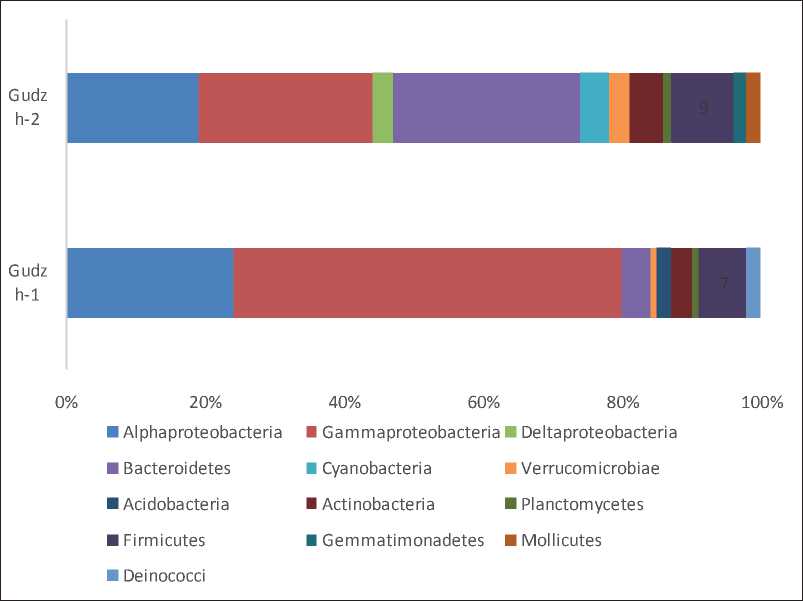
Рис. 3. Таксономическое разнообразие микробного сообщества в солевых корках озера Гуджирганское
Количество последовательностей, отнесенных к филуму Firmicutes, составило 7 и 9%. Большинство последовательностей были отнесены к классам Bacilli и Clostridia. К классу Bacilli отнесены алкалофильные бактерии родов Salipaludi-bacillus, Alkalibacterium и др. а также сульфатредуцирующий и арсенатредуци-рующий Desulfuribacillus . Представители этого рода солеустойчивы и алкало-фильны. Среди класса Clostridia наиболее распространены умеренные алкало-филы Anoxynatronum.
Около 3–5% последовательностей в микробном сообществе соляных корок отнесены к Actinobacteria. Последовательности актинобактерий были отнесены к Nitriliruptoria Actinobacteria, Acidimicrobia. Более половины актинобактериальных последовательностей принадлежали Nitriliruptoraceae . Представители актинобактерий отнесены к галотолерантным бактериям из соленых сред обитания со специфическими механизмами адаптации к экстремальным средам, особенно соленым и щелочным местообитаниям [Singh et al., 2012]. В филуме Actinobacteria обнаружены последовательности, которые содержат несколько неклассифицированных и ранее некультивируемых форм бактерий.
Представители архей представлены хемоорганотрофными галофильными Haloferacales. Также нами обнаружены последовательности нового филума Nano-archaeota, который широко распространен и в высокотемпературных биотопах.
В изученных солевых корках встречаются и другие филумы, такие как Verrucomicrobia , Chloroflexi и Deinococci. Эти результаты согласуются с исследованиями, где эти бактериальные филумы, по-видимому, доминируют в этих экосистемах [Farías et al., 2014]. Все эти группы, как известно, в изобилии присутствуют в морских экосистемах, а также в экстремальных условиях, таких как микробные маты из гиперсоленых озер.
В образце Gudzh-1 обнаружены последовательности, отнесенные к филуму Deinococci (2%) и которые представлены родом Truepera. Аэробные и хемоорга-нотрофные Deinococci характеризуются высокой устойчивостью к экстремальным факторам окружающей среды — высокой температуре [Theodorakopoulos et al., 2013] и ионизирующему излучению [Asker et al., 2011]. Мы предполагаем, что присутствие бактерий рода Truepera в озере Гуджирганское косвенно свидетельствует о разгрузке трещинно-жильных термальных вод сульфатно-натриевого химического типа.
Заключение
В этом исследовании мы использовали высокопроизводительное секвенирование бактериальных ампликонов гена 16S рРНК для изучения разнообразия. Proteobacteria, Firmicutes и Bacteroidetes являются основными филумами, представленными в изученных образцах солевых корок. Показано, что микробные сообщества солевых корок озера Гуджирганское состоят из множества высокоа-даптируемых организмов с гетерогенными физиологическими возможностями. На родовом уровне представлены галофильные и умеренно галофильные алкало-фильные бактерии, такие как Halomonas, Rhodobaca, Rhodobaculum и др. Интересным моментом является обнаружение большой доли последовательностей генов 16S рРНК, которые не могут быть классифицированы на уровне родов, что указывает на потенциальных новых представителей микробного мира, присутствующих в этой экстремальной экосистеме.
Список литературы Структура и разнообразие микробной солевой корки в сульфатном озере Гуджирганское Баргузинской котловины (Бурятия)
- Плюснин А. М., Перязева Е. Г., Чернявский М. К., Жамбалова Д. И., Будаев Р. Ц., Ангахаева Н. А. Генезис воды и растворенных веществ содовых озер Нижнего Куйтуна Баргузинской впадины // География и природные ресурсы. 2020. № 3. С. 89-97. Тесст: непосредственный.
- Asker D., Awad T. S., McLandsborough L., Beppu T., Ueda K. Deinococcus depoly-merans sp. nov., a gamma- and UV-radiation-resistant bacterium, isolated from a naturally radioactive site.Int. J. Syst. Evol. Microbiol. 2011; 61: 1448-1453.
- Edgar R. C. SINTAX: a simple non-Bayesian taxonomy classifier for 16S and ITS Sequences. BioRxiv preprint, 2016, p.20.
- Wang Y.-N., Cai H., Chi C.-Q., Lu A.-H., Lin X.-G., Jiang Z.-F., Wu X.-L. Halomonas shengliensis sp. nov., a moderately halophilic, denitrifying, crudeoil-utilizing bacterium.Int. J. Syst. Evol. Microbiol. 2007; 57(6): 1222-1226.
- Tamura K., Stecher G., Peterson D., Filipski A., Kumar S. MEGA6: Molecular Evolutionary Genetics Analysis version 6.0. Mol. Biol. Evol. 2013; 30: 2725-2729.
- Edgar R. C. UPARSE: highly accurate OTU sequences from microbial amplicon reads. Nat. Methods. 2013; 10: 996-998.
- Farias M. E., Contreras M., Rasuk M. C., Kurth D., Flores M. R., Poire D. G., Novoa F., Visscher P. T. Characterization of bacterial diversity associated with microbial mats, gypsum evaporites and carbonate microbialites in thalassic wetlands: Tebenquiche and La Brava, Salar de Atacama Chile. Extremophiles. 2014; 18(2): 311-29.
- Rothschild L. J., and Mancinelli R. L. Life in extreme environments. Nature. 2001; 409: 1092-1101.
- Theodorakopoulos N., Bachar D., Christen R., Alain K., Chapon V. Exploration of Deinococcus-Thermus molecular diversity by novel group-specific PCR primers. Microbiology Open. 2013; 2(5): 862-872.
- Wierzchos J., Ascaso C., and McKay C. P. Endolithic cyanobacteria in halite rocks from the hyperarid core of the Atacama Desert. Astrobiology. 2006; 6: 415-422. 10.1089/ ast.2006.6.415.


