Структура микокомплексов ризосферы и филлопланы арахиса культурного
Автор: Куркина Юлия Николаевна
Журнал: Овощи России @vegetables
Рубрика: Общее земледелие, растениеводство
Статья в выпуске: 2 (64), 2022 года.
Бесплатный доступ
Актуальность. Семена арахиса богаты маслами, белком, углеводами, витаминами и флавоноидами, поэтому широко используются в производстве продуктов питания, кормов, биодизеля, а также в медицине. При возделывании арахиса обязательно встает проблема снижения урожайности, а порой и качества семян, из-за воздействия фитопатогенных микроскопических грибов, а главными факторами передачи инфекционного начала являются почва и растительные остатки. Система защиты растений должна базироваться на знания структуры микокомплексов ризосферы и филлопланы. Методы. На типичном черноземе на естественном инфекционном фоне в г. Белгороде (Россия) изучали образец арахиса культурного V-2012 (Вьетнам) из коллекции кафедры биотехнологии и мкиробиологии Института фармации, химии и биологии НИУ «БелГУ». Анализировали видовой состав микроскопических грибов ризосферы арахиса в сравнении с парующей почвой (контроль), обнаруженный методом высева почвенных разведений и образцов листьев на плотные питательные среды с последующей идентификацией до вида. Результаты. По сравнению с контрольной почвой, микокомплекс ризосферы арахиса (значение индекса Шеннона на уровне 2,5 и 2,7 в ризосфере и контроле соответственно) отличался меньшей степенью разнообразия и степень сходста почвенных образцов высокая (коэффициент Жаккара составил 50%), а это значит, что возделывание арахиса незначительно влияет на состав и структуру типичного чернозема. В ризосфере арахиса наблюдалось снижение частоты встречаемости фитопатогенного вида F. oxysporum, что может быть связано с повышением ранга в микокомплексе микофильного вида T. lignorum. Чувствительными к возделыванию арахиса видами оказались Aspergillus ochraceus, A. terreus, A. ustus, Candida albicans, Curvularia lunata, Fusarium oxysporum, Trichothecium roseum. Пятнистость листьев арахиса ежегодно вызывал вид Alternaria alternate, способный приводить к снижению продуктивности семян до 80%.
Арахис, фитопатогены, альтернариоз, микромицеты, индикаторные виды, биотестирование, болезни растений, продуктивность семян
Короткий адрес: https://sciup.org/140293843
IDR: 140293843 | УДК: 631.81.095.337:633.852.52
Текст научной статьи Структура микокомплексов ризосферы и филлопланы арахиса культурного
Оригинальные статьи / Originalarticles УДК 631.81.095.337:633.852.52
Б обовое растение арахис культурный (Arachis hypogaea L.) считается королем масличных куль- тур, его так и называют – «King of oil seeds», т.к. семена его содержат около 60% масла, до 33% белка, до 20% углеводов, рекордное количество олеиновой кислоты (более 75%) и около 4% клетчатки, а также соли кальция, магния, железа, витамины группы В, С, Е, РР, биотин, бетаин, холин, тритерпеновые сапонины, фитостеролы, флавоноиды [1]. В масле арахиса 80% ненасыщенных (линоленовая, эруковая, эйкозеновая) и 20% насыщенных (пальмитиновая, арахиновая, стеариновая, миристиновая, лигноцериновая, бегоновая) жирных кис-лот.Белок арахиса отличается легкой усваиваемостью, содержанием глобулинов арахина и конарахина, неза- мениными аминокислотами, такими как аргинин, лизином, гистидин, триптофан, цистин [2], поэтому семена арахиса используют в качестве растительного источника полноценного белка, токоферолов и полиненасыщен-ных жирных кислот в продуктах функционального назначения [3], что способствует политике государства в области совершенствования тенденции здорового питания населения [4-7]. Масло арахиса применяют в качестве салатного, а также в производстве десертов, кормов и даже биодизеля [8] и содержит оно почти половину из необходимых витаминов, а также непредельные жиры, необходимые для понижения уровня холестерина в крови [9]. В народной медицине семена арахиса применяют как седативное средство, а в современной официальной медицине и используются антиоксидантные, бактерицидные, противовирусные, регенерирующие, слабительные, обволакивающие, гемостатические, противосудоржные и обезболивающие свойства масла, семян и экстрактов кожуры арахиса [10].
И хотя площади возделывания арахиса в мире составляют более 24 млн. га в 100 странах, Россия пока входит в число стран-покупателей [8, 11].
Одной из глобальных проблем является снижение потерь урожая сельскохозяйственных культур от воздействия патогенов. Известно более 10 тыс. видов грибов-фитопатогенов, как значительно снижающих продуктивность культур, так и ухудшающих качество продукции [12, 13]. Одним из главных факторов передачи инфекционного начала являются почва и растительные остатки, где микроскопические грибы могут сохраняться до 10 лет [14]. При интродукции и селекции арахиса следует учитывать, что его бобы и семена являются объектом особого риска из-за контаминации потенциально патогенными микромицетами [15-18]. С целью защиты арахиса при возделывании необходимо знать структуру микокомплексов как зоны ризосферы, так и филлопланы здоровых растений на естественном инфекционном фоне, что и стало целью наших исследований.
Материалы и методы исследования
Изучали образец арахиса культурного V-2012 (Вьетнам) из коллекции кафедры биотехнологии и мкиробиологии Института фармации,химии и биологии НИУ «БелГУ» в 2012-2014, 2017-2020 годах на территории Ботанического сада НИУ «БелГУ» (г. Белгород). Посев проводили по схеме 50х20 см на обыкновенном черноземе с рН водной вытяжки 7,6 по методике Б.А. Доспехова (1985). Отбор проб проводили в фазу бутонизации – начала цветения растений. Почвенные образцы отбирали асептически, численность грибных пропагул определяли после отбора проб посевом водных разведений на плотные питательные среды и выражали в количестве колониеобразующих единиц (КОЕ) на 1 г сухой почвы. Контролем служила парующая почва. Выделяли грибы методом почвенных разведений с последующим глубинным посевом на плотные питательные среды Чапека, Сабуро и КМА (картофельно-морковный агар). Материалом лабораторного изучения филлопланы служили листья арахиса. Количественный учет колоний грибов проводили на 7-14-е сутки инкубирования при 23±2оС.
Определение грибов проводили до вида по совокупности морфологических и культуральных призна-ков.Структуры микокомплексов ризосферы и филло-планы арахиса описывали с учетом пространственной и временной частот встречаемости видов и их обилия. Определили долю типичных видов в микокомплексе.Влияние прижизненных корневых экссудатов арахиса на типичный чернозем оценили с помощью коэффициента Жаккара.Оценку биоразнообразия комплексов микромицетов филлопланы проводили с помощью индекса Шеннона [19, 20].
Учитывая, что темноокрашенные микромицеты могут накапливаться в почвах агроценозов, по литературным источникам определили принадлежность выделенных видов микромицетов к группам оппортунистических и аллергенных организмов [21].
Статистический анализ проводили с расчетом среднего арифметического, ошибки среднего, критерия Стьюдента с использованием методов вариационной статистики в компьютерной программе Excel.
Результаты исследования и их обсуждение
Для характеристики своеобразия состава видов грибов разных типов почв используется понятие комплекса типичных видов,который выделяется на основе пространственной и временной частоты встречаемости вида. Многие антропогенные воздействия могут изменять структуру комплексов почвенных грибов, в том числе и выделения растений [22, 23].
В составе контрольных почвенных образцов доминантные виды не обнаружены (табл.). Всего выявлено 17 видов из 11-ти родов микроскопических грибов, а частым и в данном комплексе оказались 2 вида ( Aspergillus ochraceus и Rhizopus microsporus ), редких видов было 6, остальные 9 видов не относились к типичным видам и отнесены в ранг случайных.В микокомплексе ризосферы арахиса культурного выделены 15 видов из 9-ти родов микромицетов, среди которых в ранге частых оказались 4 вида,редких – 2 и 9 видов отнесены к случайным.По сравнению с контрольной почвой,микокомплекс ризосферы арахиса отличался меньшей степенью разнообразия, о чем свидетельствуют и значения индекса Шеннона (табл.). В целом же, степень сходства почвенных образцов высокая, так как коэффициент Жаккара составил 50% , а это значит, что возделывание арахиса незначительно влияет на состав и структуру почвенных комплексов.
Таблица. Видовой состав почвенных микокомплексов Table. Species composition of soil mycocomplexes
|
Виды грибов |
Значимость видов в почвенном комплексе |
Реакция вида гриба на арахис |
|
|
контроль |
под арахисом (КОЕ)* |
||
|
Acremonium strictum W. Gams |
С |
С (0,6) |
У |
|
Actinomucor elegans (Eidam) C.R. Benj. & Hesselt. |
- |
Р (4,1) |
Н |
|
Alternaria alternate (Fr.) Keissl. |
- |
С (1,2) |
Н |
|
Arthrinium phaeospermum (Corda) M.B. Ellis |
С |
- |
ЧВ |
|
Aspergillus candidus Link |
Р |
Ч (4,5) |
И |
|
A. flavus Link |
С |
С (0,1) |
У |
|
A. nidulans (Eidam) G. Winter |
С |
С (0,2) |
У |
|
A. niger Tieghem |
Р |
Р (4,3) |
У |
|
A. ochraceus Wilh. |
Ч |
С (0,4) |
ЧВ |
|
A. terreus Thom |
Р |
- |
ЧВ |
|
A. ustus (Bainier) Thom & Church |
Р |
С (1,8) |
ЧВ |
|
A. versicolor (Vuill.) Tirab. |
- |
С (2,5) |
Н |
|
Candida albicans (C.P. Robin) Berkhout |
Р |
- |
ЧВ |
|
Cladosporium epiphyllum |
- |
С (0,1) |
Н |
|
Curvularia lunata (Wakker) Boedijn |
С |
- |
ЧВ |
|
Fusarium oxysporum Schltdl. |
Р |
С (0,7) |
ЧВ |
|
Penicillium funiculosum Thom |
С |
Ч (4,1) |
И |
|
Rhizopus microsporus Tiegh. |
Ч |
Д (11,2) |
И |
|
Torula lucifuga Oudem. |
С |
- |
Ч |
|
Trichoderma lignorum (Tode) Harz |
С |
Ч (4,8) |
И |
|
Trichothecium roseum (Pers.) Link |
С |
- |
ЧВ |
|
Всего видов |
17 |
15 |
|
|
Коэффициент Жаккара, % |
50% |
||
|
Индекс Шеннона |
2,7 |
2,5 |
|
|
Доля оппортунистических видов, % |
59 |
69 |
|
|
Доля аллергенных видов, % |
24 |
23 |
|
Условные обозначения видов: * – численность грибных пропагул (тыс. КОЕ/г); Д – доминантный, Ч – частый, Р – редкий, С – случайный, ЧВ – чувствительный, У – устойчивый, И – индикаторный, Н – нехарактерный для контроля (заносной вид)
По сравнению с контрольной почвой под арахисом в фазу цветения в ризосферном микокомплексе не встречались 2 типичных (рангом выше случайного) для контроля вида (A. terreus и Candida albicans), но появился редкий вид Actinomucor elegans и случайные виды A. versicolor, Alternaria alternate и Cladosporium epiphyllum. Грибы A. candidus, Penicillium funiculosum, Rhizopus microsporus, Trichoderma lignorum повысили ранг до частого, а частый вид A. ochraceus и редкие виды A. ustus, Fusarium oxysporum перешли в ранг случайных. Редким видом в сравниваемых образцах оказался – A. niger, случайными – виды Acremonium strictum, A. flavus и A. nidulans.
Выявлены наиболее показательные виды грибов для биоиндикации почвы (см. таблицу). Грибы, которые не выделялись под арахисом или резко снижали ранг по сравнению с контрольной почвой, отнесены в группу чувствительных к воздействию прижизненных корневых экссудатов растений. Если ранг вида не изменялся в вариантах опыта, то вид отнесен к устойчивым. Индикаторными считали виды микромицетов, для которых характерно повышение ранга доминирования. В группу чувствительных к возделыванию арахиса видов типичного чернозема отнесены Arthrinium phaeospermum, A. ochraceus, A. terreus, A. ustus, C. albicans, Curvularia lunata, F. oxysporum. Микромицетами с индикаторными особенностями оказались виды A. candidus, P. funiculosum, Rh. microspores, T. lignorum. Виды A. strictum, A. flavus, A. nidulans, A. niger, отмечены как устойчивые и остальные 4 вида оказались нехарактерными для контроля (см. таблицу).
Наблюдалось снижение частоты встречаемости фито-патогенного вида F. oxysporum, что может быть связано с повышением ранга в комплексе микромицетов под арахисом микофильного вида T. lignorum . Известно, что трихо-дерма затрудняет развитие других видов микромицетов как контактно, гиперпаразитируя, так и дистантно, синтезируя микотоксины, а окультуривание почвы благоприятно для развития триходерм [24]. Частый в контрольной почве вид Rh. microsporesв ризосфере арахиса повымил ранг до доминантного, что может объясняться большим (по сравнению с контролем) содержанием слабо разложенных органических веществ.
Среди типичных видов почвенных комплексов в нашем исследовании обнаружены грибы из родов Alternaria, Aspergillus, Candida, Cladosporium, Fusarium, Penicillium, способные провоцировать микогенные аллергии, в основе которых лежит аллергизация организма антигенами мицелиальных грибов [25], с долей в микокомплексах 2324% (табл.).
Определены и грибы, в литературе описанные как оппортунистические, то есть способные быть причиной микозов у людей с ослабленным иммунитетом [26], например, Candida albicans и представители родов Aspergillus, Fusarium и Trichoderma , выделены из микокоплексов с долей 59-69% (с повышением доли под арахисом).
Микромицеты в подавляющем своем большинстве являются убиквистами, т.е. способными развиваться на поверхности всех органов растений [27]. В филлосфере арахиса выявлены 9 видов микроскопических грибов из 8 родов (рис. 1), причем, 8 видов не были обнаружены при изучении почвенных образцов.
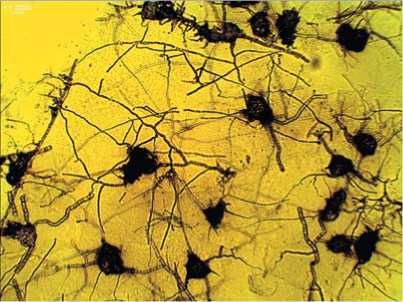
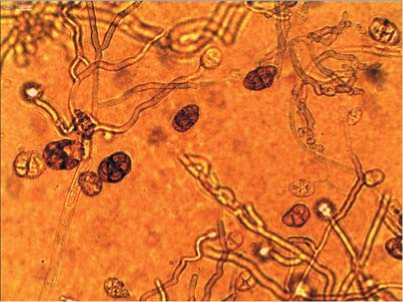
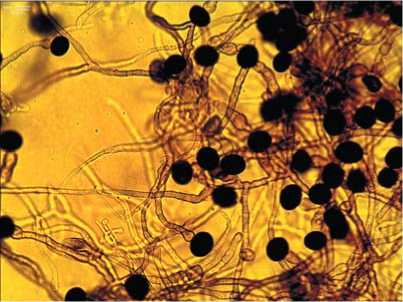
На растениях арахиса культурного значительные доли характерны для фитопатогенных грибов Macrophomina phaseolina, Ulocladium chartarum, Cladosporium cladosporioides (рис. 2. А-В) и Colletotrichum
Б.
В.
Penicillium stolon if erum;
4,3
Nigrospora sphaerica; 8,4
Г.
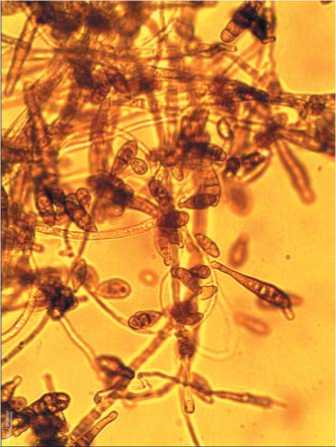
Рис.2.Микрофотографии выделенных из филлосферы арахиса Macrophominaphaseolina (А) при ув.100×, Ulocladium chartarum (Б),Cladosporium cladosporioides (В) и Nigrospora sphaerica (Г) при ув.400×
Fig.2. Micrographs of Macrophomina phaseolina isolated from the peanut phyllosphere(A) at uv.100×, Ulocladium chartarum (B), Cladosporium cladosporioides (C)and Nigrospora sphaerica (D)at SW.400×
Ulocladium chartarum;
16,6
Aspergillus flavipes; 3,2
к Aspergillus sydowii; 4,4
Alternaria olternato;
15,1
Macrophomina phaseolina;
21,7

Ctadosporium cladosporioides ; 13,2
olletotrichum lindemuthianu m;13,l
Рис.1.Видовой состав миркомицетов филлосферы арахиса культурного и доля каждого вида в комплексе (%) Fig.1.Species composition ofmyrcomycetes of culturalpeanut phyllosphere and shareofeach species inthe complex (%)

A.
lindemuthianum, которые вызывали склероциальную гниль, красную пятнистость, кладоспориоз и антракноз у бобовых культур. Также в комплексе микромицетов фил-лопланы выявлен вид Nigrospora sphaerica (рис. 2. Г), который является возбудителем нигроспороза растений [2830].
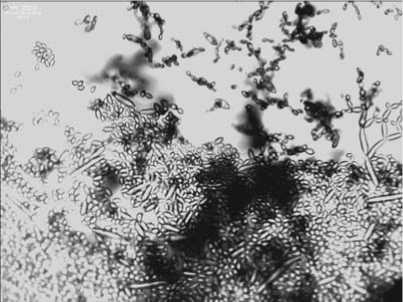
За все годы изучения вегетации арахиса в Белгороде ежегодно отмечались симптомы альтернариоза. На рисунке 3 хорошо заметна краевая пятнистость листовых пластинок арахиса.
В среднем по годам на посевах арахиса альтернариоз проявлялся на 6-18% растений и приводил к недобору 2180% продуктивности семян. Причем, страдала, как вегетативная, так и генеративная части растений (рис. 4). Так, растения с альтернариоидной пятнистостью (больные) были в 1,7 раза ниже, имели в 1,4 раза меньше боковых побегов, а индивидуальная продуктивность семян была ниже в 3,6 раза.
Б.
Таким образом, изучение вегетации арахиса на естественном инфекционном фоне в почвенно-климатических условиях г. Белгорода выявлены 15 видов микроскопических грибов в ризосфере и 9 видов – в филлоплане арахиса. Большинство (69%) микромицетов ризосферы арахиса являются оппортунистическими и 23% могут вызывать у человека аллергии.
При выращивании арахиса выявлены чувствительные (Aspergillus ochraceus, A. terreus, A. ustus, Candida albicans, Curvularia lunata, Fusarium oxysporum, Trichothecium roseum) и индикаторные (Aspergillus candidus, Penicillium funiculosum, Rhizopus microspores, Trichoderma lignorum) к прижизненным корневым экссудатам виды.
Представители темноокрашенных гифомицетов Alternaria alternate присутствовали в ранге случайного вида в ризосфере арахиса и были обнаружены в его фил-лоплане. Кроме того, этот вид являлся причиной альтерна-риоидной пятнистости и в отдельные годы приводил к потере 80% семян арахиса. Поэтому, изучение характеристик болезней арахиса в агрофитоценозе должно послужить обоснованием для разработки и применения современных методов защиты растений. В связи с чем чрезвычайно актуально контролировать рост микроскопических грибов в ризосфере и филлоплане культурных растений.
Рис.3.Проявления альтернариоза листьев арахиса (А) и конидииAlternariaalternateпри ув. 400× (Б)
Fig.3. Manifestations ofalternariosis of peanut leaves (A) and conidia Alternaria alternateat SW.400× (B)
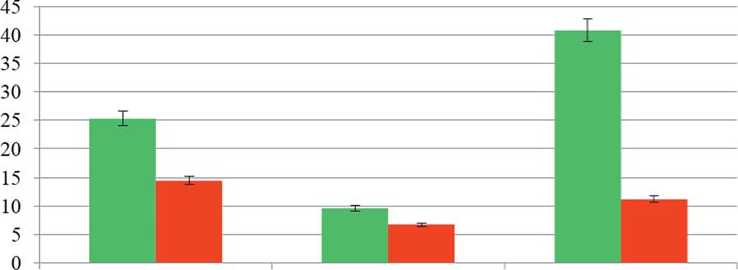
■ Здоровые растения
■ Больные растения
Высота растения в фазе Число боковых побегов. Вес семян с растения, г плодоношения, см шт.
Рис.4. Сравнение показателей здоровых (без признаков поражения) и больных (с альтернариоидной пятнистостью) растений арахиса культурного (данные 2014 г., когда поражение альтернариозом было наибольшим)
Fig.4.Comparison ofindicators of healthy (without signs ofdamage) and diseased (with Alternarioid spotting) ofcultivated peanut plants (data of2014, when thedefeat ofAlternariosis was thegreatest)
Об авторе:
About theauthor:
Yulia N. Kurkina – Cand. Sci. (Agriculture), Associate professor of the Department of Biotechnology and Microbiology, , Scopus Author ID 5702176800
Список литературы Структура микокомплексов ризосферы и филлопланы арахиса культурного
- Кишлян Н.В., Бемова В.Д., Матвеева Т.В., Гаврилова В.А. Биологические особенности и возделыванием арахиса (обзор). Труды по прикладной ботанике, генетике и селекции. 2020;181(1);119-127. https://doi.org/10.30901/2227-8834-2020-1-119-127
- Wang M.L., Khera P., Pandey M.K., Wang H., Qiao L., Feng S. et al. Genetic Mapping of QTLs Controlling Fatty Acids Provided Insights into the Genetic Control of Fatty Acid Synthesis Pathway in Peanut (Arachis hypogaea L.). Plos one. 2015;10(4):e0119454. https://doi.org/10.1371/journal. pone.0119454.
- Стриженко АВ, Яковлева ТВ. Продукты перерабокти семян арахиса в рецептурах бискитных полуфабрикатов функционального назначения. Научно-теоретический журнал. 2015;(1):176-179.
- Козубаева ЛА, Кузьмина СС. Перспективы применения арахиса в производстве капкейков. Ползуновский вестник. 2021;(2):20-26. https://doi.org/10.25712/ASTU.20728921.2021.02.003.
- О стратегии научно-технологического развития Российской Федерации: Указ Президента РФ №642 от 01.12.2016. Собрание законодательства Российской Федерации, 2016;(49):6887.
- Михайлов В.А., Вершинина О.Л., Росляков Ю.Ф., Шпаков А.В. Характеристика семян арахиса и их применение в хлебопечении. Успехи современного естествознания. 2005;(5):55. ID: 12931401.
- Елисеева Л.Г., Юрина О.В., Луценко Л.М. Эффективность использования природных антиоксидантов для увеличения срока хранения ореховых снеков. Пищевая промышленность, 2015;(12):30-34. ID: 25668763.
- Туз Р.К., Подольная Л.П., Асфандиярова М.Ш., Дубовская А.Г., Еремин В.А, Мигачева ЕО. Изменчивость образцов арахиса селекции ВНИИМК в условиях Астраханской области. Научно-технический бюллетень Всероссийского научноисследовательского института масличных культур. 2018;4(176):64-67. https://doi.org/10.25230/2412-608Х-2018-3-175-64-67.
- Михайлов В.А., Гончар В.В., Росляков Ю.Ф., Дамения М.Е. Микробиологическая характеристика семян арахиса, используемых в хлебопечении. Успехи соверменного естествознания. 2005;(5):56.
- Кароматов И.Д., Халилова Р.С. Лечебные свойства арахиса. Электронный научный журнал «Биология и интегрированная медицина». 2019;1(29):227-235.
- Разоков Ш.И., Мирзоев Д.М., Кононенко Г.П., Буркин А.А. Микотоксины в бобах арахиса, выращенного в Таджикистане. Российский журнал «Проблемы ветеринарной санитарии, гигиены и экологии». 2018;4(28):74-79. https://doi.org/10.25725/vet.san.hyg.ecol.201804011.
- Семенкова И.Г., Соколова Э.С. Фитопатология. М.: Академия, 2003.
- Метлицкий Л.В., Озерковская О.Л. Как растения защищаются от болезней. М.: Наука, 1985.
- Жернов ГО. Видовой состав, биологические особенности возбудителей болезней в агрофитоценозе сои и агроэкологическая оценка приемов защиты в Курганской области. Дис. … канд. биол., 2014. 157 c.
- Goncalez E., Nogueira J.Y., Fonseca H. et al. Mycobiota and mycotoxins in Brazilian peanut kernels from sowing to harvest. Int. J. Food Microbiol. 2008;(123):184-190.
- Mphande F.A., Siame B.A., Taylor J.E. Fungi, aflatoxins and cyclopiazonic acid associated with peanut retailing in Botswana. J. Food Prot. 2004;(67):96-102.
- Novas M.V., Cabral D. Association of mycotoxin and sclerotia production with compatibility groups in Aspergillus flavus from peanut in Argentina. Plant Dis, 2002;(86):215-219.
- Pildain M.B., Vaamonde G., Cabral D. Analysis of population structure of Aspergillus flavus from peanut based on vegetative compatibility, geographic origin, mycotoxin and sclerotia production. Int. J. Food Microbiol. 2004;(93):31-40.
- Tresner H.D., Bacus M.P., Curtis I.T. Soil microfungi in relation to the hardwood forest continuum in Southern Wisconsin. Mycologia. 1954;46(3):314.
- Zak J.C., Willig M.R. Fungal biodiversity patterns. In: Biodiversity of fungi. Inventory and monitoring methods. USA: Elsevier Academic Press, 2004. P.59-75.
- Чудинова Ю.В., Наплекова Н.Н. Влияние микроорганизмов из ризосферы льна на всхожесть и рост ростков и корней редиса. Вестник Алтайского ГАУ. 2009;57(7):14-18.
- Берсенева О.А., Саловарова В.П., Приставка А.А. Почвенные микромицеты основных природных зон. Известия Иркутского государственного университета. Серия «Биология. Экология». 2008;1(1):3-9.
- Kurkina Yu.N., Nguen T-L. Huong, Ngo T-D. Kieu, Lasarev A.V. Pathogenicity of micromycete strains isolated from the Legume rhizosphere and phylloplane. International Journal of Pharmacy and Technology. 2016;8(2):14441-14445.
- Сенчакова Т.Ю., Свистова И.Д. Спектр биологической активности микромицетов чернозема. Проблемы медицинской микологии. 2009;11(1):30-33.
- Кочкина Г.А., Иванушкина Н.Е., Зякун А.М., Рачиба М.Г., Озерская С.М. Мицелиальные аллергенные грибы на сухом пищевом и лекарственном растительном сырье. Иммунопатология, аллергология, инфектология, 2004;(1):49-55.
- Кузикова И.Л., Медведева Н.Г. Оппортунистические грибы - контаминанты среды обитания человека и их потенциальная патогенность. Экология человека. 2021;(3):4-14.
- Скоробогатова РА, Шинкель ТВ, Малащицкая НВ, Жебрак ИС. Микобиота пищевых и лекарственных субстратов из растений. Современная микология в России. Том 2. Материалы второго сьезда микологов России, 2008. C.105-106.
- Станчева Й. Атлас болезней сельскохозяйственных культур. Т 4. Болезни технических культур, 2003.
- Хохряков М.К., Доброзракова Т.Л., Степанов К.М., Летова М.Ф. Определитель болезней растений, 2003.
- Куркина Ю.Н. Болезни овощных бобов, вызываемые микроскопическими грибами. Овощи России. 2018;(3):99-104. https://doi.org/10.18619/2072-9146-2018-3-99-104


