Структура микробных сообществ наземных соляных сооружений Пермского края
Автор: Кузнецова М.В., Маммаева М.Г., Кириченко Л.В., Шишкин М.А., Демаков В.А.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 2, 2020 года.
Бесплатный доступ
Изучено разнообразие микробных сообществ наземных соляных сооружений (НСС), расположенных в лечебно-профилактических и санаторно-курортных учреждениях Пермского края. Установлено, что абиотические соляные поверхности всех НСС контаминированы микроорганизмами, при этом выявлена достоверная разница между сильвинитовыми (86.5% положительных проб) и галитовыми (47.4%) сооружениями. Численность жизнеспособных клеток бактерий, в том числе стафилококков, также была выше в сильвинитовых сооружениях, чем в галитовых. На основании бактериологического исследования и анализа нуклеотидных последовательностей гена 16S рРНК изолированные штаммы стафилококков отнесены к следующим видам: Staphylococcus epidermidis -42.3% (n=11), S. aureus и S. saprophyticus - по 19.2% (n=5), S. simulans - 7.7% (n=2), и по одному штамму S. cohnii urealyticum, S. hominis, S. warneri - 3.8%. Видовой состав микробиоценозов поверхностей, определенный методом газовой хроматографии-масс-спектрометрии, включал представителей 18 родов, относящихся к трем крупным филумам Actinobacteria, Firmicutes и Proteobacteria. Актинобактерии были доминирующими в обоих типах НСС. Среди фирмикутов в сильвинитовых НСС превалировали представители рода Clostridium - 63.8% общего количества бактерий, тогда как в галитовых их было в два раза меньше - 32.1%. Содержание кокковой микробиоты, напротив, было почти в 3 раза выше в галитовых сооружениях. Выявленные количественные и качественные показатели микробиоты НСС дополняют представления о структуре микробных сообществ в условиях высокой соляной нагрузки и антропогенного влияния.
Наземные соляные сооружения, микробиоценоз, газовая хроматография-масс-спектрометрия
Короткий адрес: https://sciup.org/147229641
IDR: 147229641 | УДК: 579.63:614.7 | DOI: 10.17072/1994-9952-2020-2-120-127
Текст научной статьи Структура микробных сообществ наземных соляных сооружений Пермского края
нообразия» [Akhtar et al., 2008]. Возрастание интереса к изучению структуры сообщества микроорганизмов в условиях повышенного засоления среды, с одной стороны, вызвано необходимостью понимания механизмов их длительного выживания в «неростовых» высокоминерализованных природных или искусственных системах [Ventosa et al., 2014]. Другая причина обусловлена прикладным значением – возможностью выделения среди представителей гало-фильных и/или галотолерантных бактерий потенциально перспективных источников биологически активных соединений: ферментов, полимеров, органических веществ с противоопухолевой или антимикробной активностью [Akhtar et al., 2008: Chen et al., 2010; da Silva et al., 2015]. Например, галофильные микроорганизмы различных таксономических групп, продуцирующие вещества с цитотоксической активностью, выделены из образцов рассолов и твердых галогенных образований (отложений каменной соли) на руднике Сипакира (Zipaquirá, Колумбия) [DiazCardenas et al., 2017]. Кроме того, отдельные штаммы или консорциумы солеустойчивых бактерий с высокой биодеградирующей активностью могут быть использованы для утилизации органических отходов, при разработке новых технологий очистки промышленных вод и стоков в условиях засоления [Пастухова и др., 2010; Ястребова, Кошелева, Плотникова, 2016].
Сегодня активно обсуждаются вопросы влияния антропогенного воздействия на микробиоценозы естественных или искусственных пещер [Ikner et al., 2007; Kelly et al., 2009; Engel, 2010]. Обнаружение представителей нормальной или патогенной микробиоты человека, как правило, связывают с интенсивностью антропогенной нагрузки на подземное сооружение. Оказалось, что почти все карстовые источники в юго-западной части штата Иллинойс (США) имеют высокие показатели встречаемости представителей Escherichia coli , Enterococcus spp., Staphylococcus spp. [Kelly et al., 2009]. Известно, что соли обладают угнетающим действием на микроорганизмы, однако многими исследователями выявлена высокая обсеменен-ность воздуха различных соляных сооружений. Ряд публикаций посвящены изучению распространения биологического фактора в подземных шахтах для добычи соли, солелечебницах, а также в санаторных зонах пещер [Akhtar et al., 2008; Frączek, Gorny, 2011; Frączek, Gorny, Ropek, 2013; Gebarowska et al., 2018].
В настоящее время, как в России, так и за рубежом, для лечения и профилактики различных видов соматических и инфекционных заболеваний широко применяются наземные соляные сооружения (НСС) [Sandu et al., 2011; Физиологогигиеническая ..., 2013; Rashleigh, Smith, Roberts, 2014; Zając et al., 2014]. Воздушная среда и абиотические поверхности НСС, используемые для со- летерапии пациентов с заболеваниями органов дыхательной системы, представляют искусственную экосистему, в которой могут накапливаться и персистировать бактерии антропогенного происхождения, обладающие природной солеустойчивостью [Федотова, Горовиц, Баранников, 2005]. Показано, что микробная контаминация воздуха во время сеанса солетерапии составляет от 130‒200 микроорганизмов на 1 м3 [Stirbu, Stirbu, Sandu, 2012]. Дальнейшее выживание микроорганизмов в этих условиях возможно, в первую очередь, на абиотических поверхностях данных сооружений, тем не менее, исследований, направленных на изучение биоразнообразия НСС, в доступной нам литературе не обнаружено.
Цель исследования – изучить структуру микробных сообществ, сформированных на соляных абиотических поверхностях НСС.
Материал и методы
Материал
За период 2017‒2018 гг. исследованы 11 объектов, включающих 7 сильвинитовых и 4 галитовых НСС, расположенных в лечебно-профилактических и санаторно-курортных учреждениях Пермского края. Стены и пол шести сильвинитовых сооружений были облицованы шлифованными соляными блоками, одного – прессованной солеплиткой. Потолок всех сооружений выполнен из деревянных панелей с напылением из природного сильвинита. Галокамеры в основном были выполнены методом напыления соляного материала на ограждающие поверхности с его подсыпкой на пол. В одном из четырех галитовых сооружений для отделки стен и пола использовались шлифованные соляные блоки. Срок эксплуатации соляных сооружений варьировал от 5 месяцев до 24 лет и, в среднем, составлял для сильвинитовых – 11.1±2.8, для галитовых – 2.6±1.8 лет. Показатели всех гигиенических параметров НСС: уровень радиационного фона, концентрации легких отрицательных и положительных аэроионов, микроклимата были в пределах допустимых значений существующих нормативных документов для обоих типов сооружений.
Методы исследования
Для изучения микробного пейзажа образцы проб (n = 71, не менее шести для каждой камеры) отбирали с соляных поверхностей (S = 0.5 м2) сухим способом. Высевы проводили на универсальные (кровяной агар, среда Луриа-Бертани, «Amresco», США) и селективные (солевой агар с маннитом, среда Мак-Конки, среда Сабуро, ООО «ЦФГС», Россия) агаризованные среды методом прямого высева. Уровень бактериальной обсемененности оценивали по общему микробному числу (ОМЧ), отдельно учитывали количество стафилококков, представителей семейства Enterobacteriaceae и кандид. Идентификацию выделенных микроорганизмов осуществляли согласно Приказу МЗ СССР № 535 от 22.04.1985 г. Окончательную идентификацию штаммов стафилококков проводили на основании анализа нуклеотидной последовательности гена 16S рРНК, которую получали с использованием бактериальных праймеров 515F (5′-gtgccagcmgccgcggtaa) и 1391R (5′-gacgggcggtgwgtrca), как описано [Baker et al., 2003], и определяли с применением набора реактивов Big Dye Terminator Cycle Sequencing Kit на автоматическом секвенаторе Genetic Analyser 3500XL («Applied Biosystems», США). Поиск гомологичных последовательностей производили по базе данных GenBank .
Реконструирование таксономического состава до рода/вида проводили после химического извлечения высших жирных кислот, альдегидов, стери-нов и хроматографического разделения пробы методом газовой хроматографии‒масс-спектрометрии (ГХ-МС) согласно [Верховцева, Осипов, 2008] с использованием системы Agilent 6890/5973N («Agilent», США). Липидные компоненты экстрагировали методом кислого метанолиза в 0.4 мл 1 М NaCl в метаноле в течение одного часа при температуре 80°С. Сухой остаток обрабатывали 20 мкл N,O-бис (триметилсилил)-трифторацетамида в течение 15 мин., затем 1‒2 мкл полученной смеси разбавляли гексаном 1:1 и использовали для анализа. Хроматограммы снимали в режиме программирования температуры от 130 до 320°С со скоростью 5°С в мин. Для количественных измерений в качестве внутреннего стандарта использовали тридейтеро-тридеканоат. Результаты анализировали с помощью штатной программы обработки данных и формировали рапорт о реконструированном по биохимическим маркерам составе микробного сообщества.
Статистический анализ данных проводили с использованием программ Microsoft Office Excel и STATISTICA 10. Показатели представлены в виде среднего арифметического и его ошибки (M± m ). Достоверность различий средних величин определяли с помощью t -критерия при уровне достоверности p < 0.05. При сравнении качественных признаков для выявления статистически значимых различий определяли χ² или χ² с поправкой Йейтса.
Результаты и их обсуждение
Методом прямого высева установлено, что абиотические соляные поверхности всех сооружений были контаминированы микроорганизмами. Количество положительных проб варьировало от 20 до 100%, в среднем составив 76.1%, при этом выявлена достоверная разница между сильвинито- выми (86.5%) и галитовыми (47.4%) сооружениями (р = 0.0006). Численность жизнеспособных клеток бактерий, адгезированных на поверхностях, в сильвинитовых сооружениях (4.97E+03±1.32E+04 КОЕ/м2) также была выше, чем в галитовых (1.74E+02±1.68E+02 КОЕ/м2). Уровень обсеме-ненности стафилококками в сильвинитовых сооружениях составил 55.8% (3.11E+02±2.32E+02 КОЕ/м2), тогда как в галитовых – 10.5% (детектированы только в двух пробах), и разница была статистически значима (р = 0.0007). Энтеробактерии встречались в двух сильвинитовых сооружениях, и только в образцах, отобранных с поверхности пола. Жизнеспособные кандиды не выявлены ни в одной пробе.
Получены чистые культуры штаммов стафилококков (n = 26) и проведена их видовая идентификация. Большинство изолированных штаммов принадлежали к виду Staphylococcus epidermidis, в пяти сооружениях обнаружен S. aureus, в единичных пробах – S. warneri, S. simulans, S. cohnii urealyticum и S. saprophyticus. Идентификация отдельных штаммов стафилококков на основании анализа нуклеотидной последовательности гена 16S pPНК показала, что в пяти случаях (19.2%) видовая принадлежность не соответствовала бактериологической идентификации. В результате сравнения нуклеотидной последовательности ам-плифицированных фрагментов гена 16S рРНК изолятов и известных последовательностей гена 16S рРНК типовых штаммов стафилококков распределение выделенных бактерий оказалось следующим: S. epidermidis – 42.3%, S. aureus – 19.2%, S. saprophyticus – 19.2%, S. simulans – 7.7%, и по одному штамму S. cohnii urealyticum S. hominis, S. warneri – 3.8%. Важно, что в настоящее время представители рода Staphylococcus и, в первую очередь, S. aureus рассматриваются как основные «индикаторные бактерии человека», наряду с эше-рихиями и термотолерантными бациллами [Lavoie, Northup, 2006]. Микробиологический анализ, проведенный польскими учеными в двух соляных шахтах «Величка» («Wieliczka») и «Польковице-Серошовице» («Polkowice–Sieroszowice»), одна из которых является старейшей туристической достопримечательностью и спелеолечебницей, а другая – современной промышленной шахтой, выявил, что содержание отдельных видов стафилококков, в частности S. aureus, S. epidermidis, S. haemolyticus или S. saprophyticus, от общего количества бактерий и грибов в шахтах составляет от 1 до 5% [Gebarowska et al., 2018]. Кроме того, штаммы различных видов стафилококков, за исключением S. saprophyticus, были выделены в лечебнице «Соляные копи Бохня» («Kopalnia Soli Bochnia», Польша) [Frączek, Gorny, Ropek, 2013], хотя необходимо отметить, что в упомянутых работах куль- туры изолировали из воздушной среды подземных соляных сооружений. В данном исследовании мы получили сходные показатели и по видовому составу, и по показателю обсемененности: в сильвинитовых сооружениях доля стафилококков от общего количества микроорганизмов (показатель ОМЧ) составила 4.2, в галитовых – 2.3%. Обращает внимание, что S. aureus был выделен только в сооружениях из сильвинита.
Культуральные методы, помимо явных преимуществ (простота выполнения, доступность используемых средств, экономичность) имеют ряд недостатков, связанных с отсутствием универсальной питательной среды, на которой могли бы расти все микроорганизмы, представленные в данной пробе. Кроме этого, большинство микроорганизмов являются некультивируемыми, и, как следствие, малоизученными. Чтобы обойти некоторые ограничения традиционных методик, исследователи используют молекулярные методы, основанные на выделении и анализе нуклеиновых кислот (в основном ДНК) или маркеров клеточной стенки (жирных кислот, альдегидов, спиртов и т.д.) из различных образцов без культивирования микроорганизмов [Верховцева, Осипов, 2008; Engel, 2010].
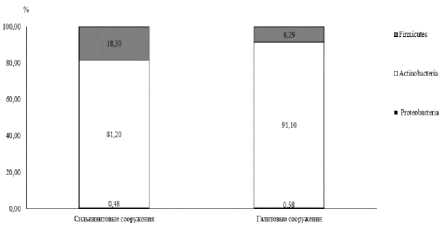
По данным ГХ–МС, в отличие от метода прямого высева, общее количество микроорганизмов было существенно выше и достоверно не различалось: 1.84E+08±7.73E+07 и 1.46E+08±6.46E+07 клеток/м2 в сильвинитовых и галитовых сооружениях, соответственно. Анализ видового состава позволил определить представителей 18 родов, относящихся к трем крупным филумам Actinobacteria, Firmicutes и Proteobacteria (рисунок, А). Актинобактерии ( Actinomyces , Corynebacterium , Nocardia , Propionibacterium , Rhodococcus и др.) были доминирующими в обеих группах: 81.2% в сильвинитовых и 91.1% в галитовых сооружениях (рисунок, Б). Среди фирмикутов в сильвинитовых НСС превалировали представители рода Clostridium ( C. ramosum, C. propionicum ) – 63.8% от общего количества бактерий, тогда как в галитовых их было в два раза меньше – 32.1% (рисунок, В).
Содержание кокковой микробиоты, напротив, было почти в 3 раза выше в галитовых НСС (21.1%), чем в сильвинитовых (7.4%). Бактерии рода Staphylococcus обнаружены во всех соляных сооружениях, представители Streptococcus – в семи из десяти. Протеобактерии выявлены почти в 30% проб, но их доля в микробном спектре не превышала 0.6% от всех микроорганизмов. Более того, детектированы маркеры представителей только 4 таксонов, при этом бактерии родов Alcaligenes и Campylobacter обнаружены только в сильвинитовых НСС. В целом можно отметить, что в сильвинитовых НСС структура микробного сообщества более разнообразная, чем в галитовых. Это может быть связано с более благоприятными условиями для выживания бактерий, так как соли K+ менее токсичны для прокариотов, чем соли Na+, а также с более длительным сроком эксплуатации сильвинитовых сооружений.
А
Proponibaeieriiiin
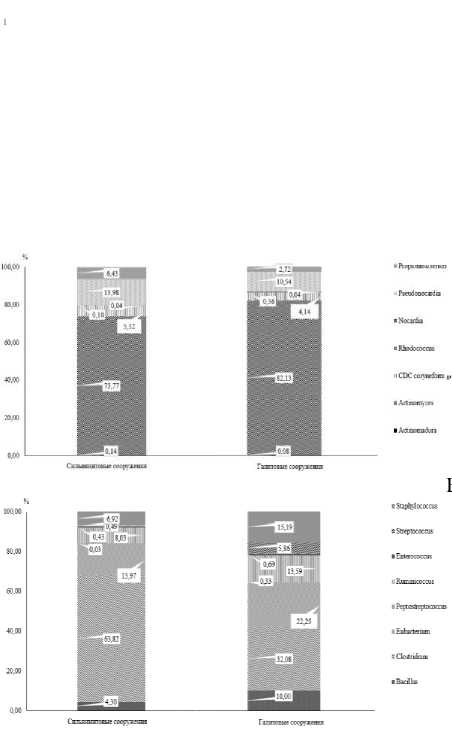
Доли филумов в структуре микробных сообществ НСС (А) и таксономическое распределение представителей внутри филумов Actinobacteria (Б) и Firmicutes (B)
Б
ICDC corynefonn groups
Принимая во внимание отличающиеся условия и методы, использованные для характеристики микробных сообществ в других исследованиях, можно констатировать, что биоразнообразие НСС было существенно меньше, чем принято обнаруживать в соленых озерах [Han et al., 2017], природных пещерах [Engel, 2010] или соляных шахтах [Chen et al., 2007; Diaz-Cardenas et al., 2017]. В большинстве исследований по изучению микробиоценозов в высокоминерализованных средах филумы Actinobacteria, Firmicutes и Proteobacteria являлись доминантными, но их распределение существенно различалось [Chen et al., 2010; Frączek, Gorny, 2011; Claverías et al., 2015; Diaz-Cardenas et al., 2017; Han et al., 2017]. По мнению некоторых ученых, бациллы представляют группу микроорга- низмов, которая более распространена в солесодержащих средах по сравнению с другими таксономическими группами [Akhtar et al., 2008; DiazCardenas et al., 2017]. Биоаэрозольный состав в соляных сооружениях также может способствовать преимущественному распространению осмотоле-рантных бактерий, таких как Bacillus spp. и различные представители семейства Micrococcaceae [Akhtar et al., 2008; Frączek, Gorny, Ropek, 2013; Gebarowska et al., 2018]. В нашем исследовании доля представителей родов Bacillus и Micrococcus оказалась существенно меньше, чем в природных экосистемах или искусственных соляных шахтах. Более значимое представительство отмечено у клостридий, некоторые виды которых входят в состав нормофлоры человека. Что касается протеобакте-рий, наиболее многочисленной и распространенной в соляных шахтах группе бактерий [Chen et al., 2007; Diaz-Cardenas et al., 2017; Han et al., 2017], то они практически не встречались на абиотической поверхности исследованных НСС, а их доля не превышала 0.6% от общего числа микроорганизмов. Доминирующими обитателями в обоих типах сооружений оказались представители рода Actinomyces. Эти микроорганизмы широко распространены в почве и воде, могут выявляться в воздухе как индикаторы загрязнения рабочей и жилой среды. Считается, что их появление в закрытых пространствах связано с повышенной влажностью воздуха [Frączek, Kozdroj, 2013]. Они были обнаружены в большом количестве в соляных шахтах различных регионов мира, а их доля в общем объеме бактерий варьировала от 2 до 15% [Xiao et al., 2007; Diaz-Cardenas et al., 2017; Gebarowska et al., 2018]. Выявленное нами доминирование актинобактерий и, в первую очередь, рода Actinomyces, которые являются сапрофитами человека и в этом качестве обнаруживаются в ротовой полости, тонзиллярных «пробках», верхних дыхательных путях, бронхах и других биотопах, также может служить показателем того, что человеческий фактор является определяющим при формировании микробиоценоза НСС.
Заключение
Естественные или искусственно созданные подземные и наземные соляные сооружения часто специализируются на лечении заболеваний органов дыхания, таких как хронические инфекции верхних и нижних дыхательных путей, аллергия, астма, бронхоэктатическая болезнь. Существует широкое медицинское свидетельство того, что условия внутренней среды в этих сооружениях оказывают полезное влияние на здоровье человека, особенно в случае респираторных заболеваний. Благодаря бактериостатическому эффекту соли, количество и видовой состав микроорганизмов в соляных сооружениях существенно отличаются от других биотопов. Способность бактерий колонизировать абиотические соляные поверхности и сохраняться в НСС ранее не изучалась.
Метод ГХ–МС позволил реконструировать таксономический состав сильвинитовых и галитовых НСС. Идентифицированы представители 18 родов, отнесенные к филумам Actinobacteria, Firmicutes, Proteobacteria, доли которых не различались в двух группах. Полученные данные о значительной численности представителей Actinomyces , обитающих на соляных абиотических поверхностях НСС, позволяют предположить, что они могут быть тем пулом клеток, который «помогает» другим бактериям сохраняться в жизнеспособном состоянии в условиях высокоминерализованной среды. Выявленные количественные и качественные показатели микробиоты соляных сооружений дополняют представления о структуре микробных сообществ в условиях высокой соляной нагрузки и антропогенного влияния. На наш взгляд, больший массив исходных данных о микробной структуре НСС позволит лучше понять распределение микроорганизмов в этой среде обитания и выявить отличительные микробные группы, составляющие постоянных и транзиторных участников экосистемы. В медицинском аспекте, бактериологическим методом выявлена высокая выживаемость как грампо-ложительных, так и грамотрицательных бактерий в условиях повышенной солености. Обнаружена высокая обсемененность поверхностей жизнеспособными стафилококками, включая патогенный S. aureus , которые являются возбудителями оппортунистических инфекций, что необходимо учитывать при разработке методов оптимизации факторов внутренней среды НСС.
Работа выполнена в рамках государственного задания АААА-А19-119112290009-1.
Список литературы Структура микробных сообществ наземных соляных сооружений Пермского края
- Верховцева Н.В., Осипов Г.А. Метод газовой хроматографии-масс-спектрометрии в изучении микробных сообществ почв агроценоза // Проблемы агрохимии и экологии. 2008. № 1. С. 51-54.
- Пастухова Е.С. и др. Бактерии-деструкторы ортофталевой кислоты, выделенные из отходов калийного производства // Вестник Пермского университета. Сер. Биология. 2010. Вып. 3. С. 253-262.
- Федотова М.Ю., Горовиц Э.С., Баранников В.Г. Особенности микрофлоры воздушной среды соляных микроклиматических палат // Пермский медицинский журнал. 2005. Т. 22, № 3. С. 118-121.
- Физиолого-гигиеническая концепция спелео-солелечения / под ред. В. А. Черешнева и др. Екатеринбург, 2013. 183 с.
- Ястребова О.В., Кошелева И.А., Плотникова Е.Г. Структурно-функциональная характеристика бактериального консорциума, выделенного из техногенных почв верхнекамского месторождения солей // Вестник Пермского университета. Сер. Биология. 2016. Вып. 3. С. 253-262.
- Akhtar N. et al. Biodiversity and phylogenetic analysis of culturable bacteria indigenous to Khewra salt mine of Pakistan and their industrial importance // Brazilian Journal of Microbiology. 2008. Vol. 39, № 1. P. 143-150.
- Baker G.C. et al. Review and reanalysis of domain-specific 16S primers // Journal of Microbiological Methods. 2003. Vol. 55, № 3. P. 541-555
- Chen Y.G. et al. Phylogenetic diversity of culturable bacteria in the ancient salt deposits of the Yiping-lang Salt Mine, P.R. China // Acta Microbiologica Sinica. 2007. Vol. 47, № 4. P. 571-577.
- Chen L. et al. Phylogenetic analysis and screening of antimicrobial and cytotoxic activities of moderately halophilic bacteria isolated from the Weihai Solar Saltern (China) // World Journal of Microbiology & Biotechnology. 2010. Vol. 26, № 5. P. 879-888. doi: s11274-009-0247-4
- Claverias F.P. et al. Culturable diversity and antimicrobial activity of Actinobacteria from marine sediments in Valparaiso bay, Chile // Frontiers in Microbiology. 2015. Vol. 6, № 737. P. 1-11. doi: 10.3389/fmicb.2015.00737
- da Silva F.S. et al. Unexplored Brazilian oceanic island host high salt tolerant biosurfactant-producing bacterial strains // Extremophiles. 2015. Vol. 19, № 3. P. 561-572. doi: 10.1007/s00792-015-0740-7.
- Diaz-Cardenas С. et al. Microbial diversity of saline environments: searching for cytotoxic activities // AMB Express. 2017. № 7. P. 223.
- Engel A.S. Microbial Diversity of Cave Ecosystems // Geomicrobiology: Molecular and Environmental Perspective. 2010. P. 219-238.
- Frqczek K., Gorny R.L. Microbial air quality at Szczawnica sanatorium, Poland // Annals of Agricultural and Environmental Medicine. 2011. Vol. 18, № 1. P. 63-71.
- Frqczek K., Gorny R.L., Ropek D. Bioaerosols of sub-terraneotherapy chambers at salt mine health resort // Aerobiologia. 2013. Vol. 29, № 4. P. 481-493.
- Frqczek K., Kozdroj J. Assessment of airborne Acti-nomycetes in subterranean and earth sanatoriums // Ecological Chemistry and Engineering S. 2013. Vol. 20, № 1. P. 151-161.
- Gebarowska E. et al. Comparative analysis of airborne bacteria and fungi in two salt mines in Poland // Aerobiologia. 2018. Vol. 34, № 2. P. 127-138.
- Han R. et al. Microbial community structure and diversity within hypersaline Keke Salt Lake environments // Canadian Journal of Microbiology. 2017. Vol. 63, № 11. P. 895-908. doi: 10.1139/cjm-2016-0773.
- Ikner L.A. et al. Culturable microbial diveristy and the impact of tourism in Kartchner Caverns, Arizona // Microbial Ecology. 2007. Vol. 53, № 1. P. 30-42.
- Kelly W.R. et al. Bacteria contamination of ground-water in a mixed land-use karst region // Water Quality, Exposure and Health. 2009. Vol. 1, № 2. P. 69-78.
- Lavoie K.H, Northup D.E. Bacteria as indicators of human impact in caves // In: Rea GT (ed) 7th National Cave and Karst Management Symposium, Proceedings. NICKMS Steering Committee, Albany, NY. 2006. P. 40-47.
- Rashleigh R., Smith S.M., Roberts N.J. A review of halotherapy for chronic obstructive pulmonary disease // International Journal of Chronic Obstructive Pulmonary Disease. 2014. Vol. 9. P. 239-246.
- Sandu I. et al. The effects of salt solions on the health of human subjects // Present Environment and Sustainable Development. 2011. Vol. 5, № 2. P. 67-88.
- Stirbu C., Stirbu C., Sandu I. Impact assessment of saline aerosols on exercise capacity of athletes // Procedia - Social and Behavioral Sciences. 2012. Vol. 46. P. 4141-4145.
- Ventosa A. et al. The Santa Pola saltern as a model for studying the microbiota of hypersaline environments // Extremophiles. 2014. V. 18. P. 811-824.
- Xiao W. et al. Prokaryotic microbial diversity of the ancient salt deposits in the Kunming Salt Mine, P.R. China // Acta Microbiologica Sinica. 2007. Vol. 47, № 2. P. 295-300.
- Zajqc J. et al. Salt caves as simulation of natural environment and significance of halotherapy // Annals of Agricultural and Environmental Medicine. 2014. Vol. 1, № 21. P. 124-127.


